脂肪酸低共熔溶剂对姜黄素的溶解作用


摘要:制备了辛酸(C8)分别与癸酸(C10)、月桂酸(C12)及肉豆蔻酸(C14)形成的 C8-C10、 C8-C12、C8-C14 3 种脂肪酸低共熔溶剂(DES)。C8-C10、C8-C12、C8-C14 对姜黄素的溶解 度分别为 1.11、1.24、1.44 mmol/L,比姜黄素在水中的溶解度分别提高了约 29、32、38 倍。 通过 Gaussian 模拟计算,得到姜黄素与 C8、C10、C12、C14 形成的分子缔合物的吉布斯自由 能分别为−48.49、−64.27、−91.26、−120.59 kJ/mol。姜黄素与烷基链最长的 C14 形成“三明 治”型分子缔合物,具有最强的氢键和疏水缔合作用,使姜黄素在 C8-C14 脂肪酸 DES 中表现 出最高的溶解度和最强的紫外吸收及荧光发射强度。姜黄素在 C8-C10、C8-C12、C8-C14 3 种 脂肪酸 DES 中均具有显著提高的稳定性和 1,1-二苯基-2-三硝基苯肼(DPPH)自由基清除能力。
关键词:低共熔溶剂(DES);姜黄素;溶解;氢键;疏水作用
中图分类号:O645.16
文献标志码:A
低共熔溶剂(Deep Eutectic Solvent, DES)是由两 种或两种以上组分通过氢键结合而形成的低熔点混 合物。自 Abbott 等[1] 于 2003 年首次报道 DES 以来, 许多物质包括氯化胆碱、葡萄糖、氨基酸、脂肪酸等 被发现能够形成 DES。作为一种新型绿色溶剂 , DES 具有成本低廉、制备简单、生物安全性高、组成 与性质易于调控等优点,被广泛应用于天然产物提 取[2]、生物质转化[3] 等领域。
姜黄素是一种从姜黄根茎中提取分离出来的多 酚类天然活性物。研究表明姜黄素具有很高的医用 价值,如抗氧化[4]、抗肿瘤[5] 等药理作用。但是,姜黄 素在水中的溶解度很低、稳定性很差,这严重限制了 姜黄素的实际应用效果。使用表面活性剂胶束、囊 泡、脂质体以及蛋白质颗粒等包载系统可以有效改 善姜黄素的上述问题[6-7]。但是,这些包载系统还存 在成分安全性低 、制备工艺复杂等缺点。最近 , DES 被用于姜黄素的提取和溶解。Jeliński 等[8] 制备 了氯化胆碱为氢键受体与甘油、果糖等氢键供体所 形成的 DES,并考察了 DES 对姜黄素的溶解性能。
相比于姜黄素在水中的低溶解性,这些 DES 对姜黄 素具有显著增强的溶解能力。李佳[9] 使用 12 种 DES 提取姜黄素,发现 DES 的种类、组分物质的量 之比、含水量等条件均可对姜黄素的提取产生影 响。 Shekaari 等[10] 进一步研究了水分对氯化胆碱类 DES 溶解姜黄素的影响,他们通过实验和活度系数 模型发现含水量的增加不利于 DES 对姜黄素的溶 解。目前报道的研究主要采用低熔点的氯化胆碱类 DES。然而,在与水接触时,由于亲水性铵盐的氯化 胆碱类 DES 的化学性质不稳定,容易发生分解,使得 人们开始关注和研究疏水性 DES 的制备和应用[11]。
脂肪酸是一类天然羧酸化合物,广泛存在于动 物脂肪、植物坚果及种子内。脂肪酸可以与氯化胆 碱、醇类等物质共同形成 DES。烷基链长度不同的 脂肪酸也能够通过氢键作用形 成 DES。脂肪 酸 DES 已被用于相变材料制备、金属离子萃取[12] 等方 面。脂肪酸带有长烷基链,从而使脂肪酸类 DES 的 熔点较高,通常需要较高的制备温度。因此,目前鲜 见脂肪酸类 DES 用于姜黄素的提取和溶解。已有研究表明[13] ,将烷基链长度不同的脂肪酸混合,通过调 节脂肪酸分子之间的相互作用,能够进一步降低脂 肪酸类 DES 的熔点。本文研究烷基链长度不同的脂 肪酸形成的 DES 对姜黄素的溶解作用。将辛酸(C8) 分别与癸酸(C10)、月桂酸(C12)和肉豆蔻酸(C14) 混合 ,采用加热-冷却方法[14] 制备了 C8-C10、 C8- C12 和 C8-C14 3 种脂肪酸 DES,测定了 3 种脂肪酸 DES 对姜黄素的溶解度,使用 Gaussian 软件模拟计 算了姜黄素与不同脂肪酸的分子缔合作用,并考察 了姜黄素在 3 种脂肪酸 DES 中的紫外和荧光性质、 稳定性和 1,1-二苯基-2-三硝基苯肼(DPPH)自由基清 除性能。
1""" 实验部分
1.1 试剂和原料
姜黄素(Curcumin):纯度gt;70%,阿拉丁生化科技 股份有限公司;C8:纯度gt;98%,上海泰坦科技股份有 限公司;C10:纯度gt;98%,上海泰坦科技股份有限公 司 ;C12:纯度≥99%,国药集团化学试剂有限公司; C14:纯度≥99%,Sigma-Aldrich 试剂有限公司;DPPH: 纯度 98%,北京百灵威科技有限公司。实验用水为 超纯水。图 1 所示为姜黄素和 4 种脂肪酸的分子结 构式。
1.2 脂肪酸 DES 的制备及相变温度测定
按照一定的物质的量之比将 C8 分别与 C10、 C12、C14 混合,在 60 ℃ 下恒温搅拌 1 h,然后将脂肪 酸混合物置于烘箱中,于 60 ℃ 继续干燥 2 h。通过 精细梯度升温和降温处理,观察脂肪酸混合物的相 态变化,记录样品的熔点和凝固点。使用差示扫描 量热仪(DSC,德国 Netzsch 公司 TA200F3)测定脂肪 酸混合物的相变温度,测试气体氛围为 N2,温度范围 为−10~80 ℃,升温和降温速率均为 5 ℃/min。 在 C8-C10、C8-C12、C8-C14 3 种脂肪酸混合物 中,选择 C8 与 C10、C12、C14 物质的量之比分别为 2∶1、5∶1 和 6∶1(此时混合物熔点最低)制备 C8- C10、C8-C12 和 C8-C14 脂肪酸 DES,用于姜黄素的 溶解作用研究。
1.3 姜黄素在脂肪酸 DES 中的溶解度测定
在室温下,将过量的姜黄素加入到脂肪酸 DES 中 ,搅拌 1 h 并静置 24 h。离心分离后 ,取脂肪酸 DES 的上层清液。同时,配制一系列不同姜黄素浓 度的乙醇溶液,通过测定姜黄素的紫外吸收光谱确 定姜黄素吸光度-浓度标准曲线。定量移取脂肪酸 DES 的上层清液并溶解于乙醇中,然后测定姜黄素 的吸光度。最后,根据姜黄素吸光度-浓度标准曲线 计算姜黄素在脂肪酸 DES 中的溶解度。
1.4 姜黄素与脂肪酸的分子缔合作用模拟计算
利用 Sobtop 软件[15] 与 Multiwfn 软件[16] 构建姜 黄素(简写为 Cur)、C8、C10、C12 和 C14 的分子结 构,然后使用 Gromacs 模拟退火算法对 Cur-C8、Cur[1]C10、Cur-C12 和 Cur-C14 分子缔合物进行构象统计, 并使用 Molclus 程序[17] 计算分子缔合物的能量。选 择能量最低的分子缔合物构象,使用 Gaussian 软件 进行构象优化并计算分子缔合物的吉布斯自由能。
最 后 , 使 用 Multiwfn 和 Visual" Molecular" Dynamics (VMD)软件绘制分子缔合物的 Core-Pauling-Koltum (CPK)模型。
1.5 姜黄素在脂肪酸 DES 中的紫外吸收光谱和荧 光发射光谱测定
在 298 K 下,使用紫外吸收光谱仪(日本岛津公 司 Shimadzu UV-1800 型)测定 10 μmol/L 姜黄素在水 及 C8-C10、C8-C12 和 C8-C14 脂肪酸 DES 中的紫外 吸收光谱。 在 298" K 下 ,使用荧光光谱仪 ( 英 国 Edinburgh Instruments FLS920 型)测定姜黄素样品的 荧光发射光谱 ,激发波长为 424" nm,扫描范围为 430~600 nm。在姜黄素的紫外吸收光谱和荧光发射 光谱测定中,均取 3 次测定的实验平均值。
1.6 姜黄素在脂肪酸 DES 中的稳定性测定
在 298 K 下,使用 Shimadzu UV-1800 紫外吸收 光谱仪测定姜黄素样品在 0 和 3 h 时的紫外吸光度,考察姜黄素在不同脂肪酸 DES 中的稳定性。
1.7 姜黄素在脂肪酸 DES 中的 DPPH 自由基清除 能力测定
在 298 K 下,将姜黄素样品与 DPPH 的乙醇溶 液在棕色瓶中混合,使用 Shimadzu UV-1800 紫外吸 收光谱仪测定 0 和 3 h 时样品在 517 nm 处的紫外吸 光度。
DPPH 自由基清除率(RDPPH)根据式(1)计算:
式中:Asample 为姜黄素样品与 DPPH 乙醇溶液混合物 的紫外吸光度;Ablank 为姜黄素样品与无水乙醇混合 物的紫外吸光度;Acontrol 为水与 DPPH 乙醇溶液混合 物的紫外吸光度。
2""" 结果与讨论
2.1 脂肪酸 DES 的制备
按照组分物质的量之比,采用加热-冷却[17]方法 配制 C8-C10、C8-C12 和 C8-C14 脂肪酸混合物。对 脂肪酸混合物进行精细梯度升温/降温处理,通过观 察样品的液固相变,获得脂肪酸混合物的熔点和凝 固点。同时,使用 DSC 测定脂肪酸混合物的相变温 度。图 2 所示为 C8-C12混合物的 DSC 升温和降温 曲线。可以看到,C8-C12混合物的熔点和凝固点分 别为 8.45 ℃ 和−2.87 ℃。在 DSC 测定时的冷却过程 中,由于过冷或晶核形成等因素,样品会在比熔化温 度更低的温度下凝固[18] ,因此,由 DSC 方法获得的样 品凝固点明显低于熔点。由于对样品温度的恒温控 制,采用精细梯度升温/降温方法测定的脂肪酸混合 物的熔点和凝固点比较接近。同时,由 DSC实验得 到的脂肪酸混合物的熔点与采用精细梯度升温/降温 方法得到的结果也比较接近。
图 3 所示为 C8-C10、C8-C12、C8-C14 3 种脂肪 酸混合物的熔点随 C8 摩尔分数(xC8)的变化曲线。 单 独 C8、 C10、 C12 和 C14 的熔点分别 为 16、 31、 44、52 ℃,可以看出,当 C8 分别与 C10、C12、C14 混 合时,熔点均呈现减小的趋势。C8-C10、C8-C12 和 C8-C14 3 种混合物分别在 C8 与 C10、C12、C14 物质 的量之比为 2∶1、5∶1 和 6∶1 处出现最低熔点,即 形成 3 种脂肪酸 DES。Florindo 等[19] 发现解离常数 (pKa)的不同会使烷基链较长的脂肪酸充当氢键供 体,而烷基链较短的脂肪酸充当氢键受体。黄雪[20] 曾使用红外光谱技术证明脂肪酸分子羧基中的羰基 氧与另一个脂肪酸分子中的羧基氢以氢键相连的方 式形成脂肪酸缔合物。在 C8 与 C10、C12、C14 这 3 种脂肪酸形成的 DES 中,不同烷基链长度的脂肪 酸之间的氢键作用能够中断相同脂肪酸分子之间的 缔合作用。因此,3 种脂肪酸 DES具有最低熔点,均 低于单独脂肪酸的熔点。
将 C8、C10、C12 和 C14 的熔点及熔化热数据 代入施罗德方程[21] ,可以得到脂肪酸混合物的熔点- 摩尔分数关系式,如式(2)~式(5)所示。
式中:Tm 为脂肪酸混合物的熔点,xC8、xC10 、xC12 和 xC14 分别为 C8、C10、C12 和 C14 的摩尔分数。将式 (2)分别与式(3)~式(5)相结合,可以计算 C8-C10、 C8-C12 和 C8-C14 脂肪酸 DES 的熔点和组成,结果 如表 1 所示,可见,3 种脂肪酸 DES 的熔点和组成的 计算值与实验结果十分吻合。这些结果说明,通过 混合不同烷基链长度的脂肪酸并改变混合物组成能够调节脂肪酸 DES 的熔点。
2.2 姜黄素在脂肪酸 DES 中的溶解度
姜黄素在水中的溶解度为 3.74×10−2 mmol/L,根 据 姜 黄 素 吸 光 度 -浓 度 标 准 曲 线 ( 方 程 为y = 115.845 24x−0.095 61 ,其中,x 表示吸光度,y 表示浓 度。相关系数 R 2=0.998 81),代入测得的各脂肪酸 DES 的吸光度数据 ,即可以计算出姜黄素在 C8- C10、C8-C12 和 C8-C14 3 种脂肪酸 DES中的溶解度 分别为 1.11、1.24、1.44 mmol/L。与水相比,C8-C10、 C8-C12、C8-C14 脂肪酸 DES 能够使姜黄素的溶解度 分别提高约 29、32 和 38 倍。
姜黄素分子中含有苯环、双键等疏水性基团,不 易与水分子发生作用,因此姜黄素在水中的溶解度 很低。当姜黄素溶解于氯化胆碱 类 DES 中时 , Jeliński 等[8] 发现姜黄素溶解的主要驱动力是姜黄素 与 DES 组分之间的氢键作用,同时也归因于 DES 组 分间的氢键网格结构。与表面活性剂对姜黄素的增 溶作用类似,脂肪酸分子中的羧基能够与姜黄素分 子中的羟基形成氢键,同时脂肪酸分子中的烷基链 能够与姜黄素分子中的苯环、双键等疏水性基团产 生疏水作用。因此,不同于其他类型的 DES,氢键和 疏水作用均会有助于姜黄素在脂肪酸 DES 中的 溶解。
2.3 姜黄素与脂肪酸的分子缔合作用模拟计算
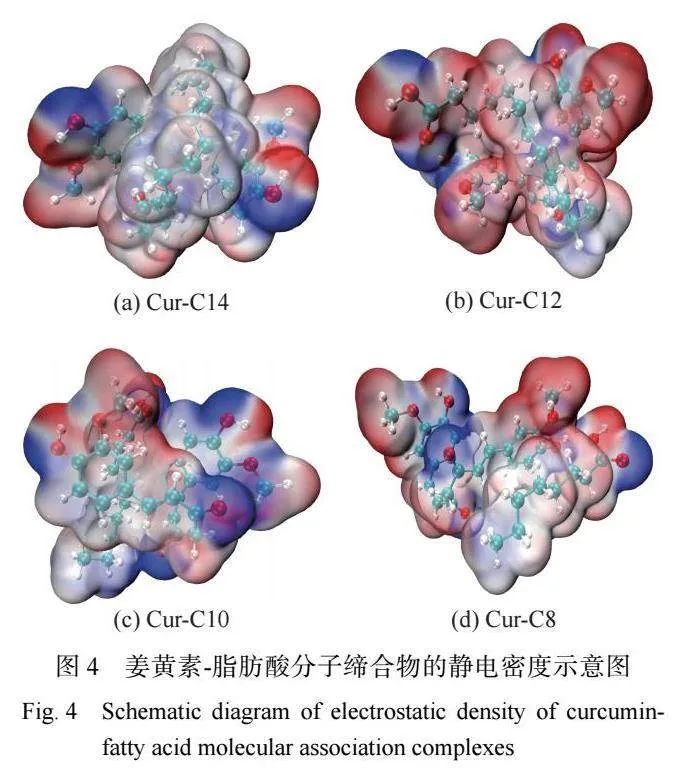
当姜黄素加入到脂肪酸 DES 中时,姜黄素分子 与脂肪酸分子之间存在氢键、疏水等弱相互作用,同 时会伴随着分子构象的变化。使用 Gaussian 软件对 姜黄素与 C8、C10、C12 和 C14 形成的分子缔合物的 构象进行了优化。如图 4 所示,姜黄素通常采用半展 开的分子形态,其酚羟基能够与脂肪酸的羧基产生 氢键作用,这会使姜黄素分子的两个苯环彼此远离, 从而减弱姜黄素分子自身的缔合作用[22]。然而,脂肪 酸的烷基链长度不同,姜黄素与脂肪酸所形成的分 """ 子缔合物呈现不同的构象。在 Cur-C8 分子缔合物 中,C8 分子缔合于姜黄素分子的外侧,二者为并排结构。Cur-C10 分子缔合物呈现半并排、半交叉的分子 结象,C10 的烷基链部分插入姜黄素的两个苯环之 间。在姜黄素与 C12 和 C14 形成的“三明治”型分子 缔合物中,姜黄素的酚羟基与脂肪酸的羧基产生氢 键作用,而姜黄素的苯环、双键会与脂肪酸的烷基链 发生强疏水缔合作用。通过 Gaussian 模拟计算,姜黄 素与 C8、C10、C12 和 C14 形成的分子缔合物的吉布斯 自由能分别为−48.49、−64.27、−91.26、−120.59 kJ/mol。 姜黄素与 C14 形成的分子缔合物具有最高负值的吉 布斯自由能,这说明姜黄素与 C14 之间存在最强的 分子缔合作用。这个结果也可以解释姜黄素在 C8- C14 脂肪酸 DES 中具有最高的溶解度。
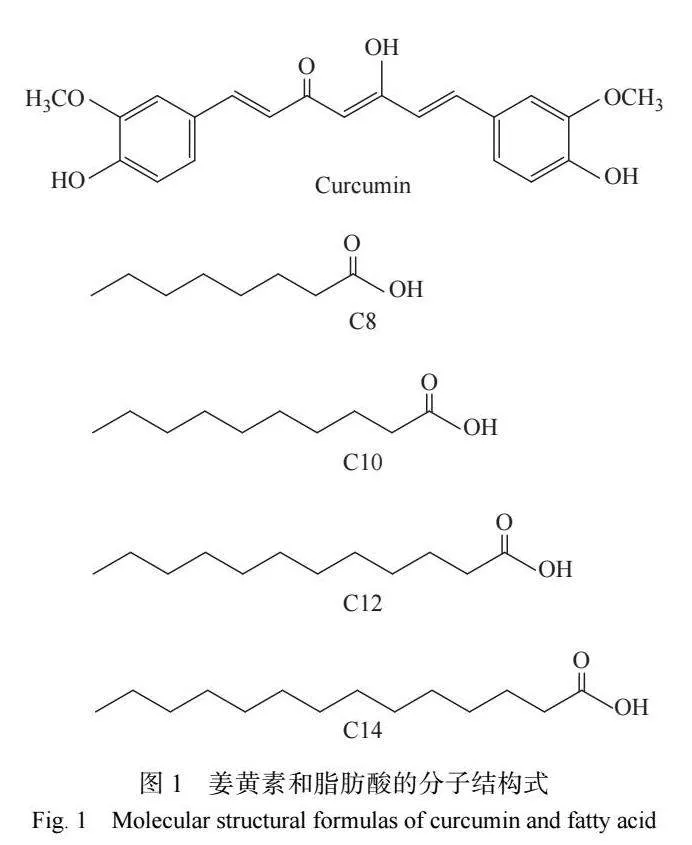
2.4 姜黄素在脂肪酸 DES 中的光谱性质
姜黄素是一种高度共轭性分子,其紫外吸收和 荧光光谱性质对周围环境的变化非常敏感[23]。因此, 紫外吸收光谱和荧光发射光谱可以用来考察姜黄素 在脂肪酸 DES 中的溶解状态[24]。图 5 所示为姜黄素 溶解在 3 种脂肪酸 DES 中的紫外吸收光谱和荧光发 射光谱。溶解在水中的姜黄素分别在 425 nm 和 560 nm处呈现较宽的紫外吸收峰和微弱的荧光发射峰。当 姜黄素溶解在脂肪酸 DES 中时,姜黄素与脂肪酸会 形成分子缔合物,姜黄素分子的苯环、双键与脂肪酸 分子的烷基链之间发生疏水缔合作用,能够为姜黄 素提供疏水环境,从而大大提高姜黄素的紫外吸收 和荧光发射强度。在脂肪酸烷基链形成的低极性疏 水环境中,姜黄素分子的 π-π* 跃迁产生的吸收峰会 发生蓝移,n-π* 跃迁产生的吸收峰会发生红移。这 些因素会导致脂肪酸 DES 溶解的姜黄素除了在 417 nm 处呈现明显的吸收峰外,还在 437 nm 处出现了肩峰[25]。 虽然姜黄素在 3 种脂肪酸 DES 样品中具有相同的浓 度,但是姜黄素的紫外吸收和荧光发射强度均与脂 肪酸的烷基链长度呈现正相关性。姜黄素在 C8- C14 脂肪酸 DES 中具有最高的紫外吸收和荧光发射 强度,这表明 C8-C14 脂肪酸 DES 能够为姜黄素提供 更疏水的缔合微环境[26]。
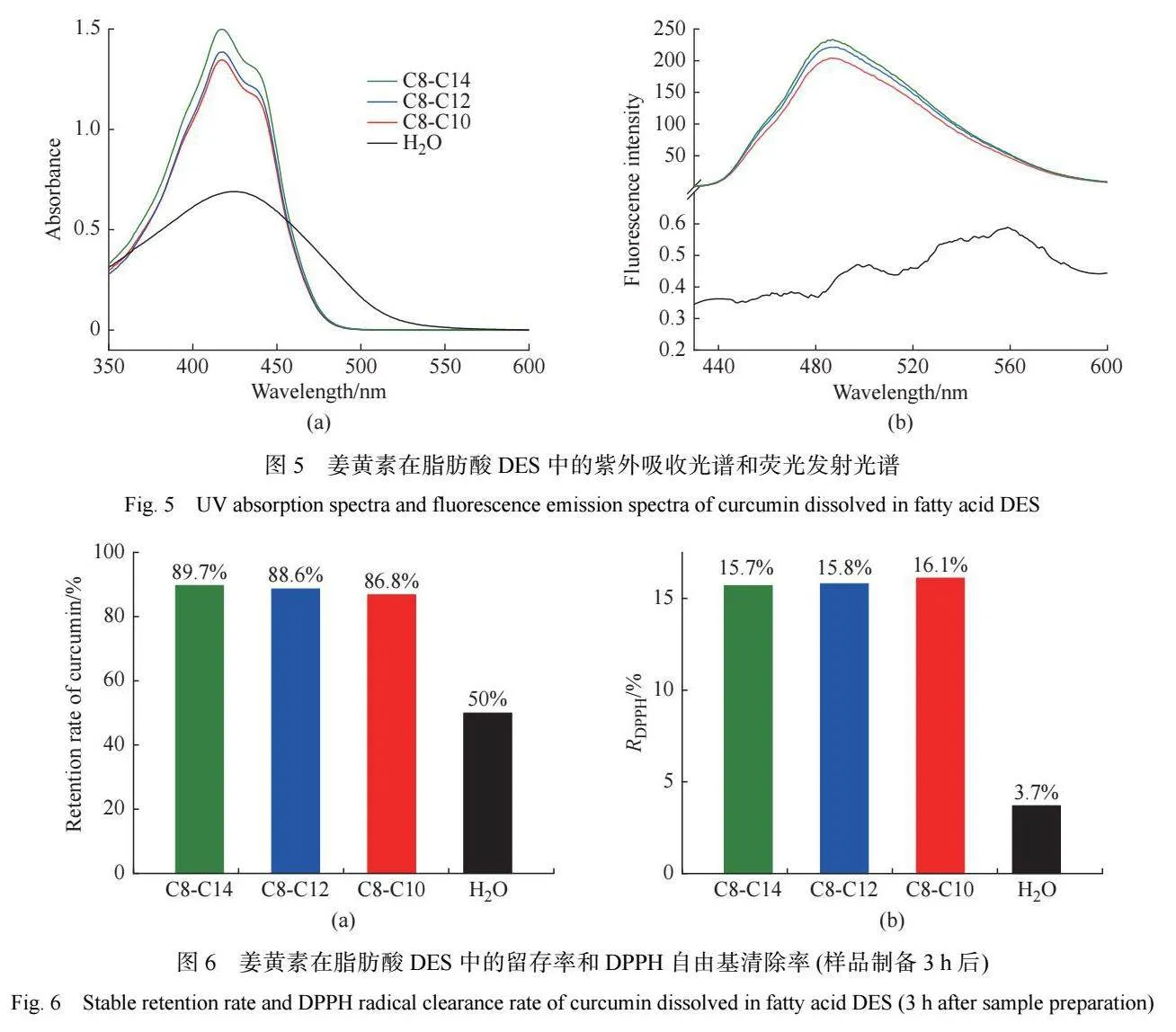
2.5 姜黄素的稳定性和 DPPH 自由基清除能力
通过测定姜黄素分子和 DPPH 自由基分子的紫 外吸收强度的变化 ,可以考察姜黄素在脂肪 酸DES 中的稳定性和自由基清除能力。在水环境中, 姜黄素分子的酮-烯醇基团容易发生去质子化,因而 姜黄素在水溶液中不稳定[27]。但是,姜黄素分子的 酮-烯醇基团能够提供氢原子,这使姜黄素分子具有 很强的自由基清除能力[28]。由图 6 中可以看出,溶解 于水中的姜黄素在 3 h 后降解了 50%,其 DPPH 自由 基清除率为 3.7%。当姜黄素溶解于脂肪酸 DES 中 时,3 h 后姜黄素的留存率可以超过 86%,DPPH 自由 基清除率不低于 15.7%。当被聚合物纳米颗粒、表面 活性剂胶束包载时,姜黄素通常能够表现出显著提 高的稳定性和 DPPH 自由基清除能力[29-30]。在脂肪 酸 DES 的非水环境中,脂肪酸与姜黄素的氢键和疏 水缔合作用能够抑制姜黄素分子中酮-烯醇结构的去 质子化 ,从而提高姜黄素分子的稳定性。当加入 DPPH 自由基时,脂肪酸烷基链提供的疏水微环境能 够促进姜黄素对 DPPH 自由基的还原反应。姜黄素 在 3 种脂肪酸 DES 中的稳定性和 DPPH自由基清除 能力相差不大,这也说明氢键作用对脂肪酸 DES 的 形成及姜黄素的溶解具有同样重要的影响。
3""" 结 论
( 1) 在 C8-C10、 C8-C12、 C8-C14" 脂 肪 酸 DES 中,C8-C14 DES 对姜黄素具有最高的溶解能力。
(2)姜黄素在脂肪酸 DES 中的溶解性和姜黄素 与脂肪酸分子缔合物的吉布斯自由能数据一致,这 可归因于姜黄素与脂肪酸之间的氢键、疏水的共同 作用。
(3)脂肪酸 DES 能够为姜黄素提供低极性疏水 环境,使姜黄素表现出显著提高的紫外吸收和荧光 发射强度、稳定性及 DPPH 自由基清除能力。作为 一种疏水性 DES,通过改变脂肪酸的种类、组成等条 件,不仅能够有效调节脂肪酸 DES 的基础物理化学 性质,也能够精细调控疏水区域的微观结构,从而显 著提高脂肪酸 DES 对姜黄素等难溶性植物活性物的 提取、溶解及应用性能。
参考文献:
ABBOTT" A" P," CAPPER" G," DAVIES" D" L, et al." Novel solvent properties" of" choline" chloride/urea" mixtures"" elec[1]tronic supplementary information (ESI) available: Spectro[1]scopic data[J]. Chemical Communications, 2003, 1: 70-71.
DUAN L, DOU L L, GUO L, et al. Comprehensive evalu[1]ation" of" deep" eutectic" solvents" in" extraction" of" bioactive natural" products[J]. ACS" Sustainable" Chemistry" amp;" Engi[1]neering, 2016, 4(4): 2405-2411.
GUTIÉRREZ" M" C," FERRER" M" L," YUSTE" L, et al. Bacteria" incorporation" in" deep-eutectic" solvents" through freeze-drying[J]. Angewandte Chemie International Edition, 2010, 49(12): 2158-2162.
BASNET P, SKALKO B N. Curcumin: An anti-inflamma[1]tory molecule from a curry spice on the path to cancer treat[1]ment[J]. Molecules, 2011, 16(6): 4567-4598.
李晨晨, 龚飞荣, 程树军,等. 姜黄素缓释胶束的制备、表 征及其抗细胞毒类药物的多药耐药性评价[J]. 华东理工 大学学报 (自然科学版), 2014, 40(5): 562-567.
郑雨晴, 王小永. 烷基链结构对吐温表面活性剂包载姜黄 素的影响[J]. 华东理工大学学报 (自然科学版), 2023, 49(2): 188-195.
褚翔宇, 王小永. 玉米蛋白/吐温-20复合纳米颗粒对姜黄 素的包载作用[J]. 化学通报, 2018, 81(7): 625-629.
JELIŃSKI" T," PRZYBYŁEK" M," CYSEWSKI" P." Natural deep" eutectic" solvents" as" agents" for" improving" solubility, stability" and" delivery" of" curcumin[J]. Pharmaceutical Research, 2019, 36(8): 116.
李佳. 天然低共熔溶剂提取姜黄素类化合物的研究[D]. 天津: 天津科技大学, 2020.
SHEKAARI" H," MOKHTARPOUR" M," FARAJI" S, et al. Enhancement of curcumin solubility by some choline chlor[1]ide-based deep eutectic solvents as a new category of green solvents at different temperatures[J]. Fluid Phase Equilibria, 2020, 532. DOI: 10.1016/j.fluid.2020.112917.
BELINDA" S," ARMANDO" J" D," SILVESTRE" P" C, et al. Hydrotropy" and" cosolvency" in" lignin" solubilization" with deep" eutectic" solvents[J]. ACS" Sustainable" Chemistry" amp; Engineering, 2019, 7(14): 12485-12493.
LI D. Natural deep eutectic solvents in phytonutrient extrac[1]tion" and" other" applications[J]." Frontiers" in" Plant" Science, 2022, 13. DOI: 10.3389/fpls.2022.1004332.
马尚文, 底梦飞, 杨嵘晟, 等. 双脂肪酸憎水性低共熔溶剂 的合成及富集水中铜离子的研究[J]. 煤炭与化工, 2020, 43(6): 121-128.
ZHAO P, YUE Q, HE H, et al. Study on phase diagram of fatty acids mixtures to determine eutectic temperatures and the" corresponding" mixing" proportions[J]. Applied" Energy, 2014, 115: 483-490.
TIAN" LU." Sobtop," Version" 1.0[EB/OL]." (2022-2-15) [2023-02-01]. http://sobereva.com/soft/sobtop.
TIAN" LU." Multiwfn," Version" 3.8[EB/OL].nbsp; (2022-2-15) [2023-02-01]. http://sobereva.com/multiwfn.
TIAN" LU." Molclus" Program," Version" 1.9.9.9[EB/OL]. (2022-2-15)" [2023-02-01]. http://www.keinsci.com/resear ch/molclus.html.
SIEW W L. Crystallisation and melting behaviour of palm kernel" oil" and" related" products" by" differential" scanning calorimetry[J]. European" Journal" of" Lipid" Science" and Technology, 2001, 103(11): 729-734.
FLORINDO" C," ROMERO" L," RINTOUL" I, et al." From phase change materials to green solvents: Hydrophobic low viscous" fatty" acid-based" deep" eutectic" solvents[J]. ACS Sustainable" Chemistry" amp;" Engineering," 2018," 6(3):" 3888- 3895.
黄雪. 三元低共熔脂肪酸复合相变材料的制备及热性能 研究[D]. 广州: 广东工业大学, 2015.
张寅平, 苏跃红, 葛新石. (准)共晶系相变材料融点及融 解热的理论预测[J]. 中国科学技术大学学报, 1995, 25(4): 474-478.
TONNESEN H H. Solubility, chemical and photochemical stability" of" curcumin" in" surfactant" solutions-studies" of curcumin" and" curcuminolds," XXVIII[J]." Pharmazie," 2002, 57(12): 820-824.
ZSILA" F," BIKÁDI" Z," SIMONYI" M." Molecular" basis" of the" cotton" effects" induced" by" the" binding" of" curcumin" to human" serum" albumin[J]. Tetrahedron" Asymmetry, 2003, 14(16): 2433-2444.
SAHU A, KASOJU N, BORA U. Fluorescence study of the curcumin-casein" micelle" complexation" and" its" application as" a" drug" nanocarrier" to" cancer" cells[J]. Biomacromole[1]cules, 2008, 9(10): 2905-2912.
WANG F, WU X, WANG F, et al. The sensitive fluorime[1]tric" method" for" the" determination" of" curcumin" using" the enhancement of mixed micelle[J]. Journal of Fluorescence, 2006, 16(1): 53-59.
PARK" C," MEGHANI" N," LOEBENBERG" R, et al." Fatty acid chain length impacts nanonizing capacity of albumin[1]fatty acid" nanomicelles:" Enhanced" physicochemical"" prop[1]erty" and" cellular" delivery" of" poorly" water-soluble" drug[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2020, 152: 257-269.
WANG" Y" J," PAN" M" H," CHENG" A" L, et al." Stability" of curcumin" in" buffer" solutions" and" characterization" of" its degradation" products[J]. Journal" of" Pharmaceutical" and Biomedical Analysis, 1997, 15(12): 1867-1876.
MORALES" N" P," SIRIJAROONWONG" S," YAMANONT P, et al. Electron paramagnetic resonance study of the free radical scavenging capacity of curcumin and its demethoxy and hydrogenated derivatives[J]. Biological amp; Pharmaceu[1]tical Bulletin, 2015, 38(10): 1478-1483.
卢艺惠. 低共熔介质中姜黄素的提取及其纳米颗粒的性 质研究[D]. 江苏淮安: 淮阴工学院, 2021.
郝兴坤, 郑雨晴, 王倩, 等. 吐温表面活性剂囊泡对姜黄素 的包载作用[J]. 化学通报, 2021, 84(11): 1243-1247.[24]

