华蟾素通过调控MYH9/USP7/c-MYC通路抑制急性髓系白血病细胞免疫逃逸
黄蓉, 刘凯, 郝敬全, 王理槐, 甘卓
(1.湖南中医药大学第一附属医院血液肿瘤科,湖南长沙 410007;2.湖南中医药大学第一附属医院肿瘤科,湖南长沙 410007;3.湖南中医药大学第一附属医院核医学科,湖南长沙 410007)
急性髓系白血病(acute myeloid leukemia,AML)是起源于骨髓造血干细胞的血液系统恶性肿瘤,具有高度的遗传异质性和侵袭性[1]。AML 可发生于各年龄阶段,最常见的是老年群体,极易复发且预后较差,5 年总生存率不超过21%[2]。越来越多的研究表明,AML 的难治性和易复发性与免疫逃逸有关。免疫逃逸是AML 患者异体造血干细胞移植后复发的主要危险因素[3]。蟾酥,为蟾蜍科动物中华大蟾蜍Bufo bufo gargarizansCantor 或黑眶蟾蜍Bufo melanostictusSchneider 的干燥分泌物,辛、温,有毒,归心经,具有解毒、止痛、开窍醒神功效,用于治疗痈疽疔疮、咽喉肿痛等病证,现代药理研究表明,其具有广泛抗癌作用[4]。华蟾素是一种从蟾酥中分离的蟾蜍二烯内酯,既往研究表明,其能够诱导人T 细胞白血病细胞的凋亡[5];但对AML 的治疗作用及机制尚不清楚。肌球蛋白重链9(MYH9)基因编码非肌肉肌球蛋白ⅡA(NMⅡ-A)的重链(MHCⅡ),参与调控细胞黏附、细胞迁移和细胞信号转导等多种生物学过程[6]。MYH9 也被证实与多种肿瘤的免疫逃逸有关[7-8]。据报道,MYH9 高表达与AML 患者较差的总生存期相关[9]。此外,有关于肺癌的研究表明,抑制MYH9 能够减少去泛素化酶泛素特异性蛋白酶7(USP7)对骨髓细胞瘤病毒癌基因(c-MYC)的募集、促进c-MYC 的泛素化降解进而参与肿瘤进展[10]。本研究旨在探讨华蟾素调控MYH9/USP7/c-MYC 通路对AML 细胞免疫逃逸的影响,现将研究结果报道如下。
1 材料与方法
1.1 实验动物10 只SPF 级雌性BALB/c 裸鼠,4~6 周龄,体质量(20 ± 2)g,购自湖南斯莱克景达实验动物有限公司,实验动物生产许可证号:SCXK(湘)2019-0004,湖南中医药大学第一附属医院饲养,实验动物使用许可证号:SYXK(湘)2022-0003。本研究中所有的动物实验程序均经湖南中医药大学第一附属医院动物伦理委员会批准,批准号:zyh-202103046,并按照实验动物护理和使用指南进行。
1.2 细胞人AML 细胞株HL-60,由中国科学院上海细胞库提供。
1.3 药物、试剂与仪器华蟾素,分子量458.54,分子式C26H34O7,分子结构见图1,购自美国MedChemExpress 公司,批号:1108-68-5,纯度99.87%。RPMI-1640 培养基,胎牛血清(FBS),抗人CD3/CD28磁珠,Lipofectamine 3000试剂,Pierce免疫共沉淀(Co-IP)试剂盒(美国Thermo Fisher Scientific公司);人淋巴细胞分离液Lymphoprep(加拿大Stemcell 公司);细胞计数试剂盒8(CCK-8)溶液(日本Dojindo公司);vector和MYH9过表达质粒(广州RiboBio 生物公司); GolgiStop 试剂盒(美国BD Biosciences 公司);末端脱氧核苷酸转移酶介导的dUTP缺口末端标记(TUNEL)检测试剂盒、放射免疫沉淀分析(RIPA)裂解液、二喹啉甲酸(BCA)蛋白定量试剂盒、增强化学发光试剂(ECL)(上海碧云天生物技术有限公司);聚偏氟乙烯(PVDF)膜(美国Millipore 公司);AIM-V 培养基(美国Gibco 公司);MYH9、USP7、c-MYC、CD8 等抗体,甘油醛-3-磷酸脱氢酶(GAPDH)抗体,辣根过氧化物酶(HRP)-IgG 二抗、异硫氰酸荧光素(FITC)标记的荧光二抗、泛素结合酶抗体、干扰素γ(IFN-γ)酶联免疫吸附分析(ELISA)试剂盒、白细胞介素2(IL-2)ELISA 试剂盒(英国Abcam 公司);佛波酯、离子霉素(美国Sigma-Aldrich 公司);CytoTox96 非放射性细胞毒性测定试剂盒(美国Promega 公司)。酶标仪(美国Bio-Rad 公司);Transwell 小室(美国Coring 公司);流式细胞仪(美国Beckman 公司);荧光显微镜(德国Leica 公司)。
图1 华蟾素分子结构Figure 1 Molecular structure of cinobufacini
1.4 分子对接MYH9 的蛋白质3D 结构分别从Uniport(https://www.uniprot.org/)和Alpha fold(https://alphafold.ebi.ac.uk)数据库获取。使用PyMOL 2.3.0 软件将蛋白质结构中的水分子、无关蛋白链和原配体删除以备对接所用。小分子化合物为华蟾素,其3D 结构文件从PubChem 数据库下载并使用Chem3D 对小分子结构进行分子力场优化,最终获得能量最低状态的最优分子结构。使用AutoDock Tools 1.5.6 对蛋白质进行加氢处理,对小分子进行加氢和判定可扭转键的处理,保存为pdbqt 文件。使用Grid 板块设置分子对接范围参数,设定对接方式为半柔性对接,对接算法为拉马克遗传算法。运行Auto Dock Vina 1.2.0进行分子对接,得到对接结合自由能以及对接结果文件。
1.5 体内实验
1.5.1 造模、分组与给药 裸鼠成瘤造模方法:用无血清培养基重悬HL-60 细胞,调整细胞密度,将5 × 106个细胞注射至每只裸鼠的腋窝处皮下。待瘤体可触及时,将裸鼠随机分为华蟾素组与对照组,每组5只。按人与裸鼠体表面积等效剂量换算法计算华蟾素组祼鼠用药量。华蟾素组给予华蟾素生理盐水溶液(10 mg/mL)4 mg/kg 腹腔注射,每3 d 1 次,对照组同时给予等体积生理盐水10 mg/mL 腹腔注射。连续给药4 周。实验结束后,通过吸入过量CO2对祼鼠实施安乐死。
1.5.2 移植瘤体积测量 给药期间使用游标卡尺测量移植瘤的大小,计算肿瘤体积,肿瘤体积=(长×宽2)/2。
1.5.3 免疫荧光染色法检测CD8 表达 将肿瘤组织常规石蜡包埋切成5µm 切片,石蜡切片脱蜡再水化。切片抗原修复,磷酸盐缓冲液(PBS)洗涤,使用5%羊血清封闭液室温孵育2 h,加入CD8 抗体4 ℃孵育过夜。PBS漂洗后,将切片与FITC标记的二抗室温孵育1 h。4’,6-二脒基-2-苯基吲哚(DAPI)复染,抗荧光淬灭剂封片,荧光显微镜下进行观察,CD8阳性细胞被标记为绿色。
1.5.4 IL-2 和IFN-γ 检测 取肿瘤组织,剪碎后匀浆、离心,收集上清液进行IL-2 和IFN-γ 指标的ELISA检测。
1.6 体外实验
1.6.1 细胞培养 HL-60 细胞以添加10% FBS、100 U/mL 青霉素和100µg/mL 链霉素的RPMI-1640培养基,于37 ℃、5%CO2加湿的培养箱中培养。
1.6.2 人CD8+T 细胞的分离与培养 于健康供体的外周血中分离CD8+T 细胞。使用人淋巴细胞分离液Lymphoprep 分离外周血单核细胞(PBMCs),然后通过CD8 磁珠对PBMCs 进行CD8+T 细胞阳性纯化。纯化CD8+T 细胞用人CD3/CD28单抗偶联磁珠刺激48 h,将纯化的CD8+T 细胞在含有IL-2(10 ng/mL)的AIM-V 培养基中培养48 h。对于T 细胞肿瘤杀伤实验,将活化的T细胞与HL-60细胞以3∶1 的效靶比在存在或不存在华蟾素的条件下共培养48 h。
1.6.3 CCK-8 法检测细胞活力 将HL-60 细胞接种于96 孔板中,2 × 103个/孔,加入不同浓度(0、0.05、0.1、0.25、0.5、0.75、1 µmol/L)华蟾素培养48 h。弃去培养基上清液,向每孔中加入10µL CCK-8 溶液孵育2 h。最后应用酶标仪检测各孔450 nm波长处的吸光度(OD)值。
1.6.4 Transwell 实验测定细胞侵袭能力 华蟾素处理完毕后,用无血清的RPMI-1640 培养基将HL-60 细胞制备成单细胞悬液,调整密度为2 ×105个/mL。将Transwell 小室(孔径8µm)放入24 孔板中,上室用50 µL 稀释后的Matrigel 预包埋。上室中加入200µL 细胞悬液,下室中加入600µL 含有10% FBS 的培养基。培养48 h 后,取出小室用棉签擦去未侵入的细胞,侵入Transwell 膜下表面的细胞用4%多聚甲醛固定,0.5%结晶紫染色,自来水冲洗,显微镜下观察并计数。
1.6.5 TUNEL 法检测细胞凋亡 将HL-60细胞接种于6孔板中,使用华蟾素(0.25、0.5、0.75µmol/L)处理。PBS洗涤后,细胞4%多聚甲醛固定15 min,0.2% Triton X-100 透化10 min。PBS 再次洗涤,加入TdT 和dUTP 混合溶液37 ℃避光孵育60 min,然后用DAPI 染核。使用抗荧光猝灭剂封片后在荧光显微镜下观察。
1.6. 6 细胞转染 将1 × 106个HL-60 细胞接种于6 孔板中孵育过夜,使用Lipofectamine 3000试剂将vector、MYH9 过表达质粒(浓度50 ng/mL)转染至HL-60细胞,转染48 h收获细胞。
1.6. 7 流式细胞术检测CD25 阳性细胞表达 使用50 ng/mL 佛波酯和500 ng/mL 离子霉素刺激CD8+T 细胞3.5 h 使其活化,然后加入GolgiStop 抑制细胞内细胞因子向外分泌。收集细胞,使用荧光染料标记的CD25 抗体进行细胞表面染色,应用流式细胞仪分析染色细胞。
1.6.8 IL-2 和IFN-γ 检测 将HL-60 细胞与活化的CD8+T 细胞在6 孔板中培养48 h,收集共培养基,4 ℃、2 000×g离心5 min,获得上清液,使用ELISA试剂盒检测IFN-γ 和IL-2 的水平。
1.6.9 细胞毒性检测 将HL-60 细胞和CD8+T细胞(效靶比为10∶1)加入对应培养孔,37 ℃孵育4 h,加入细胞裂解液后以250×g离心4 min。然后加入CytoTox96 试剂,依据试剂盒说明书配制底物并且进行后续操作。在室温避光孵育30 min,加入终止液,使用酶标仪检测490 nm 处吸光度值来测定细胞培养上清液中乳酸脱氢酶(LDH)的水平。细胞毒性(%)=(实验孔吸光度值-效应细胞自发吸光度值-靶细胞自发吸光度值)/(靶细胞最大吸光度值-靶细胞自发吸光度值)×100%。
1.6.10 放线菌酮(CHX)和蛋白酶体抑制剂MG132 处理 将HL-60 细胞以1 × 106个/孔接种于6 孔板中,使用50µg/mL 的CHX 处理0、4、8、12 h。在收获细胞前使用蛋白酶体抑制剂MG132(20 µmol/L)处理6 h。最后通过Western Blot 法检测c-MYC蛋白表达。
1.6.11 Western Blot和Co-IP 使用添加有蛋白酶和磷酸酶抑制剂的RIPA 裂解液提取细胞总蛋白,应用BCA 试剂盒测定蛋白质的浓度并煮沸变性。将蛋白质进行10%十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳(PAGE)分离后,转移至PVDF 膜上。使用5%脱脂牛奶封闭膜1 h,加入稀释的抗体包括抗MYH9(1∶1 000)、抗USP7(1∶1 000)、抗c-MYC(1∶1 000)和抗GAPDH(1∶1 000),4 ℃孵育过夜。TBST 洗膜,加入HRP-IgG 二抗室温孵育1 h。TBST 再次洗膜,ECL 对蛋白条带显影,使用ImageJ 软件分析各目的蛋白条带的相对灰度值,GAPDH作为内参。
对于Co-IP,使用Pierce Co-IP 试剂盒提取细胞总蛋白,BCA 试剂盒测定蛋白浓度后将蛋白质与抗体[抗MYH9(1∶1 000)、抗USP7(1∶1 000)、抗c-MYC(1∶1 000)或IgG(阴性对照)]一起孵育过夜,加入泛素结合酶抗体并且用蛋白A/G琼脂糖行免疫沉淀,洗涤混合物后进行Western Blot 分析,确定c-MYC 的表达,同时通过泛素结合酶表达确定分子间的作用情况。
1.7 统计方法采用GraphPad Prism 8.0统计软件进行数据分析,数据以均数±标准差 (±s)表示。多组间比较采用单因素方差分析,2 组间比较采用t检验。所有实验均独立重复3次。以P<0.05为差异有统计学意义。
2 结果
2.1 华蟾素抑制异种移植瘤的生长并增强CD8+T细胞抗肿瘤能力构建异种移植瘤模型,使用华蟾素(4 mg/kg)治疗。结果显示,与对照组比较,华蟾素组肉眼可见肿瘤缩小(图2-A),测量肿瘤体积显著减小(P<0.05)(图2-B),肿瘤组织中CD8的荧光强度增强(图2-C)及IL-2 和IFN-γ 水平升高(P<0.05)(图2-D)。以上结果表明,华蟾素可抑制HL-60 细胞在体内生长,增强CD8+T 细胞抗肿瘤能力。

图2 华蟾素抑制异种移植瘤的生长并增强CD8+T细胞抗肿瘤能力Figure 2 Cinobufotalin inhibits the growth of allograft tumors and enhances the anti-tumor ability of CD8+T cells
2.2 华蟾素抑制AML细胞活力、侵袭,促进细胞凋亡使用华蟾素(0、0.05、0.1、0.25、0.5、0.75、1 µmol/L)处理HL-60 细胞,CCK-8 法检测细胞活力,结果表明华蟾素以浓度依赖性的方式抑制细胞活力,IC50值为0.47,见图3-A。使用华蟾素(0.25、0.5、0.75 µmol/L)处理HL-60 细胞,Transwell 检测细胞侵袭能力,结果显示,与对照组比较,华蟾素各浓度组AML 细胞侵袭数目呈浓度依赖性降低(P<0.05),见图3-B。TUNEL 检测结果显示,华蟾素能够以浓度依赖性促进AML 细胞凋亡,见图3-C。以上结果表明,华蟾素可显著抑制AML细胞活力、侵袭,促进细胞凋亡。
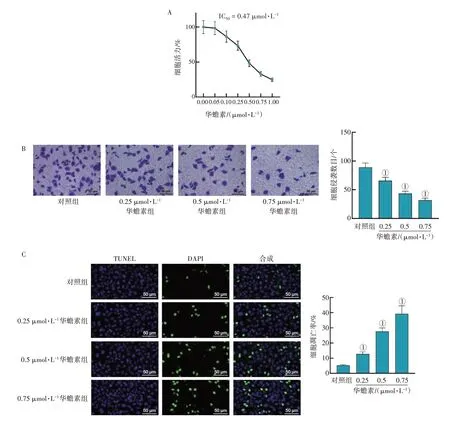
图3 华蟾素抑制AML细胞活力、侵袭,促进细胞凋亡Figure 3 Cinobufotalin inhibits AML cell viability and invasion and induces cell apoptosis
2.3 华蟾素增强CD8+ T 细胞的抗肿瘤能力将HL-60细胞与CD8+T细胞以1∶3的比例共培养,使用华蟾素(0.25、0.5、0.75 µmol/L)处理。结果显示,与对照组比较,华蟾素各浓度组细胞表面标志物CD25 表达上调,细胞因子IL-2 和IFN-γ 水平升高,同时华蟾素处理还增强CD8+T 细胞对HL-60细胞的毒性,均呈浓度依赖性。见表1。
表1 华蟾素对CD8+T细胞抗肿瘤能力的影响Table 1 Effects of cinobufotalin on the anti-tumor ability of CD8+T cells (± s)
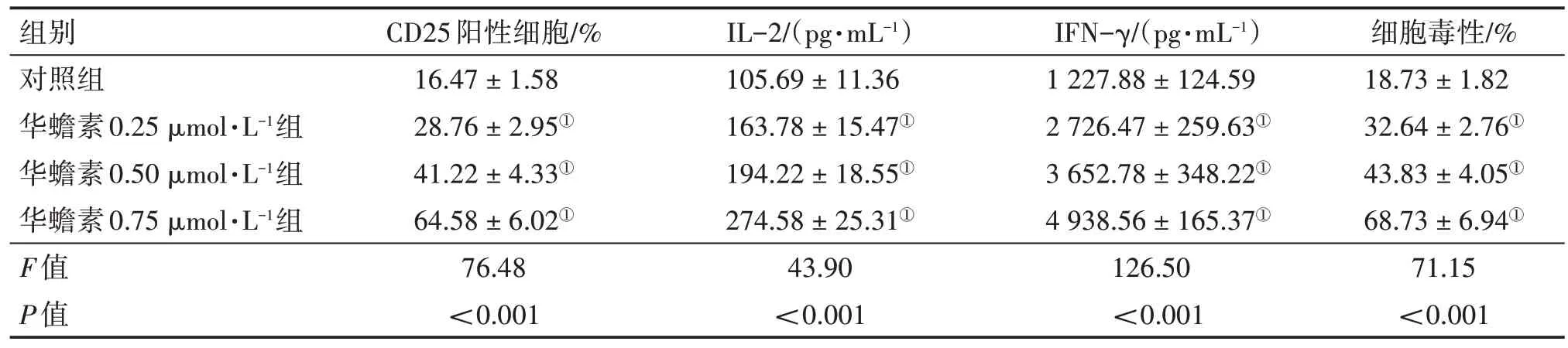
表1 华蟾素对CD8+T细胞抗肿瘤能力的影响Table 1 Effects of cinobufotalin on the anti-tumor ability of CD8+T cells (± s)
注:①P<0.05,与对照组比较
?
2.4 华蟾素通过抑制MYH9/USP7 促进c-MYC泛素化和降解分子对接结果显示华蟾素和MYH9的分子对接结合能为-9.9 kcal·mol-1,结合作用强烈且形成多个作用键,见图4-A。使用华蟾素(0.25、0.5、0.75µmol/L)处理HL-60细胞,Western Blot 法检测MYH9、USP7 和c-MYC 的表达,结果表明,相比对照组,华蟾素可抑制MYH9、USP7和c-MYC 的表达,见图4-B。Co-IP 法检测结果表明,MYH9 通过募集USP7 抑制c-MYC 的泛素化,见图4-C。图4-D结果表明,相比对照组,华蟾素能够抑制c-MYC 的蛋白表达,蛋白酶体抑制剂MG132 能够促进c-MYC 的蛋白表达,而华蟾素能够逆转MG132 对c-MYC 的促进作用,促进c-MYC蛋白降解。
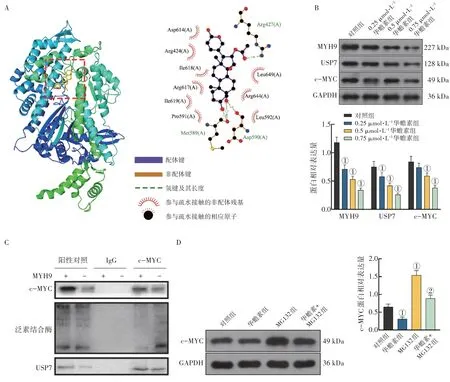
图4 华蟾素通过抑制MYH9/USP7促进c-MYC泛素化和降解Figure 4 Cinobufotalin promotes c-MYC ubiquitination and degradation by inhibiting MYH9/USP7
2.5 华蟾素通过抑制MYH9/USP7/c-MYC 通路增强CD8+ T 细胞的抗肿瘤活性为了验证华蟾素在AML 中的作用机制,本研究评估过表达MYH9对CD8+T 细胞功能的影响。结果显示:与对照组比较,华蟾素组CD25阳性细胞比例,IL-2、IFN-γ水平和细胞毒性增强,而MYH9 组则相反(均P<0.01);与华蟾素组比较,华蟾素+MYH9 组的CD25 阳性细胞比例,IL-2、IFN-γ 水平和细胞毒性均被抑制(均P<0.01)。表明华蟾素对CD8+T 细胞抗肿瘤活性的作用能够被MYH9 过表达逆转。见表2。Western Blot检测结果显示,与MYH9组比较,华蟾素0.75 µmol/L+MYH9 组MYH9、USP7 和c-MYC的蛋白表达水平均降低(P<0.01),见表3。
表2 各组HL-60细胞活化后CD25阳性细胞比例,IL-2、IFN-γ水平和细胞毒性比较Table 2 Comparison of proportion of CD25 positive cells,concentration of IL-2,IFN-γ and cytotoxicity among various groups of activated HL-60 cells (± s)
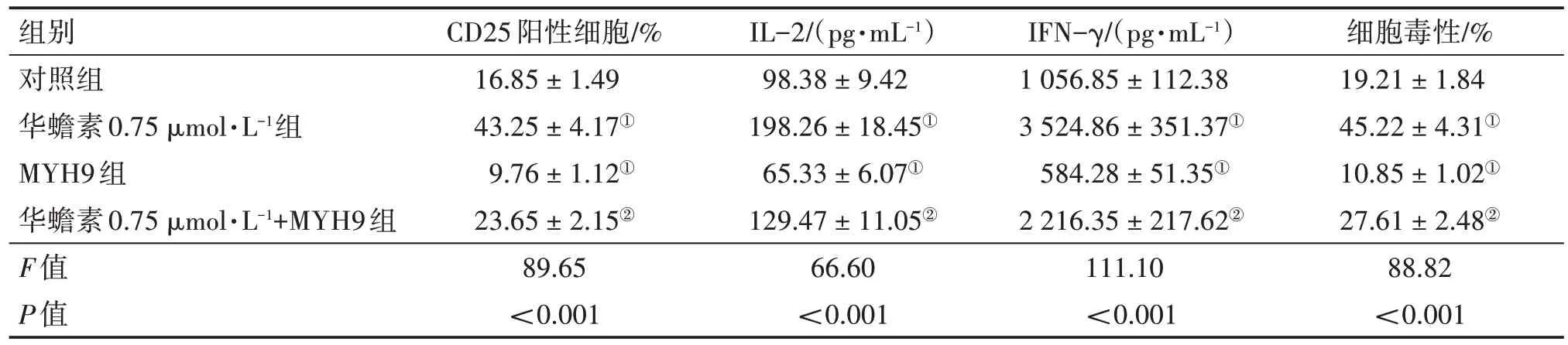
表2 各组HL-60细胞活化后CD25阳性细胞比例,IL-2、IFN-γ水平和细胞毒性比较Table 2 Comparison of proportion of CD25 positive cells,concentration of IL-2,IFN-γ and cytotoxicity among various groups of activated HL-60 cells (± s)
注:①P<0.05,与对照组比较;②P<0.05,与华蟾素0.75µmol/L组比较
?
表3 各组HL-60细胞MYH9、USP7、c-MYC相对蛋白表达量比较Table 3 Comparison of the relative protein expressions of MYH9,USP7 and c-MYC in HL-60 cells among various groups (± s)
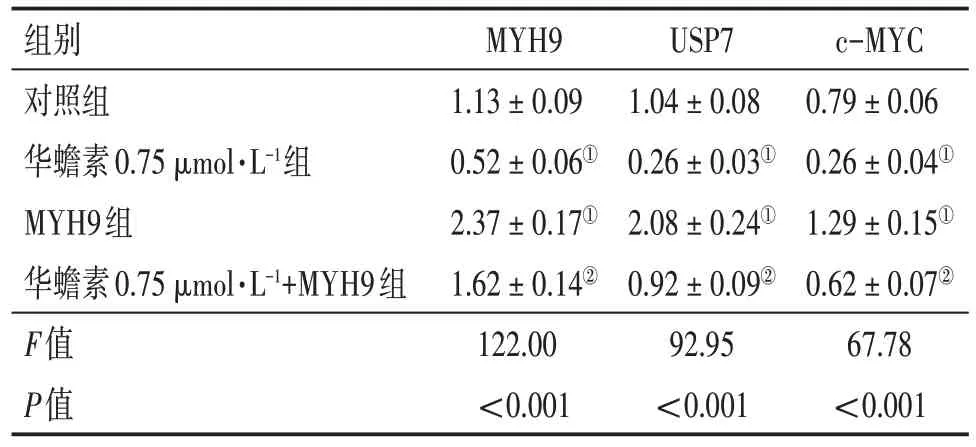
表3 各组HL-60细胞MYH9、USP7、c-MYC相对蛋白表达量比较Table 3 Comparison of the relative protein expressions of MYH9,USP7 and c-MYC in HL-60 cells among various groups (± s)
注:①P<0.05,与对照组比较;②P<0.05,与华蟾素0.75µmol·L-1组比较
?
3 讨论
目前急性髓系白血病(AML)的治疗方法主要包括阿糖胞苷联合柔红霉素的标准“7+3 方案”、分子靶向治疗、同种异体造血干细胞移植[11]。尽管在过去几年里批准了一些新的分子靶向疗法,但AML 的预后仍不理想[12]。有研究[13]表明,通过靶向激活与自然杀伤细胞和T细胞免疫识别的相关受体可以抑制AML 免疫逃逸。临床研究[14-15,5]表明,华蟾素在胆囊癌、肺癌、结肠癌中均具有良好的抗癌活性;但其在AML 中的作用和相关分子机制尚不清楚。本研究发现华蟾素通过减弱MYH9介导的c-MYC 去泛素化抑制AML 细胞活力、侵袭,并促进细胞凋亡。同时,华蟾素还能够增强CD8+T细胞抗肿瘤能力,抑制AML细胞免疫逃逸。
AML 免疫逃逸涉及多种机制,主要包括抗原呈递分子减少、T 细胞和NK 细胞的细胞毒功能抑制、免疫微环境的改变[16]。肿瘤部位T细胞的存在是启动免疫识别和杀死AML 细胞的先决条件。据报道,活化的CD4+和CD8+T 细胞可以直接抑制AML 的进展,且肿瘤部位中淋巴细胞和T 细胞的浸润增多与AML 的预后改善相关[17-18]。白血病细胞衍生的外泌体通过抑制CD8+T 细胞的免疫功能诱导AML 细胞免疫逃逸[19]。本研究结果表明,华蟾素处理可上调CD8+T 细胞表面激活标志物CD25的表达,促进效应细胞因子IL-2 和IFN-γ 的生成增加。此外,华蟾素处理还增强CD8+T 细胞对HL-60 细胞的毒性。提示华蟾素处理可通过增强CD8+T细胞的免疫功能抑制AML细胞免疫逃逸。
MYH9最初被发现其异常突变会导致血小板减少症,最近的研究表明MYH9 作为致癌基因,在人类多种癌症(如肝细胞癌、胶质瘤)中过度表达,促进癌细胞增殖、迁移、侵袭和化疗耐药[20-21]。据报道,抑制MYH9 的表达可以增加结直肠癌肿瘤微环境中CD8+T 细胞的浸润[22]。c-MYC 是一个关键的癌基因,靶向c-MYC 核定位区域并通过泛素-蛋白体(UPS)途径促进c-MYC 蛋白降解可以有效消退包括AML 在内的多种高表达c-MYC 的肿瘤[23]。泛素化是一种蛋白质翻译后修饰,UPS 定向降解是抑制细胞内c-MYC 表达的主要方式之一[24]。既往已有关于肺癌的研究[10]表明,MYH9 表达的下调抑制USP7(一种去泛素化酶)的募集,进而促进c-MYC 泛素化降解。本研究结果表明,华蟾素抑制MYH9、USP7 和c-MYC 的表达,进一步研究显示MYH9 可以招募USP7 形成泛素连接酶复合物,并增强c-MYC 的稳定性。华蟾素处理后的MYH9 表达下调,对USP7 的招募减少。MG132 是一种蛋白酶体抑制剂,通过抑制细胞内蛋白酶体活性促进蛋白质的稳定性[25]。本研究使用MG132稳定细胞中c-MYC 的蛋白表达,发现华蟾素具逆转MG132 稳定c-MYC 蛋白的作用,促进c-MYC的泛素化和降解。
综上所述,华蟾素可以抑制AML 细胞恶性生物行为,并通过增强CD8+T 细胞的抗肿瘤能力抑制细胞免疫逃逸。华蟾素作为一种潜在的抗癌剂可通过抑制MYH9/USP7通路诱导c-MYC 降解在AML中发挥抑癌作用。然而,本研究也存在一些局限性和不足之处。首先,本研究主要基于体外细胞和裸鼠模型,在临床研究方面的数据信息并不明确,需要进一步进行临床前和临床试验来验证华蟾素在治疗AML 中的疗效和安全性。其次,本研究未对华蟾素与其他常用抗癌药物的联合应用进行探索,如华蟾素与化疗药物的协同效应等。未来,有待深入研究华蟾素在AML 治疗中的实际应用潜力,并进一步探索其作用机制。

