槐杞黄颗粒对糖尿病肾病大鼠及高糖环境下肾细胞的保护机制
王利元, 刘红, 李晶, 白梦婷, 吴悠
(武汉市中西医结合医院,湖北武汉 430030)
糖尿病肾病(diabetic kidney disease,DKD)是糖尿病最重要的微血管并发症之一,是终末期肾病(ESRD)的主要病因,伴有尿微量白蛋白分泌逐渐增加和肾小球硬化,是公认的心血管疾病的独立危险因素[1]。尽管糖尿病患者血糖、血脂、血压控制较好,但进展至ESRD 时,除肾脏替代治疗外,目前DKD仍缺乏有效的治疗手段[2]。因此,探索DKD 新的药物或治疗方法具有重要意义。槐杞黄颗粒是由槐耳菌质、枸杞子、黄精配制的中成药,既往临床观察发现,其可有效改善DKD 患者尿蛋白水平[3]。前期药理研究表明槐杞黄颗粒可通过保护肾小球足细胞、抑制肾小球系膜细胞增殖、抗肾间质纤维化、减轻肾脏炎症反应、抗氧化应激、调控肾脏细胞凋亡及调节免疫系统功能等多种机制干预慢性肾脏病的进展[4];但其具体作用机制尚不完全明确。因此,本研究构建DKD 大鼠模型以及对体外高糖暴露的肾细胞HK2 模型,进一步观察槐杞黄颗粒的肾保护作用机制,以期为槐杞黄颗粒临床应用于DKD 的治疗提供理论依据。现将研究结果报道如下。
1 材料与方法
1.1 实验动物SPF 级4~5 周龄雄性SD 大鼠,体质量110 ~150 g,购自于北京卓凯生物技术有限公司,动物质量合格证号:SYXK(京)2021-0025。所有动物饲养在SPF 房间,温度为(25 ±1)℃,相对湿度55% ~60%,光照/黑暗循环12 h,均可自由获得食物和饮用水。所有涉及动物的程序均严格按照武汉市中西医结合医院动物伦理委员会批准的指导方针和方案进行(批准号:20230015)。高脂肪饲料(40 kJ/kg,脂肪含量占20%)购自上海斯莱克实验动物有限责任公司。
1.2 细胞株人近端肾小管上皮细胞(HK2),购自中国典型培养物保藏中心。以添加100 U/mL青霉素/链霉素混合物和10%胎牛血清的RPMI-1640 培养基,在37 ℃、5%CO2的潮湿环境中培养。
1.3 药物、试剂与仪器槐杞黄颗粒(启东盖天力药业有限公司生产,批号:国药准字B20020074);氯沙坦(美国MCE 公司,CAS:114798-26-4,纯度:99.67%)。RPMI-1640 培养基(上海哈灵生物科技有限公司);胎牛血清(德国Capricorn Scientific GmbH 公司);链脲佐菌素(streptozotocin,STZ)(美国Sigma公司);尿微量白蛋白酶联免疫吸附测定(ELISA)试剂盒(上海江莱生物科技有限公司);空腹血糖、血清肌酐、总胆固醇和低密度脂蛋白胆固醇等检测试剂盒(南京建成生物工程研究所有限公司);纤维连接蛋白(FN)抗体、Ⅳ型胶原蛋白(Col Ⅳ)抗体(美国Abcam 公司);NOD 样受体蛋白3(NLRP3)抗体(美国Epitomics公司);裂解型半胱天冬酶3(cleaved-Caspase-3)抗体、白细胞介素1β(IL-1β)抗体和β-actin 抗体(美国Cell Signaling Technology 公司);二抗包括过氧化物酶偶联山羊抗兔和抗小鼠免疫球蛋白G(IgG)(美国Jackson ImmunoResearch Laboratory 公司);2’,7’-二氢二氯荧光素二乙酸酯(DCFH-DA)(Beyotime 公司);聚偏氟乙烯(PVDF)膜(美国Millipore 公司)。ACCU-CHEK血糖测定仪(瑞士Roche公司)。
1.4 体内实验
1.4.1 分组、造模与给药 大鼠适应性喂养1 周后,随机分为2组:正常组(10只)、造模组(63只)。造模组大鼠采用高脂肪饲料喂养结合STZ腹腔注射法构建DKD模型[5]。方法:造模组大鼠饲喂高脂肪饲料(40 kJ/kg,脂肪含量占20%)4 周,同期正常组大鼠饲喂正常颗粒饲料(20 kJ/kg,脂肪含量占5%),然后造模组大鼠单次腹腔注射30 mg/kg STZ[溶解于冰冷的柠檬酸钠缓冲液(0.1 mol/L,pH 4.4)],正常组大鼠注射等体积的柠檬酸钠缓冲液。STZ 注射后第3 天,采用血糖测定仪测定大鼠尾尖空腹血糖,若血糖>16.7 mmol/L,再结合肾组织病理结果,则判断DKD 模型构建成功。将造模成功的大鼠随机分为5 组,即模型组,槐杞黄颗粒低、中、高剂量组及氯沙坦组,每组10 只。槐杞黄颗粒低、中、高剂量组大鼠分别给予25、50、100 mg·kg-1·d-1槐杞黄颗粒生理盐水混悬液灌胃,氯沙坦组以20 mg·kg-1·d-1氯沙坦生理盐水混悬液灌胃,模型组和正常组给予等体积生理盐水灌胃。疗程均为12 周。动物剂量按成人与大鼠的体表面积换算。每2周测定一次体质量和空腹血糖。干预结束后,测定尿微量白蛋白,然后称体质量,麻醉处死,快速采集血液、肾脏等样本。
1.4.2 血清与尿液生化指标分析 干预结束后,收集24 h 尿液,采用ELISA 法测定尿微量白蛋白水平。采用葡萄糖氧化酶(GOD)/过氧化物酶(POD)法测定空腹血糖,采用肌氨酸氧化酶(SOX)法测定血清肌酐,甘油磷酸氧化酶(GPO)-PAP法测定血清总胆固醇,双试剂直接法检测血清低密度脂蛋白胆固醇。
1.4.3 肾指数 称体质量、肾脏质量,计算肾指数,公式:肾指数(mg/g)=肾质量(mg)/体质量(g)。
1.4.4 肾组织病理学观察 取肾脏组织,在4%多聚甲醛溶液中固定24 h,石蜡包埋,4µm 切片。采用苏木素-伊红(HE)染色法进行一般病理形态学分析,采用高碘酸希夫(PAS)染色法进行肾小球硬化评估,采用马松(Masson)染色法进行胶原沉积和间质病变评估。每组随机选取20 个肾小球,用ImageJ软件(National Institute of Health,美国)评估肾小球中PAS阳性面积的百分比,记为系膜指数。
1.5 体外实验
1.5.1 采用四甲基偶氮唑盐(MTT)法测定细胞增殖能力 将细胞以4 000 个/孔接种于96 孔板中,每组设6 个平行孔。将细胞暴露于正常葡萄糖(5 mmol/L)或高糖(30 mmol/L)[6]中,每孔分别加入终浓度为10、20、40、80µmol/L 的槐杞黄颗粒培养48、72 h。加入MTT 溶液(0.5 mg/mL),37 ℃孵育4 h,应用酶标仪于570 nm 波长处测定吸光度(OD)值。
1.5.2 细胞内ROS 生成和线粒体ROS 生成的检测 将细胞以4 000 个/孔接种于96 孔板中,每组设6 个平行孔,暴露于正常葡萄糖(5 mmol/L)或高糖(30 mmol/L)中,每孔分别加入5、10、20 µmol/L 槐杞黄颗粒孵育24 h。加入10µmol/L 的ROS 荧光探针DCFH-DA 避光培养20 min 后,应用荧光分光光度计检测。
为了观察线粒体ROS 生成情况,将细胞以1×105个/mL 的密度接种于直径35 mm 培养皿的盖玻片上。贴壁后,将细胞暴露于正常葡萄糖(5 mmol/L)或高糖(30 mmol/L)中,同时用或不用20µmol/L 槐杞黄颗粒处理24 h。同时段,甘露醇组不加槐杞黄颗粒以排除渗透压影响:5 mmol/L葡萄糖+25 mmol/L甘露醇。进行MitoSOX(呈红色)/Hoechst 33342(呈蓝色)染色。所有实验过程均在避光条件下进行,应用激光扫描共聚焦显微镜对样品进行观察。
1.5.3 蛋白免疫印迹(Western Blot)法检测炎症小体相关蛋白NLRP3、cleaved-Caspase-3 和IL-1β及肾纤维化相关蛋白FN 和Col Ⅳ的表达 将细胞以8×104个/孔接种在6 孔板,每组设3 个平行孔。细胞贴壁后,暴露于正常葡萄糖(5 mmol/L)或高糖(30 mmol/L)下,每孔中加入槐杞黄颗粒,最终浓度分别为5、10、20 µmol/L,培养72 h。同时段,不加槐杞黄颗粒的甘露醇组(5 mmol/L 葡萄糖+25 mmol/L 甘露醇)排除渗透影响。然后收集细胞,裂解、提取蛋白,进行聚丙烯酰胺凝胶电泳,并转移到PVDF 膜上。3%牛血清白蛋白封闭,加入一抗和二抗孵育,显色,显影。采用ImageJ 软件进行半定量分析。
1.6 统计方法采用GraphPad Prism 6 统计软件进行数据分析。至少3 个独立实验的结果以均数±标准差 (±s)表示。2 组间比较采用Studentt检验(双尾),多组间的比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 槐杞黄颗粒对DKD 大鼠尿微量白蛋白排泄、血清肌酐水平,高血糖和脂质代谢紊乱及肾脏组织病理病变的影响在槐杞黄颗粒给药12 周结束时,检测反映肾损伤的24 h 尿微量白蛋白排泄量和反映肾功能的血清肌酐水平。如图1-A~B 结果所示:与正常组比较,模型组尿微量白蛋白和血清肌酐水平显著升高(P<0.05);而与模型组比较,50、100 mg/kg 槐杞黄颗粒组的尿微量白蛋白和血清肌酐水平显著降低(P<0.05)。测定空腹血糖以评价槐杞黄颗粒对糖代谢的影响,如图1-C 结果所示:与模型组比较,25、50 mg/kg槐杞黄颗粒组大鼠空腹血糖水平显著降低(P<0.05)。观察槐杞黄颗粒对脂质代谢紊乱的调节作用,如图1-D~E结果所示:与正常组比较,模型组低密度脂蛋白胆固醇和总胆固醇的水平显著升高(P<0.05);50、100 mg/kg槐杞黄颗粒组的低密度脂蛋白胆固醇和总胆固醇水平水平显著低于模型组(P<0.05)。此外,与正常组比较,模型组肾指数显著升高(P<0.05);与模型组比较,50、100 mg/kg 槐杞黄颗粒组肾指数显著下降(P<0.05)。槐杞黄颗粒各剂量组以上各指标与氯沙坦组比较,差异均无统计学意义(P>0.05)。见图1-F。
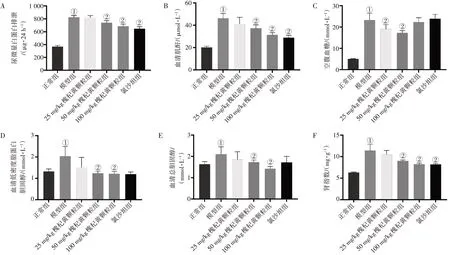
图1 各组大鼠24 h尿微量白蛋白、血清肌酐、血糖、血脂及肾指数水平比较Figure 1 Comparison of 24-hour urinary albumin,serum creatinine,blood glucose,blood lipids and renal index levels in rats among various groups
肾组织切片分别进行HE、PAS 和Masson 染色,结果显示:与正常组比较,模型组大鼠出现肾脏病理改变, 包括HE 染色可见系膜基质增加,PAS 染色可见明显的节段性肾小球硬化。由于DKD 动物模型的局限性,所有DKD 大鼠Masson 染色均未见间质病变。与模型组比较,槐杞黄颗粒各剂量组肾脏病变明显减轻,特别是100 mg/kg 槐杞黄颗粒。见图2。各组PAS 染色量化肾小球系膜基质扩张情况见图3,结果显示:模型组肾小球系膜指数显著高于正常组(P<0.05),50、100 mg/kg槐杞黄颗粒组肾小球系膜指数显著低于模型组(P<0.05),且与氯沙坦组比较,差异无统计学意义(P>0.05)。表明槐杞黄颗粒可抑制DKD 大鼠的细胞外基质积累和系膜基质扩张,减轻肾纤维化。
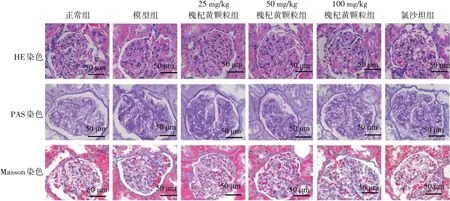
图2 各组大鼠肾脏组织病理病变比较(×400)Figure 2 Comparison of features of renal histopathological lesions in rats among various groups(×400)
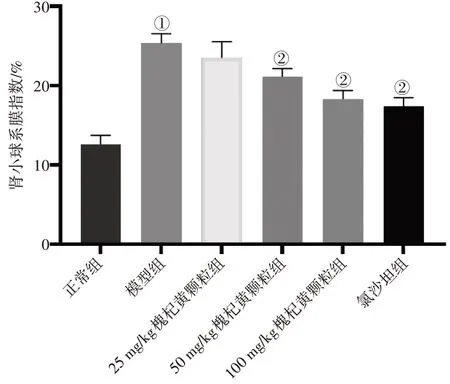
图3 各组PAS染色量化肾小球系膜基质扩张比较Figure 3 Comparison of PAS staining quantitative glomerular mesangial matrix expansion among various groups
2.2 槐杞黄颗粒对高糖诱导HK2细胞增殖活力的影响采用MTT 法检测槐杞黄颗粒对HK2 细胞增殖的影响,如图4所示:与正常糖组比较,高糖暴露48、72 h 后HK2 细胞增殖活力增加(P<0.05)。与不含槐杞黄颗粒的高糖组比较,高于20µmol/L槐杞黄颗粒处理48 h 和72 h 后细胞增殖活力显著降低(P<0.05)。

图4 槐杞黄颗粒对高糖诱导人肾近端小管上皮细胞(HK2)48、72 h增殖情况的影响(n=6)Figure 4 Effect of Huaiqihuang Granules on the proliferation of human renal proximal tubular epithelial cells(HK2)induced by high glucose for 48 and 72 hours(n=6)
2.3 槐杞黄颗粒对高糖诱导HK2细胞内ROS生成和线粒体ROS生成的影响采用荧光探针DCFHDA 法和MitoSOX/Hoechst 33342 染色法分别检测HK2 细胞胞内ROS 生成和线粒体ROS 生成。结果如图5-A 所示:与正常糖组比较,高糖组细胞内ROS 水平显著升高(P<0.05);与高糖组比较,槐杞黄颗粒处理后ROS 水平呈浓度依赖性降低,特别是10µmol/L和20µmol/L浓度的槐杞黄颗粒处理组HK2 细胞中ROS 的产生显著减少(P<0.05)。如图5-B 所示,在高糖组中观察到线粒体ROS 生成增加,但被20µmol/L 的槐杞黄颗粒处理后显著抑制。此外,正常糖组和甘露醇组线粒体ROS 生成无明显差异。这2个ROS检测实验证实了槐杞黄颗粒可增强高糖诱导肾细胞的抗氧化能力。
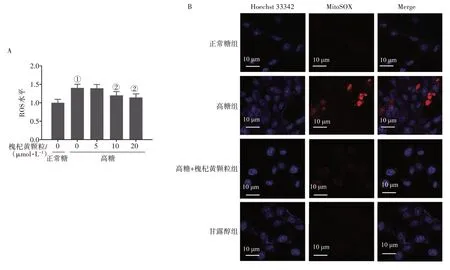
图5 槐杞黄颗粒对高糖诱导HK2细胞内ROS生成和线粒体ROS生成的影响Figure 5 Effects of Huaiqihuang Granules on intracellular ROS generation and mitochondrial ROS generation in HK2 cells induced by high glucose
2.4 槐杞黄颗粒对高糖诱导HK2细胞NLRP3炎症小体活化的影响如图6 所示:与正常糖组比较,高糖组的NLRP3、cleaved-Caspase-1和IL-1β 的蛋白表达水平显著提高;而与高糖组比较,槐杞黄颗粒组的NLRP3、cleaved-Caspase-1和IL-1β 的蛋白表达水平显著降低(P<0.05)。
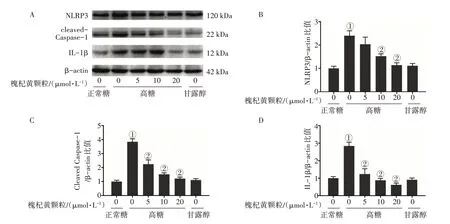
图6 槐杞黄颗粒对高糖诱导HK2细胞NLRP3炎症小体活化的影响Figure 6 Effect of Huaiqihuang Granules on NLRP3 inflammasome activation in HK2 cells induced by high glucose
2.5 槐杞黄颗粒对高糖诱导HK2 细胞肾纤维化相关蛋白FN、Col Ⅳ表达的影响如图7 所示:HK2 细胞中FN、Col Ⅳ的蛋白表达水平在高糖作用下升高,但在槐杞黄颗粒处理后逐渐降低。高糖组HK2 细胞中FN、Col Ⅳ的蛋白表达水平显著高于正常糖组(P<0.05);10、20µmol·L-1槐杞黄颗粒组细胞中FN、Col Ⅳ的蛋白表达水平显著低于高糖组(P<0.05)。

图7 槐杞黄颗粒对高糖诱导HK2细胞纤维连接蛋白(FN)和Ⅳ型胶原蛋白(Col Ⅳ)表达的影响Figure 7 Effects of Huaiqihuang Granules on the expression of fibronectin(FN)and collagen Ⅳ(Col Ⅳ)in HK2 cells induced by high glucose
3 讨论
糖尿病肾病(DKD)属中医消渴病并发症,其病因归同消渴病。糖尿病肾病的基本病机为本虚标实,气阴两虚是发病根本,病变初期以阴虚为主,迁延日久阴伤及气,终致气阴两虚,贯穿始终,其他变证均由气阴两虚所致,只有气阴两虚得到有效控制,疾病才能有所缓解[6]。槐杞黄颗粒正具有益气养阴功效。本研究结果表明,槐杞黄颗粒可显著改善DKD 大鼠的尿微量白蛋白排泄、血清肌酐水平,高血糖及脂质代谢紊乱,并可通过抑制细胞外基质积聚和系膜基质扩张而减轻肾脏纤维化,从而减轻DKD 大鼠的肾损害,提示槐杞黄颗粒可能成为治疗DKD的一种新药物。
氧化应激和慢性低度炎症在DKD 中起着至关重要的作用[7]。高糖不仅促进ROS的生成和NLRP3炎症小体的激活[8],也会刺激包括纤维连接蛋白(FN)和Ⅳ型胶原蛋白(Col Ⅳ)在内的细胞外基质蛋白在DKD 中的积累增加,从而导致肾小球硬化和小管间质纤维化[9]。在经典DKD发病机制的初始激活和核心事件中,ROS 的产生可以通过PI3K 途径激活炎症介质,从而促进巨噬细胞中Caspase-1 的激活和IL-1β 的分泌[10-11]。高血糖或高糖诱导的NLRP3 炎症介质的关键调节因子硫氧还蛋白相互作用蛋白(TXNIP),与NLRP3 共同构成细胞应激传感器,识别过度氧化应激或危险信号,触发炎症反应。ROS 刺激后,氧化的硫氧还蛋白(Trx)释放出硫氧还蛋白相互作用蛋白,直接结合NLRP3的LRR 结构域,介导炎症小体的组装[12]。ROS 还可以引起核转录因子κB(NF-κB)和p38 丝裂原活化蛋白激酶(p38MAPK)信号激活NLRP3 炎症小体[13]。激活的NLRP3 炎症小体刺激促炎细胞因子的分泌,随后Caspase-1 激活,引发慢性低度炎症。此外,ROS 通过促进肾脏炎性细胞因子的产生,加速细胞外基质的过度积累。本研究结果表明,高糖刺激诱导HK2 细胞增殖,过量的ROS 生成,激活NLRP3炎症小体和细胞外基质蛋白表达。槐杞黄颗粒抑制高糖诱导的HK2 细胞增殖、细胞内和线粒体ROS 过量生成,显著降低高糖诱导的HK2 细胞肾纤维化标志蛋白FN、Col Ⅳ,NLRP3炎症小体活化及cleaved-Caspase-1 和IL-1β表达。
综上所述,槐杞黄颗粒可以降低DKD 大鼠的尿微量白蛋白排泄、血清肌酐水平,改善糖脂代谢紊乱,减轻肾脏组织病理损害。槐杞黄颗粒可能通过抑制高糖诱导HK2 细胞ROS 生成、减轻NLRP3 炎症小体的激活和肾纤维化相关蛋白的表达发挥肾保护作用。

