苦参碱调节IL-6/STAT3信号通路对炎症性肠病大鼠肠黏膜损伤的影响
孔冰慧, 白龙洲, 杨丽
[1.河南中医药大学第五临床医学院(郑州人民医院),河南郑州 450046;2.郑州人民医院消化内科,河南郑州 450053]
炎症性肠病(inflammatory bowel disease,IBD)是临床常见的以溃疡性结肠炎和克罗恩病为主的炎症性肠道疾病,作为一种免疫介导的非特异性、进行性慢性疾病,可发生于各年龄层,但在儿童中多发,可造成腹泻、腹痛、黏液性脓血便、肠黏膜溃疡等症状,极大危害了患者身心健康,特别是对儿童身心发育造成很大负面影响[1-2]。目前临床治疗以减轻症状与防治并发症为主,但部分患者疗效不佳[3-4]。而中医药因疗效独特、毒副作用小,被广泛应用于防治IBD 中,成为研究热点。IBD 归属中医“肠僻”“泄泻”“痢疾”等范畴,邪毒损及脾胃、湿热下迫大肠是其主要病机,主要以清热、祛毒、燥湿法进行治疗[5]。苦参,为豆科植物苦参Sophora flavescensAit. 的干燥根,性寒、味苦,具有燥湿清热、杀菌凉血等功效,对湿热导致的腹泻、痢疾、黄疸等有一定疗效。苦参碱是苦参的主要活性成分,既往研究表明,其可抑制结直肠推进运动、调节胃肠道功能、保护胃肠黏膜,能用于防治结肠炎、胃炎、腹泻等胃肠道疾病[6-9];但其对IBD 的具体治疗作用及机制尚不清楚。
现代医学研究[10-11]表明,炎症因子与氧自由基等介质的过度释放引发的炎性级联反应及氧化应激在IBD 发病过程中起到重要作用。白细胞介素6(IL-6)/信号转导子和转录激活子3(STAT3)是调控过氧化及炎性级联反应的关键信号,与各种肠道疾病的发生发展关系密切。有研究表明,抑制IL-6/STAT3 信号通路可降低炎性细胞因子水平,进而减轻5-氟脲嘧啶化疗诱导的肠黏膜炎[12],并可缓解右旋糖酐硫酸钠诱导IBD 小鼠的结肠炎症状[13]。由此可知IL-6/STAT3 是治疗IBD 的潜在靶点。因此,本研究以IBD大鼠模型为研究对象,探讨苦参碱调节IL-6/STAT3 信号通路对其肠黏膜损伤的影响,以期为苦参碱在IBD临床治疗中的开发应用提供新的理论资料,现将研究结果报道如下。
1 材料与方法
1.1 实验动物53只SPF级健康雄性SD大鼠,体质量200 ~240 g,鼠龄为7 周,购自厦门万泰沧海生物技术有限公司,生产许可证号:SCXK(闽)2018-0002。所有大鼠在河南中医药大学动物房中饲养,动物使用许可证号:SYXK(豫)2022-0004。动物房内维持屏障环境,湿度为55%~65%、温度为23 ~26 ℃、光照为12 h/12 h 明暗循环。本动物实验获得河南中医药大学伦理委员会审批通过,批号:22-073623。
1.2 药物、试剂与仪器苦参碱(中国食品药品检定研究院提供,批号:110805-201709,纯度:98.7%),分子式:C15H24N2O,分子量:248.37,分子结构:摩尔折射率为71.12、摩尔体积为213.3(cm3/moL)、等张比容为562.5(90.2 K)、表面张力为48.3(dyne/cm)、极化率为28.19(10-24cm3),将其溶于生理盐水中制成3、6 mg/mL 的苦参碱溶液备用。三硝基苯磺酸(TNBS)(大连美仑生物技术有限公司,批号:MB5547-1);colivelin(美国TargetMol公司,批号:143955,纯度:96.56%);大鼠IL-6、C-反应蛋白(CRP)酶联免疫吸附测定(ELISA)试剂盒,苏木素-伊红(HE)染色试剂盒,超氧化物歧化酶(SOD)检测试剂盒,兔源抗大鼠IL-6、p-STAT3、STAT3 及β-actin 等一抗,标记辣根过氧化物酶(HRP)的驴抗兔二抗(均美国Abcam 公司);丙二醛(MDA)检测试剂盒(北京索莱宝科技有限公司)。HistoCore MULTICUT 半自动轮转式切片机、Aperio VERSA 数字病理显微镜[徕卡显微系统(上海)贸易有限公司];UM10超薄切片机(江苏雷博科学仪器有限公司);ZC1099 透射电镜(上海茁彩生物科技有限公司);LD-96A全自动酶标仪(山东莱恩德智能科技有限公司);PowerPac Basic 1645050 电泳仪、UVTransilluminator 化学发光凝胶成像仪、Mini PROTEAN 蛋白电泳与转膜仪(美国伯乐公司)。
1.3 IBD 大鼠模型制备与分组处理参考文献研究[14],采用TNBS 结肠灌注法制备IBD 大鼠模型。具体操作:以生理盐水配制质量分数为50%的TNBS 溶液,取43 只SD 大鼠进行结肠灌注(灌胃针经大鼠肛门插入8 cm),TNBS 剂量为100 mg/kg,倒提大鼠30 s,继续常规饲养,3 d 后观察大鼠。若其发生进食明显减少,腹部肿大,大便稀软、带血并附着肛门,即视为IBD大鼠造模成功。结果因操作不当死亡1 只,另有2 只未出现IBD 典型症状,造模失败,共成功造模40 只。将造模成功的大鼠随机分为模型组、苦参碱低剂量组、苦参碱高剂量组、苦参碱高剂量+colivelin 组,每组10只,再选10 只正常大鼠结肠灌注等体积生理盐水作为正常组。
分组处理:苦参碱低、高剂量组大鼠灌胃30、60 mg/kg 苦参碱(3、6 mg/mL 的苦参碱生理盐水溶液分别灌胃10 mL/kg)[15],同时腹腔注射10 mL/kg生理盐水;苦参碱高剂量+colivelin 组大鼠灌胃60 mg/kg苦参碱(6 mg/mL的苦参碱生理盐水溶液分别灌胃10 mL/kg),同时腹腔注射1 mg/kg 的colivelin(0.1 mg/mL 的colivelin 生理盐水溶液注射10 mL/kg)[16];模型组、正常组大鼠分别灌胃及腹腔注射10 mL/kg 生理盐水。各组大鼠均处理7 d,每日1次。
1.4 观察指标与检测方法
1.4.1 大鼠体质量和疾病活动指数(DAI) 造模成功后开始测量各组大鼠体质量,此时记为第0 天,2 d 测一次体质量,直至末次处理后24 h,此时记为第8天。测量结束后观察大鼠便血、腹泻情况并进行DAI 评分[14]:体质量不降低且无便血、腹泻情况,计0 分;体质量降低1% ~5%,无腹泻、便血情况或不明显,计1 分;体质量降低6% ~10%,呈隐血便且形状松散、半成形、不粘附肛门,计2 分;体质量降低11%~15%,呈稀便且不粘附于肛门,计3 分;体质量降低15%以上,呈稀水样便且粘附于肛门,腹泻明显、肉眼可见便血,计4分。
1.4.2 HE 染色、透射电镜分别观察大鼠结肠黏膜组织病理学、超微结构变化并采集标本 DAI评分结束后在充满乙醚的玻璃瓶内麻醉各组大鼠,开腹取腹主动脉血离心(1 000 r/min、离心半径20 cm、4 ℃、10 min),分别收集各组血清存于-20 ℃备用;取出结肠组织,漂洗后剪下约0.5 g黏膜组织存在液氮备用。
HE 染色:剩余结肠黏膜组织取1.5 cm ×1.5cm × 0.2 cm 的大小,以80% ~100%乙醇梯度脱水、二甲苯透明、热石蜡包埋、切片,所得约5 µm厚的切片进行二甲苯脱蜡、100%~75%梯度水化处理,按HE 染色试剂盒说明书中方法行HE 染色。蒸馏水漂洗后以数字病理显微镜观察大鼠结肠黏膜组织形态并采集其任意视野图像。参考文献研究[17]中标准进行结肠黏膜组织病理评分:固有层很少有炎症细胞,无溃疡灶,计0分;固有层有少量炎症细胞浸润,有1 ~2 个溃疡灶,病变深入黏膜层,计1分;炎症细胞进入黏膜下层,有3 ~4 个溃疡灶,病变深入黏膜下层,计2 分;炎症细胞广泛浸润结肠黏膜组织,有广泛且连续的溃疡灶,病变深入肌肉层,计3分;溃疡病变深入浆膜且有大量炎症细胞浸润,计4分。
透射电镜:取0.5 cm × 1.5 cm × 0.2 cm 大小的结肠黏膜组织,以4%多聚甲醛固定、蒸馏水漂洗、锇酸固定、80% ~100%梯度乙醇和纯丙酮脱水,然后渗透、包埋、切片所得70 nm 厚的切片以醋酸双氧铀和枸橼酸铅进行双染,干燥后应用透射电镜观察结肠黏膜组织超微结构并采集其任意视野图像。
1.4.3 大鼠血清和结肠黏膜组织IL-6、CRP、SOD、MDA 水平检测 取结肠黏膜组织,裂解、匀浆,离心(3 000 r/min、离心半径20 cm、4 ℃、20 min)取上清,比色法检测SOD、MDA 水平,采用ELISA 法检测IL-6、CRP 水平。采用上述同样方法检测血清CRP、IL-6、SOD、MDA 水平。具体检测方法按试剂盒说明书进行操作。
1.4.4 Western Blot 法检测大鼠肠黏膜组织IL-6/STAT3 通路相关蛋白表达 取结肠黏膜组织,裂解、匀浆,离心取上清,根据其总蛋白浓度测定结果每组取15µg 样本蛋白进行电泳。等蛋白按分子量大小分散在凝胶中后进行湿转,使其转印到PVDF膜上。以3%牛血清白蛋白溶液封闭后剪下内参蛋白β-actin和目的蛋白IL-6、STAT3、p-STAT3条带,以对应一抗(稀释比例均为1∶1 000)和二抗(稀释比例为1∶2 000)进行抗原抗体反应后显色,拍摄各组蛋白图像后以ImageJ 软件进行分析,定量图中各组蛋白灰度值后量化其相对表达(即检测目的蛋白与内参蛋白灰度值之比)。
1.5 统计方法采用SPSS 26.0软件进行统计学分析,计量数据以均数±标准差 (±s)表示,多组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠体质量及DAI评分比较图1 结果显示,随着给药时间的延长,苦参碱低、高剂量组大鼠体质量逐渐增加,尤其苦参碱高剂量组的体质量增长趋势似正常组。表1结果显示:与正常组比较,模型组大鼠体质量显著降低(P<0.05),DAI 评分显著升高(P<0.05);与模型组比较,苦参碱低、高剂量组大鼠体质量均升高(P<0.05),DAI 评分均降低(P<0.05);与苦参碱低剂量组比较,苦参碱高剂量组大鼠体质量升高(P<0.05),DAI 评分降低(P<0.05);与苦参碱高剂量组比较,苦参碱高剂量+colivelin 组大鼠体质量降低(P<0.05),DAI评分升高(P<0.05)。
表1 各组大鼠体质量及DAI评分比较Table 1 Comparison of body mass and DAI among various group of rats (± s)

表1 各组大鼠体质量及DAI评分比较Table 1 Comparison of body mass and DAI among various group of rats (± s)
注: ①P<0.05,与正常组比较;②P<0.05,与模型组比较;③P<0.05,与苦参碱低剂量组比较;④P<0.05,与苦参碱高剂量组比较
?
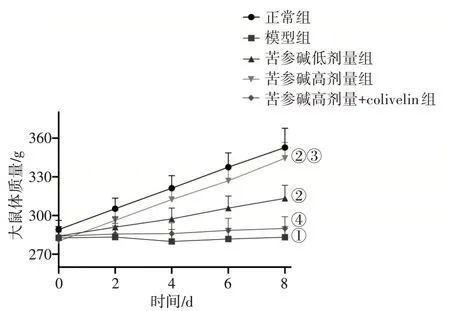
图1 各组大鼠体质量变化比较Figure 1 Comparison of body mass changes among various groups of rats
2.2 各组大鼠结肠黏膜组织病理学变化比较图2、表2结果显示:正常组大鼠结肠黏膜组织形态正常完好,无损伤;与正常组比较,模型组大鼠结肠黏膜组织出现严重病理损伤,可见结肠上皮细胞部分脱落且排列杂乱,结肠黏膜水肿、坏死明显并有不同程度的溃疡,肠绒毛坏死萎缩、稀疏,黏膜组织内有大量炎症细胞浸润,结肠黏膜组织病理评分显著升高(P<0.05);与模型组比较,苦参碱低、高剂量组大鼠结肠黏膜组织病理损伤均减轻,病理评分均降低(P<0.05);与苦参碱低剂量组比较,苦参碱高剂量组大鼠结肠黏膜组织病理损伤减轻,病理评分降低(P<0.05);与苦参碱高剂量组比较,苦参碱高剂量+colivelin 组大鼠结肠黏膜组织病理损伤加重,病理评分升高(P<0.05)。
表2 各组大鼠结肠黏膜组织病理评分比较Table 2 Comparison of pathological scores of colonic mucosal tissue among various groups of rats (± s)

表2 各组大鼠结肠黏膜组织病理评分比较Table 2 Comparison of pathological scores of colonic mucosal tissue among various groups of rats (± s)
注: ①P<0.05,与正常组比较;②P<0.05,与模型组比较;③P<0.05,与苦参碱低剂量组比较;④P<0.05,与苦参碱高剂量组比较
?

图2 各组大鼠结肠黏膜组织病理学变化(HE染色,×200)Figure 2 Pathological changes in colonic mucosal tissue in each group of rats(HE staining,×200)
2.3 各组大鼠结肠黏膜组织超微结构比较图3结果显示:正常组大鼠结肠黏膜组织超微结构正常,肠绒毛均匀且排列整齐,细胞及其核结构清晰,线粒体整体及嵴结构完整无异常,细胞间连接正常;与正常组比较,模型组大鼠结肠黏膜组织超微结构明显受损,可见肠绒毛脱失、断裂、倒伏、肿胀,细胞间质增宽,线粒体呈空泡样变性且嵴结构缺损,核质界限不清且染色质固缩严重;与模型组比较,苦参碱低、高剂量组大鼠结肠黏膜组织超微结构损伤均减轻;与苦参碱低剂量组比较,苦参碱高剂量组大鼠结肠黏膜组织超微结构损伤更轻;与苦参碱高剂量组比较,苦参碱高剂量+colivelin 组大鼠结肠黏膜组织超微结构损伤加重。

图3 各组大鼠结肠黏膜组织超微结构变化(透射电镜,×15 000)Figure 3 Ultrastructural changes in colonic mucosal tissue in each group of rats(transmission electron microscopy,×15 000)
2.4 各组大鼠血清炎症及氧化应激因子水平比较表3结果显示:与正常组比较,模型组大鼠血清CRP、IL-6、MDA 水平显著升高(P<0.05),SOD 水平显著降低(P<0.05);与模型组比较,苦参碱低、高剂量组大鼠血清CRP、IL-6、MDA 水平均降低(P<0.05),SOD 水平均升高(P<0.05);与苦参碱低剂量组比较,苦参碱高剂量组大鼠血清CRP、IL-6、MDA 水平降低(P<0.05),SOD 水平升高(P<0.05);与苦参碱高剂量组比较,苦参碱高剂量+colivelin 组大鼠血清CRP、IL-6、MDA水平升高(P<0.05),SOD水平降低(P<0.05)。
表3 各组大鼠血清CRP、IL-6、SOD、MDA水平比较Table 3 Comparison of serum CRP,IL-6,SOD,and MDA levels among various groups of rats (± s)
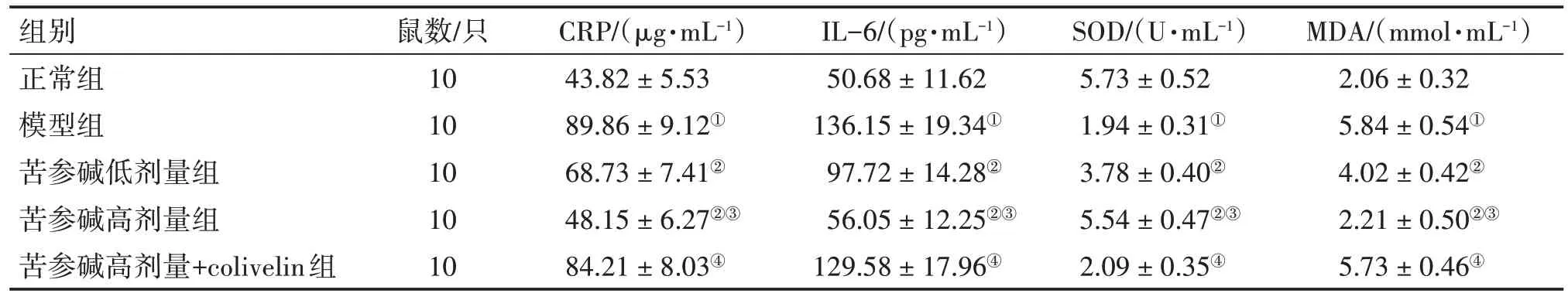
表3 各组大鼠血清CRP、IL-6、SOD、MDA水平比较Table 3 Comparison of serum CRP,IL-6,SOD,and MDA levels among various groups of rats (± s)
注:①P<0.05,与正常组比较;②P<0.05,与模型组比较;③P<0.05,与苦参碱低剂量组比较;④P<0.05,与苦参碱高剂量组比较
?
2.5 各组大鼠结肠黏膜组织炎症及氧化应激因子水平比较表4结果显示:与正常组比较,模型组大鼠结肠黏膜组织CRP、IL-6、MDA 水平显著升高(P<0.05),SOD 水平显著降低(P<0.05);与模型组比较,苦参碱低、高剂量组大鼠结肠黏膜组织CRP、IL-6、MDA 水平均降低(P<0.05),SOD水平均升高(P<0.05);与苦参碱低剂量组比较,苦参碱高剂量组大鼠结肠黏膜组织CRP、IL-6、MDA水平降低(P<0.05),SOD水平升高(P<0.05);与苦参碱高剂量组比较,苦参碱高剂量+colivelin组大鼠结肠黏膜组织CRP、IL-6、MDA 水平升高(P<0.05),SOD水平降低(P<0.05)。
表4 各组大鼠结肠黏膜组织CRP、IL-6、SOD、MDA水平比较Table 4 Comparison of CRP,IL-6,SOD,and MDA levels in colon mucosal tissue among various groups of rats (± s)

表4 各组大鼠结肠黏膜组织CRP、IL-6、SOD、MDA水平比较Table 4 Comparison of CRP,IL-6,SOD,and MDA levels in colon mucosal tissue among various groups of rats (± s)
注:①P<0.05,与正常组比较;②P<0.05,与模型组比较;③P<0.05,与苦参碱低剂量组比较;④P<0.05,与苦参碱高剂量组比较
?
2.6 各组大鼠结肠黏膜组织IL-6/STAT3通路相关蛋白表达比较图4、表5 结果显示:与正常组比较,模型组大鼠结肠黏膜组织IL-6 蛋白表达水平及p-STAT3/STAT3 比值显著升高(P<0.05);与模型组比较,苦参碱低、高剂量组大鼠结肠黏膜组织IL-6 蛋白表达水平及p-STAT3/STAT3 比值均降低(P<0.05);与苦参碱低剂量组比较,苦参碱高剂量组大鼠结肠黏膜组织IL-6 蛋白表达水平及p-STAT3/STAT3 比值降低(P<0.05);与苦参碱高剂量组比较,苦参碱高剂量+colivelin 组大鼠结肠黏膜组织IL-6 蛋白表达水平及p-STAT3/STAT3 比值升高(P<0.05)。
表5 各组大鼠结肠黏膜组织IL-6和p-STAT3/STAT3蛋白相对表达量比较Table 5 Comparison of relative expression levels of IL-6 and p-STAT3/STAT3 proteins in colon mucosal tissues among various groups of rats (± s)
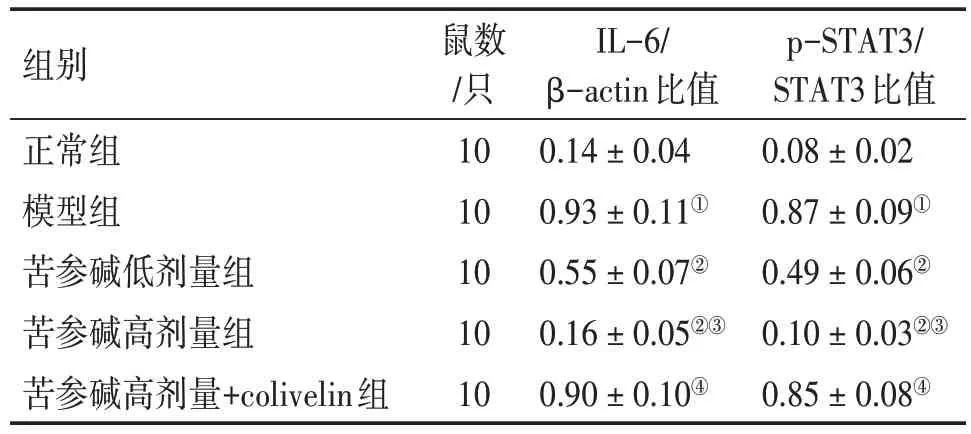
表5 各组大鼠结肠黏膜组织IL-6和p-STAT3/STAT3蛋白相对表达量比较Table 5 Comparison of relative expression levels of IL-6 and p-STAT3/STAT3 proteins in colon mucosal tissues among various groups of rats (± s)
注:①P<0.05,与正常组比较;②P<0.05,与模型组比较;③P<0.05,与苦参碱低剂量组比较;④P<0.05,与苦参碱高剂量组比较
?

图4 各组大鼠结肠黏膜组织IL-6、STAT3、p-STAT3蛋白的Western Blot条带Figure 4 Western Blot bands of IL-6,STAT3,and p-STAT3 proteins in colon mucosal tissues in each group of rats
3 讨论
本研究以TNBS 结肠灌注法构建炎症性肠病(IBD)大鼠模型,结果显示,结肠灌注TNBS 后可引发炎症因子CRP、IL-6 过度释放及抗氧化酶活性降低,诱导高水平的炎症和氧化应激,造成结肠黏膜组织超微结构明显受损并产生严重病理损伤,导致大鼠食欲明显降低,产生腹部肿大,大便稀软、带血并附着肛门的症状,提示大鼠IBD造模成功。
已有研究证实,炎症和过氧化反应造成的肠黏膜损伤是IBD的主要病理基础,保持氧化还原平衡并防止炎症进展是一种很有前途的IBD治疗选择,可有效改善肠上皮细胞损伤和肠道功能[10-11,18]。苦参碱作为一种具有抗炎及抗氧化作用的天然生物碱类化合物,研究表明,其可通过失活JAK2/STAT3途径保护肠上皮细胞免受右旋糖酐硫酸钠引发的炎性损伤[8],还能调节肠道菌群失衡并降低促炎细胞因子表达,进而抑制2型猪圆环病毒诱导的肠道炎症[9],由此可知苦参碱对于IBD 治疗具有一定的潜力。本研究结果显示,苦参碱可减轻IBD大鼠结肠黏膜组织病理及超微结构受损,降低血清和结肠黏膜组织CRP、IL-6、MDA 水平,升高体质量、血清和结肠黏膜组织SOD 水平,表明苦参碱可减少炎症因子过度释放并增强抗氧化酶功能,进而抑制炎症和氧化应激,从而减轻IBD大鼠肠黏膜损伤,改善大鼠腹泻、便血等临床症状,进一步证实了苦参碱在IBD临床治疗中具有很大的治疗潜力。
IL-6/STAT3 信号通路参与炎症、氧化应激和免疫紊乱的发生发展,在IBD、溃疡性结肠炎等肠道疾病中发挥重要调控作用。研究显示,IL-6/STAT3信号通路异常激活,与IBD 的发生发展关系密切,而阻止该通路的激活可提高丁酸产生菌丰度、减轻炎症,抑制右旋糖酐硫酸钠诱导的IBD模型结肠炎进展[19]。抑制IL-6 表达和STAT3 磷酸化亦可减少肠上皮细胞凋亡、增加肠紧密连接蛋白的表达,进而减轻肠黏膜屏障功能损伤[20]。Chen等[8]研究发现,苦参碱体外通过阻断IL-6/STAT3信号传导通路减轻右旋糖酐硫酸钠诱导的肠上皮细胞炎症损伤。本研究结果显示:IBD 大鼠结肠黏膜组织IL-6 蛋白表达及p-STAT3/STAT3 比值较正常大鼠显著升高,证明IL-6/STAT3 信号激活参与了IBD 的发病过程。施以苦参碱处理可逆转上述蛋白的变化趋势,表明IL-6/STAT3 信号参与介导苦参碱减轻IBD大鼠肠黏膜损伤的过程。再以苦参碱和STAT3 激活剂colivelin 联合处理,发现colivelin 可减弱苦参碱单独处理对IBD大鼠的抗炎与抗氧化应激作用,拮抗苦参碱对IBD大鼠肠黏膜损伤的减轻作用,逆转苦参碱对IBD大鼠腹泻、便血等临床症状的改善作用。提示苦参碱减轻IBD大鼠肠黏膜损伤是通过抑制STAT3信号通路激活实现的。
综上所述,苦参碱可通过降低IL-6 表达、抑制STAT3 磷酸化,减少炎症细胞因子过度分泌并提升抗氧化酶活性,进而阻止炎症和氧化应激反应发生和进展,减轻IBD大鼠肠黏膜损伤,改善其腹泻、便血等临床症状;阻断IL-6/STAT3 信号通路激活可能是苦参碱起到上述药理作用的分子机制。

