基于自淬灭探针的LAMP 可视化快速检测方法
熊雄,薛晗玥,费延堻,王诗慧,谢普军
(1.南京工业大学食品与轻工学院,江苏南京 211800;2.中国林业科学研究院林产化学工业研究所,江苏南京 210042)
环介导等温扩增(loop-mediated isothermal amplification,LAMP)是2000 年由Notomi 等[1]首次公开的一种核酸等温扩增技术。该技术在靶标的6 个区域上设计4 条特异性引物,并利用具有链置换活性的BstDNA 聚合酶在等温条件下进行反应。自公开以来,LAMP 技术凭借快速、高效、特异性强等特点,在食品掺假检测[2-3]、人类流行病检测[4-5]、植物病害检测[6-7]等方面已得到广泛应用。
LAMP 反应需要使用多对引物,集中在体系时容易相互作用形成二聚体结构。此外,内引物的长度较长,导致自身错配易形成发夹结构[8],最终产生非特异性扩增[9]。染料法等传统方法无法区分由非特异性扩增导致的假阳性,造成结果误判。而序列特异性检测方法则是通过使用靶标特异性探针或修饰引物作为生物识别元件来进行结果判断,能够准确检测出扩增子且不受非特异性产物的影响[10]。目前,基于LAMP 所设计的探针包括同化探针[11]、荧光双向位移探针[12]、自淬灭探针[13]和分子信标[14-15]等。其中,自淬灭探针具有设计简单、灵敏度高等特点,在LAMP 中逐渐受到关注[13]。
自淬灭探针是荧光基团修饰在内引物或环引物3′端第2、3 位的寡核苷酸序列,其中内引物和环引物以G、C 碱基结尾并尽可能保证3′端存在丰富的G 碱基[13]。自淬灭探针利用氧化电位低的碱基发生光诱导电子转移(photoinduced electron transfer,PET)淬灭荧光,仅当结合靶标后淬灭才会消失[16]。目前,由于自淬灭探针在反应后阳性和阴性表现出肉眼无法区分的荧光,因此利用自淬灭探针进行LAMP 检测的方法主要包括实时荧光或结合其他技术实现可视化。如Gadkar等[13]将环引物设计成自淬灭探针检测水痘-带状疱疹病毒,反应后根据实时荧光曲线判断是否检出靶标。而在可视化检测中,Li 等[17]将自淬灭探针与聚乙烯亚胺(polyethylenimine,PEI)结合,反应后根据是否出现具有荧光的聚沉物来实现结果判断。
关于自淬灭探针背景荧光的研究,Nazarenko等[18-19]介绍了一种与自淬灭探针结构类似的荧光标记链,其与互补序列结合后出现荧光淬灭,同时利用互补序列淬灭荧光设计了具有钝端发夹结构的荧光引物,实现了多重聚合酶链式反应(polymerase chain reaction,PCR)的可视化检测。然而,在LAMP 的可视化研究中,利用互补序列降低自淬灭探针背景鲜见报道。
因此,本研究以自淬灭探针为研究对象,评估其背景荧光强度和淬灭效率,通过对比不同互补序列对自淬灭探针的淬灭效率,筛选得到设计简单且淬灭效率高的互补序列。最终,构建出具有低背景荧光的LAMP 体系,为实现基于自淬灭探针的LAMP 可视化检测奠定基础。
1 材料与方法
1.1 材料与试剂
BstDNA 聚合酶、100 mmol/L MgSO4、10×Thermo-Pol Buffer:南京诺唯赞生物科技股份有限公司;dNTP预混液:宝日医生物技术(北京)有限公司;自淬灭探针和引物合成:通用生物(安徽)股份有限公司。
1.2 仪器与设备
S1010 掌上离心机:美国赛洛捷克公司;MS-100 恒温混匀仪:杭州奥盛仪器有限公司;Gentier 96 全自动医用PCR 分析系统:西安天隆科技有限公司;F-4700 荧光分光光度计:日本Hitachi 公司;BleEye 蓝光切胶仪(蓝光LED,波长470 nm):苏州优逸兰迪生物科技有限公司。
1.3 方法
1.3.1 互补序列的设计
5 种自淬灭探针来自前期研究,包括BIP-FAM[20]、ZJ-FAM[21]、R-FIP-FAM[17]、S-LB-6-FAM[22]和R-LBFAM[17]。该5 种自淬灭探针均可应用于对应物种的LAMP 扩增,满足基于实时荧光的LAMP 检测。同时,根据自淬灭探针的碱基排列顺序进行反向互补得到互补序列[16],并分别对互补序列进行引入错配碱基、延长5′端、缩短5′端和缩短3′端的改造,具体见表1。
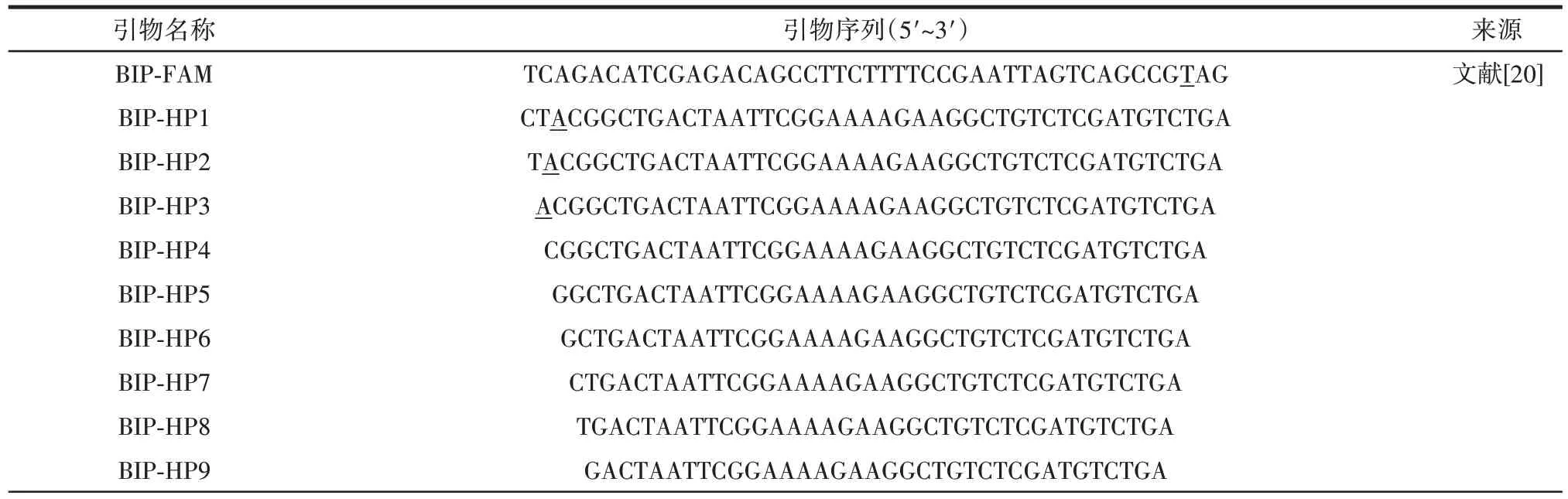
表1 引物序列信息Table 1 Primer sequences
1.3.2 荧光强度测定
将2.5 μL 的10×ThermolPol Buffer、2 mmol/L MgSO4、0.8 μmol/L 或0.4 μmol/L 的自淬灭探针(其中BIP-FAM、ZJ-FAM 和R-FIP-FAM 为0.8 μmol/L,S-LB-FAM 和RLB-FAM 为0.4 μmol/L)以及0.8 μmol/L 或0.4 μmol/L的互补序列混合,并使用无菌水补足20 μL。利用全自动医用PCR 分析系统收集35~97 ℃范围内的荧光,并对35 ℃的荧光强度进行记录。
全自动医用PCR 分析系统能够测定的最低温度为35 ℃,因此使用荧光分光光度计测定不同温度混合体系荧光。将配制的20 μL 体系添加至480 μL 灭菌水中稀释,充分混合。稀释好的体系分别在-4 ℃、室温、35 ℃和45 ℃内处理30 min。荧光分光光度计的激发波长设置为470 nm,扫描速度为1 200 nm/min,光谱带宽为10 nm,测定不同处理条件下的体系荧光强度。荧光淬灭效率(Kq,%)计算公式如下。
式中:A为起始自淬灭探针荧光强度;B为结合互补序列后的荧光强度。
1.3.3 LAMP 可视化反应体系构建
20 μL LAMP 反应体系,各成分含量:内引物FIP、BIP 各0.8 μmol/L,外引物F3、B3 各0.2 μmol/L,环引物LF、LB、自淬灭探针R-LB-FAM 和互补序列R-LBFAM-HP4 各0.4 μmol/L,0.45 mmol/L dNTP,2.5 μL 10×ThermoPol Buffer,2 mmol/L MgSO4、8 UBstDNA 聚合酶、1 μL 虹鳟鱼DNA(20 ng/μL),用无菌水补足20 μL。LAMP 扩增条件为63 ℃恒温扩增60 min[3]。反应结束后体系恢复至室温,利用蓝光切胶仪观察体系荧光,判断反应结果。
1.4 数据统计与分析
数据利用Excel 和SPSS 27 软件进行处理统计,并使用Duncan 法多重比较及差异显著性分析,P<0.05 认为具有显著差异。采用Origin 2022 软件绘制分析图。
2 结果与分析
2.1 互补序列对自淬灭探针荧光强度的影响
自淬灭探针与互补序列结合后荧光强度会发生降低[18]。为探究自淬灭探针荧光强度的影响因素,测定不同自淬灭探针的荧光强度及结合互补序列后的荧光强度变化,分析影响自淬灭探针荧光强度的原因。不同自淬灭探针和其互补序列结合的荧光强度见图1。
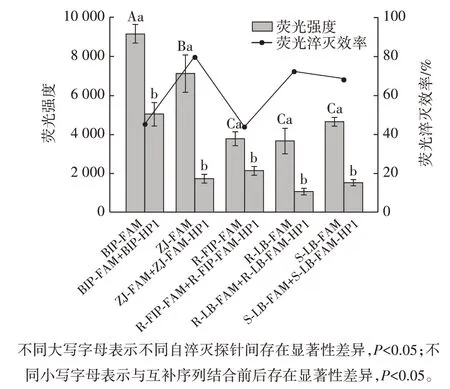
图1 不同自淬灭探针和其互补序列结合的荧光强度Fig.1 Fluorescence intensity of different self-quenching fluorogenic probes combined with their complementary sequences
由图1 可知,根据Gadkar 等[13]所述方法设计的自淬灭探针均存在较高的背景荧光,表明基于光诱导电子转移的荧光淬灭效果较弱。其中,添加量相同时,BIP-FAM 荧光强度显著高于R-FIP-FAM(P<0.05),说明荧光基团修饰位置越靠近3′末端G 碱基,自淬灭探针的淬灭效果越强,背景荧光强度越低。而ZJ-FAM的荧光强度显著高于R-FIP-FAM(P<0.05),说明当3′末端为G 碱基时,自淬灭探针的荧光强度更低,G 的淬灭效果更好。
在添加与自淬灭探针完全互补的序列时(BIPHP1、ZJ-FAM-HP1、R-FIP-FAM-HP1、R-LB-FAM-HP1和S-LB-FAM-HP1),自淬灭探针的背景荧光均显著降低(P<0.05),与Nazarenko 等[18]的研究结果一致。可能的原因是当自淬灭探针与完全互补序列退火结合时,电子会沿着DNA 双链进行传输,产生比单链DNA 状态下更强的淬灭[23]。
ZJ-FAM-HP1、R-LB-FAM-HP1 和S-LB-FAM-HP1对自淬灭探针具有良好的淬灭效果,Kq分别为79.73%、71.87%和68.14%。然而,BIP-HP1 和R-FIP-HP1 对自淬灭探针的淬灭效率Kq分别仅为45.08%和43.44%。该结果表明互补序列对荧光基团修饰在3′端第2 位的自淬灭探针淬灭效果更强,印证了Nazarenko 等[18]关于荧光基团距离3′末端GC 碱基对距离越远淬灭效率低的结论。而对于同样修饰在荧光基团3′端第2 位的自淬灭探针而言,由推导公式可得具有高背景荧光的自淬灭探针,添加互补序列后可对其表现出高淬灭效率。
由于自淬灭探针BIP-FAM 背景荧光信号高,且BIP-HP1 对其淬灭效率低。因此,选择互补序列BIPHP1,进行改造和后续试验。
2.2 互补序列上的碱基错配对自淬灭探针荧光强度的影响
互补序列上的碱基错配对自淬灭探针荧光强度的影响见图2。
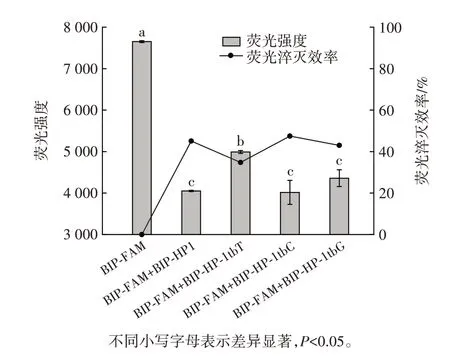
图2 互补序列上的碱基错配对自淬灭探针荧光强度的影响Fig.2 Effect of base mispairing on complementary sequences on the fluorescence intensity of the self-quenching fluorogenic probe
如图2 所示,调整BIP-HP1 中与荧光基团修饰位点T 配对的碱基A 为T,C 和G,分别得到互补序列BIP-HP-1tbT、BIP-HP-1tbC 和BIP-HP-1tbG。当自淬灭探针与此类互补序列结合时,荧光强度均出现显著降低(P<0.05)。其中BIP-HP-1tbC、BIP-HP-1tbG 和BIPHP1 结合自淬灭探针后的荧光强度差异均不显著(P>0.05),说明BIP-HP-1tbC 和BIP-HP-1tbG 均可以表现出与完全互补序列相同程度的淬灭效果。
然而,BIP-HP-1tbT 虽然对自淬灭探针表现出显著淬灭(P<0.05),但其淬灭效率(Kq为34.77%)明显低于BIP-HP1、BIP-HP-1tbC 和BIP-HP-1tbG(Kq分别为45.08%、47.50% 和43.02%)。由此可知,改造互补序列,形成存在错配碱基对的双链,难以提高对自淬灭探针的淬灭效果,并且当错配位点的碱基由A 颠换为T时,反而会降低淬灭效率。
2.3 互补序列的5′端延长对自淬灭探针荧光强度的影响
研究提出,互补序列的5′端延长会对自淬灭探针荧光强度产生不同影响[16]。因此,分别以3 种方式对互补序列的5′端延长,探究不同类型互补序列对自淬灭探针的淬灭能力,结果见图3。
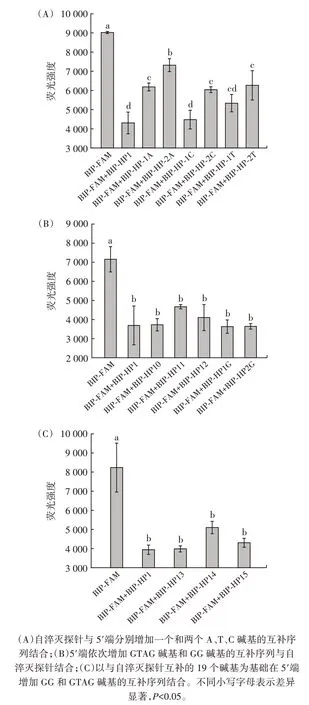
图3 互补序列的5′端延长对自淬灭探针荧光强度的影响Fig.3 Effect of lengthened 5′end of the complementary sequences on the fluorescence intensity of the self-quenching fluorogenic probe
如图3 所示,首先在互补序列的5′端分别增加1 个和2 个A、T、C 碱基。延长后的互补序列结合自淬灭探针后荧光强度表现出显著下降(P<0.05),互补序列延长2 个碱基比延长一个碱基后结合自淬灭探针呈现出更强的荧光强度。说明非互补区域增加的碱基会提高DNA 链的整体电阻,阻碍电子在DNA 双链间的传输,使得互补序列对自淬灭探针的淬灭效果减弱[16]。
第2 种延长方式是在互补序列的5′端增加GTAG和GG 碱基[图3(B)]。第3 种延长是从与自淬灭探针互补19 个碱基的互补序列BIP-HP13 开始,在其5′端添加GTAG 和GG 碱基[图3(C)]。两种延长方式得到的互补序列在结合自淬灭探针时不仅荧光强度显著降低(P<0.05),而且淬灭后的荧光强度与完全互补序列淬灭的荧光强度相近,差异没有统计学意义。毛慧慧[16]提出荧光基团的电子不仅可以沿着DNA 链传输,而且可以与互补序列中非互补区域的碱基进行电子转移。G 最容易失电子,对荧光基团淬灭作用最大,更易产生显著降低的荧光强度。因此,推测在互补序列的5′端增加G 碱基,仍可保持对自淬灭探针荧光的淬灭。
2.4 互补序列的5′端缩短对自淬灭探针荧光强度的影响
为确定能够对自淬灭探针荧光产生淬灭的最短互补序列,从互补序列5′端开始进行缩短,优化互补序列的设计。互补序列的5′端缩短对自淬灭探针荧光强度的影响见图4。
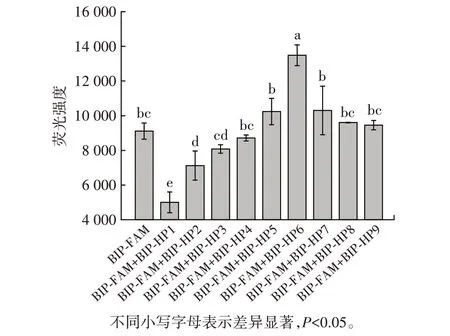
图4 互补序列的5′端缩短对自淬灭探针荧光强度的影响Fig.4 Effect of shortened 5′end of the complementary sequences on the fluorescence intensity of the self-quenching fluorogenic probe
对互补序列的长短进行优化,从互补序列5′端开始逐个减少碱基,筛选合适的互补序列进行对自淬灭探针的淬灭。如2.1 所述,在添加与自淬灭探针完全互补的序列BIP-HP1 时,自淬灭探针的背景荧光显著降低(P<0.05)。
当添加互补序列BIP-HP2 至BIP-HP6 时,仅BIPHP2 与自淬灭探针结合,自淬灭探针背景荧光强度发生显著降低(P<0.05),BIP-HP3、BIP-HP4 和BIP-HP5添加入自淬灭探针后,荧光强度无明显差异,与自淬灭探针自身荧光强度相近。但BIP-HP6 退火结合自淬灭探针后,荧光强度反而出现显著升高(P<0.05)。由于退火后形成的双链末端不存在GC 碱基对,故此部分荧光强度发生变化可能是由PET 和双链淬灭双重因素引起的。
最后,BIP-HP7、BIP-HP8 和BIP-HP9 加入自淬灭探针后,荧光强度与自淬灭探针荧光强度差异不显著(P>0.05)。研究表明,PET 需要经过范德瓦尔斯接触才可发生,BIP-FAM 中荧光基团修饰位点位于序列3′端第3 位,BIP-HP7 与荧光基团修饰位点相距3 个碱基长度[24]。因此,BIP-HP7 及更短的互补序列与自淬灭探针结合后不影响PET 的进行,荧光强度不会表现出显著差异。
2.5 互补序列的3′端缩短对自淬灭探针荧光强度的影响
确定对自淬灭探针荧光产生显著淬灭的最短互补序列,从3′端缩短互补序列,再对其与自淬灭探针结合的荧光强度进行测定,结果见图5。
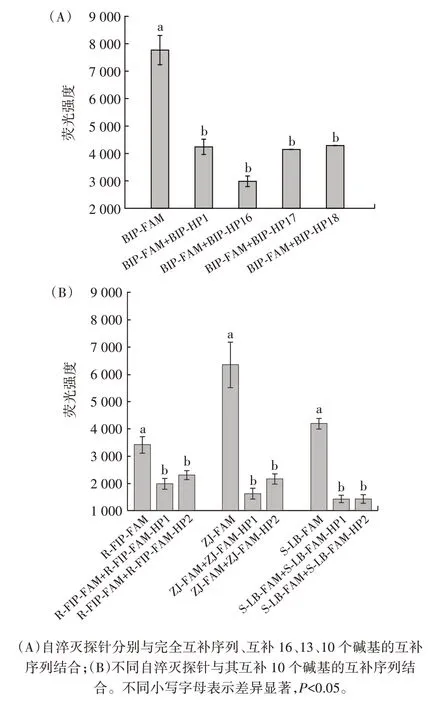
图5 互补序列的3′端缩短对探针荧光强度的影响Fig.5 Effect of shortened 3′end of the complementary sequences on the fluorescence intensity of the self-quenching fluorogenic probe
从互补序列BIP-HP13 开始,按照梯度依次从3′端进行缩短,得到互补序列BIP-HP16、BIP-HP17 和BIP-HP18。当加入此类互补序列时,自淬灭探针的荧光强度呈现显著下降(P<0.05),且各个组合之间的荧光强度与完全互补序列结合自淬灭探针时的荧光强度相近,差异无统计学意义。说明对BIP-FAM 而言,与3′端互补10 个碱基的序列也可以对自淬灭探针荧光强度产生显著淬灭。
对自淬灭探针R-FIP-FAM、ZJ-FAM 和S-LB-FAM分别设计与3′端互补10 个碱基的互补序列。由图5(B)所示,自淬灭探针分别退火结合各自互补10 个碱基的互补序列后,荧光强度均表现出显著下降(P<0.05),且荧光强度与各自完全互补序列退火结合后的荧光强度相近,表现出程度相仿的淬灭效果。因此推断,对于所有自淬灭探针,3′端互补序列可实现对自淬灭探针的显著淬灭。
2.6 互补序列解链温度和环境温度对自淬灭探针荧光强度的影响
解链温度是指双链DNA 分子在变性过程中,50%的碱基对变为单链时的温度[25]。因此,溶解温度(melting temperature,Tm)值和环境温度的关系,会直接影响互补序列与自淬灭探针的退火结合,能否形成稳定的DNA 双链,是自淬灭探针淬灭的重要影响因素。互补序列Tm 值和环境温度自淬灭探针荧光强度的影响见图6。
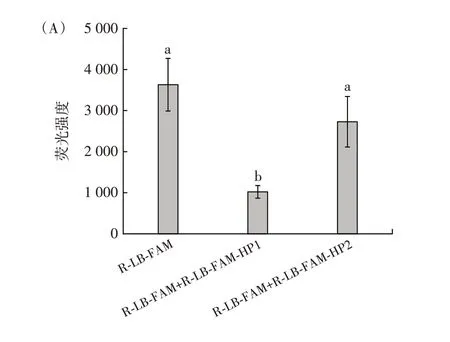
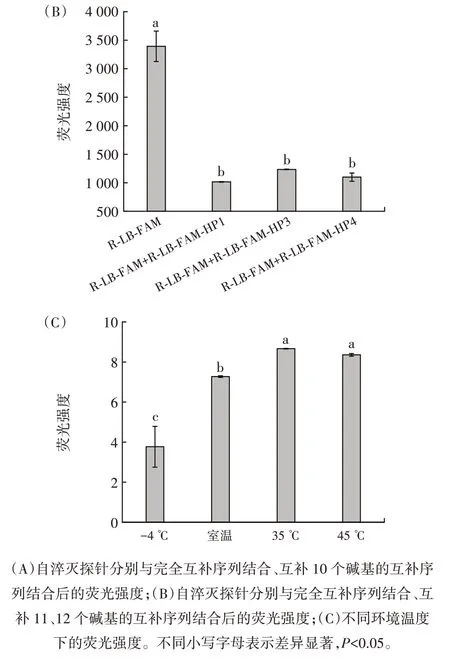
图6 互补序列Tm 值和环境温度对自淬灭探针荧光强度的影响Fig.6 Effect of melting temperature and ambient temperature of complementary sequence on the fluorescence intensity of selfquenching fluorogenic probe
如图6(A)所示,在自淬灭探针R-LB-FAM 中,结合与其互补10 个碱基的互补序列R-LB-FAM-HP2(Tm 值28.88 ℃)后,荧光强度未出现显著下降。延长R-LB-FAM-HP2 的3′端碱基,得到11 个碱基长度的RLB-FAM-HP3(Tm 值34.55 ℃)和12 个碱基R-LB-FAMHP4(Tm 值41.79 ℃)。自淬灭探针加入延长后的互补序列时,荧光强度与完全互补序列结合自淬灭探针时接近,相比自淬灭探针荧光强度均呈现出显著降低(P<0.05)。表明通过增加碱基得到Tm 较高的互补序列,可以提高结合自淬灭探针后的双链稳定性,电子会沿着稳定的DNA 双链进行传输,产生更强的淬灭。
如图6(C)所示,由R-LB-FAM 和R-LB-FAM-HP2配制的体系在4 种温度下表现出不同的荧光强度。-4 ℃处理30 min 后的体系具有最低的荧光强度,而室温放置30 min 的体系荧光强度出现显著上升(P<0.05),35 ℃和45 ℃处理的体系相比前两者,荧光强度均表现出显著上升(P<0.05)。说明环境温度高于Tm 值时,双链DNA 分子中部分双链变成单链,淬灭效果明显减弱,荧光强度随之升高。而35 ℃和45℃处理后的体系荧光强度差异不显著(P>0.05),则表明在大于Tm 值的温度下,R-LB-FAM-HP2 无法与R-LB-FAM 退火结合,无法形成双链DNA,不能对自淬灭探针起到淬灭作用。
因此,当短的互补序列对自淬灭探针无法产生显著淬灭时,通过延长互补序列提高Tm 值或通过降低环境温度可以重新恢复超淬灭。对于互补序列淬灭自淬灭探针时,互补序列Tm 值应高于环境温度,可以形成稳定的DNA 双链,保证自淬灭探针的显著淬灭。
2.7 LAMP 可视化体系验证
以虹鳟鱼(Oncorhynchusmykiss)为例,建立LAMP体系进行可视化验证,结果见图7。
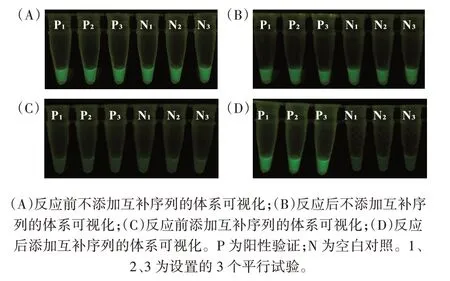
图7 LAMP 体系验证结果Fig.7 Result of LAMP system
如图7(A)和图7(C)所示,反应前LAMP 体系阳性验证和空白对照表现为统一的荧光强度,不添加互补序列的LAMP 体系均为明亮的荧光,而添加互补序列的体系表现为微弱的荧光,说明互补序列在LAMP 体系依然能够稳定地降低自淬灭探针背景荧光。然而当反应结束,不添加互补序列的体系阳性和阴性仍保持着难以分辨的荧光[图7(B)],添加互补序列的体系的可视化则出现了易于区分的差异,阳性呈现明亮的荧光,空白对照则表现出与反应前一致的低荧光[图7(D)]。由此说明,互补序列不仅能够在反应前对LAMP 体系中的自淬灭探针产生淬灭,而且在反应结束恢复至室温时能够恢复对自淬灭探针的淬灭。同时,该互补序列在体系中未对阳性产生明显抑制,阳性验证在反应后得到了与不添加互补序列体系一致的明亮荧光。
3 结论
本研究以自淬灭探针为研究对象,筛选具有降低自淬灭探针背景荧光的互补序列,并将其应用于LAMP 中,实现基于自淬灭探针的LAMP 可视化检测。结果表明,3′端缩短的互补序列Tm 值大于室温的情况下,可以使自淬灭探针荧光发生显著降低(P<0.05)。并且该互补序列加入到LAMP 体系中,可在不影响扩增反应的前提下降低体系的背景荧光。本研究所建立的基于自淬灭探针的LAMP 快速可视化检测方法,能在反应结束后直接通过肉眼观察得到结果,简化了LAMP 的检测流程,对实现现场快速检测展现出广阔的应用前景。

