甲基乙二醛毒性机制及天然抑制剂的研究进展
易弛,王文悦,余帆,樊鑫,朱晓青,肖俊锋,周梦舟,穆杨
(湖北工业大学发酵工程教育部重点实验室,工业发酵省部协同创新中心,细胞调控与分子药物“111”引智基地,湖北武汉 430068)
甲基乙二醛(methylglyoxal,MGO)是具有较高活性的二羰基化合物,可共价修饰核酸和氨基酸内的亲核位点,形成晚期糖基化终末产物(advanced glycosylation end products,AGEs)。这些二羰基化合物和AGEs 在体内积累与各种慢性疾病相关联,如糖尿病、心血管疾病、神经退行性疾病。除了人体内源性产生,膳食(外源性)MGO 对体内MGO 和AGEs 的积累以及对人类健康问题也有所影响。本文概述外源性MGO在人体胃肠道的消化吸收与代谢,强调胃肠道也可作为外源性AGEs 的场所来源。作为AGEs 重要前体物质的MGO 具有细胞毒性,可导致细胞损伤,引起氧化应激、细胞炎症、诱导细胞凋亡,同时在分子机制上激活多种信号通路响应应激。
人体和食品加工中都能产生MGO,而人体中也含有清除MGO 的酶系统,但在高血糖、糖尿病患者体内清除系统受阻,易引起MGO 积累。目前已有的MGO清除剂二甲双胍通过降低血糖水平、诱导乙二醛酶I(glyoxalase I,GLO1)活性,从而降低MGO 的水平[1]。氨基胍可通过胍基团与MGO 迅速反应消除还原羰基。但是这些氨基胍类化合物具有较大的副作用,主要包括胃肠反应、罕见发生乳酸酸中毒等[2],限制了其临床应用。而天然化学产物因较高的安全性及其生理和药理活性受到广泛关注。因此利用天然产物抑制MGO 已成为研究的热点。目前关于MGO 的代谢与毒性机制并未完全阐明,因此本文对MGO 的产生与代谢、细胞毒性机制进行总结,综述其发挥毒性的信号转导通路,以期为抑制MGO 体内毒性提供角度与思路。并对具有清除MGO 的天然化学产物进行分类,总结各种天然产物对MGO 的抑制机制,为开发新的MGO天然抑制剂提供理论基础。
1 MGO 的产生及代谢
1.1 MGO 的产生
由于食品在贮藏和加工过程中各组分间相互作用发生美拉德反应,会产生有害活性中间产物α-二羰基化合物,如甲基乙二醛、乙二醛、3-脱氧葡萄糖酮等[3]。而具有较高活性的MGO 已在烘焙食品、乳制品、发酵食品以及油炸食品中被发现,通过膳食摄入在体内积累并影响人体健康[4]。据报道,食源性MGO 的产生主要来自美拉德反应、焦糖化反应(也称己糖自氧化)、脂质过氧化以及微生物代谢[5-6]。美拉德反应有3 个阶段,其中初级阶段主要由于食品在储存和热处理过程中,葡萄糖和果糖与氨基酸反应经羰氨缩合生成席夫碱(Schiff Base),席夫碱发生分子内重排产生Amadori产物[7]。中间阶段Amadori 产物经烯醇化、脱氨基、脱水、分裂等步骤形成1-脱氧葡萄糖醛酮(1-deoxyglucosone,1-DG)或3-脱氧葡萄糖醛酮(3-deoxyglucosone,3-DG)。随后这些二羰基化合物可以进一步与氨基酸发生降解反应(Strecker 反应),裂解形成MGO,MGO 产生及代谢见图1[6]。
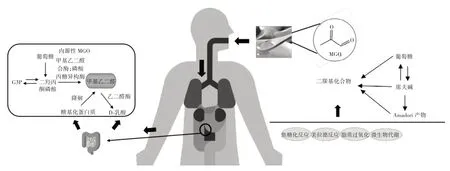
图1 MGO 产生及代谢Fig.1 Production and metabolism of methylglyoxal
在一些含大量单糖的食物中(如蜂蜜),极易氧化裂解发生焦糖化反应,产生MGO,其中麦卢卡蜂蜜中的MGO 浓度最高,是普通蜂蜜的5~100 倍[8]。在高脂肪食品中如油炸薯条等,MGO 则通过不饱和脂肪酸的氧化产生。在发酵食品中(如酱油、醋)中检测到相对高浓度的MGO(分别为12 mg/kg 和5 mg/kg),这是由于微生物酶的催化作用使糖酵解中形成的中间体转化为MGO[6,9-10]。除了食源性的MGO 外,人体内源性也会产生MGO,主要来自糖酵解过程,少部分来自糖基化蛋白质的降解[11]。
1.2 食源性MGO 消化吸收与代谢
据报道,人体每天摄入的MGO 约为0.04~0.30 mmol,由于其亲电性易与蛋白质和肽的侧链氨基反应,导致形成晚期糖基化终产物(AGEs)[11]。经MGO 补充喂食的啮齿动物,其脑和血清中会存在MGO 积累,并表明至少10% 的MGO 衍生AGEs 被吸收,然后积聚在血管、心脏、肝脏、肾脏和脂肪组织等组织中[12]。研究发现,食源性MGO 经口腔摄入后,经消化后被分解为D-乳酸等,然而MGO 在胃阶段消化率极低,在pH 值为2的模拟胃阶段基本稳定,但在十二指肠和结肠阶段,随着pH 值的升高和消化酶的作用,MGO 迅速反应[13]。研究表明可能是食物中存在的MGO 与消化酶、胃蛋白酶、胰酶形成糖基化蛋白,导致消化结束后MGO 含量降低[14]。在模拟MGO 和蛋白体系中,蛋白释放的多肽可能与MGO 相互作用形成糖化蛋白,而糖基化后会降低蛋白质消化率,胃肠道也为AGEs 的产生提供了场所[15]。
总之,MGO 不仅存在于人体的各个细胞中,热加工食品中也广泛存在,现如今也发现胃肠道可能为MGO的转变提供了场所,(寡聚)肽、游离氨基酸、蛋白酶都可能与MGO 在消化过程中发生额外的糖化反应。
2 MGO 的细胞毒性机制
MGO 对细胞的毒性通常通过诱导凋亡发生,MGO造成羰基应激和氧化应激,引起细胞毒性可能是由AGEs 激活晚期糖基化终末产物受体(the receptor for advanced glycation end products,RAGE)进而产生大量活性氧(reactive oxygen species,ROS),也可能是由MGO 诱导细胞凋亡而引起蛋白质氧化损伤,这一途径可不依赖AGEs-RAGE 途径而直接损害细胞功能,或者因线粒体损伤而引起[16],MGO 细胞毒性信号通路示意图概述见图2。
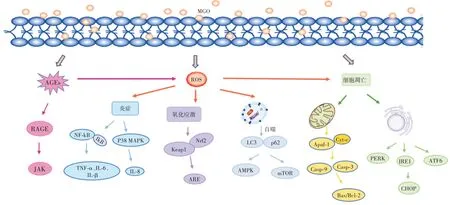
图2 MGO 细胞毒性信号通路示意图Fig.2 Schematic diagram of methylglyoxal-induced cytotoxicity signaling pathway
MGO 衍生形成AGEs,作用于RAGE 受体,激活JAK 通路,AGEs 可通过ROS 触发炎症、氧化应激、自噬以及细胞凋亡;MGO 通过ROS 介导炎症,NF-κB 调控炎症的表达,IκB 蛋白磷酸化并降解,促进肿瘤坏死因子α(tumor necrosis factor alpha-like,TNF-α)、白细胞介素-1β(interleukin 1β,IL-1β)和白细胞介素-6(interleukin 6,IL-6)的释放;或通过p38MAPK 通路的激活,促进促炎细胞因子白细胞介素-8(interleukin 8,IL-8)分泌;MGO 通过ROS 介导氧化应激,Keap1 将Nrf2 释放,Nrf2 与抗氧化反应元件ARE 序列结合,驱动ARE编码抗氧化酶和解毒蛋白酶等基因的转录;MGO 通过ROS 介导自噬标志物p62 和LC3 的激活,引起腺苷单磷酸活化蛋白激酶(AMPK)以及mTOR 通路激活;MGO 诱导细胞凋亡,线粒体、内质网功能障碍,线粒体基质中的细胞色素C(cytochrome C,Cyt-C)结合凋亡蛋白酶活化因子(apoptotic protease activating factor-1,Apaf-1),激活Caspase-9/Caspase-3 启动级联反应,导致细胞凋亡;内质网应激受双链RNA 激活蛋白激酶样内质网激酶(PERK)、肌醇要求酶-1(IRE1)和激活转录因子6(ATF6)调控,激活促凋亡转录因子CHOP。
2.1 线粒体
线粒体既是活性氧的来源又是活性氧的作用目标。MGO 诱发线粒体功能障碍,并损害呼吸链重要步骤[17]。MGO 诱导发育中的胚胎细胞生长迟缓,可能与线粒体紊乱以及产生的ATP 减少有关[18]。MGO 增加了不同类型肾细胞中黏附分子、促炎细胞因子和转化生长因子TGF-β 的表达,也使肾细胞的电子呼吸链受抑制,导致线粒体功能障碍,还诱导ROS 的生成并激活了转化生长因子[19]。在人造骨细胞上,MGO 诱导ROS 的增加并进一步激活下游凋亡信号因子[20]。但在小鼠肌细胞中,MGO 不仅造成线粒体功能障碍而且还伴随ROS 的增加,说明MGO 诱导的细胞损伤中还伴有ROS 的参与[21]。
线粒体的完整性对于细胞的生存至关重要,只有维持正常的线粒体膜电位才能使线粒体进行氧化磷酸化、产生三磷酸腺苷[17]。线粒体产生的ROS 会破坏电子运输链复合物,使得线粒体内膜发生变化,引起线粒体内、外膜之间的线粒体通透性转换膜(mitochondrial permeability transition pore,MPTP)不可逆的开放,线粒体膜电位下降,线粒体基质中的细胞色素C(cytochrome C,Cyt-C)被释放到胞浆中[22]。Cyt-C 结合凋亡蛋白酶活化因子(apoptotic protease activating factor-1,Apaf-1),激活Caspase-9 形成凋亡小体,进而激活Caspase-3 启动级联反应,导致细胞凋亡。而Bcl-2 家族在调控线粒体通道上起着至关重要的作用,调节细胞线粒体凋亡途径。MGO 可影响Bcl-2 家族蛋白的表达[16,22]。
综上,MGO 诱导细胞ROS 积累,ROS 的过度积累会损害线粒体功能,使得线粒体膜电位发生变化,并激活Caspase-3 级联反应响应MGO 引起的细胞凋亡。
2.2 内质网
MGO 靶向细胞中的蛋白质,会对蛋白质结构和功能产生不可逆的影响[11]。而蛋白质合成和修饰的场所发生在内质网(endoplasmic reticulum,ER)中,因而内质网可能是MGO 作用的一个靶点,同时内质网也是钙离子在细胞内的存储位置[23]。新合成的分泌膜蛋白被转移到ER 进行修饰。如果未折叠蛋白反应(unfolded protein response,UPR)系统不能从内质网腔中去除未折叠或错误折叠的蛋白质,则会诱导内质网应激。内质网应激诱导后,新蛋白向内质网转运减少,逆转录易位、蛋白降解,内质网折叠能力增强[24]。UPR 是一个由3 种内质网跨膜受体蛋白组成的复杂系统:双链RNA 激活蛋白激酶样内质网激酶[the protein kinase ribonucleic acid(RNA)-activated-like ER kinase,PERK]、肌醇要求酶-1(inositol-requiring kinase 1,IRE1)和激活转录因子6(activating transcription factor 6,ATF6)。CHOP(也称为生长阻滞和DNA 损伤诱导蛋白GADD153)是一种只与内质网应激诱导的凋亡相关的促凋亡转录因子[25]。MGO 可诱导血管平滑肌上皮细胞内质网应激,并以时间和浓度依赖性的方式激活并响应内质网的三条主要应激途径,但在VSMCs 细胞中未观察到CHOP 促凋亡因子的变化[26]。MGO 还可以通过ROS 依赖的方式诱导ARPE-19 细胞死亡,MGO 激活了典型的URP 信号传导通路,使用内质网应激抑制剂处理可降低MGO 诱导的ROS 生成以及细胞内钙升高,对MGO 引起的线粒体膜电位(mitochondrial membrane potential,MMP)损失和细胞死亡都有所减少[27]。
可见,内质网应激依赖于细胞内ROS 的产生,而MGO 可通过ROS 介导内质网应激,激活典型URP 信号转导途径,细胞内钙离子增加,线粒体膜电位损失,进而诱导细胞凋亡。
2.3 自噬
自噬是一种进化高度保守的细胞内机制,提供溶酶体,降解旧的或受损的细胞器、脂质和聚集蛋白来保持细胞稳态[28]。通过MGO 处理神经细胞增加了自噬标志物自噬衔接蛋白螯合体1(p62)以及微管相关蛋白轻链3(LC3)的脂化和活性形式[29]。MGO 通过与信号通路的直接相互作用或ROS 的形成来影响触发自噬的信号通路。mTOR 是自噬的主要调节途径,除此之外还可通过非依赖性途径被激活。腺苷单磷酸活化蛋白激酶(AMPK)是维持细胞能量稳态的主要调节因子,磷酸化后,AMPK 可以通过将下游自噬相关蛋白募集到自噬体形成位点来控制自噬体的形成[28,30]。AMPK 的激活通常也会导致mTOR 失活和自噬增加,经MGO 处理细胞后,自噬通过AMPK 激活诱导,ACC(AMPK 底物)磷酸化增强,阻止mTOR 的激活[31]。
MGO 诱导细胞损伤,而自噬在二羰基应激中对细胞具有保护作用,且自噬激活剂可以显著增加细胞活性。自噬调节途径主要是通过mTOR 信号介导。
2.4 促进炎症反应
肠道中的羰基化合物可以引起炎症反应,如在炎症性肠病(inflammatory bowel disease,IBD)患者肠道中促炎细胞因子白细胞介素-8(interleukin,IL-8)分泌增加,主要是超氧化物阴离子的诱导和p38MAPK 通路的激活[31]。MGO 诱导肠上皮细胞产生活性氧(ROS),使得不同信号通路受损后导致不同激酶级联的激活,刺激IL-6 和IL-8 的合成[32]。动物实验发现,MGO 会引起大鼠炎症,诱导胰腺损伤,MGO 促进促炎细胞因子的释放,增加促氧化酶如NADPH 氧化酶和JNK 的活性,并上调大鼠胰腺细胞中NF-κB 的表达[33]。NF-κB可促进细胞因子的释放,包括肿瘤坏死因子α(TNFα)、白细胞介素-1β(IL-1β)和白细胞介素-6(IL-6)[11]。MAPK 在炎症细胞因子、ROS、化学物质和氧化剂等多种因素诱导的胰岛素抵抗发展中起关键作用,MGO 以氧化还原依赖性方式激活成骨细胞、内皮细胞和Jurkat 白血病细胞中的MAPK 炎症途径[34]。
综上,MGO 引起细胞炎症主要是通过MAPK 以及NF-κB 途径,进而促进炎症因子的表达,也可通过ROS的过度积累进一步导致炎症的发生。
2.5 Keap1/Nrf2/ARE 信号系统调节
Keap1-Nrf2-ARE 是一种将外源刺激转导成真核转录反应的信号通路。Keap1-Nrf2-ARE 途径在细胞防御应激中至关重要,并且与醛应激直接相关[35]。MGO 对该信号通路具有双重作用,编码解毒蛋白和抗氧化酶的基因表达均受到转录因子Nrf2 调控,GLO1作为MGO 解毒的主要酶也受到Nrf2 调控,Nrf2 可促进GLO1 的表达和MGO 向D-乳酸的转化[11]。Nrf2 为细胞内抗氧化剂和II 期解毒酶的关键调节因子通过许多ARE 依赖基因的转录上调,在胞液内Nrf2 与Keap1 结合存在,当细胞遭受MGO 攻击后,与Keap1的半胱氨酸残基和精氨酸残基结合,形成交联物质,并将Nrf2 释放出来,随后Nrf2 位移到细胞核与抗氧化反应元件ARE 序列结合,驱动ARE 编码抗氧化酶和解毒蛋白酶等基因的转录[11,36]。Nrf2/Keap1 通路在MGO对抗神经元解毒机制中对MGO 诱导的羰基应激很重要,Nrf2 激活剂有助于羰基应激介质的积累和毒性表达的抑制[36]。NF-κB 参与拮抗Nrf2 的转录活性[12]。
MGO 引起细胞内ROS 积累,造成氧化应激,Keap1-Nrf2-ARE 作为氧化应激调节通路,在MGO 诱导的细胞氧化应激中起着关键解毒作用,Nrf2 促进GLO1 的表达和MGO 向D-乳酸的转化。
2.6 AGE/RAGE
MGO 对细胞毒性的影响可通过形成AGEs 破坏生物分子的结构和功能特性,并参与ROS 的形成。MGO 来源的AGEs 可通过与特定的细胞表面受体晚期糖基化终产物受体(RAGE)结合,MGO 经人血清蛋白修饰后形成的AGEs 对人胚胎细胞造成损害,在细胞水平上引起炎症反应[37]。AGE-RAGE 的信号效应最常通过激活JAK 和STAT 通路发生[38]。甲基乙二醛赖氨酸二聚体(methylglyoxal-lysine dimer,MOLD)处理小鼠系膜细胞后RAGE 表达明显增加,并与RAGE 的v 型免疫球蛋白结构域连接[39]。AGEs 激活小胶质细胞可增加促炎细胞因子(如TNF-α、IL-1β 和IL-6)的表达和分泌[40]。
MGO 作为一种糖化剂,可导致MGO 衍生的AGEs水平升高,AGEs 可与RAGE 结合,激活下游JAK 和STAT 通路发生。AGEs 也可通过ROS 促进炎症的正反馈调节。
综上,ROS 在MGO 介导的细胞毒性中起着媒介作用,ROS 可直接或间接引起线粒体、内质网损伤,也可引起自噬、炎症、氧化应激或AGEs 的产生。NF-κB既可促进炎症因子的表达,也参与Nrf2 的调节,而对于炎症和自噬之间除了ROS 的连接作用外,是否还有其它基因的共同调节还有待研究。
3 MGO 解毒系统
正常人体内含有清除MGO 的机制,主要以乙二醛酶1(glyoxalase 1,GLO1)和乙二醛酶2(glyoxalase 2,GLO2)组成的酶系统为主。在正常情况下,细胞通过不同的机制保护免受甲基乙二醛毒性,特别是乙二醛酶系统,这是甲基乙二醛解毒的最重要的途径,除此之外,还有醛糖还原酶以及醛脱氢酶解毒系统,见图3。
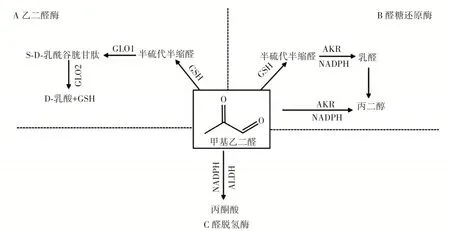
图3 MGO 解毒系统Fig.3 Detoxification system of methylglyoxal
3.1 乙二醛酶系统
乙二醛酶系统是所有哺乳动物均含有的一种代谢途径,能够清除体内的MGO[11]。乙二醛酶系统由两种酶组成,GLO1、GLO2 和还原型谷胱甘肽(glutathione,GSH)。MGO 与GSH 非酶反应形成半硫代缩醛,被GLO1 识别[41]。GLO1 将半硫代缩醛转化为S-D-乳酰谷胱甘肽,S-D-乳酰谷胱甘肽为无毒化合物,因此GLO1 是MGO 解毒的关键,此外S-D-乳酰谷胱甘肽代谢为D-乳酸过程中GSH 再生,这意味着MGO 水平的大幅增加或GLO2 活性低均可能使S-D-乳酰谷胱甘肽积累,导致GSH 被捕获[34]。研究表明在原代人主动脉内皮细胞中,GLO1 敲除增加了MGO 水平,并导致随后的炎症、凋亡和功能障碍,从而导致血管损伤和功能受损[42]。在神经母细胞瘤中,MGO 激发导致GLO1 酶活性受到抑制[18]。
3.2 醛糖还原酶
醛糖还原酶(aldose reductase,AKR)是NAD(P)H依赖性酶的超家族,可将醛和酮还原为反应性较低的醇。AKR 超家族包括来自细菌、酵母、植物和哺乳动物的酶,这些酶能够减少存在于各种天然和合成化合物中的羰基。AKR 的几个成员,包括AKR1A1、AKR1B1、AKR1C1 和AKR7A2,能够代谢MGO[43-44]。AKR 介导的MGO 解毒通过两种不同的途径进行,一种是在GSH和MGO 的非酶反应之间形成半硫代缩醛,被AKR 和NADPH 转化为乳醛;另一种是GSH 独立性,MGO 与AKR 以及NADPH 反应生成丙二醇[40,45]。AKR7A2 和AKR1C3 酶参与保护神经母细胞瘤和星形细胞瘤细胞免受MGO 诱导的细胞毒性[44,46]。
3.3 醛脱氢酶
ALDHs 是一类烟酰胺腺嘌呤二核苷酸(NAD)和NAD 磷酸(NADP)依赖性酶,可将醛氧化成羧酸。醛脱氢酶ALDH1A1 通过氧化生成丙酮酸来代谢MGO。然而,由于存在高活性GLO1 和AKR1B1,该反应在体内不是主要的清除系统[1]。ALDH 的E1、E2 和E3 同工酶与MGO 反应,并以NAD 依赖的方式将其氧化为丙酮酸盐。同样,2-氧代醛脱氢酶(2-oxidative dehydrogenation,2-ODH)以NADP 依赖的方式将MGO 转化为丙酮酸[43]。
4 天然产物对MGO 毒性缓解作用
天然化学产物是次生代谢物、生物活性物质和各种天然存在的化学部分,目前的研究多从膳食植物、水果和草药中寻找有效的植物化学化合物去清除食品中或体内MGO 含量[41]。一些天然化学产物如黄酮、酚酸、多糖、萜类化合物、维生素等可以通过清除自由基、改善氧化应激、降低炎症、调节相关代谢酶从而达到清除二羰基化合物的作用。常见天然化学产物清除MGO 作用见表1。
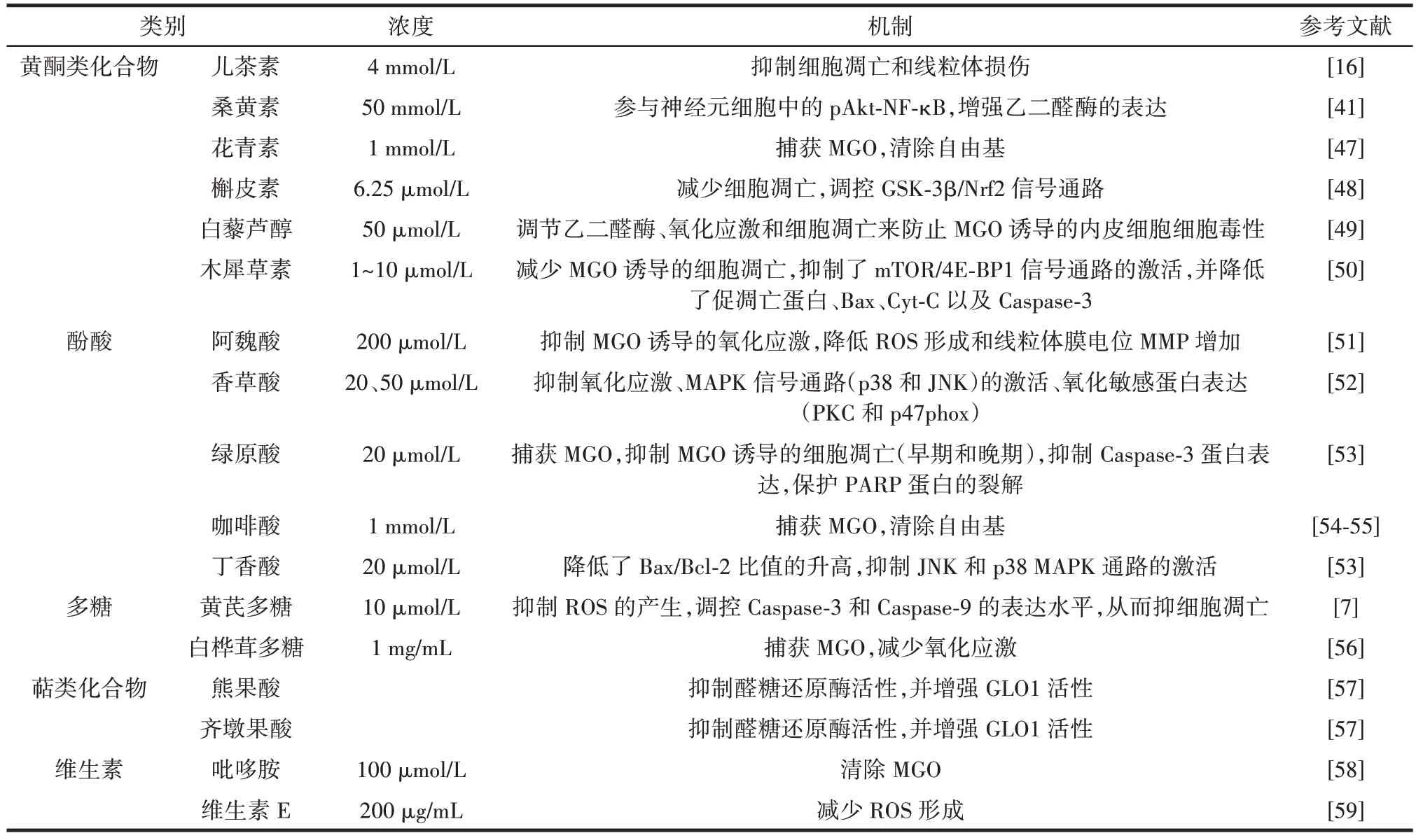
表1 常见天然化学产物清除MGO 作用Table 1 Common natural chemical products for methylglyoxal clearance
4.1 黄酮类化合物
黄酮类化合物的结构对其保护活性有重要影响,相较而言黄烷-3-醇亚型中的大多数化合物表现出较强的保护活性,其次是黄烷酮亚型,最后是黄烷醇亚型[60]。对于黄烷-3-醇亚型,表没食子儿茶素3-O-没食子酸酯(epigallocatechin gallate,EGCG)和表儿茶素3-O-没食子酸酯(epicatechin gallate,ECG)显示出比EGC和EC 更强的保护活性,表明没食子酸盐基团替代增强了MGO 处理的PC-12 细胞的保护活性[61]。对于黄烷酮亚型如柚皮素和芹菜素,保护作用在于结构上C-2和C-3 位置双键。而黄烷醇亚型的保护作用主要是由于C 环上3 位羟基取代[62]。
儿茶素(catechins)属于黄烷醇类化合物,具有很强的抗氧化活性,体外试验证明,儿茶素能捕获MGO中的羰基,从而抑制羰基化反应[61]。在人血管细胞中,儿茶素通过阻止线粒体通透性改变以及下游凋亡的启动来抑制MGO 诱导的细胞凋亡[16]。天然类黄酮木犀草素可以阻止MGO 诱导的神经元细胞凋亡,通过阻止Bax 蛋白的激活,抑制Cyt-C 和Caspase-3 水平,从线粒体凋亡途径减少神经元细胞凋亡,而Bax 蛋白是mTOR 的靶点,通过AKT/mTOR 途径介导凋亡[50]。槲皮素通过GSK-3β/Nrf2 通路减少MGO 对成骨细胞凋亡,GSK-3β 能调控线粒体膜通道的开放[48]。桑黄素增加GLO1 活性和GSH 浓度,同时降低了MGO 的浓度[41]。白藜芦醇衍生物PTS 通过提高GLO1 水平以及抑制氧化应激和相关的下游线粒体依赖性信号转导凋亡级联来减轻MGO 诱导的人脐静脉内皮HUVEC 凋亡[49]。接骨木中的花青素和槲皮素能有效捕获MGO后形成加合物,并降低MGO 对人肝癌HepG2 细胞的毒性作用[47]。
4.2 酚酸
酚酸具有高抗氧化活性以及清除自由基能力,螯合金属离子,能在糖基化反应期间中和羰基中间体,从而抑制AGEs 的形成[53]。白酒酒糟提取物中七种酚酸化合物(阿魏酸、香草酸、绿原酸、对香豆酸、介子酸、咖啡酸、丁香酸)具有很好的捕获乙二醛的能力,其捕获/清除率高达49.57%[63]。香草酸抑制糖基化机制包括ROS、p38 和JNK、PKC 和氧化敏感蛋白p47phox 表达并且抑制MGO 衍生的CML 形成,从而减少了MGO诱导的神经-2A 细胞凋亡[52]。咖啡酸和绿原酸具有很好的抗糖机化作用,咖啡酸已被证明是一种脂氧合酶抑制剂,绿原酸可干扰葡萄糖吸收,具有清除自由基和金属的能力,可调节一些抗氧化酶基因的表达[54]。体外BSA 模型中发现朝鲜蓟固体废物中提取的绿原酸具有捕获MGO 的能力,并具有清除ABTS+自由基和DPPH 自由基能力[54-55]。阿魏酸可减少MGO 诱导的大鼠肝细胞毒性和氧化应激,降低ROS 形成和线粒体膜电位MMP 增加[51]。香草酸、绿原酸、丁香酸通过改变线粒体膜电位和降低Bax/Bcl-2 的升高、抑制Caspase-3 的激活以及PARP 的裂解减少MGO 对神经元细胞凋亡,抑制MAPK 信号通路(JNK 和p38)的激活[7]。
4.3 多糖
多糖是药用植物中丰富的大分子,具有抗氧化、抗炎、降低血糖等功能。在牛血清蛋白(bovine serum protein,BSA)糖化模型中,Pholiotanameko多糖捕获MGO 并减少MGO 诱导的官能团(羰基和ε-NH2),清除ABTS 和DPPH 自由基,螯合金属亚铁离子并保护人类成纤维细胞Hs68 在糖化胁迫下的细胞活力[56]。黄芪多糖能够维持视网膜周细胞线粒体膜,抑制线粒体膜电位的下降,通过减少ROS 的产生从而抑制氧化应激,调节Bcl-2 家族蛋白(Bcl-2 和Bax)和Caspase 家族蛋白(Caspase-3 和Caspase-9)的表达进而减少MGO引起的细胞凋亡[7]。
4.4 萜类化合物
熊果酸及其异构体齐墩果酸是三萜类化合物,具有抗炎,抗关节炎,细胞抑制和抗增殖作用,对小鼠具有保肝作用,以及膜稳定特性[55]。齐墩果酸和熊果酸降低了醛糖还原酶(AKR)和山梨醇脱氢酶的肾活性,下调了AKR 的mRNA 表达,增强了GLO1 的活性和表达[57]。红苋菜水提物中含有萜类化合物,能降低人类晶状体上皮细胞HLE-B3 中MGO 水平和AKR 活性[64]。
4.5 维生素
维生素是维持人体正常生理功能所必需的有机物质,在新陈代谢中起着重要作用。其中,维生素C(抗坏血酸)、维生素E(α-生育酚)、苯基硫胺素和吡哆胺是优良的抗氧化剂,维生素E 可以阻止ROS 和MGO 衍生的AGEs 的增加[59]。吡哆胺淬灭MGO,改善功能失调的炎症反应,并加速伤口愈合,糖尿病小鼠伤口组织和THP-1M1 样巨噬细胞中GLO1 的表达下降[58]。吡哆醇、硫胺素和焦磷酸硫胺素可通过捕获羰基来抑制AGEs 形成,抑制糖基化级联中的后Amadori 阶段[65]。
5 总结与展望
食品中的MGO 主要来自高糖的食品和饮料中或食品加工中,这些都会导致MGO 的积累。体内糖酵解是MGO 产生的核心,而体内MGO 水平升高与一些慢性疾病密切相关,如高血糖、糖尿病患者体内清除系统受阻,易引起MGO 积累。MGO 引起细胞毒性是多方面的,MGO 可直接作用细胞对细胞造成损伤,可介导ROS 的产生对线粒体、内质网产生影响,导致细胞凋亡,也可通过形成AGEs 诱导细胞损伤。在分子机制上,触发mTOR-AMPK 激活自噬,MGO 还可能激活MAPK 和JAK 途径,促使NF-κB 激活,促炎细胞因子IL-6、IL-8 释放引起炎症,MGO 通过Keap1/Nrf2/ARE信号系统诱导氧化应激等。
人体自身含有MGO 清除系统,正常生理条件下,98% 以上的MGO 均能通过GLO 系统解毒,食品和饮料中的MGO 在代谢过程中的积累现多集中在MGO和蛋白结合的模拟体系中,可采用食物基质如烘焙食品、乳制品等进一步研究MGO 在体内的代谢。此外,MGO 经胃肠道消化后产生的糖基化肽阻碍蛋白酶水解的深层机制仍需探究。
随着对天然产物研究的深入,黄酮类化合物、酚酸、多糖、萜类化合物、维生素都可以清除MGO,通过捕获羰基、清除自由基、螯合金属离子来减少MGO 的积累,在体内增强GLO 酶系统活性。目前研究较多的是多酚类化合物,然而采用化学合成法提取的天然产物衍生物也存在产量有限、提取条件复杂等问题,与合成制剂相比,天然产物来源的MGO 抑制剂还未在临床医学上得到广泛应用,可以与现有的合成药物结合起来治疗或预防疾病等健康问题。对于食源性MGO而言,可考虑在食品加工过程中添加天然产物,探究食品成分、加工过程与天然产物之间的作用以及清除MGO 能力。综上,继续开拓更多MGO 清除剂和糖基化抑制剂及其机制研究具有重要意义。

