芹菜IDF 与多菌群益生菌连续共培养的培养物特性
楚京嬴,吕嘉枥*,高捷,杨柳青
(1.陕西科技大学食品科学与工程学院,陕西西安 710021;2.陕西巨子生物技术有限公司,陕西西安 710077)
益生菌是当摄入足够数量时能给宿主带来有益健康影响的活的微生物[1],益生菌膳食补充剂已成为膳食补充剂(dietary supplement)中最重要的种类之一[2-5]。益生菌膳食补充剂中益生菌的活性是评价其质量的重要指标,提高益生菌的活性通常是通过提高其菌体浓度的方法来实现。富集微生物是提高菌体浓度的一种有效方法,其中的生物膜法富集微生物,具有菌体浓度高、活性强、稳定性好等优势,因此在食品与医药等领域的研究与应用越来越受到关注[6]。
生物膜是指依附于载体材料的特殊微生物聚集体,是由高度密集的微生物组成的生态系统[7]。自然界中大多数微生物都以生物膜的形式存在[8],生物膜富集技术通过微生物与载体材料间的弱相互作用而黏附到载体表面,微生物大量聚集形成生物膜,在流动过程中通过膜富集在载体表面及内部的孔隙来截留微生物,菌体与载体发生共聚集不断黏附到载体表面,从而达到富集效果[9]。张国丽等[10]研究发现,植物乳杆菌PF3-1 生物膜形成过程中菌活性显著提高。Speranza等[11]研究了4 株益生菌在不锈钢材料上形成的生物膜特性,结果表明4 株益生菌在不锈钢材料上均能富集形成生物膜。浦明珠等[12]利用椰果表面的乳酸菌生物膜对牛乳发酵,发现其对牛奶pH 值的降低速率明显高于游离乳酸菌组,且发酵终点时的活菌数也高于游离乳酸菌组。陈翠翠等[13]在振荡培养下,比较了双歧杆菌在6 种植物基水不溶性膳食纤维(insoluble dietary fiber,IDF)中成膜的情况及生物膜特性,结果发现双歧杆菌在葡萄籽IDF 上成膜效果最好,存活率较游离菌株提高4~6.5 倍,模拟胃液耐受性存活率为59.82%,模拟肠液耐受性存活率为13.53%。檀利军等[14]研究发现,不同种类的益生菌混合培养过程中存在一定的调控因素,混合培养这些益生菌形成的生物膜特性优于单菌。薛胜平等[15]通过模拟肠道环境,选用5 株益生菌,以玉米IDF 为载体,连续培养12 d,发现接入的5 种菌均可稳定共存,扫描电镜观察到5 种菌均在玉米纤维上形成了生物膜。玛依诺·木图拉等[16]以不锈钢网布为载体,使嗜热链球菌和保加利亚乳杆菌在其表面形成混菌生物膜,该混菌生物膜对酸和高温具有更高的抗性。目前,有关生物膜法富集益生菌方面的研究尚处于起步阶段,其中选用的载体至关重要,一般应符合以下条件[17]:具有较大表面积且不影响细胞的生物活性,有利于微生物的黏附,不易被水解,不影响微生物间信号分子的交流和营养物质的传递,应为食品级等。
膳食纤维被称为“第七大营养素”,是平衡膳食结构的必须营养素之一[18],在益生菌膳食补充剂研制中,膳食纤维不仅可以作为必须营养素的来源,还可作为保护益生菌的微胶囊壁材[19-21]。目前与益生菌复合的膳食纤维多为谷类、低聚糖类或非食品级材料等,水不溶性膳食纤维(IDF)是易获得的可食性天然食物来源,表面粗糙、比表面积大、有稳定的网状结构等,不仅具有强的持水力、吸附力、抗氧化、改善便秘等生理功能,而且是富集益生菌的理想载体,对益生菌活性有很好保护作用。
芹菜是一种常见的蔬菜,来源广泛,产量高,且含有大量的膳食纤维。芹菜中的IDF 含量为59.4%,高于大部分蔬菜[22];芹菜IDF 主要包括纤维素、半纤维素、木质素和壳聚糖等[23],结构中维管束大量密集,呈丝状,其表面粗糙,有大量管状空腔,比表面积大,利于菌体附着。芹菜IDF 还具有增加饱腹感、有助减肥、减轻水肿、降低血压和血脂等功效[24]。
综上,本文利用生物膜富集微生物的原理,以芹菜IDF 为载体,5 株益生菌为菌株,MRS 为营养液,通过自主设计的富集培养装置,使芹菜IDF 上富集多菌群益生菌,形成富含芹菜IDF 与多菌群益生菌的生物膜培养物,并对其活菌数、菌群结构、代谢物组成、对消化液的耐受性以及抗氧化活性等特性进行分析,以期为进一步研制活性高、功能性强的益生菌与蔬菜膳食纤维有机复合型膳食补充剂提供依据。
1 材料与方法
1.1 材料与试剂
保加利亚乳杆菌LactobacillusbulgaricusG302(Lb G302)、植物乳杆菌L.plantarumG304(Lp G304)、副干酪乳杆菌L.paracaseiG305(Lcp G305)、鼠李糖乳杆菌L.rhamnosusG306(Lr G306)、嗜热链球菌Streptococcus thermophilusQ305(St Q305):陕西科技大学食品科学与工程学院微生物室提供;芹菜:市售;MRS 肉汤培养基、琼脂粉(生物试剂):北京奥博星生物技术有限公司;无水乙醇、戊二醛、邻苯二甲醛、浓盐酸、磷酸二氢钠、氯化钠、碳酸氢钠、尿素、尿酸、硫酸钠、氰化钾、磷酸二氢钾(均为分析纯):天津市科密欧化学试剂有限公司;1,1-二苯基-2-苦基肼(1,1-diphenyl-2-picryl-hydrazyl,DPPH)、黏蛋白、α-淀粉酶(3 700 U/g)、胃蛋白酶(猪胃黏膜)(3 000 U/g)、胰酶(生物试剂)(4 000 U/g):上海源叶生物科技有限公司;DNA 抽提试剂盒、E.Z.N.A.®Soil DNA Kit:美国Omega Bio-Tek 公司;建库试剂盒、NEXTFLEX®Rapid DNA-Seq Kit:美国柏尔生物技术公司;DNA 测序试剂盒、NovaSeq Reagent Kits:美国Illumina 公司;甲醇、乙腈(均为色谱纯):美国Fisher Chemical 公司;甲酸(色谱纯):德国CNW 公司。
1.2 仪器与设备
UV-2600 紫外可见分光光度计:尤尼柯(上海)仪器有限公司;SHA-B 恒温水浴振荡器:常州国华电器有限公司;HC-3018R 高速冷冻离心机:安徽中科中佳仪器有限公司;DSX-280A 高压蒸汽灭菌锅:上海申安医疗器械厂有限公司;PHENOM-PRO 台式扫描电镜:上海飞纳仪器有限公司;Illumina Miseq 测序仪:美国Illumina 公司;UHPLC -Q Exactive HF-X 超高效液相色谱串联傅里叶变换质谱仪:美国Thermo Scientific 公司。
1.3 试验方法
1.3.1 芹菜IDF 的制备
将芹菜洗净,切段,按料水比1∶1(g/mL)打浆1 min 后得浆液,浆液过200 目的滤网使芹菜渣与芹菜汁分离,得到芹菜汁和芹菜渣,分离出的芹菜渣即为芹菜IDF。
1.3.2 富集培养装置的设计
富集培养装置如图1 所示。
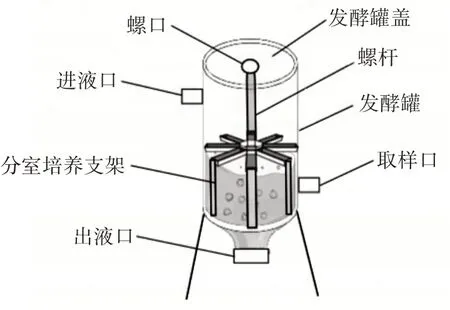
图1 芹菜IDF 富集培养多菌群益生菌的培养装置Fig.1 Celery IDF enrichment culture multi-probiotics culture device diagram
如图1 所示,富集培养装置主要包括两个部分:发酵罐和内置的分室培养支架。发酵罐上设置了发酵罐盖、进液口、取样口和出液口,发酵罐盖上设有螺口,分室培养支架上设有螺杆。分室培养支架可以将富集后的不同益生菌芹菜IDF 分隔开,以便同时获得不同菌体与芹菜IDF 生物膜培养物,通过旋转发酵罐盖可在发酵罐侧面的取样口取不同室内的样品。富集培养具体操作步骤如下。
灭菌:将发酵罐、分室培养支架于灭菌锅中121 ℃、15 min 灭菌处理。接种:将选取的5 种益生菌分别以1%接种量接种于装有MRS 液体培养基和芹菜IDF 的蓝口瓶中培养36 h,过滤得到含有5 种不同益生菌的芹菜IDF,然后将其分别放入分室培养支架的5 个分室内,按罐体容积80%加入MRS 培养液,置于恒温培养箱37 ℃连续动态培养7 d,每隔1 d 更换罐内的MRS 培养液。富集培养:富集培养过程中,于0、1、2、3、4、5、6、7 d 在发酵罐的取样口取各菌复合培养物,混匀,6 000 r/min 离心10 min,弃上清液,获得益生菌与IDF 的复合培养物,测定其活菌数,采用高通量测序技术(16S rDNA)对培养物的细菌V3~V4 区进行测序,同时对0、3、7 d 的各菌复合培养物进行代谢组学分析。
1.3.3 芹菜IDF 与多菌群益生菌混合生物膜培养物对模拟消化液耐受性
参考文献[25]方法制备模拟消化液。以培养7 d的多菌群益生菌与芹菜IDF 复合培养物为试验组,以5 株单菌与芹菜IDF 培养7 d 的培养物为对照组。在模拟口腔消化液中37 ℃恒温水浴振荡器中培养0、10 min;在模拟胃消化液中37 ℃恒温水浴振荡器中培养0、1、2、3 h;在模拟肠消化液中37 ℃恒温水浴振荡器中培养0、2、4、6 h,分别测活菌数。
1.3.4 芹菜IDF 与多菌群益生菌混合生物膜培养物的抗氧化活性
以培养7 d 的多菌群益生菌与芹菜IDF 的复合培养物为试验组,以芹菜IDF 为一个对照组,以5 株单菌与芹菜IDF 培养7 d 的培养物为另一个对照组,分别测定3 组对DPPH 自由基的清除率。
1.4 检测方法
1.4.1 益生菌活菌数量检测
参考GB 4789.35—2016《食品安全国家标准食品微生物学检验乳酸菌检验》[26]检测益生菌活菌数量。
1.4.2 显微表征
参考文献[27]方法,进行扫描电镜显微观察。
1.4.3 芹菜IDF 与多菌群益生菌混合生物膜培养物菌群结构分析
无菌条件下收集0~7 d 的芹菜IDF 与多菌群益生菌混合生物膜培养物,置于离心管中,液氮速冻。在干冰中送至上海美吉生物医药科技有限公司,通过高通量测序技术(16S rDNA)对培养物的细菌V3~V4 区进行微生物多样性测序。
1.4.4 芹菜IDF 与多菌群益生菌混合生物膜培养物代谢组学分析
1.4.4.1 样本的制备
取200 μg 样本于2 mL 离心管中,加入一颗直径6 mm 的研磨珠。用400 μL 提取液(甲醇∶水=4∶1,体积比)含0.02 mg/mL 的内标(L-2-氯苯丙氨酸)进行代谢产物提取。样本溶液于冷冻组织研磨仪-10 ℃、50 Hz研磨6 min 后,低温超声提取30 min(5 ℃、40 kHz)。将样品于-20 ℃静置30 min,离心15 min(4 ℃、13 000×g),移取上清液至微量进样瓶中进行上机分析。此外,取等体积的所有样本代谢物混合制备成质控样本(quality control,QC),在仪器分析过程中,每5~15 个样本中插入一个QC 样本,以考察整个分析过程的重复性。
1.4.4.2 液相色谱-串联质谱法(liquid chromatographytandem mass spectrometry,LC-MS/MS)测试条件
1)色谱条件:2 μL 样本经HSS T3 色谱柱(100 mm×2.1 mm i.d.,1.8 μm)分离后进入质谱检测。流动相A 为95%水+5%乙腈(含0.1%甲酸),流动相B 为47.5%乙腈+47.5%异丙醇+5%水(含0.1%甲酸)。柱温为40 ℃。
2)质谱条件:样品质谱信号采集采用正负离子扫描模式,质量扫描范围m/z 70~1 050。鞘气流速为50 psi(1 psi=6 895 Pa),辅助气流速为13 psi,辅助气加热温度为425 ℃,正模式离子喷雾电压设置为3 500 V,负模式离子喷雾电压设置为-3 500 V,离子传输管温度为325 ℃,归一化的碰撞能为20V-40V-60 V 循环碰撞能。一级质谱分辨率60 000,二级质谱分辨率7 500,采用数据依赖性采集模式采集数据。
1.4.5 芹菜IDF 与多菌群益生菌混合生物膜培养物对消化液耐受性的检测
参照文献[25]的检测方法测定消化液耐受性。
1.4.6 DPPH 自由基清除率的测定
参照文献[28]的方法测定DPPH 自由基清除率。
1.5 数据处理
芹菜IDF 与多菌群益生菌富集培养活菌数的分析使用OriginPro 9.0 软件。芹菜IDF 与多菌群益生菌混合生物膜培养物对消化液的耐受性、抗氧化活性以及对DPPH 自由基清除率分析使用GraphPad Prism 8 软件。
采用液相色谱-串联质谱法分析,使用超高效液相色谱串联傅里叶变换质谱UHPLC-Q Exactive HF-X 系统进行高分辨非靶向代谢组学分析。将原始数据导入代谢组学处理软件Progenesis QI 进行基线过滤、峰识别、积分、保留时间校正、峰对齐,最终得到一个保留时间、质荷比和峰强度的数据矩阵,同时将MS 和MSMS 质谱信息与人类代谢组学数据库(Human Metabolome Database,HMDB)和Metlin 以及测试公司自建库进行匹配,得到代谢物信息。
对预处理后的矩阵文件进行差异分析,R 软件包ropls(Version1.6.2)进行主成分分析(principal component analysis,PCA)和偏最二乘判别分析法分析(partial leastsquares discrimination analysis,PLS-DA),筛选芹菜IDF 与多菌益生菌不同培养阶段的差异代谢物,筛选的标准为VIP>1 且差异显著性检验结果P<0.05。
2 结果与分析
2.1 富集培养过程中芹菜IDF 上活菌数的变化
芹菜IDF 富集培养多菌益生菌过程中5 株益生菌(Lb G302、Lp G304、Lcp G305、Lr G306 和St Q305)在芹菜IDF 上活菌数的变化如图2 所示。
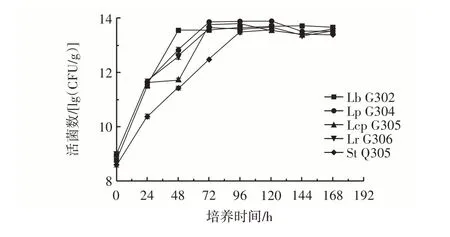
图2 芹菜IDF 富集培养多菌群益生菌过程中IDF 上活菌数的变化Fig.2 Change of viable count on IDF in celery IDF enrichment process of multi-probiotics
如图2 所示,在0~24 h,芹菜IDF 上的活菌数迅速上升,培养24~120 h,芹菜IDF 上的菌体浓度保持缓慢上升趋势,120 h 时活菌数最高可达到7.5×1013CFU/g,之后IDF 上的活菌数目开始出现下降,因为生物膜形成一定厚度后,会自动脱落。
2.2 富集培养过程中芹菜IDF 的显微表征
富集培养过程中,对富集了5 种不同菌株的芹菜IDF 进行扫描电镜的显微表征,培养0 d 和培养7 d 时的扫描电镜图如图3 所示。

图3 5 种菌培养0 d 和7 d 时芹菜IDF 的扫描电镜图(2 000×)Fig.3 Scanning electron microscope images of celery IDF after 0 d and 7 d of cultivation with five strains(2 000×)
图3 显示,在富集培养7 d 时,5 种益生菌的菌体均在芹菜IDF 表面或空腔内富集,形成了具有一定厚度的生物菌膜。
2.3 富集培养过程中菌群结构的变化
在富集培养0~7 d 过程中,菌群结构在属水平上的物种相对丰度变化如图4 所示。
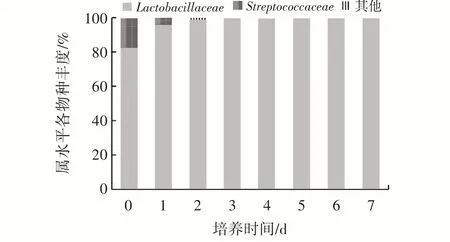
图4 属水平上的物种相对丰度Fig.4 Relative abundance of the species at the genus level
由图4 可知,整个富集培养过程中,在属分类水平上,芹菜IDF 上的细菌主要由乳杆菌属(Lactobacillaceae)和链球菌属(Streptococcaceae)组成,且乳杆菌属在整个培养过程中占据主导地位。乳杆菌属0~7 d 中的丰度依次为82.58%、96.48%、99.27%、99.92%、99.93%、99.93%、99.96%、99.95%,链球菌属依次为17.23%、3.49%、0.72%、0.07%、0.06%、0.05%、0.04%、0.04%,其结果与加入的菌群结构一致。
2.4 富集培养过程中代谢组学分析
2.4.1 PCA 分析
富集培养过程中,采集0、3、7 d 时的培养物,进行代谢组学分析,其PCA 结果如图5 所示。
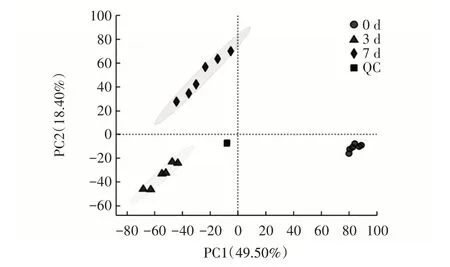
图5 培养物的PCA 模型得分图Fig.5 PCA model score plots of the cultures
通过对0、3、7 d 3 组样本分别进行主成分分析,判断芹菜IDF 与多菌群益生菌富集培养0、3、7 d 的3 组样本间以及组内6 个样本间的变异度大小。如图5 所示,PC1 为49.50%,PC2 为18.40%,累计贡献率达67.90%。其中,3 组样本间出现明显的分离,表明不同培养时间段多菌群益生菌具有不同的代谢特征。此外,3 组样本内的6 个重复样本聚集程度较好,表明组内每个重复样本的代谢物差异较小。
在样本组间代谢差异较小时,由于PCA 分析无法很好地分离组间样本,需采用偏最二乘判别分析法(partial leastsquares discrimination analysis,PLS-DA)建立代谢物表达量与样本之间的关系模型,使各组样本间的区分最大化,从而更好地确立样本关系。根据PLS-DA 模型对1 468 个代谢组数据进行分析,结果如图6 所示。
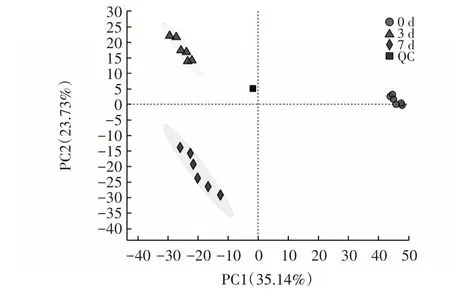
图6 培养物的PLS-DA 模型得分Fig.6 PLS-DA model scores of the cultures
如图6 所示,PLS-DA 得到2 个主成分,主成分1的贡献率为35.14%、主成分2 的贡献率为23.73%。3 组样品的区分效果非常明显,0 d 样本分布在置信区间的右侧,3 d、7 d 样品分布在置信区间的左侧,表明多菌群益生菌在培养后期代谢物的变化程度相对于培养前期较小。
在3 组样本中,共检测出了1 468 个代谢物,代谢物主要为脂类、肽类、碳水化合物、核酸、有机酸、维生素和辅酶因子等。其中培养0 d 时样本中有1 432 个代谢物,3 d 样本中有1 432 个代谢物,7 d 样本中有1 398 个代谢物。
2.4.2 差异代谢物分析
0、3、7 d 时芹菜IDF 与多菌益生菌培养物差异代谢物的分析结果如图7 所示。
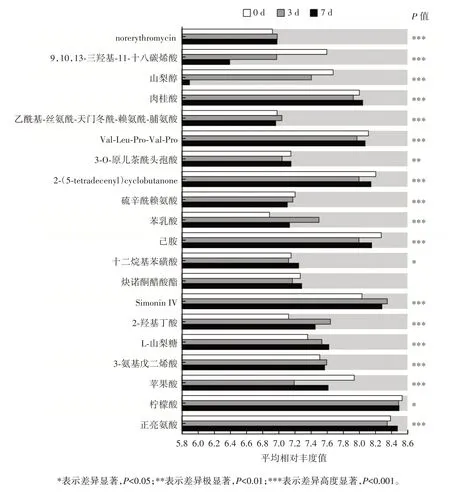
图7 多组间差异代谢物的比较分析Fig.7 Comparative analysis of differential metabolites between multiple groups
图7 表明,3 组样本中,有16 个差异高度显著的代谢物,分别是norerythromycin、9,10,13-三羟基-11-十八碳烯酸、山梨醇、肉桂酸、乙酰基-丝氨酰-天门冬酰-赖氨酰-脯氨酸、Val-Leu-Pro-Val-Pro、2-(5-tetradecenyl)cyclobutanone、硫辛酰赖氨酸、苯乳酸、己胺、Simonin IV、2-羟基丁酸、L-山梨糖、3-氨基戊二烯酸、苹果酸和正亮氨酸。差异极显著的代谢物有1 个为3-O-原儿茶酰头孢酸,差异显著的代谢物有2 个,分别为十二烷基苯磺酸和柠檬酸。
2.4.3 功能性代谢物差异分析
2.4.3.1 神经递质类代谢物
神经递质类代谢物的变化分析结果如图8 所示。

图8 芹菜IDF 富集培养多菌群益生菌过程中神经递质类代谢物的变化分析图Fig.8 Analysis of changes in neurotransmitter metabolites during multi-probiotics cultivation by celery IDF enrichment
如图8 所示,芹菜IDF 富集培养多菌群益生菌过程中,存在20 种有差异的神经递质类代谢物。其中2种差异显著,分别是1-十四烷酰基-2-(9Z,12Z,15Z-十八碳三烯酰基)-sn-甘油和十六酰胺乙醇;2 种差异极显著,分别是ADP 和乙酰辅酶A;16 种差异高度显著,分别是Morph、L-谷氨酸、L-谷氨酸盐、3H-多巴胺、自行素-1、血栓素B2、腺苷、γ-氨基丁酸、5-羟基-L-色氨酸、琥珀酸、血清素、adenosine,8-(butylamino)-N-cyclopentyl、5-羟基吲哚乙酸、L-色氨酸、前列腺素E2 和脱氧腺苷。与培养0 d 相比,培养7 d 时显著上调的神经递质类代谢物有14 种,分别是L-谷氨酸、3H-多巴胺、自行素-1、血栓素B2、adenosine,8-(butylamino)-N-cyclopentyl、5-羟基-L-色氨酸、琥珀酸、血清素、5-羟基吲哚乙酸、L-色氨酸、脱氧腺苷、ADP 和乙酰辅酶A;下调的神经递质类代谢物有6 种,分别是Morph、腺苷、γ-氨基丁酸、前列腺素E2、1-十四烷酰基-2-(9Z,12Z,15Z-十八碳三烯酰基)-sn-甘油和十六酰胺乙醇。
2.4.3.2 维生素和辅酶类代谢物
维生素和辅酶类代谢物的变化分析结果如图9所示。
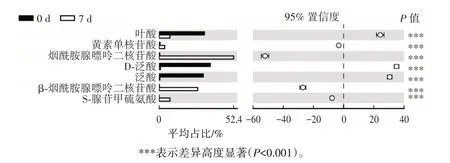
图9 芹菜IDF 富集培养多菌群益生菌过程中维生素和辅酶类代谢物的变化分析图Fig.9 Analysis of changes in vitamins and coenzyme metabolites during multi-probiotics cultivation by celery IDF enrichment
由图9 可知,在富集培养过程中,共代谢产生7 种维生素和辅酶类的代谢物且均差异高度显著。这7 种代谢物分别是β-烟酰胺腺嘌呤二核苷酸、烟酰胺腺嘌呤二核苷酸、泛酸、D-泛酸、叶酸、S-腺苷甲硫氨酸和黄素单核苷酸。
2.4.3.3 肽类代谢物
肽类代谢物的变化分析结果如图10 所示。
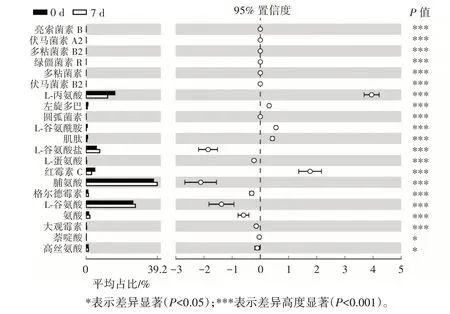
图10 芹菜IDF 富集培养多菌群益生菌过程中肽类代谢物的变化分析图Fig.10 Analysis of changes in peptide metabolites during multi-probiotics cultivation by celery IDF enrichment
由图10 可知,富集培养过程中,共代谢产生21 种有差异的肽类代谢物。其中2 种差异显著,分别为萘啶酸和高丝氨酸;19 种差异高度显著,分别为亮索菌素B、伏马菌素A2、多粘菌素B2、绿僵菌素R、多粘菌素、伏马菌素B2、L-丙氨酸、左旋多巴、圆孤菌素、L-谷氨酰胺、肌肽、L-谷氨酸盐、L-蛋氨酸、红霉素C、脯氨酸、格尔德霉素、L-谷氨酸、氨酸和大观霉素。与培养0 d 相比,培养7 d 时表达量显著上调的肽类代谢物有9 种。
综上,富集培养7 d 与培养0 d 相比,神经递质类、维生素和辅酶类以及肽类代谢物,不仅种类有所增加,且大部分代谢物的表达量上调,说明芹菜IDF 与多菌群益生菌混合生物膜培养物的益生效果有所增强。
2.5 芹菜IDF 与多菌群益生菌混合生物膜培养物对消化道的耐受性
芹菜IDF 与多菌群益生菌混合生物膜培养物对消化道的耐受性分析结果如图11 所示。

图11 芹菜IDF 与多菌益生菌混合生物膜培养物对消化液的耐受性Fig.11 Digestive fluid tolerance of celery IDF and mixed biofilm with multi-probiotics
由图11 可知,在不同消化液中,随着时间的延长,活菌数均有不同程度的降低。模拟口腔消化10 min时,单菌与多菌的耐受力差异较小,存活率都达到了98.00%以上,表明人工模拟的口腔消化对益生菌的影响较小;人工模拟胃液处理1、2、3 h 后,单菌和多菌活菌数均持续下降,Lb G302、Lp G304 的存活率最低,且下降速度最快,而多菌存活率下降缓慢,且存活率较比单菌高。经过模拟胃液消化3 h 后,5 株单菌和多菌的存活率分别为7.74%、5.50%、31.52%、26.35%、26.00%、41.28%,芹菜IDF 中活菌数保持在1010CFU/g 左右;在人工模拟的肠液中处理6 h,单菌和多菌的存活率下降均缓慢,且多菌的最后存活率与Lb G302 和Lp G304无明显差异,5 株单菌和多菌在人工肠液处理6 h 后的存活率分别为55.16%、51.59%、40.79%、42.11%、19.65%、55.07%,且多菌培养物中的活菌数维持在1011CFU/g左右。综上,在整个模拟消化体系中,模拟胃液消化阶段存活率最低,其次是模拟肠道消化和口腔消化;多菌较单菌对消化液有较强的耐受力。
2.6 芹菜IDF 与多菌群益生菌混合生物膜培养物的抗氧化活性
富集培养7 d 时培养物对DPPH 自由基清除率如图12 所示。
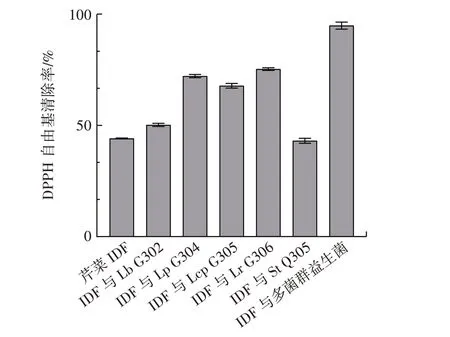
图12 芹菜IDF 与多菌群益生菌混合生物膜培养物对DPPH 自由基清除率Fig.12 DPPH free radical scavenging rate of celery IDF and mixed biofilm with multi-probiotics
由图12 可知,多菌对DPPH 自由基的清除率明显高于单菌,清除率达到了95% 以上;5 株单菌Lr G306、Lp G304、Lcp G305、Lb G302、St Q305 对DPPH的清除率依次为74.95%、71.86%、67.33%、49.54%、44.10%;芹菜IDF 对DPPH 自由基的清除率为44.28%。说明多菌群复合有助于提高其抗氧化性能。
3 结论
以可食性、易获取、表面粗糙、表面积大的天然膳食纤维源芹菜IDF 为载体,利用生物膜富集微生物的原理,利用自主设计的富集培养装置,分室连续共培养5 株试验菌株,培养7 d 时,获得的芹菜IDF 与多菌群益生菌的生物膜培养物中的活菌数最高可达到7.5×1013CFU/g;经菌群结构分析,其中加入的乳杆菌属和链球菌属始终均被检出;与单菌相比,芹菜IDF 与多菌群益生菌混合生物膜培养物对模拟口腔消化液、模拟胃消化液和模拟肠消化液的抗逆性显著增强,对DPPH 自由基的清除率显著提高;代谢组学分析结果,培养7 d 与培养0 d 相比,功能性代谢物神经递质类、维生素和辅酶类以及肽类等,不仅种类有所增加,且大部分代谢物的表达量上调,说明芹菜IDF 与多菌群益生菌混合生物膜培养物的益生效果一定程度上有所增强。可见试验设计采用生物膜法,利用蔬菜IDF 为载体,将有单菌的芹菜IDF 分隔于各分室内,可使5 种不同的益生菌都能富集在各室的芹菜IDF 上,富集培养装置和培养方法可行。另一方面,芹菜IDF 不仅是富集益生菌的载体,而且是后续研制的膳食补充剂的功能物质,同时还是益生菌的保护剂。研究结果可为进一步研制富集菌浓更高、功能性更强的益生菌与蔬菜IDF 有机复合膳食补充剂提供科学依据和技术支撑。

