银杏内酯B对膀胱癌J82细胞增殖、凋亡的机制研究
庞华 智静涛 边建华 刘文杰
膀胱癌是泌尿系统常见的恶性肿瘤,近年来发病率呈上升趋势,男性发病率高于女性,中老年群体发病率高于年轻群体,手术、化疗和免疫治疗是主要治疗方法,但会导致其预后不良,且复发率高[1-2]。因此,寻找新的有效的治疗手段迫在眉睫。中医药具有增效减毒作用,在治疗肿瘤方面应用越来越广。膀胱癌属尿血、血淋及癃闭范畴,以止血凉血、泻火清热和散结利湿治疗为主[3]。
银杏内酯B 是一种从银杏叶中提取的二萜内酯,具有抗氧化、抗炎、清除自由基功效,此外银杏内酯B还有抗肿瘤活性,能有效抑制肿瘤细胞增殖,诱导其凋亡,还可提高化疗药物的有效性,降低耐药发生,增强放疗敏感性[4]。Wang等[5]报道银杏内酯B通过beclin-1依赖性自噬抑制肺癌细胞增殖,银杏内酯B 还可诱导人结肠癌SW480 细胞的凋亡[6],银杏内酯B还可以通过上调mi R-223-3p抑制ZEB1蛋白翻译,从而抑制膀胱癌细胞的侵袭性[7],但其抗癌的作用机制尚不完全明确。
核转录因子-κB(nuclear transcription f actor-Κb,NF-κB)通路是活化的NF-κB 进入细胞核内与DNA 结合,通过调控靶基因的转录,参与多种肿瘤增殖、凋亡等生物学行为,当外界刺激导致NF-κB通路被激活时,IKK 将NF-κB 家族的抑制蛋白IκB磷酸化,从而抑制蛋白失去活性,进一步导致NFκB核转录因子发生解离后进入细胞核后并且发挥对应的生物学机制[8-9]。据报道,苦参碱通过抑制toll样受体4(toll-like receptor,TLR4)/NF-κB 通路减弱膀胱癌小鼠模型的肿瘤生长和诱导凋亡[10],但银杏内酯B 是否可以通过调控NF-κB 信号通路影响膀胱癌J82细胞的生物学行为尚未可知。基于此,本研究探讨银杏内酯B干预对J82细胞增殖、凋亡的影响以及对NF-κB信号通路的调控机制,可为膀胱癌的治疗研究提供新的理论参考。现报告如下。
材料与方法
一、材料
人膀胱移行细胞癌细胞(J82)购自上海赛百慷生物技术股份有限公司。银杏内酯B、紫杉醇购自上海源叶生物科技有限公司,纯度≥98%,NF-κB通路抑制剂BAY 11-7082购自上海源叶生物科技有限公司,纯度≥99%,NF-κB 信号通路激活剂Prostratin购自Aladdin公司,纯度≥98%,胎牛血清和高糖DMEM 培养液购自美国Gibco 公司,CCK-8试剂盒购自上海翌圣生物科技有限公司,5-乙炔基-2′脱氧尿嘧啶核苷(5-et hynyl-2′-deoxyuridine,Ed U)细胞增殖检测试剂盒购自上海碧云天生物技术有限公司,Hoechst 33258 染色试剂盒购自江苏凯基生物技术股份有限公司,逆转录试剂盒、SYBR Pre mix Ex TaqⅡ试剂盒购自杭州主诺生物技术有限公司,RIPA 裂解液购自美国abw 公司,二喹啉甲酸蛋白试剂盒购自英国Abca m 公司,鼠抗人[IκBα、p-IκBα、NF-κB p65、p-NF-κB p65、Caspase-3、D1及β-actin一抗、辣根过氧化物酶标记的山羊抗鼠Ig G(二抗)购自美国CST 公司。
MF52-N 型倒置荧光显微镜购自广州市明美光电技术有限公司;H WO301型二氧化碳培养箱购自美国FORMA 公司;Multiskan Ascent型酶标仪购自美国Ther mo公司;7500 型实时荧光定量PCR仪器购自美国ABI公司,Gel Doc 2000型凝胶成像系统购自美国Back man公司。
二、实验方法
1.人膀胱癌J82细胞培养:在37℃,5%CO2培养箱中培养,将人膀胱癌J82 细胞培养于高糖DMEM 培养液(含10%胎牛血清,1%青-链霉素)中,待细胞贴壁达80%以上时进行细胞传代,取第4代对数期生长J82细胞用于实验。
2.分组及给药:选取第4代对数期生长的膀胱癌J82细胞,调整密度至2×105个/ml,接种到96孔板中,每孔100μl。将膀胱癌J82细胞分为①对照组、低/中/高浓度实验组和阳性药物组;②对照组、银杏内酯B组、激活剂组和抑制剂组,对照组细胞不做干预,低/中/高浓度实验组分别加入5、10和20μmol/L银杏内酯B[11]进行干预,阳性药物组用100 n mol/L 紫杉醇[12]进行干预,银杏内酯B组是用20μmol/L银杏内酯B进行干预,激活剂组是在20μmol/L银杏内酯B 基础上加入1μmol/L NFκB通路激活剂Prostratin,抑制剂组是在20μmol/L银杏内酯B基础上加入5μmol/L NF-κB通路抑制剂BAY 11-7082,干预24 h。每组设置3个复孔,后置于37℃、5%CO2培养箱中培养。
3.CCK-8法测定J82细胞的活力:细胞分组与给药方法同上,选取第4代对数期生长的细胞,调整密度至2×105个/ml,接种到96 孔板中,每孔加100μl,实验重复3 次。各组干预24 h 后,加 入CCK-8溶液10μl,继续孵育2 h,使用酶标仪测定各组光密度(OD)值(450 n m)。细胞活力=(低/中/高浓度实验组或阳性药物组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%。
4.Ed U 法测定J82细胞的增殖能力:细胞分组与给药方法同上,干预24 h后,收集细胞,用完全细胞培养液重悬,以2×105个/孔的密度接种于12孔板,于37℃、5%CO2培养箱中培养24 h,进行Ed U 处理,去除培养液,用0.5 ml 4%多聚甲醛固定,室温15 min,再用0.5 ml 3%BSA 洗涤3次;用0.5 ml 0.3%Triton X-100去除BSA,室温10 min,再用BSA 洗涤3次;12孔板中每孔加200μl Click反应液,室温避光孵育30 min,3%BSA 洗涤3次去除Click反应液;每孔加入0.5 ml Hoechst,室温避光孵育10 min;再用3%BSA 洗涤3次去除Hoechst;装片,荧光显微镜拍照,再用I mage J软件处理图片。Ed U 阳性染色细胞(红色)占总细胞(蓝色)的百分比表示细胞增殖率。
5.Hoechst 33258染色法测定J82细胞凋亡情况:细胞分组与给药方法同上,干预24 h后,将J82细胞接种到12 孔板中,每孔加约2×105个细胞,PBS洗涤细胞2次(每次5 min)加入新鲜配置4%多聚甲醛,4℃固定10 min。PBS洗涤3次(5 min/次),加Hoechst 33258染液(5 mg/L)10μl/孔,避光孵育10 min,PBS洗涤3次(5 min/次),封固后,用荧光显微镜对细胞凋亡情况进行拍照。凋亡细胞的形态特征是细胞核染色不均浓染且所发荧光较强,呈亮蓝色。I mage-J图像分析软件计算凋亡细胞数。细胞凋亡率= 凋亡细胞数/细胞总数×100%。
6.RT-qPCR 测 定J82 细 胞 中Cyclin D1 和Caspase 3 mRNA 相对表达量:细胞分组与给药方法 同上,干 预24 h 后,将J82 细 胞 接 种 到12 孔 板中,每孔加约2×105个细胞,Trizol试剂盒提取总RNA,按逆转录试剂盒说明进行逆转录反应,获取c DNA 模版。参照SYBR Premix Ex TaqⅡ试剂盒说明书进行RT-q PCR 扩增。反应条件为:94℃预变性5 min;94℃变性35 s,58℃退火35 s,72℃延伸35 s,设置40 次循环。以GAPDH 为内参,2-△△CT法计算Cyclin D1和Caspase 3相对表达量。引物序列见表1。

表1 RT-q PCR 引物序列
7.Western blotting 法 检 测J82 细 胞 中Caspase-3、Cyclin D1和NF-κB 通路相关蛋白的表达水平:细胞分组与给药方法同上,干预24 h时,收集各组细胞于RIPA 液在冰上进行裂解,4℃、12 000 r/min 离心20 min,取上清进行蛋白变性后,制胶,上样,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳凝胶电泳,300 mA 恒流转聚偏二氟乙烯膜,使用5%脱脂牛奶封闭2 h,然后参照抗体说明书加入一定稀释比例的一抗(IκBα、p-IκBα、NF-κB p65、p-NF-κB p65、Caspase-3、Cyclin D1及β-actin),4℃孵育过夜,TBST 洗涤3次后加入辣根过氧化物酶标记山羊抗鼠Ig G 二抗,孵育2 h 后弃去液体,TBST 洗涤3次,最后加显影液,使用凝胶成像系统拍照记录。蛋白灰度值用G 表示,蛋白相对表达量=G目的蛋白/G内参蛋白(β-actin)。
三、统计学方法
采用SPSS 23.0软件进行统计分析,符合正态分布且方差齐性,数据以(±s)表示。多组间比较采用单因素方差分析法,进一步两组间比较Dunnett'st检验,P<0.05表示差异有统计学意义。使用Graph Pad Pris m 8软件进行作图,I mage J计算细胞增殖、凋亡细胞数和蛋白灰度值。
结 果
一、银杏内酯B抑制J82细胞的活力和增殖诱导其凋亡
分别使用CCK-8、Ed U 和Hoechst法检测银杏内酯B对J82细胞活力、增殖和凋亡的影响(图1~图3),实验结果显示,干预24 h时,对照组、低/中/高浓度实验组和阳性药物组的细胞活力分别为(100±8.61)%、(90.97±5.94)%、(83.84±5.20)%、(68.13±4.29)%、(67.17±3.90)%,细胞增殖率分别为(38.76±1.47)%、(33.27±3.58)%、(28.93±2.51)%、(20.20±2.89)%、(18.20±3.36)%,细胞凋亡率分别为(1.72±0.55)%、(2.82±0.41)%、(7.49±1.76)%、(12.16±1.93)%、(12.17±1.41)%,各组细胞活力、细胞增殖率、细胞凋亡率之间均差异有统计学意义(F活力=18.084、F增殖=27.604、F凋亡=39.829,均P<0.001)。与对照组相比,低/中/高浓度实验组和阳性药物组细胞活力和增殖率降低,细胞凋亡率升高,其中低浓度实验组差异无统计学意义(P>0.05),中/高浓度实验组和阳性药物组差异有统计学意义(P<0.05);与阳性药物组相比,低/中/高浓度实验组细胞活力和增殖率升高,细胞凋亡率降低,其中高浓度实验组差异无统计学意义(P>0.05),低/中浓度实验组差异有统计学意义(P<0.05),所以选择与阳性药物组效果相当的高浓度实验组加上NF-κB 通路激活剂和抑制剂分别作为激活剂组和抑制剂组进行后续通路的验证实验。

图1 银杏内酯B对J82细胞活力的影响
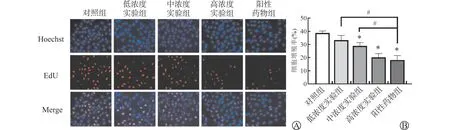
图2 银杏内酯B对J82细胞增殖的影响
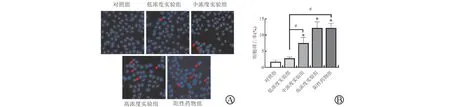
图3 银杏内酯B对J82细胞凋亡的影响
二、银杏内酯B通过抑制NF-κB 通路抑制J82细胞的活力和增殖诱导其凋亡
为了验证银杏内酯B 是否通过NF-κB 通路影响J82细胞的活力、增殖和凋亡,在20μmol/L银杏内酯B基础上加入NF-κB 通路抑制剂和激活剂作为激活剂组和抑制剂组,结果显示,对照组、银杏内酯B 组、激活剂组、抑制剂组的细胞活力分别为(100.27±6.35)%、(61.58±7.24)%、(86.06±9.26)%、(34.21±8.77)%,细胞增殖率分别为(38.76±2.46)%、(25.87±2.16)%、(33.27±3.58)%、(18.38±1.68)%,细胞凋亡率分别为(1.72±0.55)%、(12.16±1.93)%、(7.42±1.31)%、(24.67±2.70)%,各组细胞活力、细胞增殖率、细胞凋亡率之间均差异有统计学意义(F活力=39.544、F增殖=35.825、F凋亡=87.829,均P<0.001)。与银杏内酯B 组相比,激活剂组细胞活力和增殖率显著升高,细胞凋亡率显著降低,而抑制剂组细胞活力和增殖率显著降低,细胞凋亡率显著升高(P<0.05),见图4~6。

图4 银杏内酯B通过NF-κB通路对J82细胞活力的影响

图5 银杏内酯B通过NF-κB通路对J82细胞增殖的影响

图6 银杏内酯B通过NF-κB通路对J82细胞凋亡的影响
三、银杏内酯B通过抑制NF-κB 通路抑制J82细胞Cyclin D1表达诱导Caspase-3表达
分别用RT-qPCR 和Wester n bl otting 法对Caspase-3和Cyclin D1 mRNA 和蛋白表达水平进行检测,结果如图7所示,对照组、银杏内酯B 组、激活剂组、抑制剂组细胞中Caspase-3 mRNA 表达水平分别为(1.00±0.04)、(1.76±0.16)、(1.10±0.06)、(2.27±0.21),Cyclin D1 mRNA 表达水平分别为(1.00±0.04)、(0.49±0.08)、(0.78±0.07)、(0.22±0.03),Caspase-3蛋白表达水平分别为(0.64±0.03)、(1.01±0.1)、(0.76±0.09)、(1.32±0.11),Cyclin D1 蛋白表达水平分别为(1.04±0.04)、(0.58±0.06)、(0.87±0.05)、(0.26±0.04),各组Caspase-3、Cyclin D1 mRNA 和蛋白表达水平之间均差异有统计学意义(FCaspase-3mRNA=56.944、FCyclinD1mRNA= 100.543、FCaspase-3蛋白=34.916、FCyclinD1蛋白=151.344,均P<0.001)。与对照组相比,银杏内酯B 组Caspase-3 mRNA 和蛋白表达水平显著升高,而Cyclin D1 mRNA 和蛋白表达水平显著降低(P<0.05);与银杏内酯B组相比,激活剂组Caspase-3 mRNA 和蛋白表达水平显著降低,而Cyclin D1 mRNA 和蛋白表达水平显著升高(P<0.05),与之相反,抑制剂组Caspase-3 mRNA 和蛋白表达水平显著升高,Cyclin D1 mRNA和蛋白表达水平显著降低(P<0.05)。
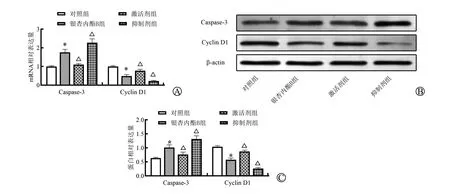
图7 银杏内酯B通过NF-κB通路对J82细胞Caspase-3和Cyclin D1表达水平的影响
四、银杏内酯B抑制J82细胞NF-κB通路的活化
为了确定银杏内酯B 对NF-κB 信号通路活化状态的影响,本研究检测了该通路的关键性蛋白IκBα、p-IκBα、NF-κB p65和p-NF-κB p65的表达水平(图8 A),蛋白定量分析结果显示(图8B),对照组、银杏内酯B组、激活剂组、抑制剂组细胞中IκBα蛋白表达水平分别为(0.39±0.01)、(0.39±0.01)、(0.43±0.02)、(0.44±0.04),p-IκBα蛋白表达水平分别为(0.70±0.05)、(0.47±0.04)、(0.66±0.07)、(0.31±0.04),NF-κB p65蛋白表达水平分别为(0.83±0.04)、(0.82±0.02)、(0.80±0.06)、(0.86±0.05),p-NF-κB p65蛋白表达水平分别为(1.05±0.07)、(0.76±0.07)、(1.04±0.10)、(0.43±0.02),各组IκBα和NF-κB p65蛋白表达水平之间差异无统计学意义(FIκBα=3.773,PIκBα=0.059;FNF-κBp65=0.926,PNF-κBp65=0.471);各组p-IκBα和p-NF-κB p65蛋白表达水平之间均差异有统计学意义(Fp-IκBα=36.868、Fp-NF-κBp65=50.891,均P<0.001)。与对照组相比,银杏内酯B组p-IκBα和p-NF-κB p65蛋白表达水平显著降低(P<0.05);与银杏内酯B 组相比,激活剂组p-IκBα 和p-NF-κB p65蛋白表达水平显著升高(P<0.05),而抑制剂组p-IκBα和p-NF-κB p65蛋白表达水平显著降低(P<0.05)。
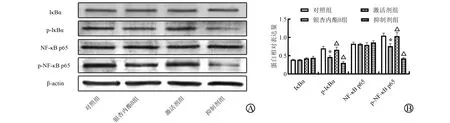
图8 银杏内酯B对J82细胞NF-κB信号通路相关蛋白表达的影响
讨 论
膀胱癌是一种常发生于男性老年群体的恶性肿瘤,随着老龄化出现发病率也在逐渐上升,目前治疗膀胱癌的方法仍是手术、放化疗,但治疗效果不理想,治疗后病情易反复甚至加剧,且患者生活质量低下[13-14],开发新的药物尤为迫切。中医药可降低手术创伤及毒副作用,中医学认为膀胱癌发病机理与湿热久郁、膀胱热度郁结相关,当以养阴益气为主,配合利湿[15]。银杏内酯B 是银杏叶提取物的主要活性成分,目前已被用作抗癌剂,例如王怀安等[16]证明了银杏内酯B 可以用于治疗多种恶性肿瘤,Kawasaki等[17]研究发现银杏内酯B可以增强口腔癌患者的化疗效果,Zhi等[18]报道银杏内酯B 可抑制膀胱癌细胞的侵袭能力,说明银杏内酯B具有抑癌作用,然而,其对膀胱癌的抑癌作用机制仍尚不完全清楚,因此本实验研究了银杏内酯B对膀胱癌细胞的恶性生物学行为,并发现与对照组相比,中/高浓度实验组和阳性药物组细胞活力、增殖率显著降低,细胞凋亡率显著升高,提示中/高浓度实验组可抑制J82细胞增殖促进J82细胞凋亡;与阳性药物组相比,低/中/高浓度实验组细胞活力和增殖率升高,细胞凋亡率降低,但高浓度实验组差异无统计学意义,说明了高浓度实验组与阳性药物组对J82细胞的抑增殖和促凋亡作用相当,所以选择高浓度实验组进行后续通路验证实验,以上结果证明了银杏内酯B可以抑制J82细胞的增殖促进其凋亡,有良好的医学前景。肿瘤生长是细胞过度增殖和逃避凋亡的结果。Cyclin D1是一种在细胞周期进程中起关键作用的细胞周期蛋白依赖性激酶调节蛋白,可作为膀胱癌的增殖标志物[19]。Caspase-3的过表达被认为与膀胱组织的肿瘤发生和凋亡密切相关[20]。Cyclin D1 和Caspase-3 作为膀胱癌增殖和凋亡标志性蛋白,在膀胱癌细胞增殖和凋亡中发挥重要作用,因此,我们检测了Caspase-3 和Cyclin D1 的mRNA 和蛋白表达,结果发现,与对照组相比,银杏内酯B组Caspase-3 mRNA 和蛋白表达水平显著升高,而Cyclin D1 mRNA 和蛋白表达水平显著降低,提示银杏内酯B可以抑制J82细胞的Cyclin D1表达,促进Caspase-3表达。综上,银杏内酯B可能是通过下调Cyclin D1、上调Caspase-3 来抑制J82细胞的增殖促进其凋亡的。
NF-κB通路已广泛参与癌症的发展和进展,可参与调控多种癌细胞生长和分化[21]。静息状态下,存在于胞浆中,与IκBα结合,当炎症或恶性行为发生时,特异性激酶可将IκBα磷酸化使其快速被蛋白小体降解,NF-KB 与IκB 解离并释出,进入细胞核与靶基因启动子区特定结合序列结合,增加相关基因转录速度。而银杏内酯B 具有抗炎和抗癌等生物活性,可抑制炎性介质释放和肿瘤细胞的迁移、侵袭,从而阻断NF-KB 通路的活化。因此,抑制NFKB为抗炎药银杏内酯B 重要的作用靶点。NF-κB信号通路还参与膀胱癌的发生、发展,阻断NF-k B可抑制膀胱癌的生长[22]。卢友路[23]报道尼古丁通过激活NF-κB通路促进膀胱癌细胞增殖、迁移和侵袭,还有研究表明,银杏内酯通过抑制NF-κB 信号通路对阿尔茨海默病细胞具有保护作用[24],银杏内酯B通过抑制NF-κB 信号通路抑制小胶质细胞的活化[25]。但关于银杏内酯B 对膀胱癌细胞中NFκB信号通路的调控作用未见报道,因此本研究分析了银杏内酯B对NF-κB通路关键蛋白的表达水平,结果显示,与对照组相比,银杏内酯B 组p-IκBα和p-NF-κB p65蛋白表达水平显著降低,提示银杏内酯B可能抑制了NF-κB 通路的信号转导,与王瑾等[26]的研究相符。也进一步验证了NF-k B 通路在各种细胞进程中起重要作用。在银杏内酯B 组中加入NF-κB 信号通路抑制剂和激活剂进行NF-κB通路验证实验,发现与银杏内酯B 组相比,激活剂组细胞凋亡率及Caspase-3 mRNA 和蛋白表达水平显著降低,细胞活力、增殖率、Cyclin D1 mRNA和蛋白以及p-IκBα、p-NF-κB p65蛋白表达水平显著升高,抑制剂组的这些指标变化趋势与激活剂组相反,提示银杏内酯B是通过抑制NF-κB信号通路下调Cyclin D1、上调Caspase-3进而抑制细胞的增殖诱导其凋亡。
综上所述,银杏内酯B 可抑制人膀胱癌J82细胞增殖促进其凋亡,其作用机制与抑制NF-κB信号通路的活化有关。本研究从细胞功能方面揭示了银杏内酯B对人膀胱癌系J82细胞增殖和凋亡的作用以及在NF-κB信号通路上的机制研究,但是本文仅在NF-κB信号通路上进行分析,是否存在其他通路参与膀胱癌的生物学过程还未研究。

