KDM6B通过MAPK 信号通路调控肾癌细胞的增殖和迁移
林昌伟 袁祖君
肾细胞癌(renal cell carcino ma,RCC)已成为泌尿生殖系统最常见的肿瘤之一,约占所有恶性肿瘤的3%[1]。而其中最常见的亚型为肾透明细胞癌(clear cell renal cell carcino ma,cc RCC),约占RCC的80%~90%[2]。在首次诊断时,约有25%~30%的cc RCC患者已经出现转移[3]。因此,研究cc RCC的发生发展机制,寻找新的生物标志物和潜在的治疗靶点对于cc RCC诊疗具有重要意义。
组蛋白甲基化异常是肿瘤细胞中常见的表观遗传学改变之一,针对相关基因进行靶向治疗能否成为恶性肿瘤的关键潜在治疗策略也成为肿瘤研究的热点[4]。赖氨酸特异性去甲基酶6B(lysine specific de met hylase 6B,KDM6B)是Ju monji C 组蛋 白去甲基化酶家族的成员,其作用是特异性去除组蛋白H3的第27个氨基酸的甲基化修饰,从而影响基因的转录调控。KDM6B广泛参与细胞的分化、增殖、衰老和凋亡过程,是细胞应对环境压力做出应激反应的关键调控基因。在多种病理生理过程中,赖氨酸特异性去甲基酶蛋白家族的成员发挥双重作用[5-7]。在某些人类癌症(如非小细胞肺癌[8]和结直肠癌[9])中,KDM6B 基因表达显著下调,然而在其他情况下(如食管鳞状细胞癌[10]和肝癌[11]),KDM6B的表达水平在癌组织中显著升高。尽管对KDM6B已有一定的研究,但对其在cc RCC 中的表达情况及具体作用机制仍知之甚少。因此,本研究旨在探究KDM6B 异常表达在cc RCC 中的潜在临床意义,并研究KDM6B对cc RCC细胞增殖和迁移侵袭能力的影响及潜在的下游效应。
材料与方法
一、实验材料与组织样本
cc RCC组织蜡块来源于在我院诊疗的42名患者。排除标准:①年龄小于18岁患者;②缺乏完整临床病理资料的患者;③既往有其他恶性肿瘤病史的患者;④预期寿命<6个月的患者。南充市中心医院伦理委员会批准本次研究,所有患者均签署知情同意书,同意以匿名方式使用患者肿瘤组织蜡块、临床病理资料及随访信息。
人肾癌细胞株ACHN 和Caki-1均购自中国科学院上海细胞库;RPMI-1640培养基(31800),Cell Counting Kit-8 assay(CCK8,CA1210),BCA 蛋白定量试剂盒,SDS-PAGE预制胶试剂盒(P1200),超强化学发光ECL 试剂(PE0010),RIPA 蛋白裂解液(R0010)、一抗及二抗稀释液(A1800)、1×TBST洗膜液(D1061)、PBS缓冲液(P1022)、结晶紫(C8470)均购自中国北京索莱宝科技有限公司;PVDF膜购自德国罗氏诊断有限公司(03010040001);胎牛血清(16140089)和Lipofectamine 2000脂质体(11668500)购自美国Ther mo公司;垂直蛋白电泳仪和转膜电泳槽购自美国Bio-Rad公司;酶标仪购自Ther mo公司;电子显微镜购自Leica公司;小干扰RNA 的设计和合成、PON1基因及GAPDH 基因的PCR 引物均由上海生工生物工程有限公司完成。Transwell小室购自Merck Millipore,Matrigel胶购自BD Biosciences。兔源KDM6B 抗体(ab169197)和兔源GAPDH 抗体(ab8245)均购自美国Abcam 公司;兔源细胞外信号调节激酶蛋白(extracellular signal-regulated kinase,ERK)抗体(4695),兔源细胞外信号调节激酶蛋白(phosphor ylated extracell ular signal-regulated kinase,p-ERK)抗体(4370)购自美国CST 公司。
二、癌症基因组图谱(The Cancer Geno me Atlas Progra m,TCGA)数据库分析
通过基因表达谱交互分析(gene expression profiling interactive analysis,GEPIA)(http://gepia.cancer-pku.cn/)数据库分析TCGA 数据库中533个样本KDM6B 表达水平与病理分期的关系。根据KDM6B 表达水平中位值,将患者分为KDM6B高表达水平组及KDM6B 低表达水平组。采用Kaplan-Meier分析L MNB1 表达水平高低对患者预后的影响,并生成Kaplan-Meier生存曲线。
三、免疫组化检测
免疫组化法检测肾透明细胞癌组织中KDM6B的表达。对于I HC染色,组织部分脱蜡后进行抗原修复:在10 m M 柠檬酸钠煮沸(p H 值6.0)并在130℃维持3 min。切片自然冷却后用3%的过氧化氢溶液处理为30 min,冲洗,用5%的正常山羊血清作为阻断剂孵育20 min。切片用小鼠抗KDM6B抗体在4℃孵育过夜。第2天,载玻片在PBS中洗涤,室温下与二抗孵育30 min。所有步骤之前都用PBS(p H 7.6)冲洗切片。使用含有3,3-二氨基联苯胺的特殊试剂盒(中杉金桥,ZLI-9018)对染色片子进行显色。苏木精复染,脱水胶作密封胶;然后对切进行观察、评分和成像。根据细胞染色强度评分为4级,无阳性着色(阴性)计0分,淡黄色(弱阳性)计1分,棕黄色(阳性)计2 分,棕褐色(强阳性)计3分;根据阳性细胞百分比评为4级,≤25%计1分,26%~50%计2分,51%~75%计3分,>75%计4分,将两项评分相乘得出最终评分结果,小于6分定为低表达组,大于等于6分定为高表达组。两名病理学医师独立评估免疫组化结果,评估不一致的免疫组化染色由两名医师协商得出最终染色结果。
四、细胞培养
人源肾透明细胞癌细胞系ACHN 和Caki-1细胞系购自ATCC 并经过STR 鉴定。ACHN 用1640培养基培养,Caki-1 用MCCOYS 5 A 培养基培养,培养液中均添加10%胎牛血清(Eall bio),1%l-谷氨酰胺(Gibco),1%非必需氨基酸溶液(Gibco)和1%青霉素-链霉素(Gibco,10378016,100 U/mL青 霉 素,100μg/mL 链 霉 素)。细 胞 培 养 在37°C,5%CO2的培养箱中。
五、细胞转染实验
为了抑制KDM6B 的表达,我们使用RNAi MAX (Invitrogen)将si RNA 用Lipofectamine 2000试剂(Invitr ogen)转染到细胞中。第1天将一定量的细胞接种于6-well细胞板(Cor ning),使其第二天密度达50%左右,将无血清培养基溶解的si RNA与无血清培养基溶解的RNAi MAX 等体积轻轻混匀后静置15 min,缓慢加入细胞中。第2天更换新鲜的培养基,转染48 h后,进行后续实验。小干扰RNA 序 列:si-KDM6B:GAGACCUCGUGUGGAUUAA;negative control(NC)5’-UUCUCCGA ACGUGUCACGU-3’。
六、RNA 提取与实时荧光定量聚合酶链式反应(real-ti me quantitative poly merase chain reaction,RT-q PCR)
使用TRIzol试剂(15596026,Life Technologies)从肾透明细胞癌细胞中提取总RNA,并使用High-Capacity c DNA reverse Transcription Kit(4368814,Applied Biosyste ms)将2μg RNA 反转录为c DNA。然后用SYBR Green/ROX q PCR Master Mix (K0251,Ther mo Scientific)作为模板进行指数扩增。beta-actin 作为内参。KDM6B 上游引物:TTGGGCAACTGTACGAGTCAG,下游引物:CCATAGTTCCGTTTGTGCTCAAG。actin上游引物:GATCATTGCTCCTCCTGAGC,下游引物:ACTCCTGCTTGCTGATCCAC。VEGFR1上游引物:GAAAACGCATAATCTGGGACAGT,下游引物:GCGTGGTGTGCTTATTTGGA。ALK 上游引物:TCTCATCGCAGCCGATATGG,下 游 引 物:GGCATCTCCTTAGAACGCTCT。FGFR2 上 游 引 物:AGCACCATACTGGACCAACAC 下 游 引 物:GGCAGCGAAACTTGACAGTG。RYK 上游引物:CCCAGGTCAACATTTCTGTTCA,下游引物:TGCCAGTACAGGAAAGCTCTAC。
七、Wester n blot实验
贴壁生长的细胞用冷的PBS洗3次,加入含蛋白酶抑制剂PMSF 的RIPA 裂解液在冰上裂解30 min。细胞裂解液离心后收集上清。使用BCA 试剂盒(PC0020,Solar bio)对蛋白浓度进行定量。等量(30μg)的总蛋白经十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离,转移到0.45μm PVDF 膜上。在室温下用5%牛血清白蛋白(BSA)在TBST 缓冲液中封闭膜2 h 后,在4℃与一抗孵育过夜。用TBST缓冲液洗涤膜3 次,然后在室温下与过氧化物酶(HRP)偶联二抗孵育1 h。使用超强化学发光ECL试剂盒检测特异性抗体结合。荧光信号由荧光图像分析仪检测。
八、细胞存活率和克隆形成试验
使用CCK-8试剂盒来测量KDM6B 敲低对肾透明细胞癌细胞增殖的影响。将细胞以1 000个细胞/孔的密度接种于96孔细胞板,并在200μl的培养基中生长过夜。第2 天开始,分别在之后的0、24、48、72、96 h,每孔加20μl CCK-8试剂,37℃孵育3 h。最后,用酶标仪在450/650 n m 处测量吸光度(optical density,OD)。对于克隆形成实验,在6-well细胞板中每个孔种600个细胞。其间每4 d更换一次培养基,2周后,用磷酸盐缓冲盐水 (PBS)洗涤3次,4%多聚甲醛固定20 min,0.5%结晶紫染色15 min,然后计数。
九、Transwell细胞迁移侵袭实验
在24孔室板中,使用8μm 孔的transwell小室进行细胞迁移和侵袭检测。trans well室预涂(侵袭试验)或不涂(迁移试验)Matrigel胶(BD Biosciences)。底室充入含10%胎牛血清的培养基500 μl,上室充入不含10%胎牛血清的2×104细胞培养液200μl,并于培养箱中继续培养24 h(迁移实验)或48 h(侵袭试验)。然后,细胞表面膜的底部固定在4%聚甲醛30 min和沾0.1%结晶紫20 min。每组随机选取5个显微镜进行细胞数统计。
十、统计学方法
使用SPSS 23.0 统计学软件对数据进行统计分析,使用Graphpad pis m 9.5 绘图,使用Kaplan-Meier分析对患者的生存期进行分析,对所有计量资料进行t检验,对所有计数资料进行χ2检验,P<0.05表示差异有统计学意义。
结 果
一、免疫组化检测KDM6B 在肾透明细胞癌中的表达
我们首先运用免疫组化染色在肾透明细胞癌中对KDM6B进行表达的检测,在42例肾透明细胞癌患者的组织中,有26例呈KDM6B 高表达(评分≥6),16例呈KDM6B低表达(评分<6)(图1 A、B),42例患者的临床病理特征见表1,我们对KDM6B的表达和临床病理特征进行分析,发现KDM6B 的高表达患者其肿瘤直径更小(图1C,表1),T 分期(图1D,表1)、N 分期(图1E,表1)、M 分期更低(图1F,表1),且KDM6B 高表达患者有更长的总生存期(图1B)。上述结果表明,KDM6B 低表达与患者预后不良显著相关,其可能是肾透明细胞癌的一个重要的生物标志物。
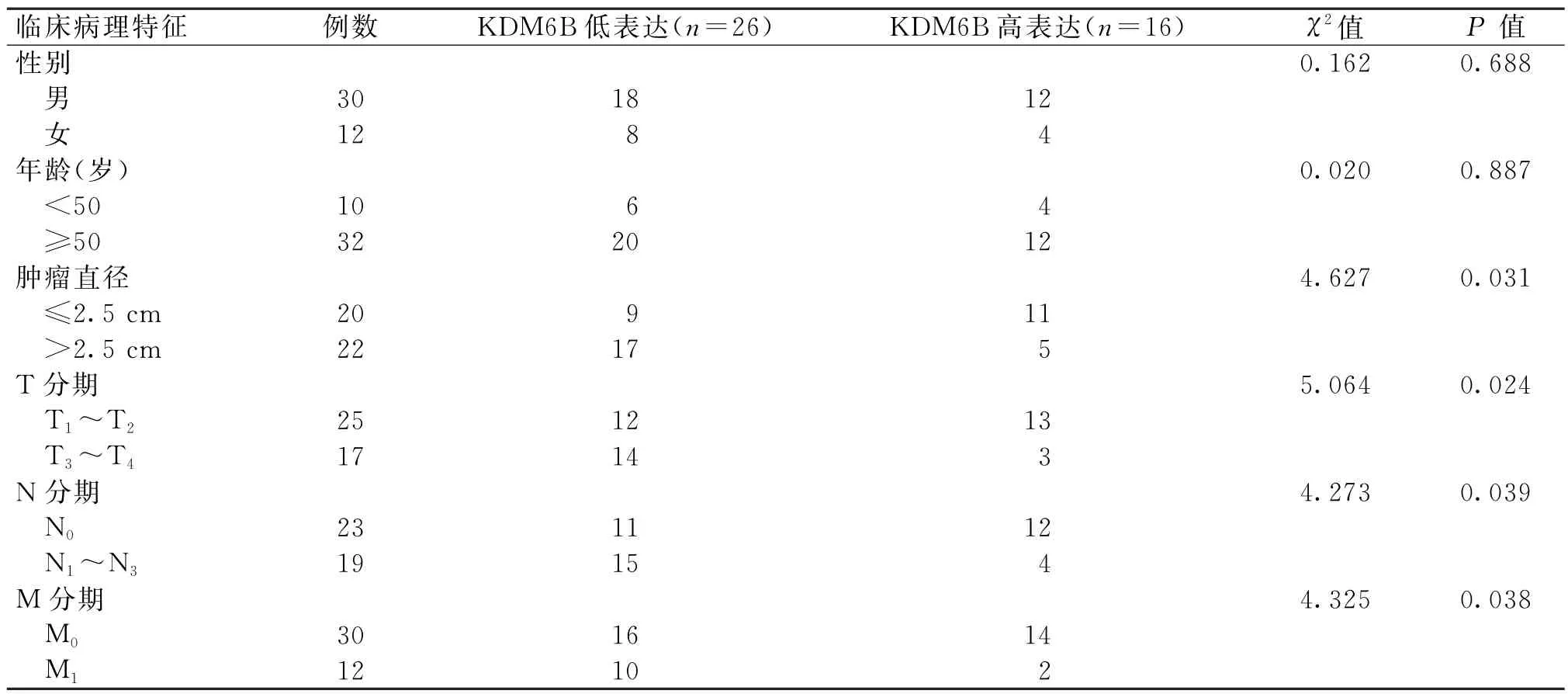
表1 不同临床病理特征患者KDM6B表达水平比较
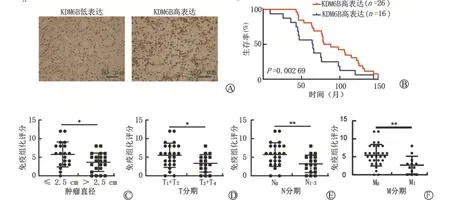
图1 KDM6B与肾透明细胞癌临床病理特征关系
二、GEPIA 网站分析KDM6B表达与肾透明细胞癌分期与预后的关系
我们利用GEPIA 网络工具分析了TCGA 数据库中的不同KDM6B表达水平的肾透明细胞癌患者的临床分期和预后是否具有显著差异。如图2 A 所示,Ⅰ、Ⅱ期患者的KDM6B 表达水平显著高于Ⅲ、Ⅳ期的患者;如图2B及2C所示,KDM6B高表达的患者,总生存期和无病生存期均显著高于低表达患者。这些结果说明KDM6B可能与肾透明细胞癌发生发展相关。
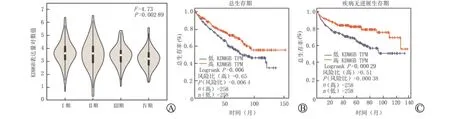
图2 GEPIA 网站分析KDM6B表达与肾透明细胞癌分期与预后的关系
三、小干扰RNA 转染敲低KDM6B 的效率检测
本研究分别从mRNA 表达水平与蛋白表达水平对小干扰RNA 转染ACHN 和Caki-1细胞的转染效率进行验证。RT-q PCR 验证ACHN 和Caki-1细胞系中转染小干扰RNA 后KDM6B 的mRNA表达水平,结果显示在ACHN 和Caki-1细胞系中,与阴性对照组相比,转染小干扰RNA 实验组的KDM6B表达水平显著降低(图3 A)。我们还通过Wester n blot实验验证KDM6B蛋白水平的敲低效率,与mRNA 水平结果一致,转染小干扰RNA 实验组的KDM6B蛋白表达水平明显比对照组低(P<0.05)(图3B),这些结果表明小干扰RNA 转染ACHN 和Caki-1细胞后有效地敲低了KDM6B 的表达。
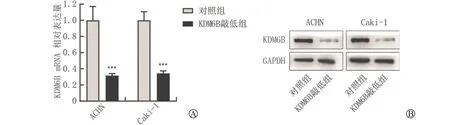
图3 小干扰RNA 可有效敲低肾癌细胞中KDM6B的表达
四、KDM6B基因敲低对ACHN 和Caki-1细胞增殖的影响
我们使用CCK8法检测敲低KDM6B后不同时间点肿瘤细胞的活性验证KDM6B对细胞增殖能力的影响,如图4 A、B 所示,与对照组相比,敲低KDM6B实验组中ACHN 和Caki-1细胞的增殖能力显著增高(P<0.05)。如图4C-D 所示,在ACHN 和Caki-1细胞系中敲低KDM6B后,与阴性对照组相比,敲低组中细胞克隆形成率明显增多(P<0.05)。表明敲低KDM6B 后ACHN 和Caki-1细胞的克隆形成显著增加。以上表明在肾透明细胞癌细胞中敲低KDM6B可以有效促进肿瘤细胞的增殖活性。

图4 敲低KDM6B可以影响肾透明细胞癌细胞增殖活性
五、KDM6B基因敲低对ACHN 和Caki-1细胞迁移侵袭的影响
我们使用Transwell实验检测敲低KDM6B后对细胞增殖能力的影响,如图5 所示,与对照组相比,敲低KDM6B 实验组中ACHN 和Caki-1 细胞的迁移和侵袭能力显著增高(P<0.05)。表明KDM6B可以影响肾透明细胞癌细胞的上皮间质转化进程,抑制肿瘤的转移。

图5 Trans well实验检测敲低KDM6B基因对肾透明细胞癌细胞迁移侵袭能力的影响
六、KDM6B基因敲低可激活ACHN 和Caki-1细胞的丝裂原活化蛋白激酶(mitogen-activated pr otein kinase,MAPK)信号通路
MAPK 通路是肿瘤的重要促癌信号通路,其中以细胞外信号调节激酶蛋白(extracellular signalregulated kinase,ERK)为特征蛋白的级联反应主要代表对生长因子和有丝分裂原的反应,从而有利于细胞的生长、分化和存活[14]。本研究中为了进一步探究KDM6B作用于肾透明细胞癌的机制,我们通过Western Blot检测了MAPK 信号通路激活指标磷酸化ERK 的表达水平,结果显示,在ACHN和Caki-1细胞系中,与对照组相比,敲低KDM6B后ERK 的活化形式磷酸化的细胞外信号调节激酶蛋白(phosphorylated extracellular signal-regulated kinase,p-ERK)的表达水平明显增加,但总ERK表达的水平没有明显变化(图6 A)。p-ERK 的表达水平极大的受其上游众多络氨酸激酶(Receptor tyr osine kinases,RTKs)表达的影响,因此我们检测了ACHN 和Caki-1细胞系中KDM6B敲低后几个常见的RTKs的表达变化,发现它们的表达水平在KDM6B 敲低后均有不同程度的上调,说明KDM6B 可能是通过下调RTKs 的表达抑制MAPK 信号通路,进而促进癌细胞增殖(图6B、C)。
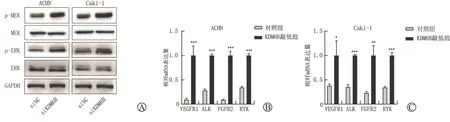
图6 敲低KDM6B激活肾透明细胞癌细胞MAPK 信号通路活性
讨 论
KDM6B是一种重要的组蛋白去甲基化酶,在炎症、发育、衰老和癌症等多种病理生理过程中发挥关键作用[8]。有研究指出在非小细胞肺癌患者中,血清KDM6B mRNA 水平降低,并且随着临床分期和淋巴结转移的增加,血清KDM6B mRNA 水平降低的趋势更加明显[13]。然而,KDM6B 也可以通过多种机制发挥癌基因的作用,包括促进增殖、炎症和细胞迁移,以及抑制细胞的分化和凋亡等。本研究结果表明,降低KDM6B 的表达会显著增强cc RCC细胞的增殖和迁移能力;生物信息学分析和免疫组化实验证实,在进展期cc RCC 中,KDM6B 的表达明显下降,提示患者预后不良。综合本研究的实验结果,KDM6B是影响cc RCC 患者临床病理分期和长期预后的关键因素之一。检测KDM6B表达水平可能成为预测患者预后的潜在生物标志物。
MAPK 通路通过一系列关键激酶传递细胞内外信号[14]。MAPK 通路活化过程存在两类经典的级联反应:以激活ERK 为特征的级联反应,主要受到生长因子和有丝分裂原的调控,从而有利于细胞的生长、分化和存活。相反,以应激活化蛋白激酶参与为主要特征的级联反应,主要受到细胞应激和炎症刺激的激活,因此激活后有利于细胞出现分化、凋亡和炎症反应[15]。因此,本研究探究了KDM6B 对MAPK 通路活性的影响,并发现敲低KDM6B表达水平可显著激活MAPK 通路活性。作为MAPK通路上游分子,RTKs 的表达水平直接影响到MAPK 通路的激活程度。为了深入研究KDM6B敲低激活MAPK 通路的具体机制,我们检测了KDM6B敲低后RTKs的表达变化,结果显示,在KDM6B敲低后,多种RTKs的mRNA 水平显著升高。这表明KDM6B可能通过抑制RTKs表达来抑制MAPK 活性,从而验证了其在cc RCC 中作为抑癌基因的作用机制。
综上所述,本研究确认了KDM6B 在肾透明细胞癌中作为一种重要的表观遗传修饰物,并与患者的疾病分期和预后密切相关。降低KDM6B表达后增强肿瘤细胞的增值和迁移侵袭能力,并激活了MAPK 信号通路。因此,本研究为肾透明细胞癌的预后提供了一个重要的新的生物标志物和潜在治疗的新靶点。

