基于甲基化驱动基因构建膀胱尿路上皮癌分子亚型和预后分子模型
张挺 管波 王浩宇 单卫民 王德彪
膀胱尿路上皮癌(bladder urothelial carcinoma,BLCA)在泌尿系统肿瘤中的发病率较高,约占全球肿瘤发病率的3%,在发达国家尤为普遍[1]。相当一部分BLCA患者有接触致癌物质病史,其中危害最大的是烟草,吸烟后患膀胱癌的相对风险仅次于肺癌[2]。已有研究证明戒烟可显著降低罹患膀胱癌的风险[1]。约有7%的BLCA患者因BLCA遗传易感性而患病[3]。
DNA甲基化作为一种特殊的表观遗传事件在疾病的发生、发展中具有重要作用。表观遗传学是一种在不改变基因序列的情况下,在细胞增殖和发育过程中发生的稳定变化,与基因表达潜能相关。DNA 甲基化是在DNA碱基的C5位置上插入1个CH3基团导致转录抑制,进一步阻止抑癌基因的表达等,可能是通过影响细胞分化过程的可塑性而导致肿瘤的发生[4]。
本研究利用癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库检索并筛选了BLCA转录组和表观基因组数据,同时进行整合分析,鉴定出一系列与BLCA预后相关的DNA甲基化驱动基因,并基于此构建了BLCA分子亚型和预后分子模型,为BLCA 患者的预后风险分层、预后评估及治疗策略的选择提供了新的参考指标,具有一定的潜在应用价值。
对象与方法
一、研究对象
从TCGA 数据库(https://www.cancer.gov)中检索并下载了411例BLCA 患者的病理数据资料,其中包括417例BLCA 组织和21 例正常膀胱组织的甲基化数据、414例BLCA 组织和19例正常膀胱组织的转录组数据(部分患者有多个组织样本数据),同时下载了这411例BLCA 患者的临床数据资料,包括性别、年龄、种族、病理分期、吸烟状态、放疗、化疗情况及存活状态等。
二、研究方法
1.BLCA 甲基化驱动基因的筛选:使用R 语言Methyl Mix包筛选甲基化驱动基因,使用R 语言Met hyl Mix包综合分析两组患者的基因表达数据和DNA 甲基化数据,按照基因表达数据和DNA 甲基化数据相关性小于-0.3、以矫正后P值小于0.05为标准,筛选BLCA 甲基化驱动基因。
2.基于BLCA 甲基化驱动甲基化程度构建分子亚型:利用R 语言中NMF包对BLCA 甲基化驱动基因表达进行无监督聚类分析,构建基于甲基化驱动基因的BLCA 分子亚型,并对不同亚组的预后进行比较,探索不同亚型之间肿瘤微环境的差异。使用“ESTI MATE”算法[5]分析每个样本的肿瘤微环境情况,包括免疫细胞浸润水平(免疫评分)、基质含量(基质评分)、总评分(免疫评分与基质评分之和)及肿瘤纯净度,比较各免疫亚组之间肿瘤微环境情况。使用CIBERSORT 软件[6]计算免疫细胞含量,为了结果准确,设定模拟次数为1 000次,采用Kr uskal-Wallis秩和检验对P<0.05作为样本成功反卷积的判断依据,分析各免疫亚组中免疫细胞亚群的含量。
3.基于BLCA 甲基化驱动基因构建预后模型:采用LASSO 回归模型进行BLCA 预后相关DNA甲基化驱动基因标志物的筛选,并通过多因素Cox的系数构建分子模型:分子标签值Risk score=βgene1×DMLgene1+βgene2×DMLgene2+……+βgene 4×DMLgene4[DNA 甲基化水平(DNA met hylation level,DML);β:回归相关系数]。代入相关数据后,计算分子模型得分。分别通过分子模型得分的中位数将BLCA 患者划分为高甲基化组和低甲基化组。
结 果
一、纳入对象的基本情况
病例总数为411例,其中男303例(73.72%),女108例(26.28%),患者基本特征见表1。
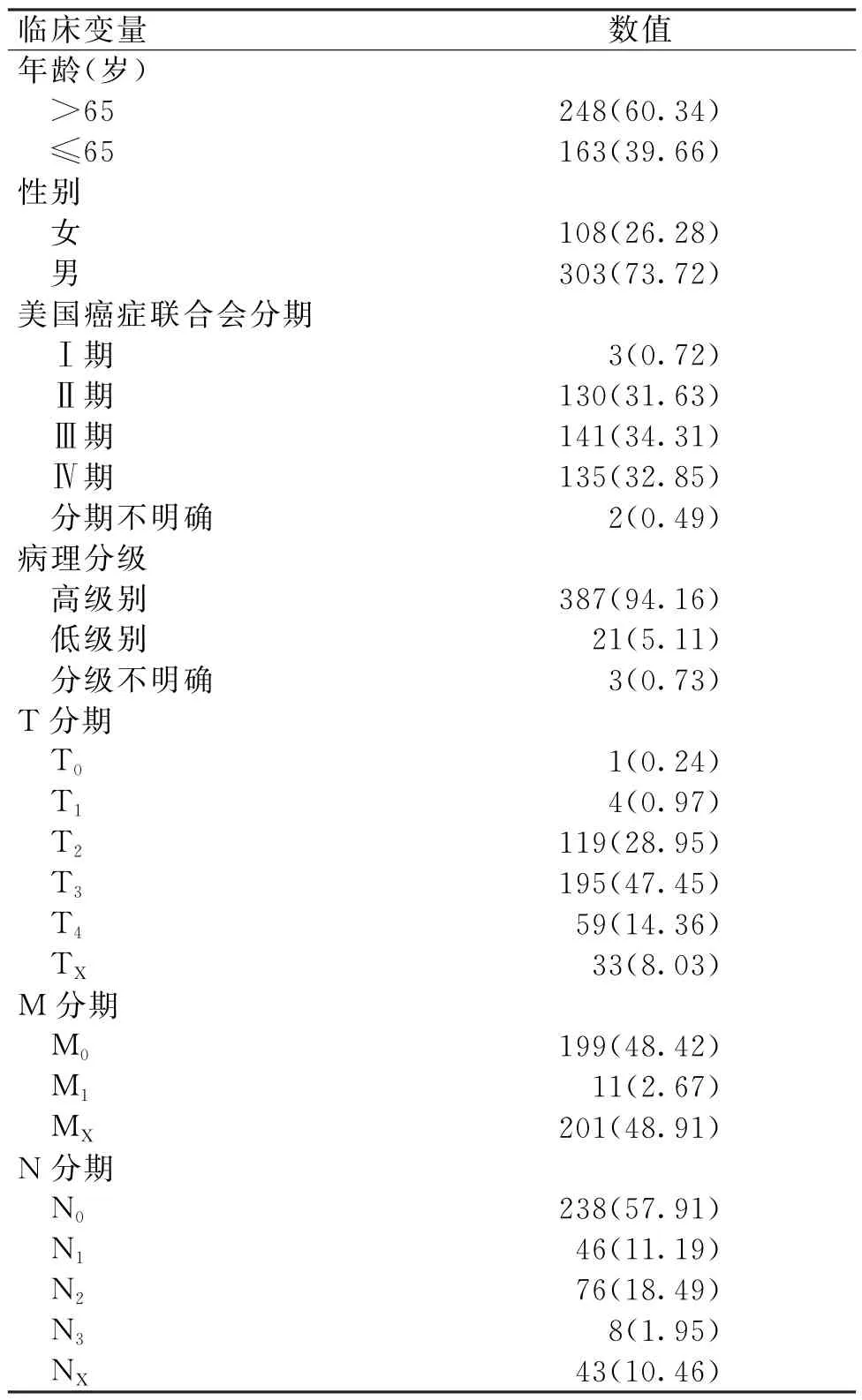
表1 TCGA 数据库中BLCA 患者的基本特征[例(%)]
二、BLCA 甲基化驱动基因筛选结果
根据BLCA 表达谱数据和甲基化数据,按照相关性小于-0.3,矫正后P值小于0.05的标准,筛选后得到190种BLCA 甲基化驱动基因,以此绘制甲基化驱动基因甲基化程度热图(图1)。

图1 190种BLCA 甲基化驱动基因甲基化程度热图
三、BLCA 分子亚型的构建
将190种甲基化驱动基因的甲基化数据与生存数据结合,进行单因素Cox 分析后得到26 种与BLCA 预后相关的基因(P<0.05)。将这26种甲基化 驱 动 基 因(ARHGDIB、LURAP1、WBP1L、GST M2、EHF、PAXIP1-AS1、CCRL2、ELF3、LINC00885、FZD7、POF1B、TPM1、 ARL14、SOWA HC、KL HDC7 A、ITGA5、AGR2、TCEAL7、CYP2J2、 DAPP1、 KRT8、 AXIN2、 IDH2、T MEM101、BH MT2、CLDN4)的甲基化数据通过NMF聚类分析,可将患者分为2~9个亚组(图2)。
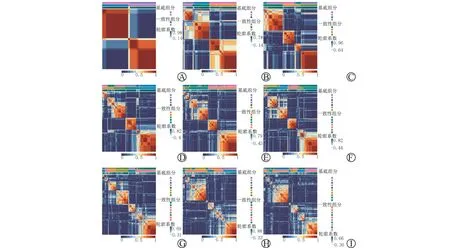
图2 基于BLCA 甲基化驱动基因的NNF聚类分析
根据NMF 聚类分组分析结果,聚类分析组内一致性高(红色模块颜色纯度高)、组间差异大(蓝色模块颜色纯度高)、且亚组之间的样本量差异不大,可以将411例BLCA 患者分为2个亚组。结合411例BLCA患者的生存数据我们进一步比较分为2个亚组、3个亚组、4个亚组下不同亚组之间的生存曲线的差别,发现分为2个亚组与3个亚组的预后均差异有统计学意义(P=0.004,P=0.017)(图3)。
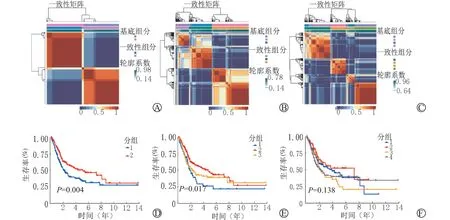
图3 不同亚组之间预后比较
为了进一步探索亚组之间的肿瘤微环境的差异,本研究以分为2个亚组的BLCA 患者作为研究对象,进一步比较了2个亚组间肿瘤微环境的差异(图4A~D),两个亚组间基质细胞评分、免疫细胞评分、综合评分之间均差异有统计学意义(P<0.001)(图4D);并比较了两个亚组中人类白细胞抗原相关基因表达和免疫细胞浸润的差异(图4E~F)。
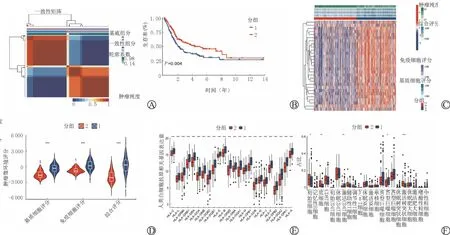
图4 基于甲基化驱动基因BLCA 患者分为2种亚组肿瘤微环境分析
四、构建BLCA 甲基化驱动基因预后分子模型
将单因素回归分析筛选出的26种与BLCA 预后相关的基因进一步做LASSO 及多因素Cox 分析,最终从中筛选出4种与BLCA 预后相关的甲基化驱动基因(表2,图5,6 A~D),分别为ARHGDIB、IDH2、LURAP1、PAXIP1-AS1,利用这4种甲基化驱动基因联合回归系数构建预后分子模型,Risk score=βgene1×DMLgene1+βgene2×DMLgene2+……+βgene4×DMLgene4。代入相关数据后,计算分子模型值。通过分子模型得分的中位数将患者划分为高分组和低分组,结合TCGA 中患者生存时间及生存状态在训练组和测试组分别绘制生存曲线,并比较高分组和低分组生存曲线差异有无统计学意义(图6E),并以1年、3年、5年生存期绘制受试者工作特征(receiver operating characteristic,ROC)曲线(图6F)。
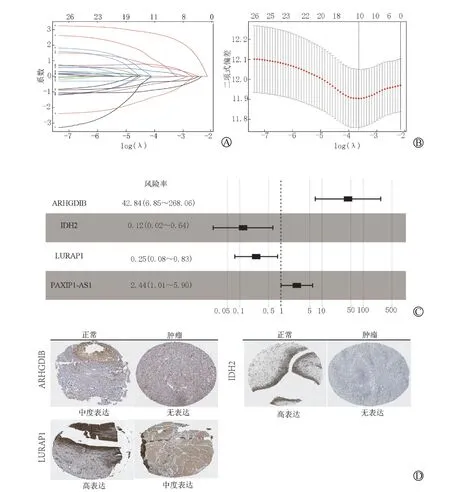
图5 LASSO 回归筛选BLCA 预后甲基驱动基因
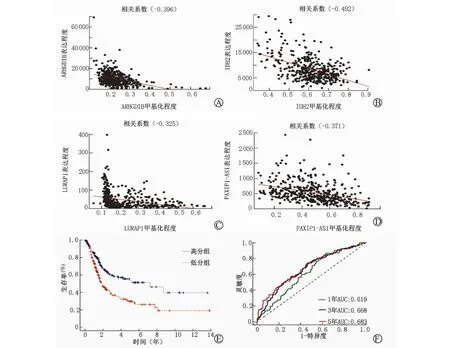
图6 分子模型中4种基因甲基化程度与表达程度相关性和分子模型生存曲线、ROC曲线
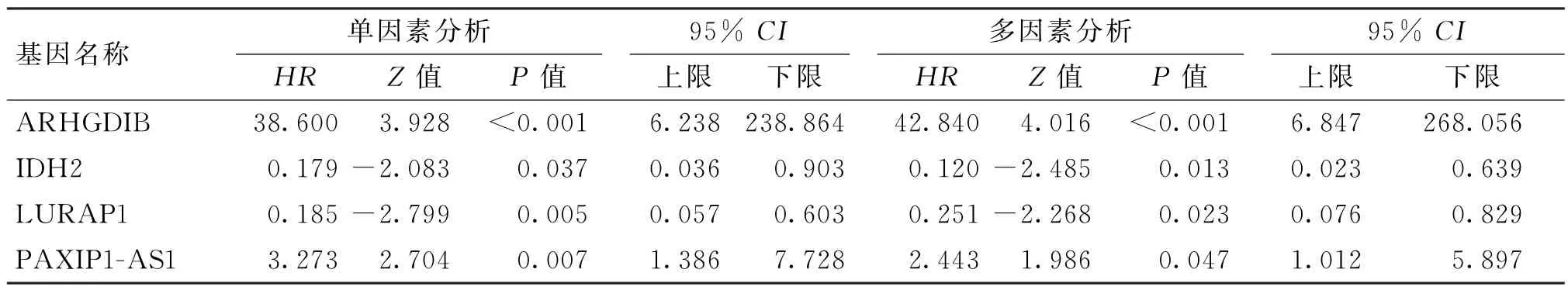
表2 筛选出的4种BLCA 预后相关甲基化驱动基因单变量及多变量Cox分析结果
讨 论
BLCA 是全球十大最常见的癌症之一,其发病率逐步上升,尤其在发达国家[7]。男性患者的发病率是女性的4倍多,这种性别差异可能主要与吸烟偏好有关[8]。DNA 甲基化是一种重要的表观遗传调控机制,它指的是在甲基转移酶催化下,活性甲基转移到目标DNA 而不改变DNA 序列组成[9],甲基化过程以s-腺苷甲硫氨酸为甲基供体,在DNA 中加入甲基(CH3)的表观遗传过程,这个过程可以发生在腺嘌呤的N6、鸟嘌呤的N7、胞嘧啶的N4和C5位置[10]。当基因组DNA 的甲基化状态发生改变时,会导致机体染色体不稳定或基因表达异常,在肿瘤的发生中起到重要作用。癌症中许多基因在癌症中的表达沉默与DNA 甲基化有关,肿瘤基因组中存在许多异常的甲基化改变,越来越多的证据表明DNA 甲基化在肿瘤中起到重要作用,例如乳腺癌中的BRCA1和FOXO3a[11],宫颈癌中的SET9[12],肾癌中的VHL[13]。DNA 甲基化在BLCA 的发生、发展过程中起着重要作用,有研究报道DNA 甲基化可以作为肌层浸润型BLCA 的预后生物标志物[14],DNA甲基化测试可以帮助尿路上皮癌患者的术后管理[15],某些基因的甲基化水平与BLCA 患者的临床病理特征密切相关[16]。此外,还有研究发现DNA 甲基化抑制剂阿扎胞苷通过诱导凋亡和抑制肿瘤细胞增殖,在BLCA的治疗中起到一定作用[17]。
本研究基于BLCA 组织的转录组和表观基因组数据,采用整合组学的分析策略,发现了与BLCA相关的190种甲基化驱动基因,结合患者的生存数据分析发现有26种基因甲基化程度与BLCA 预后相关。基于这26种甲基化驱动基因的甲基化程度构建了BLCA 分子亚型,并将BLCA 患者分为两个不同的分子亚型,两个亚型的患者具有不同的预后。进一步探索不同亚组之间的肿瘤微环境,发现这两个亚组肿瘤微环境方面有明显差异。肿瘤微环境是肿瘤细胞所处的细胞环境,包括细胞外基质、可溶性分子和肿瘤基质细胞。一旦形成肿瘤微环境,免疫细胞如T 细胞、髓源抑制性细胞和巨噬细胞会被募集并构成肿瘤微环境。在肿瘤微环境中,免疫细胞和基质细胞是除肿瘤细胞以外的两种主要类型的细胞,并且已被提出对于肿瘤的诊断和预后评估是有价值的[18]。本研究进一步基于26种基因甲基化程度建立了一个BLCA 预后预测模型,为BLCA 患者的生存预后评估提供了候选参考标准,将有助于指导临床治疗策略的选择。模型中包括4种甲基化驱动基 因,分 别 为ARHGDIB、IDH2、LURAP1 和PAXIP1-AS1。ARHGDIB 是一种蛋白质编码基因,参与多种细胞事件,包括细胞信号、增殖和细胞骨架组织等,在最近的一项研究中发现FOXA1-KDM6A-ARHGDIB轴在抑制BLCA 等恶性肿瘤中起关键作用[19];IDH2是一种蛋白质编码基因,参与呼吸电子传递、化学渗透耦合合成ATP、解偶联蛋白产热和新陈代谢等途径,尚未在BLCA 中报道,但有研究发现IDH2整合的胞质ME1对于肿瘤的生长和转移至关重要[20];LURAP1是一个蛋白质编码基因,参与I-kappaB kinase/NF-kappaB信号通路的阳性调节及细胞因子的阳性表达,研究表明LURAP1在细胞黏附和极化细胞行为中发挥着重要作用[21];PAXIP1-AS1 是一种lnc RNA,研究表明lnc RNA PAXIP1-AS1通过靶向mi R-6744-5p/PCBP2轴促进卵巢癌细胞的增殖、迁移、EMT和凋亡[22]。
综上所述,本研究通过分析TCGA 数据库,发现与BLCA 相关的190种甲基化驱动基因,并构建了新的BLCA 预后分子模型和新的分子亚型,预后分子模型能够很好的预测BLCA 患者预后,不同的亚组具有不同的预后。这些结果均表明,BLCA 的甲基化驱动基因在BLCA 的预后中发挥了重要的作用。

