米非司酮混悬液灌胃制备小鼠不完全型胚胎着床障碍模型的适宜剂量选择
葛挺,张曼丽,张于念,2,3,腊晓琳,2,3
1 新疆医科大学第一附属医院生殖医学中心,乌鲁木齐 830054;2 新疆生殖免疫临床医学研究中心;3 省部共建中亚高发病成因与防治国家重点实验室
反复种植失败(RIF)指40 岁以下女性在最少3个新鲜周期或冷冻周期内移植至少4 个优质胚胎后未能实现临床妊娠[1]。反复自然流产(RSA)指连续两次怀孕在同一妊娠周发生自然流产的现象,属于妇产科常见并发症。一次成功妊娠离不开优质胚胎和子宫内膜容受性,人类辅助生殖技术很大程度上排除了胚胎植入时胚胎质量对于妊娠结局的影响,因此探索胚胎植入时子宫内膜容受性有重要意义。小鼠因胚胎植入过程与人类相似,且因生殖周期短便于观察,成为生殖医学研究的首选动物模型。不完全型胚胎着床障碍(EID)模型鼠的子宫内膜蜕膜化异常与胚胎发育不同步,导致“种植窗”开放延后,从而出现胚胎着床数减少及发育不良,这与人类RIF 或RSA 的疾病特征更为相似[2]。米非司酮是一种具有抗糖皮质激素特性的孕激素受体拮抗剂,可以通过竞争性的与孕激素受体(PR)结合,阻断孕激素对妊娠的支持[3],导致子宫内膜蜕膜化异常,无法从增生期转变为分泌期,从而在子宫内膜水平上影响胚胎植入,但以往采用米非司酮制备的模型不稳定[4-6],寻找最佳制模剂量尤为重要。既往研究[7]发现当皮下注射0.06 mg时,小鼠着床率没有影响;当皮下注射剂量为0.08 mg时,可引起小鼠完全型胚胎着床障碍,由于根据不同药物给药方式的药物吸收率不同,灌胃药物是皮下注射的2 倍左右,并且灌胃给药较皮下给药,生物利用率较低,更容易制备不完全型EID 模型。故本研究分别采用0.12、0.14、0.16 mL/只的米非司酮(1 mg/mL)灌胃妊娠期雌性小鼠制备不完全型EID 模型,并比较各剂量制备后雌性小鼠的妊娠率、胚胎着床点数、血清雌激素及孕酮(P)的含量、子宫内膜的形态改变及PR,以筛选米非司酮的适宜剂量,旨在为建立稳定且有效的不完全型EID 动物模型提供参考依据。
1 材料与方法
1.1 实验动物 7 周龄SPF 级发育成熟、未孕且未产雌性昆明小鼠32 只,体质量30~35 g,购于新疆医科大学实验动物中心[SCXK(新) 2018-0002]。7周龄SPF 级发育成熟且未交配雄鼠16 只,体质量35~40 g,购于新疆医科大学实验动物中心[SCXK(新)2018-0002]。动物饲养于新疆医科大学实验动物中心[SYXK(新) 2018-0003],屏障环境,12 h光照,12 h 黑暗,室温20~24 ℃,相对湿度40%~60%,自由饮食,食用标准小鼠维持饲料。本研究获得新疆医科大学实验动物伦理委员会审核批准(IACUC-20211224-47)。
1.2 主要试剂与仪器 米非司酮片(25 mg,H20033551,武汉九珑人福药业有限责任公司);生理盐水(50 mL,H20044304,四川科伦药业股份有限公司);ELLSA 试剂盒(Progesterone EIA Kit,Cat.#JL20678,江莱生物);ELLSA 试剂盒(Estrogen EIA Kit,Cat.#JL11232,江莱生物);苏木素伊红染色试剂盒(G1120,索莱宝);孕激素受体抗体(25871-1-AP,proteintech),二抗(SA00001-2,proteintech);光学显微镜(日本尼康公司)。
1.3 米非司酮混悬液配制 25 mg 米非司酮片于研钵中研磨成粉状,倒入合适的容器中,加入25 mL生理盐水,超声溶解,配制成1 mg/mL的米非司酮混悬液,无耗损,现配现用。
1.4 雌性妊娠小鼠筛选及分组 先将雌、雄小鼠分笼适应性饲养。5天后每日下午5∶30通过目测法观察雌性小鼠阴道,目测法无法辨别情期时,可采用阴道涂片法。将动情期雌性小鼠于当日下午6∶00 与雄鼠以2∶1的比例合笼。次日早上9∶00检查雌性小鼠阴道后分笼喂养,若发现雌性小鼠阴栓则计为妊娠第1 天(PD1)。将32 只PD1 雌性小鼠随机分为4组,每组8只。
1.5 米非司酮混悬灌胃制备雌性妊娠小鼠不完全型EID 模型方法 于雌性小鼠妊娠第4 天(PD4)早上9∶00进行造模。对照组给予适量生理盐水,低剂量组灌胃给予0.12 mL 米非司酮混悬液制备不完全型EID 模型,中剂量组灌胃给予0.14 mL 米非司酮混悬液制备不完全型EID 模型,高剂量组灌胃给予0.16 mL米非司酮混悬液制备不完全型EID模型。
1.6 观察指标及观察方法 于妊娠第8天(PD8)早上9∶00经眼球取血,离心处理,收集血清,-80 ℃冻存,用于血清雌二醇(E2)和P 的检测。迅速剖腹,观察子宫形态及血流供应状况,并计录雌性小鼠妊娠数量及两侧子宫胚胎着床数,将胚胎去除后的子宫浸泡于4%多聚甲醛溶液中,用于后续HE染色及免疫组化。血清E2和P:从-80 ℃中取出血清样本,37 ℃水浴锅中解冻,按照酶联免疫吸附测定法,取出E2、P的ELLSA 试剂盒,经过包被、洗涤、孵育等过程,于450 nm 处测OD 值,绘制标准曲线,计算E2、P含量。雌性小鼠平均着床胚胎数、妊娠率:检查子宫,记录每只雌性小鼠胚胎着床情况,以及怀孕雌性小鼠数量。并通过以下公式计算妊娠率及平均着床胚胎数。妊娠率=孕鼠数/受试动物数×100%。平均着床胚胎数=总着床胚胎数/孕鼠数。子宫内膜组织病理学:采用HE 染色法。将浸泡在多聚甲醛溶液中的雌性小鼠子宫组织切分成大小为0.5 cm×0.5 cm 的组织块,进行石蜡包埋并进行切片,厚度为2 μm,石蜡切片进行苏木素、伊红染色,二甲苯透明,中性树脂封片。光镜下观察各组雌性小鼠子宫内膜的超微结构变化。子宫内膜组织PR:采用免疫组化法。取子宫内膜白片在60 ℃烤箱内烤4~6 h,37 ℃孵箱过夜,二甲苯脱蜡2 次,每次10 min,酒精梯度复水,每次3 min,去离子水震荡洗涤2 次,每次5 min,抗原修复,室温冷却,3%H2O2室温避光浸泡10 min,PBS 洗涤3 次,每次5 min;滴加封闭血清,室温孵育15 min,滴加一抗,4 ℃过夜;复温15 min,PBS 洗涤3 次,每次5 min;滴加二抗,常温孵育30 min,PBS 洗涤3 次,每次5 min,滴加二抗,常温孵育20 min,PBS 洗涤3 次,每次5 min,DAB 显色,苏木素复染,酒精梯度脱水,二甲苯透明2 次,每次10 min,中性树胶封片,光学显微镜下观察并拍照。利用Image J 分析软件进行分析,计算阳性表达区域的累积光密度值及对应的表达区域面积,以平均光密度值(AOD)作为阳性表达的定量标准,反映PR 表达情况。AOD=累积光密度/阳性区域面积。
1.7 统计学方法 采用SPSS27.0 统计软件。符合正态分布的计量资料以表示,多组间比较采用单因素方差分析,组间两两比较采用Tukey' HSD法;不符合正态分布用中位数(最大值,最小值)表示,组间比较采用Krus Kal-WallisH检验,多重比较采用Bonferroni 法调整α 水准。P<0.05 为差异有统计学意义。
2 结果
2.1 各组血清E2、P水平比较 各组血清E2、P水平比较,P均>0.05(详见表1)。
表1 各组血清E2、P水平()

表1 各组血清E2、P水平()
组别低剂量组中剂量组高剂量组对照组n8 8 8 8 E2(pg/mL)31.37 ± 3.06 32.08 ± 2.13 31.28 ± 3.01 32.64 ± 2.32 P(ng/mL)21.24 ± 0.36 20.56 ± 0.72 22.13 ± 0.27 21.48 ± 0.28
2.2 各组子宫肉眼观比较 对照组8 只雌性小鼠全部妊娠,且双侧子宫均匀增大,子宫血供丰富,胚胎着床点分布紧密且无出血点,胚胎发育良好。低剂量组8 只雌性小鼠也全部妊娠,双侧子宫外观形态与对照组无异常,但子宫血供较对照组差,胚胎发育无异常。中剂量组8 只雌性小鼠也均妊娠,但是雌性小鼠两侧子宫胚胎着床点较对照组和低剂量组分布不规则,部分胚胎着床处有积血;胚胎体积也较对照组和低剂量组小,未着床处的子宫较细,颜色苍白,血供不佳。高剂量组雌性小鼠中仅有1只妊娠,双侧子宫形态规则,颜色苍白,血供较差,双侧子宫弹性差。
2.3 各组妊娠率及胚胎着床数比较 低剂量组、中剂量组、高剂量组、对照组妊娠率分别为100.0%、100.0%、12.5%、100.0%,高剂量组分别与其他3 组比较,P均>0.05;低剂量组、中剂量组、高剂量组、对照组胚胎着床数分别为16.00(13,18)、12.50(8,15)、0(0,1)、16.50(14,17)个,中剂量组、高剂量组分别与低剂量组、对照组比较,高剂量组与中剂量组比较,P均<0.05。
2.4 各组子宫内膜组织病理学比较 对照组:子宫内膜间质广泛蜕膜化反应,腺体数量多,腺腔面积大,腺腔内含有分泌物,小血管增生;低剂量组:子宫内膜间质蜕膜明显,腺体数量多;中剂量组:子宫内膜有蜕膜化改变,间质较致密,腺体较少而小,血管扩张不明显;高剂量组:子宫内膜间质区蜕膜化不完全,腺体小而少,分泌不足,内膜间质致密,仍呈增生期样改变,发育明显滞后(详见图1)。
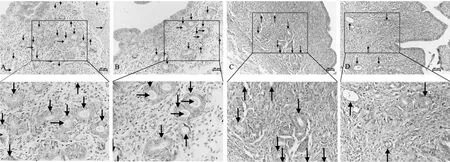
图1 各组小鼠子官内膜腺体、腺腔、血管(HE染色,×200)
2.5 各组子宫内膜PR 表达比较 对照组和低剂量组两组中上皮层PR 表达完整,形态规则。随着给药剂量的增加,中剂量和高剂量两组中上皮层PR 表达缺失,且高剂量组更明显。低剂量组、中剂量组、高剂量组、对照组PR AOD 分别为0.279 ± 0.019、0.213 ± 0.016、0.192 ± 0.017、0.301 ± 0.018,中剂量组、高剂量组分别与对照组比较,中剂量组、高剂量组分别与低剂量组比较,高剂量组与中剂量组比较,P均<0.05。
3 讨论
据统计,75%的妊娠损失与着床失败有关[8]。胚胎着床作为哺乳动物成功建立妊娠的关键前提,是一个囊胚和子宫内膜之间的复杂对话过程。根据子宫内膜对于囊胚着床的敏感性,可将子宫内膜分为接受前期、接受期以及非接受期[9]。囊胚与子宫内膜的质量以及这二者发育的同步性是成功妊娠的必要条件[10-11]。子宫内膜接受胚胎着床的时间有限,这一阶段被称为“着床窗口”,主要受P 和E2调节。于PD1,P 和E2调节子宫内膜细胞的增殖和分化,并建立着床窗口;排卵前,卵巢分泌的E2增多,诱导子宫内膜上皮细胞增殖,从PD3开始,新形成的黄体分泌的P 开始增加,并启动基质细胞分化。由于P 水平升高和卵巢分泌的E2小幅升高,在PD4 子宫由接受前期过渡为接受期[12]。在这一过程中,E2刺激基质细胞增殖,诱导子宫内膜细胞上的PR 表达,继而在P的作用下,子宫内膜转化为具有支持作用的接受态。此时,上皮细胞增殖停滞,母体在P的作用下维持妊娠[13]。目前,构建EID 模型[14]的方法有多种。吲哚美辛[15]通过抑制前列腺素的合成,阻止血管内皮生长因子的表达,从而抑制子宫内膜血管的生成,降低血管通透性,抑制子宫内膜蜕膜化。宫腔注入95%乙醇[16]通过损伤子宫内膜导致胚胎种植失败。利洛司酮[17]干扰子宫内膜孕激素和前列腺素的平衡,从而使子宫收缩较强,导致EID。上述造模方法类似于子宫内膜受损或薄型子宫内膜引起的EID,这与RIF 或RSA 因子宫内膜“种植窗”开放滞后而引起胚胎着床失败的疾病特点不相符。因此,需要构建不完全型EID 的动物模型对研究RIF或RSA的发病机制的研究具有深刻意义。
米非司酮是一种口服的活性孕激素受体拮抗剂,其与PR 结合的亲和力是P 的5 倍,竞争性与PR结合,阻止孕激素在子宫中发挥作用,从而抑制子宫上皮的分泌和基质细胞的蜕膜化,从而阻止胚胎着床[18]。米非司酮可溶于有机溶剂,不溶于水,临床上普遍采用口服的方式给药。既往的研究均通过皮下注射米非司酮,但其溶解性差,故采用皮下注射造模平均着床数波动较大,模型不稳定。皮下给药较灌胃给药的生物利用率高,更容易构建完全型EID 模型。因此,本研究通过灌胃的方式,寻找合适的剂量,建立稳定且有效的不完全型EID 模型。本实验中在雌性小鼠合笼见栓后,于PD3~PD4,发育正常的胚胎移行至两侧子宫腔,胚胎着床大约发生在PD4 傍晚[19]。因此于PD4 上午9∶00 给予米非司酮混悬液,可以排除由于胚胎自身发育问题以及输卵管功能障碍而导致的着床障碍。与此同时,由于子宫内膜对于米非司酮敏感性较高,可以阻止增生期的子宫内膜转变为分泌期,降低子宫内膜容受性,使胚胎与子宫内膜发育不同步,发生着床障碍。胚胎完成植入大概在PD6~PD7,故于PD8 进行采样[20]。本实验中,当灌胃剂量为0.12 mL/只(低剂量组)时,妊娠率和平均胚胎着床数均无影响;当灌胃剂量为0.14 mL/只(中剂量组)时,妊娠率无影响,但可显著减少平均胚胎着床数;当灌胃剂量为0.16 mL/只(高剂量组)时,妊娠率和平均胚胎着床数均降低。可见,当米非司酮剂量为0.16 mL/只时,可以抑制雌性小鼠胚胎着床。镜下观察,高剂量组子宫内膜较其他3 组相比,间质区蜕膜化不完全,腺体小而少,分泌不足,内膜间质致密,仍呈增生期样改变,发育明显滞后。同样,PR 表达明显低于其他三组,但血清中的E2和孕激素无明显变化。说明当米非司酮剂量为0.16 mL/只时,在子宫局部竞争性与PR结合,干扰孕激素的正常作用,导致子宫内膜发育迟缓,蜕膜化异常,着床窗口开放延迟。EID 动物模型目前没有统一的判断标准,研究[6-7,14,21]认为妊娠率和平均胚胎着床数显著减少是判断造模成功的标准;林益等[2]提出了根据子宫内膜“种植窗”是否完全关闭分为完全型着床障碍和不完全型着床障碍。因此根据本实验结果表明:雌性小鼠妊娠第4 天给予0.16 mL/只1 mg/mL 米非司酮构建更加符合不完全型EID 模型,为后期进一步研究RIF 和RSA 供了理想的动物模型。
总之,米非司酮制备小鼠不完全型EID 模型稳定可靠,适宜剂量为0.16 mL/只(1 mg/mL)。

