补骨脂素对人牙周膜干细胞增殖、成骨分化的促进作用及其机制
韩敏,张韶君,席迅
山东第一医科大学第一附属医院(山东省千佛山医院)口腔科,济南 250014
牙周炎是一种逐渐破坏牙周支持组织的慢性炎症性疾病,严重的牙周炎会导致牙槽骨吸收和牙齿松动脱落,并对患者的口腔功能和生活质量造成不良影响[1]。牙周炎与诸多全身性疾病有着非常密切的关系,例如不良妊娠、心血管疾病、2 型糖尿病等[2]。因此,治疗牙周炎对于改善患者的生活质量至关重要。目前,牙周炎治疗的热点方向是牙周组织再生,而间充质干细胞是牙周组织再生的重点研究内容[3]。人牙周膜干细胞(hPDLSCs)是具有多向分化潜能的间充质干细胞,具有强大的自我更新潜力,被认为是牙周炎再生治疗的一个非常有前途的干细胞群体[4]。有研究[5-7]证实,小檗碱通过MAPK/ERK 信号通路促进hPDLSCs 成骨分化,山奈酚通过Wnt/β-catenin 信号通路促进hPDLSCs 增殖和成骨分化,川续断通过血管内皮生长因子/PI3K/Akt 信号通路促进hPDLSCs 成骨分化。目前,关于补骨脂素对hPDLSCs 增殖和成骨分化影响的研究较少。补骨脂素属于呋喃香豆素类,自然存在于各种植物中[8]。现代药理研究表明,补骨脂素具有抗炎、抗癌、抗菌和雌激素活性等作用,具有广泛的生物医学应用前景[9-13]。有文献[14]报道,补骨脂素通过激活TGF-TGF/Smad3 通路,加速人骨髓间充质干细胞的成骨分化。过高浓度的补骨脂素并不利于细胞发挥正常生理功能[15]。目前,对补骨脂素作用的研究主要集中于成品细胞系和动物体内实验[16-18],对于其在hPDLSCs 成骨分化方面的研究报道较少。hPDLSCs 成骨分化过程需要诸多信号因子参与调节,其中骨特异性转录因子2(Runx2)是成骨向分化所必需的特异性转录调节因子。Runx2 能上调骨髓间充质干细胞、软骨细胞、成骨细胞的胞外基质合成,加速细胞增殖分化,促进合成代谢及成骨反应,对于观察hPDLSCs 成骨分化具有重要意义[19]。2023年3—9月,我们观察了补骨脂素对hPDLSCs增殖、成骨分化的促进作用,并探讨其机制。
1 材料与方法
1.1 主要试剂 胎牛血清(派克,上海中国),α-MEM培养基(元培,上海中国),胰酶消化液(元培,上海中国),青霉素链霉素(元培,上海中国)、磷酸盐缓冲液(元培,中国)、维生素C(索莱宝,中国)、地塞米松(索莱宝,中国)、β-甘油磷酸二钠盐(索莱宝,中国)、茜素红(索莱宝,中国)、补骨脂素(MCE,美国)、氯化合物(Sigma,美国)、PE 抗人CD34 抗体(BioLegend,英国)、APC 抗人CD90 抗体(BioLegend,英国)、增强型细胞计数试剂盒(Elabscience,武汉中国)、ALP 比色法试剂盒(Elabscience,中国)、总RNA 提取试剂盒(天根,中国)。
1.2 hPDLSCs 培养与鉴定 本研究经山东第一医科大学第一附属医院医学伦理委员会批准(No 2022-S264),取材自山东第一医科大学第一附属医院口腔颌面外科门诊拔除的健康成人的第三磨牙,拔牙后2 h内从牙根中间三分之一刮取牙周膜组织,并分离为1.0 mm×1.0 mm 的组织块,平铺在培养瓶的底部,每3天更换一次含20%胎牛血清的培养基,第7 天时镜下可见组织周围有细胞爬出。以1∶2 的比例传代培养后,细胞形态均匀,呈纤细纺锤形。通过流式细胞仪检测第三代细胞的表面标记物,造血干细胞标记物CD34 呈阴性,间充质干细胞特异性标记物CD90 呈强阳性。取第三代hPDLSCs 用于后续实验。
1.3 hPDLSCs 增殖能力检测 取第三代hPDLSCs,分为6 组,接种在96 孔板中,每组3 个复孔,每孔加入细胞悬液100 μL。5、10、25、50、100 μmol/L 补骨脂素组分别加入含最终浓度为5、10、25、50、100 μmol/L 补骨脂素的培养液培养,对照组细胞正常培养。48 h后,弃原培养液,每孔加入细胞计数试剂(CCK-8)溶液100 μL,再培养4 h,采用酶标仪检测450 nm波长处OD值。
1.4 hPDLSCs成骨分化能力检测
1.4.1 ALP 活性 采用比色法检测。取第三代hPDLSCs,并分为6 组,接种在96 孔板中,每组3 个复孔,每孔加入细胞悬液100 μL。5、10、25、50、100 μmol/L 补骨脂素组分别加入含最终浓度为5、10、25、50、100 μmol/L 补骨脂素的成骨诱导液进行培养,对照组以正常成骨液诱导培养,成骨诱导液每3 天更换1 次。培养7 d,用塑料细胞刮板从平板上刮下细胞,在冰水浴中超声处理后,提取上清液,使用比色法检测上清液中ALP 的活性,采用酶标仪检测520 nm波长处OD值。
1.4.2 成骨矿化结节 采用茜素红染色检测。取第三代hPDLSCs,并分为6组,每组3个复孔,接种在96 孔板中,每孔加入细胞悬液100 μL。5、10、25、50、100 μmol/L 补骨脂素组分别加入含最终浓度为5、10、25、50、100 μmol/L 补骨脂素的成骨诱导液进行培养,对照组以正常成骨液诱导培养,成骨诱导液每3天更换1次。培养21 d,用茜素红染色检测成骨矿化结节,并用10%氯化十六烷基吡啶进行定量,采用酶标仪检测562 nm波长处OD值。
1.5 hPDLSCs Runx2、骨桥蛋白(OPN)mRNA 检测 将第三代hPDLSCs 接种到6 孔板中,并分为两组,对照组在成骨诱导液中正常培养;25 μmol/L 补骨脂素组在含25 μmol/L 补骨脂素的成骨诱导液中培养。成骨诱导液每3 天更换1 次,培养14 d,按照RNA 提取试剂盒的说明提取总RNA,使用FastKing RT 试剂盒将RNA 逆转录为cDNA。采用实时定量PCR 检测Runx2 和OPN mRNA,以β-actin 作为内参基因,引物由生工生物工程(上海)有限公司设计和合成。
1.6 统计学方法 采用SPSS24.0 统计软件。符合正态分布的计量资料以表示,多组间比较采用单因素方差分析,多重比较若方差齐采用LSD 法检验,若方差不齐采用Tamhane 法检验,两两比较采用配对样本T检验。P<0.05 为差异有统计学意义。
2 结果
2.1 各组细胞增殖、成骨分化能力比较 细胞增殖、成骨分化能力比较见表1。
表1 各组细胞增殖、成骨分化能力比较()
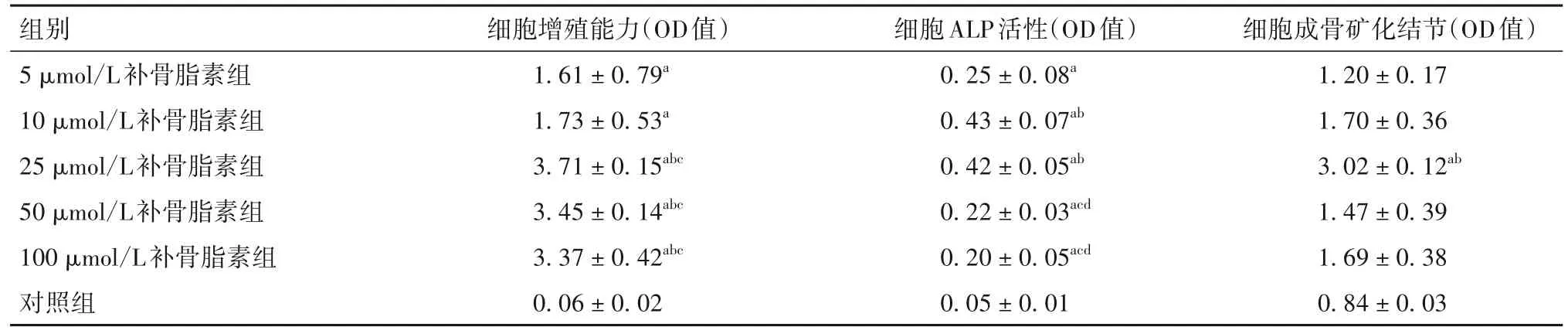
表1 各组细胞增殖、成骨分化能力比较()
注:与对照组比较,aP<0.05;与5 μmol/L 补骨脂素组比较,bP<0.05;与10 μmol/L 补骨脂素组比较,cP<0.05;与25 μmol/L 补骨脂素组比较,dP<0.05。
细胞成骨矿化结节(OD值)1.20 ± 0.17 1.70 ± 0.36 3.02 ± 0.12ab 1.47 ± 0.39 1.69 ± 0.38 0.84 ± 0.03组别5 μmol/L补骨脂素组10 μmol/L补骨脂素组25 μmol/L补骨脂素组50 μmol/L补骨脂素组100 μmol/L补骨脂素组对照组细胞增殖能力(OD值)1.61 ± 0.79a 1.73 ± 0.53a 3.71 ± 0.15abc 3.45 ± 0.14abc 3.37 ± 0.42abc 0.06 ± 0.02细胞ALP活性(OD值)0.25 ± 0.08a 0.43 ± 0.07ab 0.42 ± 0.05ab 0.22 ± 0.03acd 0.20 ± 0.05acd 0.05 ± 0.01
2.2 两组细胞Runx2、OPN mRNA 相对表达量比较 细胞Runx2、OPN mRNA 相对表达量比较见表2。
表2 两组细胞Runx2、OPN mRNA相对表达量比较()

表2 两组细胞Runx2、OPN mRNA相对表达量比较()
注:与对照组比较,aP<0.05。
组别25 μmol/L补骨脂素组对照组OPN mRNA相对表达量5.44 ± 1.36a 1.38 ± 1.34 Runx2 mRNA相对表达量7.03 ± 3.55a 1.16 ± 0.70
3 讨论
牙周炎主要由革兰氏阴性细菌感染引起,是最常见的口腔感染性疾病,对患者的口腔功能、面部美学和生活质量都有严重不良影响[20]。研究[21]显示,牙周炎的主要症状包括结缔组织破坏、牙周附着丧失和牙槽骨吸收等。目前,牙周炎的治疗方法主要为基础治疗、内科治疗和手术治疗等。引导组织再生术的主要目的是恢复和重建丧失的牙周组织,但尚不能获得理想的牙周组织再生[22]。在正常生理条件下,牙槽骨的成骨细胞、破骨细胞和骨细胞相互作用,共同维持骨改建的动态平衡[23-24]。牙周炎患者牙周组织丧失源于骨改建的失衡,如何阻止牙周炎患者牙槽骨吸收,并实现牙槽骨再生,一直是牙周炎治疗关注的热点。牙周膜干细胞是一类具有多向分化潜能的间充质干细胞,能够分化为成骨细胞、成纤维细胞、成牙骨质细胞等,具有调节牙槽骨改建的潜能,是研究牙周组织再生的首选细胞[25]。牙周膜干细胞的成骨分化功能,可成为牙槽骨再生治疗的重要手段。
补骨脂素是一种天然的呋喃香豆素类生物活性分子,广泛存在于多种自然植物中,如补骨脂、柠檬、酸橙、欧洲防风草、无花果和五指毛桃等,可用于治疗骨质疏松[15]、肿瘤[26]、骨关节炎[27]、皮肤病[28]等。现代药理研究表明,补骨脂素具有抗炎、抗癌、抗菌和雌激素活性等作用,其广泛的生物医学应用前景,正受到越来越多研究者的关注[9-13]。本实验利用补骨脂素抗炎、抗骨质疏松的生物学特性,探究其在牙槽骨再生中的作用和机制。过高浓度的补骨脂素并不利于细胞发挥正常生理功能[29],为了保证观察结果的准确性,本实验设计了5种不同补骨脂素浓度的实验组,以观察补骨脂素对细胞增殖和成骨分化的影响。
本文通过体外实验研究补骨脂素对hPDLSCs增殖、成骨分化的影响,证实补骨脂素具有促进hPDLSCs 增殖和成骨分化的作用。CCK-8 检测提示,补骨脂素能够促进hPDLSCs 增殖,浓度在25~100 μmol/L范围内效果更好。ALP活性检测用于检测成骨分化的早期潜力,是成骨分化的重要标志。ALP 活性检测结果提示,补骨脂素能够提高hPDLSCs ALP 的活性,且浓度在10~25 μmol/L 范围内效果更好。茜素红染色常用于检测钙沉积,证实细胞出现成骨分化特性。茜素红染色结果显示,25 μmol/L的补骨脂素能够促进hPDLSCs经成骨诱导形成矿化结节。当补骨脂素浓度>25 μmol/L时,细胞的成骨分化特性表达反而不强烈,可能是由于过高浓度的药物对细胞的功能产生了不利影响。Runx2是成骨分化特异性转录因子,能上调前成骨细胞、软骨细胞中各种矿化相关蛋白基因的转录,使其向成骨细胞方向分化;OPN是一种重要的骨基质蛋白,在骨矿化、代谢、重建中起重要作用。RT-qPCR法结果显示,与对照组比较,25 μmol/L 的补骨脂素能够提高hPDLSCs 中Runx2、OPN mRNA 的相对表达量,证实补骨脂素的作用可能与Runx2信号通路有关。
总之,补骨脂素能促进hPDLSCs 的增殖和成骨分化,尤以25 μmol/L 补骨脂素效果最好,机制可能与其可增强Runx2信号通路有关。

