茶树炭疽病菌拮抗链霉菌的筛选及其抑菌特性研究
张玉丹 谭琳 刘仲华 肖敦根 邓玉莲 李桂花 黄虹 杨学宇 胡秋龙
摘要:茶炭疽病菌刺盤孢菌(Colletotrichum camelliae)是引起茶树炭疽病的重要致病菌,为获得对C. camelliae具有拮抗作用的链霉菌,采用稀释涂布法和平板对峙法从茶园生境中分离筛选出对其具有明显拮抗作用的链霉菌菌株,并结合形态学观察、生理生化特征和16 S rRNA基因序列分析对其进行种属鉴定;开展基于链霉菌菌株的抗菌谱测定、茶炭疽病菌菌丝生长抑制试验和孢子萌发抑制试验;通过菌丝生长速率法测定其无菌发酵滤液对茶炭疽病菌的抑菌活性及其抑菌活性稳定性,并测定其产胞外降解酶能力、抗菌物质合成基因、挥发性与非挥发性代谢物抑菌活性。结果表明,筛选获得一株对茶炭疽病菌C. camelliae具有良好抑菌效果的菌株XS-4,对茶炭疽病菌的平板抑制效果为76.42%;结合形态学观察、生理生化特征,以及16 S rRNA基因序列分析,将菌株XS-4鉴定为多产色链霉菌(Streptomyces polychromogenes);菌株XS-4对其他8种植物病原菌均具有较好的抑菌效果,抗菌性能具有广谱性。扫描电镜结果表明,菌株XS-4能抑制茶炭疽病菌菌丝生长。孢子萌发抑制试验发现,拮抗菌XS-4发酵液能抑制茶炭疽病菌的孢子萌发,抑制率为62.48%;菌株XS-4的最佳发酵培养基为KMB培养基,在KMB培养基中培养7 d所产生的抑菌活性物质对茶炭疽病菌的抑菌效果最好;其无菌发酵滤液对温度、酸碱度、紫外照射、蛋白酶均具有较好的稳定性;菌株XS-4的非挥发性代谢物对茶炭疽病菌的抑菌活性较好,抑菌率达81.92%;菌株XS-4具有产生淀粉水解酶、蛋白酶、β-1,3-葡聚糖酶、纤维素酶的能力;菌株XS-4具有产生抗菌物质的pks-Ⅰ及pks-Ⅱ基因。综上所述,菌株XS-4在茶树炭疽病生物防治方面具有巨大的应用潜力。
关键词:茶炭疽病菌;链霉菌;抑菌效果;稳定性;抗菌基因
中图分类号:S517.1;S435.711 文献标识码:A 文章编号:1000-369X(2024)02-283-16
Identification of Antagonistic Streptomycetes Against Anthracnose Pathogen of Tea Plants and
Determination of Their Inhibitory Properties
ZHANG Yudan1,2, TAN Lin3, LIU Zhonghua1,2, XIAO Dungen4, DENG Yulian1,2,
LI Guihua1,2, HUANG Hong1,2, YANG Xueyu1,2, HU Qiulong1,2*
1. Key Lab of Tea Science of Ministry of Education, Hunan Agricultural University, Changsha 410128, China; 2. College of Horticulture, Hunan Agricultural University, Changsha 410128, China; 3. College of Plant Protection, Hunan Agricultural University, Changsha 410128, China; 4. China Tea (Hunan) Co. LTD., Changsha 410128, China
Abstract: Colletotrichum camelliae is an important pathogen causing anthracnose of tea plants. In order to obtain Streptomyces strains with better antagonistic effect on C. camelliae, the dilution coating method and plate standoff method were used to isolate and screen Streptomyces strains from the habitat of tea plantations. Morphological observation, physiological and biochemical characteristics and 16 S rRNA gene sequence analysis were combined to identify their species. Antimicrobial spectrum determination, mycelial growth inhibition test and spore germination inhibition test of C. camelliae were carried out for the isolated strains. The antifungal activities and stabilities of aseptic fermentation filtrate of the isolated strains against C. camelliae were determined by using the mycelial growth rate method. The extracellular enzyme-producing capacity, antimicrobial substance synthesis genes, volatile and non-volatile metabolite antifungal activity of the isolated strains were also determined. The results show that a strain XS-4 with better inhibitory effect on tea anthracnose pathogen was obtained and the plate inhibition effect on tea anthracnose pathogen was 76.42%. The strain XS-4 was identified as Streptomyces polychromogenes, which had good inhibitory effect on eight other plant pathogens and the antifungal properties have a broad spectrum. Scanning electron microscopy results show that the strain XS-4 could inhibit the growth of mycelium of tea anthracnose pathogen, and the mycelium was tightly entangled with each other and deformed. The spore germination inhibition test shows that the fermentation solution of strain XS-4 could inhibit the spore germination of C. camelliae, and the inhibition rate was 62.48%. The best fermentation medium for strain XS-4 was KMB medium, and the inhibitory active substance produced by 7 d incubation in KMB medium had the best inhibitory effect on tea anthracnose, the aseptic fermentation filtrate of strain XS-4 had a better stability to temperature, acid and alkali, ultraviolet, and protease. The non-volatile metabolites of strain XS-4 show better antifungal activity against tea anthracnose pathogen with aninhibition rate of 81.92%. The strain XS-4 has the ability to produce amylase, protease, β-1,3-glucanase, and cellulase. The pks-Ⅰ and pks-Ⅱ genes of strain XS-4 were associated with the production of antimicrobial substances. In conclusion, the strain XS-4 has a great potential for application in the biocontrol of anthracnose in tea plants.
Keywords: tea anthracnose, Streptomyces, antifungal effect, stability, antimicrobial genes
茶炭疽病菌刺盘孢菌(Colletotrichum camelliae)是茶树炭疽病的主要病原菌之一,能危害我国大多数茶树品种,是我国茶树炭疽病发生的主要病原菌种[1-2]。茶炭疽病的发生不仅会导致茶叶产量降低,还会严重影响茶叶品质。对于茶炭疽病的防治,目前生产上主要采用化学药剂防治,但化学药剂的使用对茶树自身和环境均存在一定的危害[3],具有使茶树病原菌产生抗药性、杀伤天敌生物等缺点。有益微生物防治已成为植物病害防治的重要研究方向。目前,已有关于利用有益微生物对茶树炭疽病进行生物防治的相关研究报道[4],但利用链霉菌防治茶炭疽病的研究报道相对较少。
放线菌是一类具有重要经济价值和生物研究价值的微生物,其中链霉菌属的应用较多,链霉菌在植物病害中具有重要的应用价值[5-7]。如桑树链霉菌(Streptomyces samsunensi)对橡胶褐根病具有较强的拮抗作用[5];毒三素链霉菌(S. toxytricini)发酵液对黄瓜枯萎病菌的抑制效果较好,对病菌的菌丝生长及孢子萌发均有明显的抑制作用[6];链霉菌3-22对樱桃叶斑病具有较强的拮抗作用,其无菌滤液抑菌率效果达80%以上[7]。链霉菌具有产生多种生物活性物质的能力,有研究表明,深红紫链霉菌(S. violaceorubidus)能产生胞外抗菌物质[8];灰锈赤链霉菌(S. griseorubiginosus)能产生多种抗菌物质[9-10],利迪链霉菌(S. lydicus)的次级代谢产物对多种植物病原真菌均具有较强的抑制作用[11];卢娜林瑞链霉菌(S. lunalinharesii)发酵液中的抗菌活性物质具有良好的热稳定性,在120 ℃以下对哈锐炭疽菌(C. horii)的抑制率均在95%以上[12]。
因此,本研究以茶炭疽病菌刺盘孢菌为指示菌,从茶园生境中分离筛选获得一株拮抗效果良好的链霉菌菌株XS-4,通过形态学观察、生理生化特征和16 S rRNA基因序列结果分析对其进行种属鉴定,抗菌谱试验测定其抗菌能力,通过扫描电镜、发酵液培养基及培养时间筛选、无菌发酵液抑菌活性稳定性测定、产胞外降解酶能力、抗菌物质合成基因检测及非挥发性代谢物抑菌活性测定分析,拮抗菌XS-4对茶炭疽病菌的抑菌特性,旨在为今后茶树炭疽病生物防治提供一些科学理论依据和支持。
1 材料与方法
1.1 供试材料
1.1.1 供试土壤
供试土壤样品于2022年9月采自湖南长沙县干杉乡茶园。
1.1.2 供试病原菌
茶炭疽病菌刺盘孢菌(C. camelliae)、半知菌亚门刺盘孢菌(C. circinans)、茄褐纹拟茎点霉菌(Phomopsis vexans)、尖孢镰刀菌(Fusarium oxysporum)、柑橘间座壳菌(Diaporthe citri)、大斑凸脐蠕孢菌(Exserohilum turcicum)、禾谷镰刀菌(F. graminearum)、草莓疫霉菌(Phytophthera fragariae)、大丽轮枝菌(Verticillium dahlia)等9种植物病原菌均分离保存于湖南农业大学第十六教学楼。
1.1.3 供试培养基
高氏一号培养基、察氏琼脂培养基、Bennett培养基、营养琼脂培养基[13];马铃薯葡萄糖琼脂培养基(PDA),不加琼脂即为PDB培養基[14];酵母浸出粉胨葡萄糖培养基(YEPD)、LB培养基[14];YG培养基、KMB培养基[15];无机盐淀粉琼脂培养基(ISP4)、酵母膏燕麦培养基(ISP2),不加琼脂即为ISP2液体培养基[16];ISP6培养基、氮源利用试验培养基[17];玉米培养基、小米培养基[18]。蛋白酶培养基:脱脂牛奶5 mL、琼脂1.5 g、蒸馏水50 mL;淀粉琼脂培养基[14];APB培养基[19]。羧甲基纤维素培养基:蛋白胨5 g、酵母提取物10 g、羧甲基纤维素钠10 g、NaCl 5 g、KH2PO4 1 g、琼脂20 g、蒸馏水1 L。
1.1.4 主要试剂
DNA提取试剂盒EasyPure? Genomic DNA Kit购自北京全式金生物技术股份有限公司,卢戈氏碘液购自青岛华洁生物科技有限公司,刚果红购自天津市化学试剂研究所,苯胺蓝购自国药集团化学试剂有限公司,壳聚糖购自鑫瑞生物科技有限公司,PCR扩增引物由生工生物工程(上海)股份有限公司合成。
将100 mg刚果红溶于100 mL水中制备刚果红溶液。称取2 g壳聚糖粉末用预冷的45 mL浓盐酸溶解,4 ℃静置24 h后加入300 mL 50%酒精,将充满絮状物的混合溶液4 000 r·min-1离心20 min,取沉淀水洗至中性后用水重悬沉淀至200 mL得到1%的胶体几丁质。
1.1.5 数据处理与分析
使用Excel收集整理数据,采用SPSS 26.0进行数据统计分析,Duncan新复极差法进行单因素方差分析,使用Origin 2018软件作图。
1.2 拮抗菌株的分离筛选
采用稀释涂布平板法从供试土壤样品中分离链霉菌菌株,即将土样依次倍比稀释10-1~10-6,分别取10-3~10-6各梯度稀释悬液100 μL涂布于高氏一号培养基平板上,每个处理设3次平行,28 ℃培养7 d后,挑取单菌落进行纯化。
采用平板对峙法[12]筛选对茶炭疽病菌刺盘孢菌(C. camelliae)具有拮抗作用的菌株,挑取待测菌株接种在距PDA平板中心25 mm两侧,28 ℃培养2 d后,平板中央接入5 mm的茶炭疽病菌菌饼,继续培养5 d后测量菌落直径,以只接病原菌的平板为对照,根据公式(1)计算其对茶炭疽病菌的抑菌率。
抑菌率=(对照菌落直径?处理菌落直径)/对照菌落直径×100%[20] ··········(1)
1.3 拮抗菌株XS-4的鉴定
1.3.1 形态特征
将菌株XS-4划线接种于高氏一号、ISP2、ISP4、ISP6、营养琼脂、察氏、PDA、Bennett等8种培养基上,28 ℃培养7~14 d,观察并记录菌株XS-4在8种培养特征培养基上的菌落生长状况、基生菌丝及气生菌丝颜色,以及有无可溶性色素产生。采用插片法在高氏一号培养基上培养菌株XS-4,待菌株菌丝长上盖玻片之后,取下盖玻片在扫描电镜下观察菌株XS-4的菌丝、孢子链及孢子等特征[21]。
1.3.2 生理生化特性
菌株XS-4的明胶液化试验、甲基红试验、产硫化氢试验、过氧化氢酶试验、Voges-Proskauer(V-P)试验、硝酸还原酶试验、精氨酸脱羧酶试验均参照《链霉菌鉴定手册》[22],氮源利用试验采用普戈二氏的唯一氮源法[23],菌株XS-4耐盐性和pH耐受性试验参照文献[24]。
1.3.3 分子生物学鉴定
使用EasyPure? Genomic DNA Kit试剂盒按说明书提取菌株XS-4基因组DNA,以提取的DNA为模板,利用通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-TACGGCTACCTTGTTACGACTT-3′)扩增其16 S rRNA基因序列[11]。PCR反应体系:DNA模板2 μL,上、下引物各1 μL,Taq PCRMasterMix酶10 μL,超纯水6 μL。PCR反应条件:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸50 s,共35个循环;72 ℃延伸5 min。PCR扩增产物经1.5%琼脂糖凝胶电泳检测合格之后,送至生工生物工程(上海)股份有限公司测序。将测序后得到的菌株XS-4基因序列提交至NCBI进行BLAST比对分析后,利用MEGA 11.0软件以邻接法(Neighbor-joining method)构建系统发育进化树,以明确菌株XS-4的种属分类。
1.4 菌株XS-4抗菌谱测定
菌株XS-4的抗菌谱测定参照1.2章节进行,每个处理重复3次,于28 ℃倒置培养7 d后,测量菌落直径,根据公式(1)计算拮抗菌株XS-4对8种植物供试病原菌的抑菌率。
1.5 菌株XS-4对茶炭疽病菌菌丝生长和孢子萌发的影响试验
采用平板对峙法将茶炭疽病菌刺盘孢菌(C. camelliae)與拮抗菌株XS-4在28 ℃培养箱中共培养5 d后,以不接种拮抗菌病原菌自然生长5 d为对照,刮取抑菌圈边缘的茶炭疽病菌菌丝进行扫描电镜观察,并拍照[25]。
挑取10块直径为5 mm的茶炭疽病菌饼置于PDB培养基中,于28 ℃、180 r·min-1条件下培养4 d后用擦镜纸过滤备用[26]。处理组将孢子液、拮抗菌发酵液、PDB以1︰1︰1的比例混合,对照组将孢子液、无菌水、PDB以1︰1︰1的比例混合,置于28 ℃培养箱中黑暗处理24 h,每个处理重复3次,在光学显微镜下观察孢子的萌发情况。孢子萌发抑制率=(对照萌发率?处理萌发率)/对照萌发率×100%[15]。
1.6 菌株XS-4的发酵培养基及时间优化
1.6.1 菌株XS-4的发酵培养基优化
参照文献[15],挑取20个5 mm大小的菌饼,分别放置于200 mL小米培养基、LB、KMB、YEPD、ISP2、PDB、玉米培养基等液体培养基中,于28 ℃、180 r·min-1条件下发酵培养7 d,取适量发酵液经12 000 r·min-1离心20 min,取上清液经0.22 μm微孔滤膜过滤后获得无菌发酵滤液。采用菌丝生长速率法测定其对茶炭疽病菌的抑菌活性,即将菌株XS-4无菌发酵滤液与PDA以1︰9的比例混匀倒平板后,在平板中央接种5 mm大小的茶炭疽病菌菌饼,每个处理设3次平行,以不加无菌发酵滤液的PDA平板接种病原菌为对照,28 ℃培养5 d后,测量病原菌菌落直径并计算其对茶炭疽病菌刺盘孢菌的抑菌率。
1.6.2 菌株XS-4的发酵时间优化
参照文献[15],在筛选出最佳培养基的基础上,挑取20个5 mm大小的菌饼,放置于200 mL KMB培养基中,于28 ℃、180 r·min-1条件下分别发酵培养4、5、6、7、8、9 d后,测定其对茶炭疽病菌的抑菌活性,具体测定方法与1.6.1章节一致。
1.7 菌株XS-4抑菌活性稳定性测定
将在最佳发酵培养基和最佳发酵时间基础上进行发酵培养所获得的菌株XS-4发酵液以12 000 r·min-1离心20 min后,取上清液经0.22 μm微孔滤膜过滤后得到菌株XS-4无菌发酵滤液。
温度的稳定性:取适量无菌发酵滤液分别放置在40、60、80、100 ℃和120 ℃下处理30 min,将处理后的无菌发酵滤液以1︰9的比例与PDA混合制成平板,将茶炭疽病菌刺盘孢菌接种在平板中央,以未经处理的无菌发酵滤液与PDA混合制成平板为阳性对照CK,以不加无菌发酵滤液的PDA平板为空白对照,每个处理设3次平行,28 ℃培养5 d后,测量病原菌菌落直径,并计算其对茶炭疽病菌刺盘孢菌的抑菌率。
酸碱的稳定性:取适量无菌发酵滤液加入到离心管中,将无菌发酵滤液pH分别调节到1.0、3.0、5.0、7.0、9.0、11.0,放置30 min后,再将pH调至7.0,采用菌丝生长速率法测定经处理后的无菌发酵滤液对茶炭疽病菌刺盘孢菌的抑菌活性稳定性。
紫外照射下的稳定性:取适量无菌发酵滤液分别用紫外照射1、2、3、4、5 h后,采用菌丝生长速率法测定经处理后的无菌发酵滤液对茶炭疽病菌刺盘孢菌的抑菌活性稳定性。
蛋白酶稳定性:参照文献[15]进行菌株XS-4的无菌发酵滤液蛋白酶稳定性试验,无菌发酵滤液经胃蛋白酶和蛋白酶K处理,采用菌丝生长速率法测定其对茶炭疽病菌刺盘孢菌的抑菌活性稳定性。
1.8 菌株XS-4的抑菌特性测定
1.8.1 菌株XS-4挥发性代谢物与非挥发性代谢物抑菌活性测定
参照文献[27-28],菌株XS-4挥发性代谢物抑菌活性采用双皿对扣法,即将菌株XS-4接种在高氏一号培养基上培养2 d后,茶炭疽病菌接种在PDA培养基上,茶炭疽病菌平板朝上两皿对扣,用封口膜密封后放入28 ℃培养箱中培养,以不接拮抗菌只接病原菌为对照,每个处理设3次平行,观察茶炭疽病菌菌落生长情况,5 d后测量病原菌菌落直径,并计算其对茶炭疽病菌刺盘孢菌的抑菌率。
菌株XS-4非挥发性代谢物抑菌活性测定参照文献[27-28]中方法,在PDA平板上平铺两层已灭菌的0.22 μm滤膜,在平板中央接入5 mm的XS-4菌株菌饼,28 ℃恒温培养箱中培养7 d后,将滤膜连同拮抗菌一起取出,在原位置接入5 mm的茶炭疽病菌菌饼,以在新的PDA平板上只接入茶炭疽病菌为对照,每个处理设3次平行,观察茶炭疽病菌菌落生长情况,5 d后测量病原菌菌落直径,并计算其对茶炭疽病菌刺盘孢菌的抑菌率。
1.8.2 菌株XS-4产胞外降解酶能力测定
菌株XS-4产淀粉水解酶、蛋白酶、β-1,3-葡聚糖酶、纤维素酶、几丁质酶等胞外降解酶能力检测均采用三点接种法,将菌株XS-4分别接种在淀粉水解酶培养基、蛋白酶培养基、APB培养基、羧甲基纤维素培养基、胶体几丁质培养基上,28 ℃恒温箱中培养7 d。淀粉琼脂培养基用卢戈氏碘液进行染色,纤维素酶先用刚果红染液染色再用NaCl溶液脱色,蛋白酶、β-1,3-葡聚糖酶、几丁质酶均直接观察,培养基上有水解圈产生即具有产酶能力,反之则无产酶能力[29-30]。
1.8.3 抗菌基因PCR扩增
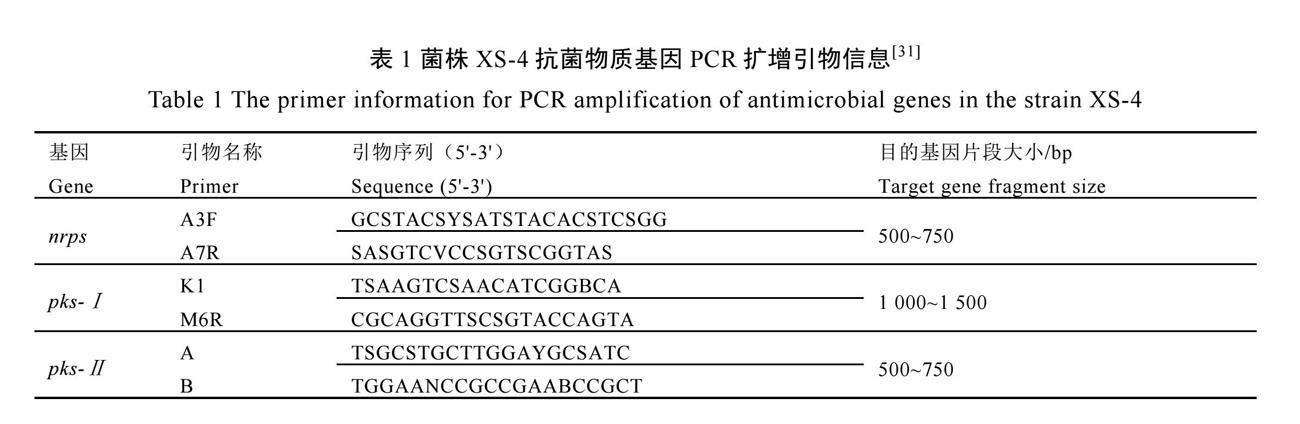
以菌株XS-4的基因组DNA为模板,使用表1中引物分别对菌株XS-4的非核糖体多肽合成酶基因(nrps)、聚酮合成酶基因(pks-Ⅰ和pks-Ⅱ)等相关抗菌物质基因进行PCR扩增检测。PCR反应体系与1.3.3章节一致。PCR反应参数:95 ℃变性3 min;94 ℃预变性30 s,63 ℃退火30 s,72 ℃延伸1 min,30个循环;72 ℃延伸5 min。PCR扩增产物用1.5%的琼脂糖凝胶电泳进行检测后送至生工生物工程(上海)股份有限公司测序。
2 结果与分析
2.1 拮抗菌株分离筛选结果
通过稀释涂布平板法从供试土壤样品中分离获得链霉菌菌株,采用平板对峙法筛选得到1株对茶炭疽病菌刺盘孢菌(C. camelliae)有较好抑制效果的链霉菌菌株XS-4,平板抑制效果達76.42%(图1)。
2.2 菌株XS-4的鉴定分析
2.2.1 形态特征
菌株XS-4在高氏一号培养基上的单菌落形态为圆形状,基生菌丝、气生菌丝均生长良好,气生菌丝颜色为淡粉色,扫描电镜下观察到菌株XS-4的孢子链为直链状,孢子圆形;
在8种培养基上观察培养特征,显示均能生长,且在ISP2和高氏一号培养基上生长最好,菌落致密,气生菌丝发达,在ISP4和营养琼脂培养基上生长缓慢,菌落稀疏,在ISP2、ISP6及PDA培养基上产可溶性色素,其他培养基上均不产可溶性色素(图2,表2)。
2.2.2 生理生化特征
菌株XS-4生理生化试验测定结果表明,其明胶液化、过氧化氢酶、精氨酸脱羧酶均为阳性,甲基红试验、V-P试验、产H2S试验、硝酸还原酶均为阴性,能利用L-丙氨酸、L-甘氨酸、L-精氨酸、L-色氨酸,不能利用L-谷氨酸、L-半胱氨酸;菌株XS-4在4% NaCl浓度以下均能生长,pH的耐受范围为5~10(表3)。
2.2.3 分子生物学鉴定
通过PCR扩增获得菌株XS-4的16 S rRNA基因序列,将其提交至GenBank数据库,获得登录号为PP001417。在NCBI进行
BLAST比对分析,选取相似性较高的基因序列构建系统发育树,结果表明,菌株XS-4与多产色链霉菌(S. polychromogenes)聚为一支。通过综合菌株XS-4的形态学观察、生理生化特征及16 S rRNA基因序列系统发育树结果,菌株XS-4被鉴定为多产色链霉菌(S. polychromogenes)(图3)。
2.3 菌株XS-4抗菌谱分析
菌株XS-4的抗菌谱测定结果表明,其对其他8种植物病原菌的抑制效果较好,抑菌率均在50%以上,对草莓疫霉菌和茄褐纹拟茎点霉菌的抑菌率均大于70%,但对草莓疫霉菌的抑制效果最好,抑菌率为(75.23±0.73)%;对大丽轮枝菌的抑菌率最低,但也达到了(53.79±1.74)%;说明菌株XS-4具有广谱抑菌活性且抑菌效果较好(表4)。
2.4 菌株XS-4对茶炭疽病菌菌丝生长和孢子萌发的影响
扫描电镜观察结果表明,菌株XS-4与茶炭疽病菌刺盘孢菌共培养后,茶炭疽病菌的菌丝生长受到抑制,与对照组相比,处理组菌丝之间相互紧紧缠绕在一起,菌丝发生变形、皱褶、干瘪等现象(图4)。
孢子萌发抑制试验结果表明,拮抗菌XS-4
发酵液能抑制茶炭疽病菌的孢子萌发,其抑制率为62.48%,且显微镜下观察到对照组和发酵液处理组的茶炭疽病菌孢子萌发状况有显著差异,处理组的孢子萌发芽管显著短于对照组,孢子萌发速度表现较慢(图5)。
2.5 菌株XS-4抑菌酵培养基及时间优化
2.5.1 菌株XS-4发酵培养基筛选
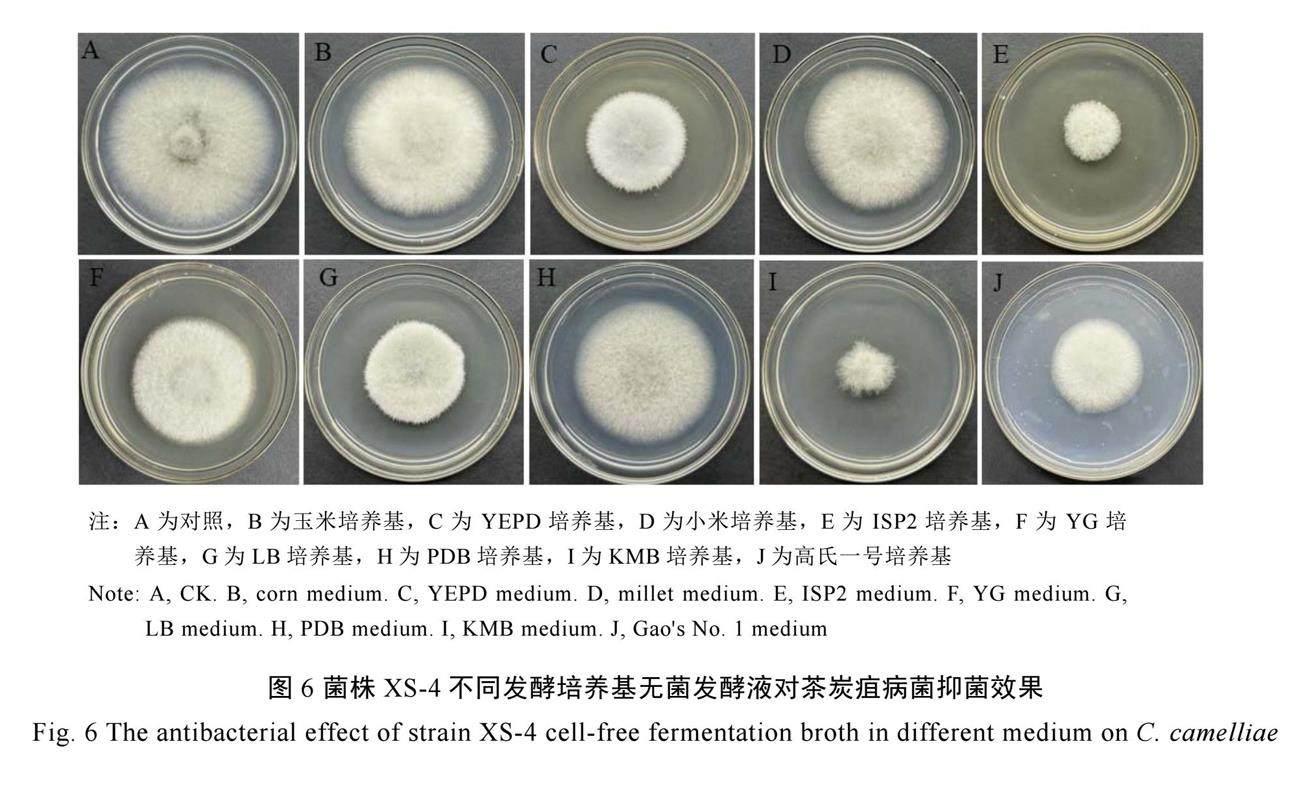
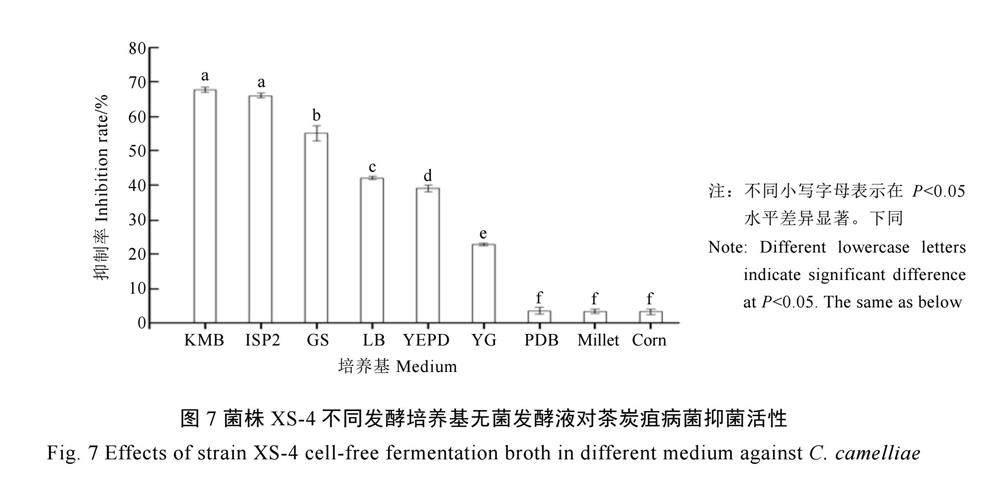
菌株XS-4发酵培养基优化试验结果表明(图6~7),使用KMB培养基发酵培养后,菌株XS-4无菌发酵滤液对茶炭疽病菌刺盘孢菌的抑菌活性最高,抑菌率达(67.73±0.72)%;其次为ISP2培养基,无菌发酵滤液对茶炭疽病菌的抑菌率为(66.08±0.61)%,但与KMB无显著性差异;而使用玉米培养基、小米培养基、PDB培养基进行发酵培养后的无菌发酵滤液对茶炭疽病菌的抑菌率很低,使用玉米培养基发酵后的无菌滤液对茶炭疽病菌的抑菌率仅为(3.35±0.81)%。因此,菌株XS-4的最佳发酵培养基为KMB培养基。
2.5.2 菌株XS-4发酵时间
菌株XS-4在KMB培养基中分别发酵培养4、5、6、7、8、9 d,所获得的无菌发酵滤液对茶炭疽病菌刺盘孢菌的抑菌活性影响,前7 d不同发酵天数间无显著差异,但随着培养时间的延迟略有增加,在7 d时其抑菌活性最高(68.02±0.81)%,在发酵培养8 d后无菌滤液抑菌率有所下降,与前7 d的相比达显著水平,但抑菌率仍保持在60%以上(图8)。
2.6 菌株XS-4无菌发酵液稳定性
菌株XS-4无菌发酵液稳定性测定结果表明,当pH<7时,其抑菌活性随pH降低而降低;在pH>7时,其抑菌活性随pH升高而显著降低,说明强酸或强碱均会影响其抑菌活性(图9A)。菌株XS-4无菌发酵液对紫外照射稳定性较好,在经紫外照射5 h后,其对茶炭疽病菌刺盘孢菌的抑菌率仍大于55%(图9B)。菌株XS-4无菌发酵液具有较好的热稳定性,在经120 ℃处理后,其无菌发酵液对茶炭疽病菌的抑菌率仍大于50%(图9C)。菌株XS-4无菌发酵液对蛋白酶K及胃蛋白酶稳定,但对胃蛋白酶相对更稳定,其无菌发酵液经胃蛋白酶处理后,其抑菌率仍大于65%(图9D)。
2.7 菌株XS-4抑菌特性
2.7.1 菌株XS-4代谢物抑菌活性
菌株XS-4代谢物抑菌活性测定结果表明,其挥发性代谢物对茶炭疽病菌刺盘孢菌具有一定抑制作用,抑菌率为47.40%(图10A);而其非挥发性代谢物对茶炭疽病菌的抑菌效果更好,处理组病原菌的菌落生长缓慢,在含非挥发性代谢物的平板上培养5 d后,处理组病原菌的菌落生长直径仅为11.06 mm,对茶炭疽病菌的抑菌率达到81.92%(图10C)。
2.7.2 菌株XS-4产降解酶能力
在淀粉琼脂培养基、蛋白酶培养基和APB培养基上,菌株XS-4能产生很明显的水解圈,说明其具有产淀粉水解酶、蛋白酶和β-1,3-葡聚糖酶的能力(图11);在羧甲基纤维素培养基上,经刚果红染色、NaCl脱色后,菌株XS-4能够产生较明显的水解圈,说明其具有产生纤维素酶的能力(图11D);而在胶体几丁质培养基上无水解圈产生,表明其不能产几丁质酶。
2.7.3 菌株XS-4的nrps及pks检测结果
PCR检测结果表明,在菌株XS-4中可以检测到pks-Ⅰ和pks-Ⅱ,但未检测到nrps(图12),表明菌株XS-4具有聚酮合成酶相关基因。将pks-Ⅰ及pks-Ⅱ基因序列在NCBI数据库中进行相似度比对,显示pks-Ⅰ与S. nojiriensis(CP071139.1)的Ⅰ型聚酮合成酶基因相似度为90.72%,pks-Ⅱ与S. katra的Ⅱ型聚酮合成酶基因相似度为89.56%(CP020043.1),表明菌株XS-4含有编码聚酮类抗菌物质合成基因,从而产生聚酮类抗菌物质。
3 讨论
链霉菌是植物病害生物防治中一类重要的微生物,拮抗菌的筛选鉴定是开发茶炭疽病生物防治资源的重要前提,形态学观察、生理生化测定及分子生物学鉴定是鉴定拮抗菌株种属分类的主要方式。本研究分离筛选得到1株对茶炭疽病菌刺盘孢菌具有良好拮抗作用的链霉菌XS-4,并且对其他8种植物病原菌均具有较好的抑制效果,再结合形态学鉴定、生理生化特征,以及16 S rRNA基因序列系统发育树分析,将菌株XS-4鉴定为多产色链霉菌(S. polychromogenes)。
微生物发酵是微生物获得代谢产物的主要方法,不同的发酵培养基和发酵时间会对代谢产物的活性有不同程度的影响,适宜的发酵条件能够促进菌株抑菌物质的产生[32-34]。有研究通过发酵培养条件的优化得到了菌株的最佳发酵条件,在最佳发酵条件下获得的发酵滤液对病原菌的抑菌效果最好[35],本研究通过对菌株XS-4的发酵培养基及发酵时间进行筛选,表明了菌株XS-4对茶炭疽病菌具有最佳抑菌活性的发酵培养基为KMB培养基,最佳发酵时间为7 d。无菌发酵液的稳定性研究对后续应用具有重要意义,暗蓝色链霉菌(S. caeruleatus)抑菌物质耐碱但对酸性环境敏感,具有较好的热、光及储藏温度稳定性[36];唐德链霉菌(S. tendae)对温度、pH、紫外照射均具有较好的稳定性[37];本研究发现菌株XS-4无菌发酵滤液对温度、紫外照射、pH、蛋白酶均具有较好的稳定性,为菌株XS-4发酵液抑菌活性成分分离纯化提供了相关理论依据。
病原菌分生孢子萌发和菌丝生长能力在其病害循环周期中非常重要[26],本研究表明,菌株XS-4的发酵液对茶炭疽病菌分生孢子萌发具有明显的抑制作用,经发酵液处理后病原菌孢子萌发速度变慢。于妍华等[38]研究表明,病原菌细胞壁物质成分容易被胞外水解酶分解,从而使病原菌菌丝崩解。本研究发现,菌株XS-4能产生淀粉水解酶、蛋白酶、纤维素酶、β-1,3-葡聚糖酶等降解酶,能够使茶炭疽病菌菌丝生长受到抑制,病原菌菌丝之间相互紧紧缠绕、菌丝变形,说明这些胞外降解酶在菌株XS-4抑制茶炭疽病菌生長过程中可能起到了重要作用。菌株的不同类型代谢产物抑菌活性测定对后续应用具有重要意义[39],本研究表明,菌株XS-4的非挥发性代谢产物对茶炭疽病菌具有较强的抑菌活性,为后续分离抗茶炭疽病菌的活性代谢产物提供了相关的理论支持。链霉菌主要是通过聚酮合成酶和非核糖体多肽合成酶途径合成抑菌活性物质[40],S. stelliscabiei具有pks-Ⅰ和pks-Ⅱ抗菌物质合成酶基因[15],S. albospinus具有nrps和pks等关键基因[38],本研究发现菌株XS-4具有聚酮合成酶途径相关基因pks-Ⅰ及pks-Ⅱ,可能主要是通过聚酮合成酶途径来合成聚酮类抑菌物质,从而发挥其抗菌作用。有研究表明,S. nojiriensis能产生具有广谱抗菌活性的吩嗪类化合物[41-42],S. katra对多种植物病原菌具有广谱抗性[43]。序列比对表明,pks-Ⅰ与S. nojiriensis的Ⅰ型聚酮合成酶基因、pks-Ⅱ与S. katra的Ⅱ型聚酮合成酶基因具有良好的同源性,说明菌株XS-4可能产生与S. nojiriensis和S. katra类似的抗菌代谢产物,但具体抑菌成分及其作用机制还需要进一步研究。
参考文献
[1] 王玉春, 郝心愿, 黄玉婷, 等. 中国主要茶区茶树炭疽菌系统发育学[J]. 中国农业科学, 2015, 48(24): 4924-4935.
Wang Y C, Hao X Y, Huang Y T, et al Phylogenetic Study of Colletotrichum Species Associated with Camellia sinensis from the major tea areas in China [J]. Scientia Agricultura Sinica, 2015, 48(24): 4924-4935.
[2] 刘威, 袁丁, 尹鹏, 等. 茶树炭疽病的研究进展[J]. 热带农业科学, 2016, 36(11): 20-26.
Liu W, Yuan D, Yin P, et al. Research progress on anthracnose of tea plant [J]. Chinese Journal of Tropical Agriculture, 2016, 36(11): 20-26.
[3] 劉荣, 姚玉仙, 周爽爽, 等. 茶炭疽病的症状识别与防治研究[J]. 福建茶叶, 2022, 44(2): 24-26.
Liu R, Yao Y X, Zhou S S, et al. Identification and control of Gloeosporium theae-sinensis Miyake [J]. Tea in Fujian, 2022, 44(2): 24-26.
[4] 孙钦玉, 张家侠, 夏先江, 等. 茶炭疽病生物防治研究现状与展望[J]. 茶业通报, 2017, 39(2): 69-72.
Sun Q Y, Zhang J X, Xia X J, et al. Status and prospects of research on biological control of tea anthracnose [J]. Journal of Tea Business, 2017, 39(2): 69-72.
[5] 刘一贤, 施玉萍, 戴利铭, 等. 橡胶褐根病拮抗放线菌17-7的筛选、鉴定及发酵条件优化[J]. 微生物学通报, 2020, 47(1): 118-129.
Li Y X, Shi Y P, Dai L M, et al. Screening, identification and fermentation optimization of an antimicrobial actinomycete strain 17-7 to Phellinus noxius [J]. Microbiology China, 2020, 47(1): 118-129.
[6] 刘金秀, 马正, 申屠旭萍, 等. 黄瓜枯萎病拮抗放线菌筛选及其生防作用鉴定[J]. 园艺学报, 2012, 39(6): 1123-1130.
Liu J X, Ma Z, Shentu X P, et al. Isolation and identification of antagonistic actinomycetes and their application in the biocontrol of Fusarium oxysporum f. sp. cucumerinum [J]. Acta Horticulturae Sinica, 2012, 39(6): 1123-1130.
[7] 刘雨芹, 杨莹, 魏有海, 等. 樱桃链格孢菌叶斑病拮抗链霉菌的筛选与鉴定[J]. 青海大学学报, 2022, 40(2): 40-47.
Liu Y Q, Yang Y, Wei Y H, et al. Screening and identification of antagonistic Streptomyces sp. against Alternaria alternata leaf spot of Prunus avium [J]. Journal of Qinghai University, 2022, 40(2): 40-47.
[8] Wadetwar R N, Patil A T. Production of antibiotic from actinomycetes isolated from Nagpur region and optimization of parameters to increase the yield [J]. Pharmaceutical Sciences and Research, 2013, 4(8): 3094-3098.
[9] Amano S I, Morota T, Kano Y K, et al. Promomycin, a polyether promoting antibiotic production in Streptomyces spp. [J]. Antibiotics, 2010(63): 486-491.
[10] Smaoui S, Mathieu F, Elleuch L, et al. Taxonomy, purification and chemical characterization of four bioactive compounds from new Streptomyces sp. TN256 strain [J]. World Journal of Microbiol Biotechnology, 2012(28): 793-804.
[11] 鲁妍璇, 曹毅, 李博雅, 等. 利迪链霉菌K2对灰霉病菌的抑菌效果及抑菌物质鉴定[J]. 微生物学报, 2023, 63(5): 1991-2006.
Lu Y X, Cao Y, Li B Y, et al. Inhibition of Streptomyces lydicus K2 on Botrytis cinerea and identification of its inhibitory substances [J]. Acta Microbiologica Sinica, 2023, 63(5): 1991-2006.
[12] 潘洁明, 陈雪玉, 贝永建, 等. 八角炭疽病拮抗放线菌RX2-2的分离鉴定及其生物活性评价[J]. 微生物学通报, 2022, 49(3): 991-1003.
Pan J M, Chen X Y, Bei Y J, et al. Isolation identification, and bioactivity evaluation of an actinomycetes strain RX2-2 against star anise anthracnose [J]. Microbiology China, 2022, 49(3): 991-1003.
[13] 王津. 一株具有抑菌活性的放線菌JN18的鉴定及发酵条件优化[D]. 南昌: 江西农业大学, 2021.
Wang J. Identification of an actinomycete JN18 with antibacterial activity and optimization of fermentation conditions [D]. Nanchang: Jiangxi Agricultural University, 2021.
[14] 范丽霞. 放线菌Z331-A的鉴定、培养条件优化及发酵液活性研究[D]. 海口: 海南大学, 2018.
Fan L X. Identification of actinomycetes Z331-A and optimization of fermentation conditions and fermentation broth activity study [D]. Haikou: Hainan University, 2018.
[15] 张强, 张艳茹, 霍云凤, 等. 禾谷镰刀菌拮抗菌21-6的鉴定及其抑菌活性测定[J]. 微生物学通报, 2022, 49(10): 4144-4157.
Zhang Q, Zhang Y R, Huo Y F, et al. Identification and activity of Streptomyces sp. 21-6 against Fusarium graminearum [J]. Microbiology China, 2022, 49(10): 4144-4157.
[16] 文娜. 拮抗轮枝镰刀菌的放线菌筛选及其活性代谢产物的初步研究[D]. 兰州: 西北师范大学, 2020.
Wen N. Screening of actinomycetes resistant to Fusarium verticillioide and preliminary study on their active metabolites [D] Lanzhou: Northwest Normal University, 2020.
[17] 宋微. 油菜菌核病拮抗放线菌的筛选及Kribbella monticol多相分类鉴定[D]. 哈尔滨: 东北农业大学, 2019.
Song W. Screening of antagonisticm actinomycetes against Sclerotinia Sclerotiorum and polyphasic taxonomy identification of Kribbella monticola [D] Haerbin: Dongbei Agricultural University, 2019.
[18] 孙迅. 烟草黑胫病菌生防放线菌发酵条件的优化及定殖动态[D]. 合肥: 安徽农业大学, 2023.
Sun X. Optimization of fermentation conditions and colonization dynamics of biocontrol actinomycetes against Phytophthora nicotianae [D]. Hefei: Anhui Agricultural University, 2023.
[19] 黄华毅, 田呈明, 梁小文. 克里本类芽孢杆菌TRCC 82001抑菌活性分析及发酵条件优化[J]. 西北林学院学报, 2022, 37(6): 153-160.
Huang H Y, Tian C M, Liang X W, et al. Antifungal activity of Paenibacillus kribbensis TRCC 82001 and optimization of fermentation conditions [J]. Journal of Northwest Forestry University, 2022, 37(6): 153-160.
[20] 阮宏椿, 石妞妞, 杜宜新, 等. 水稻稻瘟病拮抗稀有放线菌的筛选及防治效果[J]. 中国生物防治学报, 2021, 37(3): 538-546.
Ruan H C, Shi N N, Du Y X, et al. Screening and control effect of rare antagonistic actinomycetes against rice blast [J]. Chinese Journal of Biological Control, 2021, 37(3): 538-546.
[21] 方中達. 植病研究方法[M]. 3版. 北京: 中国农业出版社, 1998.
Fang Z D. Phytophthora research methods [M]. 3rd ed. Beijing: Chinese Agricultural Press, 1998.
[22] 中国科学院微生物研究所放线菌分类组. 链霉菌鉴定手册[M]. 北京: 科学出版社, 1975.
Actinomycetes Taxonomic Group, Institute of Microbiology, Chinese Academy of Sciences. Manual for identification Streptomyces [M]. Beijing: Science Press, 1975.
[23] 孙天宇. 抗水稻恶苗病放线菌的分离鉴定及功能研究[D]. 哈尔滨: 东北农业大学, 2020.
Sun T Y. Isolation, identification and functional study of actinobacteria resistant to rice bakanae disease [D]. Haerbin: Dongbei Agricultural University, 2020.
[24] 彭成慧. 云南香蒲内生放线菌的分离鉴定及抗番茄青枯病活性研究[D]. 哈尔滨: 东北农业大学, 2021.
Peng C H. Isolation and identification of endophytic actinobacteria from the root of cattail in Yunnan Province and their antibacterial activity against Ralstonia solanacearum [D]. Haerbin: Dongbei Agricultural University, 2021.
[25] 兰成忠, 甘林, 代玉立, 等. 黄瓜枯萎病菌拮抗菌的筛选、鉴定和防效测定[J]. 中国生物防治学报, 2023, 39(1): 184-193.
Lan C Z, Gan L, Dai Y L, et al. Screening, Identification and biocontrol effect of antagonistic strain against Fusarium oxysporum f. sp. cucumerinum [J]. Chinese Journal of Biological Control, 2023, 39(1): 184-193.
[26] 朱咏珊, 罗晓欣, 梁浩然, 等. 一株茶树根际细菌的鉴定与生防效果研究[J]. 茶叶科学, 2022, 42(1): 87-100.
Zhu Y S, Luo X X, Liang H R, et al. Identification of a tea rhizosphere bacterium and its biocontrol of tea anthracnose disease [J]. Journal of Tea Science, 2022, 42(1): 87-100.
[27] 张丽荣, 李鹏, 康萍芝, 等. 压砂西瓜枯萎病生防木霉菌筛选及其拮抗机制研究[J]. 河南农业科学, 2018, 47(5): 75-78, 84.
Zhang L R, Li P, Kang P Z, et al. Screening and antagonistic mechanism analysis of Trichoderma spp. against fusarium wilt of watermelon in gravel-mulched land [J]. Journal of Henan Agricultural Sciences, 2018, 47(5): 75-78, 84.
[28] 李小杰, 李成军, 姚晨虓, 等. 拮抗烟草疫霉菌的木霉菌株筛选鉴定及防病促生作用研究[J]. 中国烟草科学, 2020, 41(3): 65-70.
Li X J, Li C J, Yao C X, et al. Screening, identification of antagonistic Trichoderma spp. against tobacco black shank and its growth promotion effect on tobacco [J]. Chinese Tobacco Science, 2020, 41(3): 65-70.
[29] Huang H Y, Tian C M, Huang Y H, et al. Biological control of poplar anthracnose caused by Colletotrichum gloeosporioides (Penz.) Penz. &. Sacc [J]. Egyptian Journal of Biological Pest Control, 2020, 30(1): 1-9.

