绝经后骨质疏松症免疫反应相关基因的鉴定及其中药活性成分的筛选
王刚,董舶昶,康伯源,徐西林
1.黑龙江中医药大学,黑龙江 哈尔滨 150006
2.黑龙江中医药大学附属第三医院,黑龙江 哈尔滨 150006
绝经后骨质疏松症是女性绝经后由于雌激素的中断加速骨的丢失,是一种常见的、难治性的代谢性骨病。具有疼痛、脊柱变形、骨折以及对患者产生不良的心理状态[1]。根据我国骨质疏松症流行病学调查,在50 岁以上的人群中,骨质疏松症的患者约为19.2%,其中女性的患病率可达32.5%,患病率是男性的5 倍[2]。在骨免疫学领域认为免疫细胞与成骨细胞、破骨细胞均来源于骨髓,因此在生理病理状态下,免疫细胞与骨细胞相互影响。绝经后女性体内雌激素含量减少导致机体处于长期低水平炎症状态,这时机体内免疫细胞可以通过信号转导通路调节各种免疫细胞和免疫因子,因而骨细胞生物学功能发生改变,进一步导致骨代谢平衡发生改变[3]。绝经后女性的Th 细胞通过分泌大量的白细胞介素(IL)-17 和肿瘤坏死因子-α(TNF-α)参与核因子-κB 受体活化因子(RANK)的信号转导,并且调节破骨细胞的分化[4]。同时,女性绝经后,肠道菌群的数量、分布会发生显著改变,影响免疫调节功能,导致骨矿物质的丢失[5-6]。CD4+T 细胞中的Treg细胞,对Th1、Th2 和Th17 细胞的分化和功能具有抑制作用,同时可以分泌转化生长因子(TGF)-β1和抗炎因子IL-4、IL-10,抑制了破骨细胞的增殖分化[7-8]。而Th17 细胞所分泌的RANKL、IL-17、TNF-α,对破骨细胞的生成具有激活作用[4]。因此,在绝经后骨质疏松症中免疫调节在骨代谢平衡中起到了关键作用。
抑制免疫反应在绝经后骨质疏松症的防治过程中起着重要的作用。研究表明,肠道菌群中的长双歧杆菌可通过Breg-Treg-Th17 细胞轴增加抗炎细胞因子(IL-10、IFN-γ)的水平,并降低促炎因子(IL-6、IL-17、TNF-α)的表达,发挥抑制免疫反应以达到防治绝经后骨质疏松[9];Resolvins 来源Omega-3 脂肪酸,可通过下调炎症细胞因子的释放和抑制炎症损伤部位中性粒细胞的募集来消除炎症反应,以达到减少破骨细胞生成的目的,作为骨质疏松症的新型治疗方法[10]。本研究旨在阐明免疫反应促进绝经后骨质疏松症发生发展的分子机制,并探索绝经后骨质疏松症免疫反应相关基因的生物学功能和信号通路以及靶向中药活性成分的筛选,为靶向抑制免疫反应和探究治疗绝经后骨质疏松症潜在药物提供新思路。
1 材料与方法
1.1 绝经后骨质疏松症差异表达基因(DEGs)的筛选
在GEO和Gene Cards数据库搜索“postmenopausal osteoporosis”获得GSE230665 数据集和2 123 个基因。GSE230665 包括3 个对照组和12 个绝经后骨质疏松症组,其中这15 个样本来源于股骨的骨组织;通过R 软件中的“limma”数据包筛选DEGs。限定标准为P<0.05 和|lg2FC|>1 筛选出DEGs。并构建DEGs 的火山图进行可视化分析。
1.2 免疫反应相关的关键基因的筛选
将GSE230665 的DEGs 和Gene Cards 数据集导入Venny 2.1 软件,获得2 个数据集公共基因。将604 个公共基因输入David 工具,依次选择“Gene_Ontology”“GOTERM_BP_DIRECT”,在表格中查看富集在“immune response”条目的基因,并将这些基因定义为免疫反应相关的关键基因。
1.3 关键基因的基因本体(GO)和京都基因与基因组百科全书(KEGG)富集分析
将筛选出的关键基因输入David 工具获取GO和KEGG 通路相关分析。其中GO 功能富集分析包括生物学过程(BP)、分子功能(MF)和细胞组分(CC)3 个部分。
1.4 关键基因的蛋白相互作用(PPI)网络构建与核心基因筛选。
利用STRING 平台和Cystoscope 3.9.1 软件对关键基因进行PPI 网络构建。并在Cystoscope 3.9.1软件上使用CytoNCA 插件获取核心基因,将前10个基因定义为核心基因,并使用MCODE 插件对关键基因进行聚类分析。
1.5 鉴定与绝经后骨质疏松症相关的核心基因
在GSE230665 数据集中找到核心基因,利用热图观察核心基因的表达。并用CTD 数据库的“疾病-基因”中搜索“postmenopausal osteoporosis”,得到与绝经后骨质疏松症相关基因,然后与前10 位核心基因取交集,进一步证实绝经后骨质疏松症与核心基因相互作用,并剔除与绝经后骨质疏松症无关的核心基因。
1.6 核心基因对应中药活性成分的筛选
在 CTD 数据库中搜索“postmenopausal osteoporosis”,并在“Chemical-Genes Interaction”模块中分别搜索核心基因对应的中药活性成分,并筛选出靶向作用于各核心基因的前6 位中药活性成分(不足6 个按实际筛选的结果)。
1.7 分子对接
在PubChem 数据库中搜索与核心基因相互作用指数较高的中药活性成分的3D 结构(PDB 格式),在Uniport 数据库输入核心基因找到对应的Uniport ID,然后将Uniport ID 输入PDB 数据库中,下载对应的靶蛋白(PDB 格式),用PyMol 软件对蛋白进行处理后,再用Autodock 4 软件进行分子对接,最后用PyMol 软件进行可视化处理。
2 结果
2.1 绝经后骨质疏松症的DEGs 的确定
在 GEO 数据库搜索“ postmenopausal osteoporosis”获得GSE230665 数据集,用R 语言“limma”数据包获得差异表达基因表格,并以“P<0.05”和“|lg2FC|>1”筛选出12 856 个DEGs,利用R 软件中的“ggplot2”构建DEGs 的火山图,见图1。
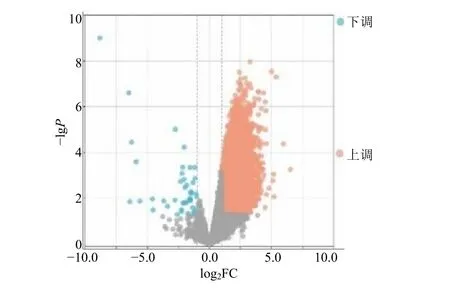
图1 绝经后骨质疏松症差异表达基因的火山图Fig.1 Volcano map of postmenopausal osteoporosis differentially expressed genes
2.2 免疫反应相关的关键基因的确定
将GSE230665 数据集的12 856 个DEGs 与GeneCards 的2 123 个基因导入Venny 2.1 软件(图2),获得604 个公共基因热图。将公共基因输入David 工具,发现有前列腺素E2 受体EP4 亚型(PTGER4)、CCAAT/增强子结合蛋白β(CEBPB)、信号素-7A(SEMA7A)、神经源性基因位点切口同源物蛋白1(NOTCH1)、CXC 趋化因子受体4 型(CXCR4)等 43 个关键基因富集在“immune response”条目上,并且这43 个基因在绝经后骨质疏松症的表达中均上调(图3)。
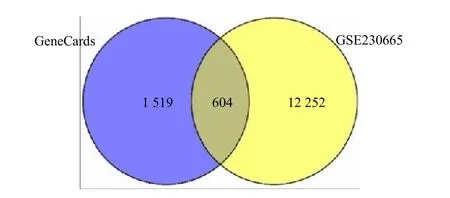
图2 公共基因韦恩图Fig.2 Venn diagram of public genes
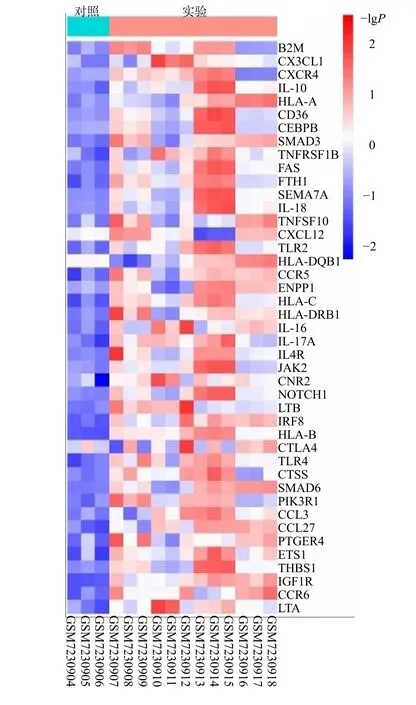
图3 关键基因表达热图Fig.3 Heat map of key gene expression
2.3 免疫反应相关的关键基因的GO 与KEGG 富集分析
将43 个关键基因输入DAVID 工具进行GO 功能富集和KEGG 通路相关分析。GO 功能富集分析,关键基因主要富集在正向调节炎症反应、IL-12 的产生、干扰素-γ 介导的信号通路、细胞迁移、肿瘤坏死因子的产生等BP;CC 主要涉及细胞膜外侧、细胞表面;MF 主要涉及肽抗原结合、受体结合、细胞因子活性、趋化因子活性、TAP 结合。KEGG 主要富集到趋化因子信号通路、磷脂酰肌醇3-激酶/蛋白激酶B(PI3K/Akt)信号通路、产生IgA 的肠道免疫网络、TNF 信号通路、细胞黏附分子、核因子-κB(NF-κB)信号通路、TGF-β 信号通路等,见图4。

图4 关键基因的GO 功能富集分析和KEGG 通路分析Fig.4 GO functional enrichment analysis and KEGG pathway analysis of key genes
2.4 关键基因PPI 网络和核心基因的确定
将关键基因导入STRING 平台进行PPI 网络可视化分析(图5A),隐藏网络中的断开节点,获得40 个节点313 条边的PPI 网络,将TSV 格式表格导入Cytoscape,使用CytoNCA 插件计算介数中心性(BC),节点的大小对应介数中心性的大小。将BC 评分前10 位基因确定位核心基因。前10 个核心基因分别为IL-10、β2-微球蛋白(B2M)、IL-17A、CXCR4、细胞毒性T 淋巴细胞蛋白4(CTLA4)、Toll样受体4(TLR4)、C-C 趋化因子受体5 型(CCR5)、神经源性基因位点切口同源物蛋白1(NOTCH1)、Toll 样受体2(TLR2)、SMAD 同源物3 重组蛋白(SMAD3)作为绝经后骨质疏松症免疫反应相关的核心基因。且这10 个核心基因在DEGs 中表达均上调。对这10 个核心基因进行PPI 网络互作(图5B),获得10 个节点和40 条边,平均局部聚类系数为0.903,PPI 富集:P<0.01。核心基因共表达结果显示这10 个核心基因表达存在一定相关性。在Cytoscape 软件上使用MCODE 插件构建关键基因的子网络2 个。子网络1(图5C)主要涉及细胞黏附分子、用于产生IgA 的肠道免疫网络;子网络2(图5D)主要涉及趋化因子信号通路、TNF 信号通路、PI3K/Akt 信号通路。对核心基因进行富集通路分析,其富集结果大多与免疫细胞、炎症反应等通路相关(图6)。

图5 关键基因的PPI 网络(A)、核心基因PPI 网络(B)、子网络1 PPI 网络(C)、子网络2 PPI 网络(D)Fig.5 PPI network of key genes (A),and PPI network of core genes (B),PPI network of subnetwork 1 (C),PPI network of subnetwork 2 (D)
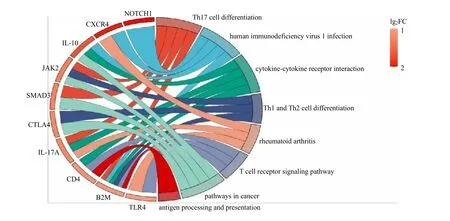
图6 核心基因富集通路图Fig.6 Core gene enrichment pathway map
2.5 绝经后骨质疏松症免疫反应相关的核心基因的筛选与鉴定
在GSE230665 数据集中观察筛选出的核心基因的表达水平,发现2.4 项下10 个核心基因的表达均上调,再使用CTD 数据库验证核心基因与绝经后骨质疏松症之间的相互作用,在CTD 数据库“疾病-基因”搜索“postmenopausal osteoporosis”,结果显示有16 710 个基因与绝经后骨质疏松症相关。16 710 个基因和筛选出的10 个核心基因取交集,交集结果显示IL-10、B2M、IL-17A、CXCR4、TLR4、CCR5、NOTCH1、TLR2、SMAD3这9 个核心基因与绝经后骨质疏松症的发生发展相关。同时发现CTLA4不在交集内,与绝经后骨质疏松症没有相互作用关系,并剔除CTLA4。因此,提示上述9 个核心基因可能是修复绝经后骨质疏松症的重要靶点,见图7。
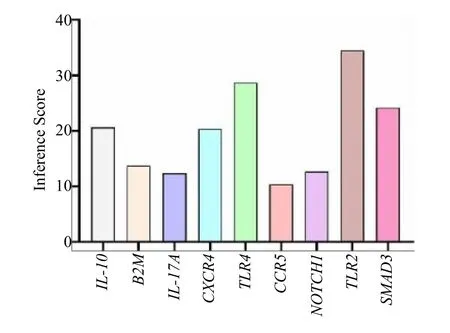
图7 核心基因与绝经后骨质疏松症的推断分数Fig.7 Core gene and postmenopausal osteoporosis inference score
2.6 靶向核心基因的活性成分的筛选
选取CTD 数据库靶向作用于各核心基因的前6个中药活性成分,见表1,其中相互作用数是指证明某个中药活性成分作用于某个基因的论文数。结果显示核心基因对应的中药活性成分为雌二醇、白藜芦醇、槲皮素、姜黄素、双酚A 和木黄酮等,提示这些活性成分可能是通过抑制免疫反应来防治绝经后骨质疏松症。

表1 核心基因对应的中药活性成分Table 1 Active ingredients of traditional Chinese medicine corresponding to core genes
2.7 分子对接
使用Autodock 4 软件将雌二醇的3D 结构分别与核心基因TLR4、SMAD3、TLR2、IL-10、CXCR4、B2M、NOTCH1、IL-17A、CCR5进行对接(图8)。对接后发现其结合能分别为-6.79、-6.45、-6.03、-7.67、-6.49 和-6.54、-8.86、-8.51、-6.65 kcal/mol(1 cal=4.2 J),结合能均小于-6 kcal/mol,因此,雌二醇与核心基因结合稳定。雌二醇结构构象稳定,与各蛋白形成的氢键丰富。如雌二醇通过氨基酸残基GLU-230 与TLR4 形成1 个氢键;通过氨基酸残基GLU-182、ALA-135 和LYS-140 与SMAD3 形成4 个氢键;通过氨基酸残基LYS-150 与TLR2 形成1 个氢键;通过氨基酸残基GLU-154、VAL-165 和ASP-164 与IL-10 形成4 个氢键;通过氨基酸残基ARG-188 与CXCR4 形成1 个氢键;通过氨基酸残基MET-99、SER-11 与B2M 形成2 个氢键;通过氨基酸残基GLU-47、HIS-58 和GLU-62 与NOTCH1形成3 个氢键;通过氨基酸残基GLU-118、SER-64和TRY-67 与IL17A 形成4 个氢键;通过氨基酸残基THR-284、GLN-280 与CCR5 形成2 个氢键。对接结果显示雌二醇可能通过核心基因对绝经后骨质疏松症发挥修复作用。

图8 雌二醇与核心基因结合点Fig.8 Estradiol binding sites to core genes
3 讨论
绝经后骨质疏松症是老年女性雌激素中断后导致骨量减少、骨的微观结构发生损坏为特征的全身性骨病[11]。骨免疫学认为免疫微环境参与骨质疏松症的发生、发展,RANK/RANKL/OPG 通路可通过免疫细胞、免疫因子和趋化因子对骨代谢进行调控,导致骨量的吸收和形成失去平衡[12]。因此,在防治绝经后骨质疏松症的过程中不仅要从骨代谢角度考虑,还要从抑制免疫反应角度考虑。绝大多数绝经后骨质疏松症患者通常得不到及时的治疗来预防骨质疏松性骨折的发生,从而使患者的生活质量下降并承担高昂的经济负担,甚至导致高死亡率[13-15]。因此,寻找绝经后骨质疏松症中与免疫反应相关的基因以及其靶向的中药活性成分是亟待解决的关键问题,为后续从免疫微环境角度出发诊断和修复绝经后骨质疏松症提供更多的机会。
本研究针对绝经后骨质疏松症患者筛选出604个DEGs,对其进行GO 分析,并筛选出43 个与免疫反应相关的关键基因,进一步通过PPI 网络分析以及CTD 数据库验证筛选出9 个核心基因,表明所筛选出的核心基因与绝经后骨质疏松症的发生、发展有着密切的关联。
研究结果显示,这些关键基因主要富集于正向调节炎症反应、IL-12 的产生、TNF-α 的产生、细胞迁移和趋化作用等;主要作用于细胞膜外侧、细胞表面和细胞外空间。研究表明绝经后骨质疏松症患者血清炎症细胞因子(TNF-α、IL-6、IL-12)促进了破骨细胞的增殖,且绝经后骨质疏松症患者在服用重组人甲状旁腺激素联合雌激素后,可有效降低机体炎症反应,提高患者骨密度[9,16-17]。KEGG 通路分析结果显示,趋化因子信号通路、PI3K/Akt 信号通路、TNF 信号通路、NF-κB 信号通路等。Wojdasiewicz 等[18]发现趋化因子CX3CL1 可以直接促进破骨细胞分化,同时CX3CL1 与免疫细胞结合并在骨表面附近产生TNF-α、IL-1β、IL-6 等炎性细胞因子。Xi 等[19]证实PI3K/Akt 通路在维持骨量的动态平衡发挥着重要作用,可以促进成骨细胞的分化并逆转骨质疏松的发生。Yasuda 等[20]证实RANKL/RANK/NF-κB 通路对破骨细胞的激活起着重要的作用,成骨细胞产生的RANKL 与破骨细胞表面的RANK 相结合,并诱导NF-κB 活化,进而促进破骨细胞的分化;趋化因子属于免疫调节因子,可将白细胞募集至炎症及损伤部位,对骨的重塑具有重要的影响[12]。研究结果提示绝经后骨质疏松症的发病与趋化因子信号通路、PI3K/Akt 信号通路、TNF 信号通路、NF-κB 信号通路等密切相关。
为进一步了解核心基因的生物功能,本研究重点分析了TLR4、SMAD3、TLR2、IL-10、CXCR4、B2M、NOTCH1、IL-17A、CCR5。这9 个核心基因可能在PMOP 的生理病理过程中发挥重要作用。TLR4、TLR2 属模式识别受体,Toll 受体家族成员。N-Myc 和STAT 交互子(NMI)和人干扰素诱导蛋白35(IFP35)可通过TLR4 激活NF-κB 通路,从而激活巨噬细胞释放促炎症细胞因子,并且这些炎症细胞因子可反作用于TLR4 炎症通路引发瀑布式炎症级联反应,进而促进破骨细胞的分化,促进绝经后骨质疏松症的发展[21-22];MYD88 和TRAF6 可通过与TLR2 相结合使NF-κB 活化,促进细胞因子分泌和炎症反应。并且还可以激活免疫细胞并促进细胞凋亡[23-24]。SMAD3 是细胞内的蛋白,是TGFβ 和相关蛋白的中心效应器,对伤口愈合和骨折的早期愈合具有抑制作用[25];IL-17A 具有潜在的强免疫炎症,可激活下游TRAF6 介导的NF-κB 和MAP激酶途径,最终导致细胞因子,趋化因子的转录激活[26];CXCR4 可与细菌脂多糖(LPS)结合介导炎症反应,同时可激活单核细胞分泌TNF[27];CCR5是许多炎症因子的受体,参与T 淋巴细胞向感染部位迁移[28]。B2M 是第一类主要组织相容性复合体(MHC)重要组成部分,参与肽抗原向免疫系统的呈递[29]。NOTCH1 作为膜结合配体的受体参与胸腺中CD4 和CD8 细胞的成熟[30]。上述8 个核心基因的功能多参与免疫反应、炎症反应和激活NF-κB 通路以促进骨吸收,抑制骨形成,促进绝经后骨质疏松症的发生。而IL-10 可作用多种免疫细胞的免疫调节因子,具有较强的抗炎作用,防止炎症反应过度损伤组织[31]。绝经后骨质疏松症属于慢性炎性疾病,因此,抗炎和促炎细胞因子可同时存在。研究表明[32],与健康的同龄人相比,骨质疏松患者IL-10的表达上调,以抑制炎性细胞因子的产生(如IL-17A),使钙磷代谢达到平衡,抑制骨的吸收。
通过CTD 数据库查询各核心基因与绝经后骨质疏松症之间的推断分数,结果显示TLR2、TLR4、SMAD3、IL-10、CXCR4、B2M、NOTCH1、IL-17A、CCR5与绝经后骨质疏松症的推断分数分别为34.48、28.74、24.23、20.66、20.38、13.75、12.67、12.35、10.31。提示这些基因可能从免疫反应角度出发修复绝经后骨质疏松症。再用CTD 数据库对核心基因对应的中药活性成分进行筛选,发现核心基因对应的中药活性成分为雌二醇、白藜芦醇、槲皮素、姜黄素、双酚A 和木黄酮等,为后续靶向治疗绝经后骨质疏松症提供新的方向。
分子对接结果显示,雌二醇与绝经后骨质疏松症中免疫反应相关的核心基因结合稳定。有研究表明,雌二醇可抑制脂多糖诱导的RAW264.7 细胞内TLR4 的表达,同时雌二醇可抑制NF-κB 通路的激活,从而抑制细胞炎症反应的发生,对绝经后骨质疏松症起到修复作用[33];姜黄素对氧化应激反应和FoxO3a 通路有抑制作用并间接抑制解除Wnt 通路,以达到改善和延迟绝经后骨质疏松症[34];槲皮素可调节NF-κB 受体,并上调RANKL/RANK/OPG 信号通路以减少骨的丢失[34]。与研究筛选结果一致。因此,本研究所筛选的中药活性成分为后续临床靶向抑制免疫反应以治疗绝经后骨质疏松症的研究提供新思路。
本研究筛选出绝经后骨质疏松症发生发展中与免疫反应相关的核心基因和信号通路,筛选出TLR2、TLR4、SMAD3、IL-10、CXCR4、B2M、NOTCH1、IL-17A和CCR5这9 个核心基因和趋化因子信号通路、PI3K/Akt 信号通路、TNF 信号通路和NF-κB 信号通路等,这些核心基因与通路可能与绝经后骨质疏松症的发生发展密切相关。
利益冲突所有作者均声明不存在利益冲突

