荆防颗粒对糖尿病小鼠视网膜的保护作用
刘冬光,赵文学#,徐 燕*,姚 茹,孟 雪,姚景春,刘 忠*
荆防颗粒对糖尿病小鼠视网膜的保护作用
刘冬光1, 2, 3,赵文学1, 2, 3#,徐 燕1, 2, 3*,姚 茹1, 2, 3,孟 雪1, 2, 3,姚景春1, 2, 3,刘 忠1, 2, 3*
1. 鲁南制药集团股份有限公司 新药药理中心,山东 临沂 276006 2. 经方与现代中药融合创新全国重点实验室,山东 临沂 276006 3. 临沂市天然药物免疫药理毒理重点实验室,山东 临沂 276006
探讨荆防颗粒对db/db小鼠血糖代谢的调控作用及对其视网膜病变(diabetic retinopaphy,DR)的保护作用。将60只雄性db/db小鼠随机分为模型组、二甲双胍(120 mg/kg)组及荆防颗粒(1、2 g/kg)组,每组15只,另取15只雄性db/m小鼠作为对照组,每周检测小鼠体质量、空腹血糖、摄食量及饮水量等基础指标,并在实验结束后进行口服葡萄糖耐量试验(oral glucose tolerance test,OGTT);采用ELISA检测小鼠视网膜组织白细胞介素-1β(interleukin-1β,IL-1β)、IL-6、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、丙二醛(malondialdehyde,MDA)水平和过氧化氢酶(catalase,CAT)、超氧化物歧化酶(superoxide dismutase,SOD)活性;采用PAS染色检测视网膜组织病理变化;采用Western blotting检测视网膜组织中血管内皮生长因子(vascular endothelial growth factor,VEGF)、紧密连接跨膜蛋白(Claudin-1)、胰岛素受体底物1(insulin receptor substrate 1,IRS1)、磷酸化IRS1(phosphorylated IRS1,p-IRS1)、磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)、磷酸化PI3K(phosphorylated PI3K,p-PI3K)、蛋白激酶B(protein kinase B,Akt)、磷酸化Akt(phosphorylated Akt,p-Akt)、B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)、剪切型半胱氨酸天冬氨酸蛋白酶-3(cleaved cystein-asparate protease-3,cleaved Caspase-3)蛋白表达。与对照组比较,模型组小鼠空腹血糖、摄食量、饮水量明显升高(<0.01),OGTT中曲线下面积(AUC)显著升高(<0.01);视网膜组织中IL-1β、IL-6、TNF-α和MDA含量显著升高(<0.01),CAT、SOD活性显著下降(<0.01);视网膜组织周细胞降低,新生血管增多(<0.01),并且视网膜组织中Claudin-1、p-IRS1/IRS1、p-PI3K/PI3K、p-Akt/Akt、Bcl-2蛋白表达下调(<0.01),VEGF、Bax、cleaved Caspase-3蛋白表达上调(<0.01)。与模型组比较,荆防颗粒组小鼠体质量明显升高(<0.05、0.01),空腹血糖、摄食量、饮水量均有不同程度下降(<0.05、0.01);视网膜组织中IL-1β、IL-6、TNF-α、MDA含量显著下降(<0.05、0.01),CAT、SOD活性显著上升(<0.05、0.01);视网膜组织病理形态有所改善,视网膜组织中Claudin-1、p-IRS1/IRS1、p-PI3K/PI3K、p-Akt/Akt、Bcl-2蛋白表达显著上调(<0.05、0.01),VEGF、Bax、cleaved Caspase-3蛋白表达显著下调(<0.05、0.01)。荆防颗粒对db/db小鼠视网膜病变具有一定的改善作用,其作用机制可能为调节小鼠视网膜组织中VEGF及Claudin-1蛋白表达,进而激活胰岛素受体IRS-1/PI3K/Akt信号通路,启动Caspase级联反应,抑制视网膜上皮细胞的凋亡,从而对视网膜病变起到一定的保护作用。
荆防颗粒;糖尿病;视网膜;氧化应激;凋亡;IRS-1/PI3K/Akt通路
伴随着人们生活质量的提高,糖尿病发病率呈现逐年上升的趋势,糖尿病主要表现为血糖过高及一系列相关症状,是血糖自平衡失调而引起的慢性代谢性综合征[1],其中糖尿病视网膜病变(diabetic retinopaphy,DR)是糖尿病微血管病变中最常见的表现,是一种具有特异性改变的眼底病变。DR是糖尿病的严重并发症之一。据统计,我国糖尿病人群中DR的患病率为20.86%,因DR临床症状较少而不被人们重视,但随着DR能够严重影响患者视力,甚至存在致盲的风险,现已逐渐进入研究范畴[2-3]。
DR的发病机制尚不十分明确,推测其机制主要涉及氧化应激、炎症反应、新血管生成及视网膜神经元凋亡等过程[4]。一方面,当机体的高糖不能通过正常途径降解时,会激活细胞多元醇途径,从而使细胞内形成高渗透状态,损伤视网膜的微循环。同时,视网膜内的高糖环境会促进糖基化终末产物(advanced glycation end products,AGEs)的形成,从而进一步激活活性氧(reactive oxygen species,ROS)信号通路,促进周细胞和内皮细胞的凋亡。另一方面,高血糖环境还能够激活胰岛素受体底物1(insulin receptor substrate 1,IRS1)/磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)途径,上调血管内皮生长因子(vascular endothelial growth factor,VEGF)表达,促进视网膜新生血管生成[5-6]。
目前临床治疗DR的方法主要包括使用各类控制代谢的药物和激素、激光治疗及玻璃体切割术等[7]。但由于DR发病机制的复杂性,药物及手术治疗都存在一定的局限性。传统药物治疗DR并不能起到根治作用[8],且药物治疗可能引发胃肠道反应、高热等不良反应;而激光光凝术虽然能有效降低DR分期并提升临床有效率[9],但其不适用于严重玻璃体积血或视网膜前出血的患者,且可能造成患者永久性视网膜损伤及不同程度的视力下降[10]。因此,探寻不良反应低、疗效好的药物已成为糖尿病治疗的首要问题,传统中医认为DR属于“视瞻昏渺”“云雾移睛”等范畴,称其为“消渴内障”,中医的基本治则是“益气养阴,活血化瘀通络”。越来越多的研究表明,中药单体、组方以及中成药可通过多种机制共同作用于DR,有效改善其临床症状。陈晶等[11]研究发现青蒿琥酯能够通过抑制基质金属蛋白酶-9表达,从而抑制糖尿病大鼠视网膜病变;桃红四物汤联合激光治疗能够增加患者血清中一氧化氮合酶水平,降低血清中VEGF和白细胞介素-6(interleukin-6,IL-6)水平[12];荆防颗粒由荆芥、防风、羌活、独活、柴胡、前胡、川芎、枳壳、茯苓、桔梗、甘草等组成,可通过影响谷氨酸代谢、能量代谢、葡萄糖代谢等通路调节荨麻疹诱导的免疫系统紊乱,且药理学实验证实其能通过调节机体免疫功能,干预免疫性炎症反应等作用发挥抗炎作用[13-16]。因此本研究基于DR的发病机制,对荆防颗粒治疗DR的疗效及作用机制进行研究,旨在为中药治疗DR提供研究证据和思路。
1 材料
1.1 动物
SPF级雄性db/db小鼠(8~12周、体质量40~42 g),SPF级雄性db/m小鼠(8~12周,体质量25~27 g),均购自北京维通利华实验动物技术有限公司,生产许可证号SCXK(京)2016-0011。小鼠饲养于鲁南制药集团股份有限公司新药安评中心(GLP)屏障区大、小鼠实验室,动物使用许可证号SYXK(鲁)2018-0008。饲养条件为室温20~26 ℃,日温差≤4 ℃;相对湿度40%~70%;人工照明,12 h/12 h明暗交替;换气次数≥15次/ h;饲喂SPF大小鼠生长繁殖饲料,自由饮水和饮食。动物实验经鲁南制药集团股份有限公司实验动物管理与使用委员会批准(批准号AN-IACUC-2020-034)。
1.2 药品与试剂
荆防颗粒(批号802230115)由鲁南制药集团股份有限公司提供;盐酸二甲双胍肠溶片(批号H52020955)购自贵州圣济堂制药有限公司;BCA蛋白浓度检测试剂盒(批号P0010S)购自上海碧云天生物技术有限公司;甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(批号2118S)、p-IRS1抗体(批号2385S)、IRS-1抗体(批号3089S)、PI3K抗体(批号4255S)、p-PI3K抗体(批号17366S)、Akt抗体(批号9272S)、p-Akt抗体(批号4060S)、B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)抗体(批号3498S)、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)抗体(批号2772S)、剪切型半胱氨酸天冬氨酸蛋白酶-3(cleaved cystein-asparate protease-3,cleaved Caspase-3)抗体(批号9661S)均购自美国CST公司;VEGF抗体(批号MA5-13182)、Claudin-1抗体(批号PA1-37465)均购自美国Thermo Fisher Scientific公司;HRP标记的山羊抗兔IgG二抗(批号A0208)、HRP标记的山羊抗小鼠IgG二抗(批号A0216)均购自上海碧云天生物技术有限公司;小鼠白细胞介素-1β(interleukin-1β,IL-1β)试剂盒(批号ml003057)、小鼠IL-6试剂盒(批号ml102828)、小鼠肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)试剂盒(批号ml002859)、小鼠过氧化氢酶(catalase,CAT)试剂盒(批号ml037079)、小鼠超氧化物歧化酶(superoxide dismutase,SOD)试剂盒(批号ml059387)、小鼠丙二醛(malondialdehyde,MDA)试剂盒(批号ml077384)均购自上海酶联生物科技有限公司。
1.3 仪器
EVOS FL型显微镜、Multiskan FC酶标仪(美国Thermo Fisher Scientific公司);ONETOUCH强生-稳豪倍优型血糖仪[强生(中国)医疗器材有限公司];WP-UP-1840型超纯水机(沃特浦);1645050型电泳仪[伯乐生命医学产品(上海)有限公司];FL1000型蛋白成像系统(上海哈灵生物技术有限公司)。
2 方法
2.1 分组及给药
动物适应性饲养1周后,以db/m小鼠作为对照组,db/db小鼠按血糖值随机分为模型组、二甲双胍(120 mg/kg)组和荆防颗粒(1、2 g/kg,分别相当于临床等效剂量的1、2倍)组,每组15只。各给药组ig相应药物,对照组和模型组ig等体积生理盐水(10 mL/kg),1次/d,连续6周。
2.2 基础指标检测
每周定时禁食6 h后,对各组小鼠的体质量、血糖值、摄食量及饮水量进行检测。
2.3 口服葡萄糖耐量试验(oral glucose tolerance test,OGTT)
末次给药前禁食6 h,并在给药1 h后ig 4 g/kg的葡萄糖溶液,检测各组小鼠在0、30、60、90、120 min后的血糖值变化[17]。
2.4 视网膜组织IL-1β、IL-6、TNF-α、MDA水平及CAT、SOD活力的检测
于实验结束后,各组小鼠腹主动脉取血后,取各组小鼠视网膜组织制备匀浆液,3 200×离心10 min,收集上清液,按照试剂盒说明书测定视网膜组织中IL-1β、IL-6、TNF-α、MDA水平及CAT、SOD活力[18-21]。
2.5 PAS染色观察视网膜组织形态学变化
实验结束后,取各组小鼠眼组织,于4%多聚甲醛溶液中固定48 h,流水轻轻冲洗5 min,从睫状体后部经锯齿缘环形剪开巩膜,去除眼前节部分,随后将后眼杯以视乳头为中心切3瓣,轻轻分离出视网膜,将分离出的视网膜用0.01 mol/L PBS(pH 7.4)轻轻漂洗10 min,加入3%胰蛋白酶于37 ℃恒温箱消化2 h,用0.01 mol/L PBS(pH 7.4)漂洗,当仅剩下一层透明的视网膜血管网时,将其取出并平铺于载玻片上,置于37 ℃展片器上5 min,以利于血管网展开[22]。用流水轻轻冲洗视网膜消化铺片5 min,随后加入PAS氧化剂处理5 min,流水轻轻冲洗5 min,以除去残留的氧化剂,擦干载玻片上多余的水分后滴加Schiff染液,染色10 min,流水冲洗5 min,随后梯度乙醇脱水、二甲苯透明、中性树胶封片,于显微镜下观察视网膜形态[23]。
2.6 Western blotting检测视网膜组织中VEGF、Claudin-1、p-IRS1/IRS1、p-PI3K/PI3K、p-Akt/Akt、Bax、Bcl-2、cleaved Caspase-3蛋白表达
实验结束后,取各组小鼠眼组织并迅速分离出视网膜,按1∶6的比例加入RIPA裂解液,于组织研磨仪以4 ℃、1 200 r/min研磨10 min,随后以4 ℃、12 000 r/min离心10 min,取上清,采用BCA蛋白浓度测定试剂盒检测蛋白浓度。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,封闭后加入相应一抗,4 ℃孵育过夜,次日PBST洗膜后,加入二抗,室温孵育2 h,PBST洗膜后,加适量的ECL发光液显影,并分析蛋白条带灰度值。
2.7 统计学分析
3 结果
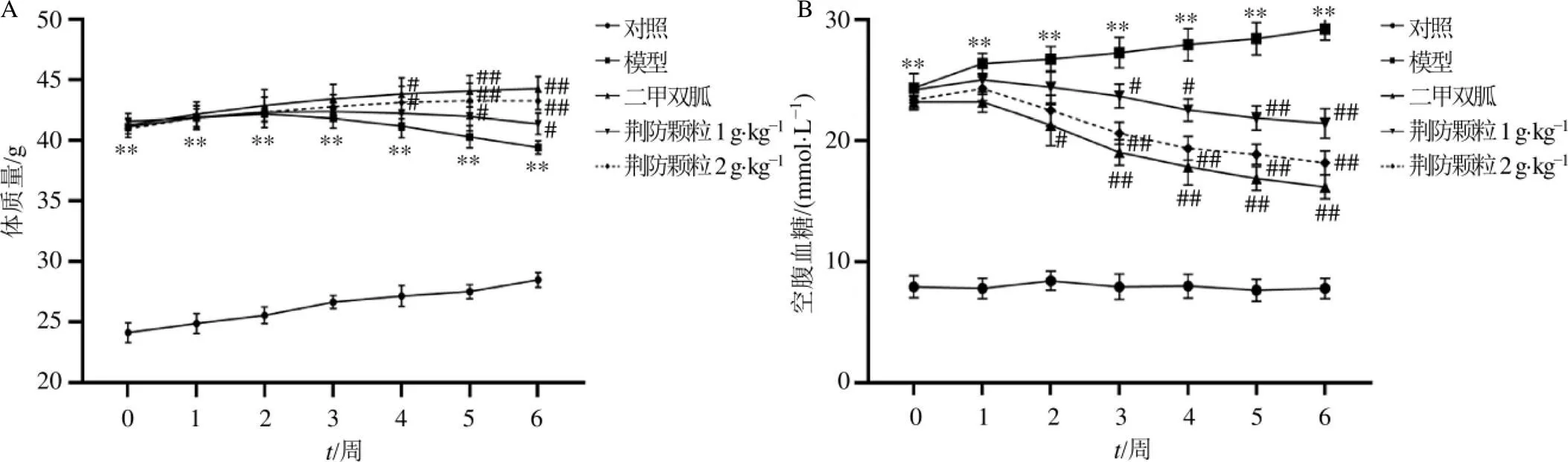
3.1 荆防颗粒对db/db小鼠体质量和血糖的影响
如图1-A所示,对照组小鼠体质量呈平缓上升趋势,db/db小鼠在实验初期(0~3周)体质量均有所增加,但各组之间无显著性差异。与模型组比较,第4周荆防颗粒(2 g/kg)组及二甲双胍组小鼠体质量显著升高(<0.05),第5~6周各给药组小鼠体质量均显著升高(<0.05、0.01)。
如图1-B所示,与对照组比较,模型组小鼠各时间点空腹血糖均显著升高(<0.01);与模型组比较,给予二甲双胍干预2周后,小鼠空腹血糖显著下降(<0.05、0.01);给予荆防颗粒干预3周后,小鼠空腹血糖显著降低(<0.05、0.01)。
3.2 荆防颗粒对db/db小鼠摄食量和饮水量的影响
如图2所示,与对照组比较,模型组小鼠摄食量及饮水量明显增多(<0.01);与模型组比较,各给药组小鼠在给药3周后摄食量及饮水量均有不同程度的减少(<0.05、0.01)。
与对照组比较:**P<0.01;与模型组比较:#P<0.05 ##P<0.01,下图同。
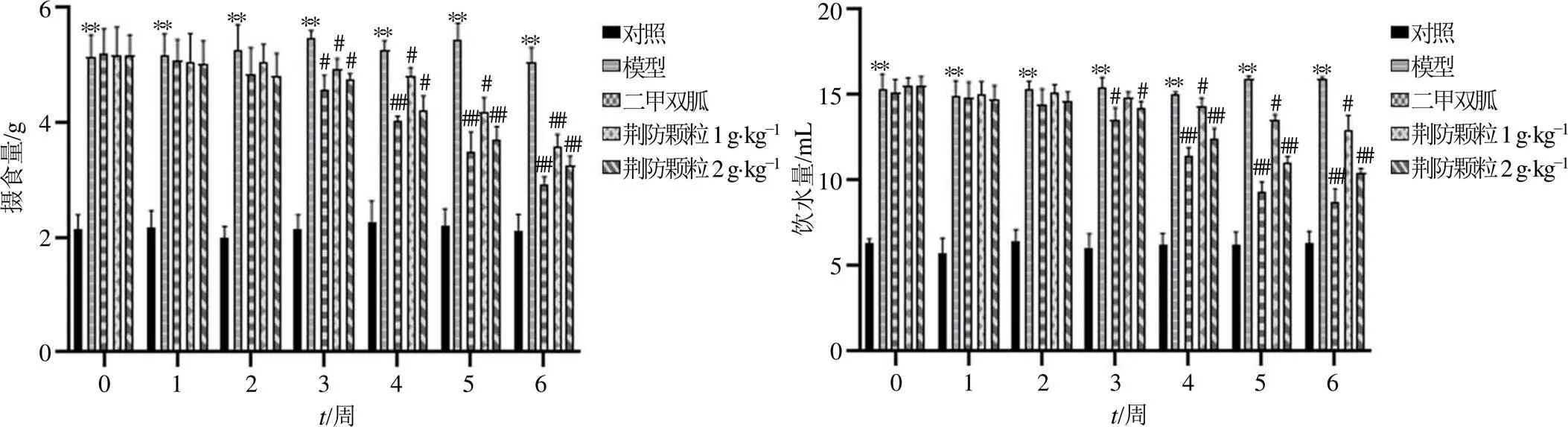
图2 荆防颗粒对db/db小鼠摄食量和饮水量的影响(, n = 15)
3.3 荆防颗粒对db/db小鼠OGTT的影响
如图3所示,与对照组比较,模型组小鼠各时间点血糖值均显著升高(<0.01),曲线下面积显著增加(<0.01);与模型组比较,荆防颗粒(1 g/kg)组小鼠在0、60、90、120 min时血糖值均显著下降(<0.05),荆防颗粒(2 g/kg)组和二甲双胍组小鼠各时间点血糖值均显著下降(<0.05、0.01),各给药组曲线下面积均显著下降(<0.05、0.01)。
3.4 荆防颗粒对视网膜组织IL-1β、IL-6、TNF-α、MDA水平及CAT、SOD活力的影响
如图4所示,与对照组比较,模型组小鼠视网膜组织中IL-1β、IL-6及TNF-α水平显著升高(<0.01);与模型组比较,各给药组小鼠视网膜组织中IL-1β、IL-6及TNF-α水平均显著降低(<0.05、0.01),表明荆防颗粒对糖尿病引起的视网膜炎性反应具有明显的改善作用。
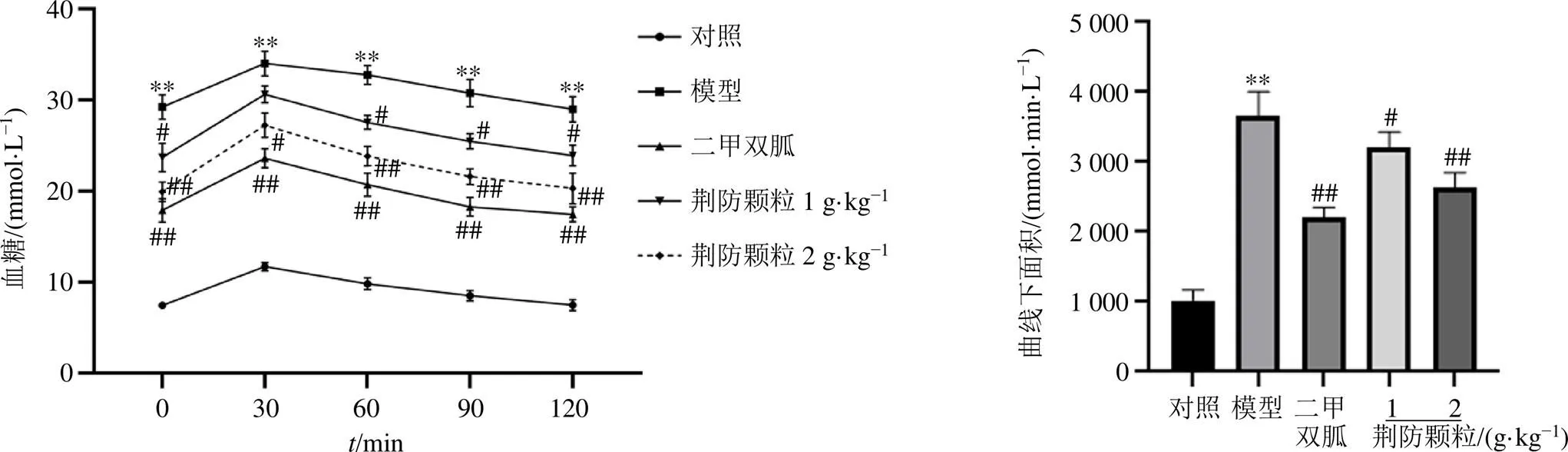
图3 荆防颗粒对db/db小鼠OGTT的影响(, n = 15)
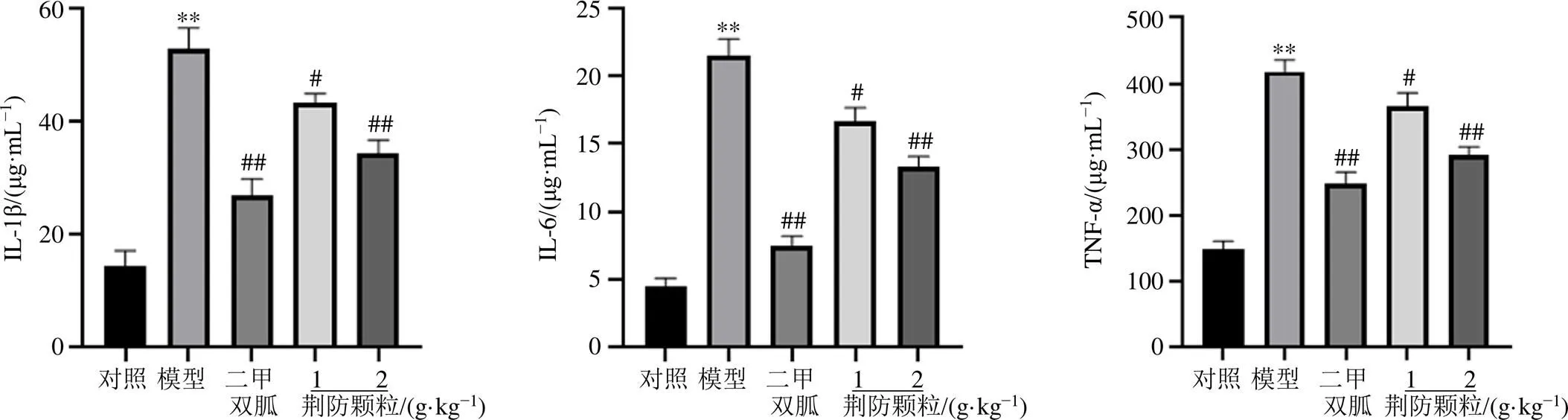
图4 荆防颗粒对db/db小鼠视网膜组织IL-1β、IL-6、TNF-α水平的影响(, n = 7)
如图5所示,与对照组比较,模型组小鼠视网膜组织中MDA含量明显升高(<0.01),CAT、SOD活性均显著下降(<0.01);与模型组比较,各给药组MDA含量明显下降(<0.05、0.01),CAT、SOD活性均明显升高(<0.05、0.01),表明荆防颗粒能够增强db/db小鼠视网膜组织的抗氧化能力,减轻机体氧化应激损伤。
3.5 荆防颗粒对db/db小鼠视网膜组织病理形态的影响
如图6所示,对照组小鼠视网膜形态无异常改变;与对照组比较,模型组小鼠视网膜出现微动脉瘤、非细胞毛细血管增多、内皮细胞增生以及周细胞选择性丢失(<0.05);与模型组比较,各给药组小鼠视网膜未见微动脉瘤组织,并且非细胞毛细血管减少,内皮细胞增生减少及周细胞丢失率明显下降(<0.05、0.01),表明荆防颗粒对db/db小鼠视网膜并发症具有良好的改善作用。
3.6 荆防颗粒对db/db小鼠视网膜组织VEGF、Claudin-1蛋白表达的影响
如图7所示,与对照组比较,模型组小鼠视网膜组织VEGF蛋白表达水平显著升高(<0.01),Claudin-1蛋白表达水平显著降低(<0.01);与模型组比较,各给药组小鼠视网膜组织中VEGF蛋白表达水平显著降低(<0.05、0.01),Claudin-1蛋白表达水平显著升高(<0.05、0.01)。
3.7 荆防颗粒对db/db小鼠视网膜组织p-IRS1/IRS1、p-PI3K/PI3K、p-Akt/Akt蛋白表达的影响
如图8所示,与对照组比较,模型组小鼠视网膜组织中p-IRS1/IRS1、p-PI3K/PI3K、p-Akt/Akt蛋白表达水平均显著降低(<0.01);与模型组比较,各给药组小鼠视网膜组织中p-IRS1/IRS1、p-PI3K/PI3K、p-Akt/Akt蛋白表达水平显著升高(<0.05、0.01)。
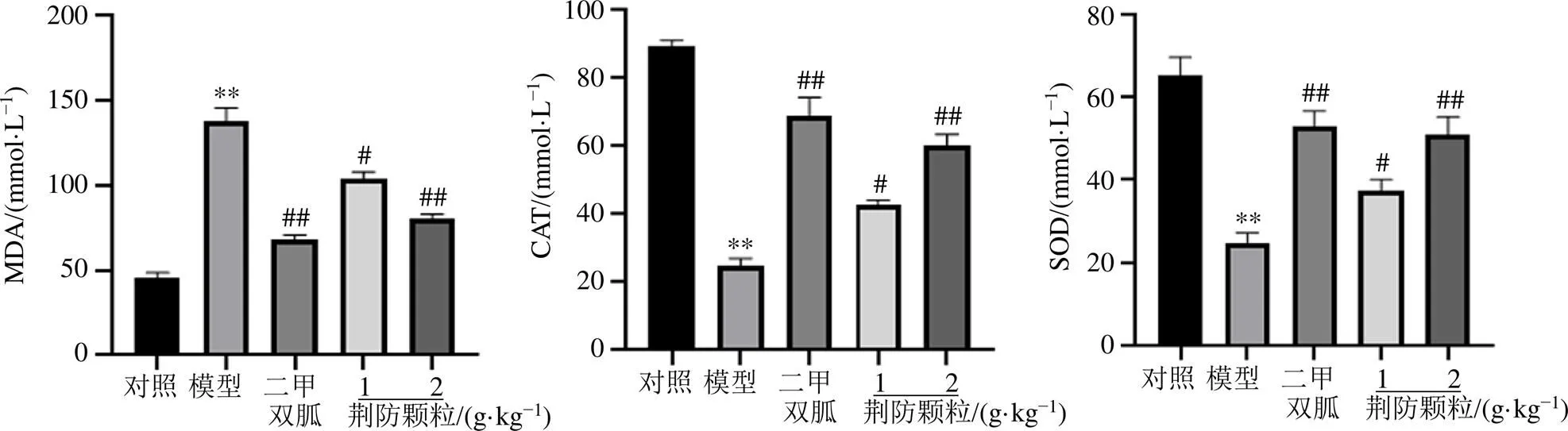
图5 荆防颗粒对db/db小鼠视网膜组织MDA含量及CAT、SOD活力的影响(, n = 7)
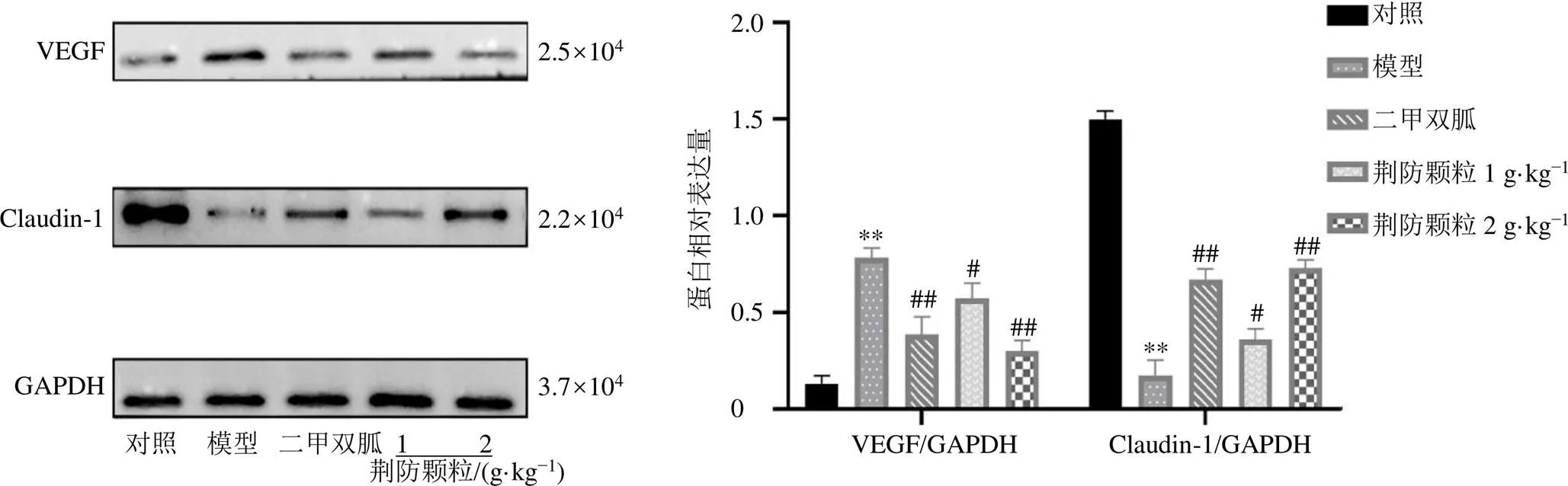
图7 荆防颗粒对db/db小鼠视网膜组织VEGF、Claudin-1蛋白表达的影响(, n = 15)

图8 荆防颗粒对db/db小鼠视网膜组织p-IRS1/IRS1、p-PI3K/PI3K、p-Akt/Akt蛋白表达的影响(, n = 15)
3.8 荆防颗粒对db/db小鼠视网膜组织Bax、Bcl-2、cleaved Caspase-3蛋白表达的影响
如图9所示,与对照组比较,模型组小鼠视网膜组织中Bax、cleaved Caspase-3蛋白表达水平显著升高(<0.01),Bcl-2蛋白表达水平显著降低(<0.01),Bcl-2/Bax值显著降低(<0.01);与模型组比较,各给药组小鼠视网膜组织中Bax、cleaved Caspase-3蛋白表达水平显著降低(<0.05、0.01),Bcl-2蛋白表达水平显著升高(<0.05、0.01),Bcl-2/ Bax值显著升高(<0.05、0.01)。
4 讨论
随着现代社会的快速发展,DR是一种常见和特殊的糖尿病微血管并发症,是导致患者视网膜出现慢性损伤,最终导致患者视力模糊,甚至失明的主要原因[24],因此糖尿病视网膜并发症已逐渐成为日益突出的社会健康问题,其病因复杂,患者由于体内长期的高糖反应,导致机体视网膜等多种器官出现炎症反应[25],因此开展糖尿病视网膜并发症的研究有着重大的意义[26-29]。
随着近几年的研究发展,DR已被认为是一种长期低炎症导致的微血管疾病,可导致糖尿病视网膜缺血、血管通透性增加、视网膜新生血管增生及糖尿病黄斑水肿等表现[30],其中细胞内发生炎症反应、氧化应激及细胞凋亡是导致DR发生及发展的主要元凶,炎症因子水平上调能够激活VEGF/ Claudin-1、IRS-1/PI3K/Akt、Caspase-3等通路,从而引起视网膜内新生血管增加,毛细血管通透性增加,进而发生BRB渗漏,最终导致患者失明[31],本研究通过db/db小鼠模型探讨荆防颗粒对小鼠DR的早期保护作用。

图9 荆防颗粒对db/db小鼠视网膜组织Bax、Bcl-2、cleaved Caspase-3蛋白表达的影响(, n = 15)
据报道,VEGF是最有效的促血管生长因子,在高血糖状态下可改变视网膜微环境,导致缺氧引起内皮细胞功能异常,从而上调VEGF的表达,VEGF上调可诱导视网膜内皮细胞通透性增加,下调内皮细胞间紧密连接蛋白Claudin-1的表达,进而导致视网膜新生血管生成[32]。Zhang等[33]研究发现通过抑制VEGF的表达,可阻止血管的生成,改善DR。也有文献报道IL-6可促进内皮细胞通透性增加,与VEGF等产生协同作用,最终导致新生血管形成及微导管闭塞,加快DR的进展[34]。TNF-α也可引起VEGF水平的提高,使视网膜通透性有所增加,同时诱发新生血管[34]。SOD是维护内皮细胞和血管功能的关键酶,也是主要的自由基清除剂,在胰岛β细胞内高度集中,维持β细胞在体内的平衡[35]。MDA是膜脂过氧化的一种重要产物,可以使视网膜细胞通透性和流通性改变,最终导致其结构的改变。有研究发现经中药治疗后糖尿病大鼠静脉血清SOD、MDA值均有显著性改变[36],本研究结果显示,模型组小鼠视网膜组织中IL-1β、IL-6、TNF-α、MDA含量升高,CAT、SOD活性下降,同时VEGF表达上调,Claudin-1表达下调,给予荆防颗粒处理可显著改善上述异常指标。
IRS-1/PI3K/Akt作为胰岛素抵抗的经典信号通路,是其调节血糖平衡的重要信号通路之一[37-38],IRS-1是胰岛素受体激活后发生级联反应的重要因子,也是参与胰岛素等重要细胞因子信号转导的磷酸化蛋白,参与调节胰岛素信号转导,同时也参与着细胞的生长代谢过程,当胰岛素受体底物被激活,会促进IRS-1蛋白磷酸化,促使下游PI3K/Akt信号通路被激活[39],活化的PI3K参与调节细胞增殖、分化、葡萄糖转运等多种功能,Akt作为PI3K信号通路的主要下游信号传导物,活化后在胰岛素传导通路中也扮演着重要的降血糖功能,并且激活的IRS-1/PI3K/Akt信号通路可以增加体内葡萄糖转运蛋白4向质膜的转移,促进糖原代谢,从而达到降血糖的目的[40],本研究结果显示,模型组小鼠视网膜组织中p-IRS1/IRS-1、p-PI3K/PI3K、p-Akt/Akt表达下调,给予荆防颗粒处理可显著上调其表达水平。
有文献表明,视网膜与视神经中含有大量的线粒体,为视觉信号传导和细胞内物质转运提供三磷酸腺苷(adenosine triphosphate,ATP)[41],细胞凋亡损伤视网膜细胞及血管功能,不可避免地引起DR的进展[42]。Caspase正常情况下以酶原形式位于细胞质中,并无活性,当收到凋亡信号的刺激后,可被激活,裂解为有酶解活性的异二聚体,并通过裂解特异底物和激活内源性核酸酶,进而引起细胞凋亡[43]。细胞色素C(cytochrome-C,Cyt-C)是线粒体呼吸链中传递电子的载体,是线粒体凋亡通路激活的标志[44]。在正常情况下,Cyt-C主要存在于线粒体内外膜之间的腔隙内,当线粒体损伤时,Cyt-C从线粒体膜间隙释放到细胞质中,与凋亡蛋白酶激活因子-1(apoptotic protease activating factor-1,Apaf-1)结合形成寡聚体复合物,进一步结合Caspase-9酶原形成凋亡体,Caspase-9活化后能激活下游Caspase-3,从而启动细胞凋亡[45]。本研究结果显示,模型组小鼠视网膜组织中Bax、cleaved Caspase-3表达上调、Bcl-2表达下调,给予荆防颗粒处理可显著下调Bax、cleaved Caspase-3的表达水平,上调Bcl-2的表达水平,由此推测,荆防颗粒可通过激活VEGF/Claudin-1、IRS1/PI3K/Akt、Caspase-3等信号通路,发挥视网膜的保护作用。
综上,荆防颗粒缓解DR的机制已初步明确,前期亦有文献表明,防风通圣散联合二甲双胍片可治疗腹型肥胖2型糖尿病[46],桂枝茯苓丸对于治疗DR也具有很好的疗效,可有效改善糖尿病大鼠眼底病变[47],同时,丹参川芎嗪注射液可用于治疗2型糖尿病血管病变的临床观察,并且能有效降低血糖、血脂、糖化血红蛋白及血液流变学等指标[48],由此推测荆防颗粒发挥抗DR药效的成分主要为防风、羌活、川芎、茯苓等,但其具体的作用靶点还需进一步深入研究,为DR的临床治疗提供更多的科学依据。
利益冲突 所有作者均声明不存在利益冲突
[1] Lv W Q, Graves D T, He L H,. Depletion of the diabetic gut microbiota resistance enhances stem cells therapy in type 1 diabetes mellitus [J]., 2020, 10(14): 6500-6516.
[2] 邓玲, 潘颖喆, 王慧. 糖尿病性视网膜病变的治疗进展 [J]. 国际眼科杂志, 2020, 20(3): 489-491.
[3] 陈雪珍, 吴慧华, 刘媛媛, 等. 糖尿病视网膜病变患病率的Meta分析 [J]. 中国公共卫生管理, 2020, 36(4): 460-465.
[4] Chai G R, Liu S, Yang H W,. Quercetin protects against diabetic retinopathy in rats by inducing heme oxygenase-1 expression [J]., 2021, 16(7): 1344-1350.
[5] 周跃, 周燕红. 白藜芦醇治疗糖尿病视网膜病变的研究进展 [J]. 重庆医学, 2020, 49(8): 1363-1366.
[6] 何媛, 周涛, 苏婷, 等. 糖尿病视网膜病变的分类、发生机制及治疗进展 [J]. 山东医药, 2020, 60(19): 111-115.
[7] 桑智慧, 李慧红, 周丽娟. 中药治疗糖尿病视网膜病变的疗效及机制研究进展 [J]. 中国药房, 2023, 34(12): 1532-1536.
[8] 薛君, 武学慧. 炎症在糖尿病视网膜病变中的研究进展 [J]. 中华老年多器官疾病杂志, 2022, 21(12): 953-956.
[9] 鞠晓妮. 探讨激光光凝术治疗糖尿病视网膜病变的疗效 [J]. 当代医学, 2021, 27(12): 159-160.
[10] 吴静, 范松涛. 激光治疗糖尿病视网膜病变的研究进展 [J]. 大连医科大学学报, 2022, 44(6): 556-560.
[11] 陈晶, 关晓海, 杨杉杉, 等. 青蒿琥酯对糖尿病大鼠视网膜MMP-9表达的影响[J]. 中草药, 2018, 49(5): 1106-1109.
[12] 刘淑萍. 桃红四物汤联合激光对糖尿病性黄斑水肿患者血脂及血清一氧化碳合酶、血管内皮生长因子、白细胞介素-6的影响[J]. 中国药物与临床, 2021, 21(24): 4046-4048.
[13] 高铭, 丁美灵, 雷紫琴, 等. 荆防败毒散及其中成药制剂研究进展[J]. 中药药理与临床, 2023, 39(5): 112-118.
[14] 曹天佑, 屈会化, 董利洋, 等. 荆防颗粒对马兜铃酸I致小鼠急性肾损伤的预防和保护作用研究[J]. 中草药, 2022, 53(18): 5742-5749.
[15] 张永康, 孙成宏, 王西双, 等. 基于网络药理学和实验验证探讨荆防颗粒对自身免疫性肝炎小鼠的治疗作用及作用机制[J]. 中草药, 2023, 54(5): 1461-1470.
[16] 尉雅洁, 刘明飞, 孙成宏, 等. 基于网络药理学和动物实验探究荆防颗粒对高尿酸血症的治疗作用及机制[J]. 中草药, 2023, 54(3): 808-816.
[17] Dantis Pereira de Campos T, da Cruz Rodrigues K C, Martins Pereira R,. Short-term combined exercise improves inflammatory profile in the retina of obese mice [J]., 2020, 21(17): 6099.
[18] Bamforth S D, Lightman S, Greenwood J. The effect of TNF-α and IL-6 on the permeability of the rat blood-retinal barrier[J]., 1996, 91(6): 624-632.
[19] Weigelt C M, Fuchs H, Schönberger T,. AAV-mediated expression of human VEGF, TNF-α, and IL-6 induces retinal pathology in mice [J]., 2021, 10(11): 15.
[20] 何东林, 贾明珍, 谭越月, 等. 房水IL-17、IL-23、TNF-α水平在糖尿病性视网膜病变诊断中的价值 [J]. 解放军医药杂志, 2021, 33(8): 62-65.
[21] 邹华, 游志鹏, 吴晓坚. 葛根素对糖尿病视网膜病变损伤的保护作用及机制研究进展 [J]. 国际眼科杂志, 2023, 23(8): 1295-1298.
[22] 王丽敏, 于静, 张林, 等. 小柴胡汤对CFA大鼠血清细胞因子TNF-α、IL-1β、IL-6、M-CSF作用的实验研究 [J]. 中华中医药学刊, 2020, 38(1): 15-19.
[23] 张博, 李凤君, 刘学政, 等. 芍药苷基于JAK2/STAT3信号通路抑制糖尿病大鼠视网膜细胞炎症的研究[J]. 中国中医眼科杂志, 2023, 33(4): 305-310.
[24] 代浩然, 王跃, 王旭, 等. 2型糖尿病及其微血管并发症动物模型生化指标特征分析[J]. 中国实验动物学报, 2023, 2(6): 1-9.
[25] Lepage P, Leclerc M C, Joossens M,. A metagenomic insight into our gut’s microbiome [J]., 2013, 62(1): 146-158.
[26] Horie M, Miura T, Hirakata S,. Comparative analysis of the intestinal flora in type 2 diabetes and nondiabetic mice [J]., 2017, 66(4): 405-416.
[27] Brunkwall L, Orho-Melander M. The gut microbiome as a target for prevention and treatment of hyperglycaemia in type 2 diabetes: From current human evidence to future possibilities [J]., 2017, 60(6): 943-951.
[28] Sonnenburg J L, Bäckhed F. Diet-microbiota interactions as moderators of human metabolism [J]., 2016, 535(7610): 56-64.
[29] Valdes A M, Walter J, Segal E,. Role of the gut microbiota in nutrition and health [J]., 2018, 361: k2179.
[30] 吴沂旎, 吴雪梅, 韩治华, 等. 复方血栓通胶囊联合前列地尔治疗糖尿病视网膜病变及其对血清活性多肽和SPARC表达的影响[J]. 药物评价研究, 2021, 44(3): 587-593.
[31] 刘梦伟, 鲍新颖, 王烁, 等. 中医药治疗糖尿病视网膜病变的研究进展 [J]. 中医临床研究, 2022, 14(36): 45-47.
[32] Yang Y, Liu Y, Li Y P,. microRNA-15b targets VEGF and inhibits angiogenesis in proliferative diabetic retinopathy [J]., 2020, 105(11): 3404-3415.
[33] Zhang D, Lv F L, Wang G H. Effects of HIF-1α on diabetic retinopathy angiogenesis and VEGF expression [J]., 2018, 22(16): 5071-5076.
[34] 鹿秋玉, 李才锐, 孙曙光. IL-6与糖尿病性视网膜病变的相关研究进展 [J]. 国际眼科杂志, 2015, 15(1): 52-54.
[35] 王伟, 李孝才. 糖尿病视网膜病变与超氧化物歧化酶活性值的关系 [J]. 武警医学, 2018, 29(8): 784-785.
[36] 董文, 颉瑞萍, 刘勤, 等. 益气养阴方对糖尿病视网膜病变患者中SOD和MDA表达的影响 [J]. 亚太传统医药, 2017, 13(20): 145-147.
[37] Huang X J, Liu G H, Guo J,. The PI3K/AKT pathway in obesity and type 2 diabetes [J]., 2018, 14(11): 1483-1496.
[38] Guo X, Sun W, Luo G B,.saponins alleviate skeletal muscle insulin resistance by regulating the IRS1-PI3K-AKT signaling pathway and GLUT4 expression [J]., 2019, 9(5): 1008-1019.
[39] Nandipati K C, Subramanian S, Agrawal D K. Protein kinases: Mechanisms and downstream targets in inflammation-mediated obesity and insulin resistance [J]., 2017, 426(1): 27-45.
[40] Wei F, Wang A X, Wang Q,. Plasma endothelial cells-derived extracellular vesicles promote wound healing in diabetes through YAP and the PI3K/Akt/mTOR pathway [J]., 2020, 12(12): 12002-12018.
[41] Kooragayala K, Gotoh N, Cogliati T,. Quantification of oxygen consumption in retinademonstrates limited reserve capacity of photoreceptor mitochondria [J]., 2015, 56(13): 8428-8436.
[42] Elshaer S, Lemtalsi T, El-Remessy A. High glucose-mediated tyrosine nitration of PI3-kinase: A molecular switch of survival and apoptosis in endothelial cells [J]., 2018, 7(4): 47.
[43] 白蔷薇, 李翠凡, 李梦媛, 等. 大黄素对肺炎链球菌诱导的肺泡II型上皮细胞凋亡和炎症的影响 [J]. 中国临床药理学杂志, 2022, 38(24): 2959-2963.
[44] Hu W L, Dong H Y, Li Y,. Bid-induced release of AIF/EndoG from mitochondria causes apoptosis of macrophages during infection with[J]., 2017, 7: 471.
[45] Yang N A, Li C, Li H L,. Emodin induced SREBP1-dependent and SREBP1-independent apoptosis in hepatocellular carcinoma cells [J]., 2019, 10: 709.
[46] 吴艳, 郑承红. 防风通圣散联合二甲双胍片治疗腹型肥胖2型糖尿病临床观察 [J]. 湖北中医杂志, 2011, 33(2): 23-24.
[47] 王映璇, 朱中贵. 桂枝茯苓丸治疗糖尿病视网膜病变效果观察 [J]. 中国医学创新, 2019, 16(6): 73-76.
[48] 吕雄, 杜育冰, 曹明满, 等. 丹参川芎嗪注射液治疗2型糖尿病血管病变的临床观察 [J]. 中国实用内科杂志, 2009, 29(S2): 221-224.
Protective effect of Jingfang Granules on retina of diabetic mice
LIU Dongguang1, 2, 3, ZHAO Wenxue1, 2, 3, XU Yan1, 2, 3, YAO Ru1, 2, 3, MENG Xue1, 2, 3, YAO Jingchun1, 2, 3, LIU Zhong1, 2, 3
1. New Drug Pharmacology Center of Lunan Pharmaceutical Group Co., Ltd., Linyi 276006, China 2. State Key Laboratory of Integration and Innovation of Classic Formula and Modern Chinese Medicine, Linyi 276006, China 3. Linyi Key Laboratory of Immunopharmacology and Toxicology of Natural Drugs, Linyi 276006, China
To investigate the regulation of Jingfang Granules (荆防颗粒) on blood glucose metabolism and protective effect of diabetic retinopaphy (DR) in db/db mice.A total of 60 male db/db mice were randomly divided into model group, metformin (120 mg/kg) group, Jingfang Granules (10, 20 mg/kg) groups, with 15 mice in each group, and 15 male db/m mice were selected as control group. The basic indexes such as body weight, fasting blood glucose, food intake and water intake of mice were detected weekly. After the experiment, oral glucose tolerance test (OGTT) was detected; The levels of interleukin-1β (IL-1β), IL-6, tumor necrosis factor-α (TNF-α), malondialdehyde (MDA) and the activities of catalase (CAT) and superoxide dismutase (SOD) in mouse retinal tissue were detected by ELISA; PAS staining was used to detect the pathological changes of retinal tissue; Western blotting was used to detect the protein expressions of vascular endothelial growth factor (VEGF), tight junction transmembrane protein (Claudin-1), insulin receptor substrate 1 (IRS1), phosphorylated IRS1 (p-IRS1), phosphatidylinositol 3-kinase (PI3K), phosphorylated PI3K (p-PI3K), protein kinase B (Akt), phosphorylated Akt (p-Akt), B-cell lymphoma-2 (Bcl-2), Bcl-2 associated X protein (Bax), and cleaved cystein-asparate protease-3 (cleaved Caspase-3) in retinal tissue.Compared with control group, fasting blood glucose, food intake and water intake of mice in model group were significantly increased (< 0.01), AUC in OGTT was significantly increased (< 0.01); The levels of IL-1β, IL-6, TNF-α, MDA in retinal tissue were increased (< 0.01). CAT and SOD activities were decreased (< 0.01); The number of peripheral cells in retinal tissue was decreased and the number of new blood vessels was increased (< 0.01), protein expressions of Claudin-1, p-IRS1/IRS1, p-PI3K/PI3K, p-Akt/Akt and Bcl-2 were down-regulated (< 0.01), VEGF, Bax and cleaved Caspase-3 protein expressions were up-regulated (< 0.01). Compared with model group, body weight of mice in Jingfang Granules group was significantly increased (< 0.05, 0.01), fasting blood glucose, food intake and water intake were decreased to varying degrees (< 0.05, 0.01); The levels of IL-1β, IL-6, TNF-α and MDA in retinal tissue were decreased (< 0.05, 0.01). CAT and SOD activities were increased (< 0.05, 0.01); The histopathologic morphology of retina was improved, and the protein expressions of Claudin-1, p-IRS1/IRS1, p-PI3K/PI3K, p-Akt/Akt, Bcl-2 in retinal tissue were up-regulated (< 0.05, 0.01), VEGF, Bax and cleaved Caspase-3 protein expressions were down-regulated (< 0.05, 0.01).Jingfang Granules can improve retinopathy in db/db mice to a certain extent, and its mechanism may be related to regulating the expressions of VEGF and Claudin-1 protein in retinal tissue of mice, thus activating the insulin receptor IRS-1/PI3K/Akt signaling pathway, initiating the Caspase cascade reaction, and inhibiting the apoptosis of retinal epithelial cells. Thus, it has a certain protective effect on retinopathy.
Jingfang Granules; diabetes; retina; oxidative stress; apoptosis; IRS-1/PI3K/Akt pathway
R285.5
A
0253 - 2670(2024)09 - 2996 - 10
10.7501/j.issn.0253-2670.2024.09.014
2023-11-04
山东省重大科技创新工程(2020CXGC010505,2021CXG010508)
刘冬光(1986—),男,硕士,中药新药研发与安全性评价。E-mail: 15866975281@163.com
赵文学(1994—),男,硕士,中药新药研发与安全性评价。E-mail: zwx940108@163.com
通信作者:徐 燕(1982—),女,硕士,中药新药研发与安全性评价。E-mail: xuyan119716@163.com
刘 忠(1975—),男,研究员,中药新药研发与安全性评价。E-mail: clevertree@163.com
[责任编辑 李亚楠]

