氧化芍药苷在正常与抑郁大鼠体内代谢产物的比较研究
金 朝,郑大华,何昊奇,于 猛,邹忠梅
氧化芍药苷在正常与抑郁大鼠体内代谢产物的比较研究
金 朝1,郑大华2,何昊奇2,于 猛2*,邹忠梅2*
1. 遵义医科大学药学院,贵州 遵义 563000 2. 中国医学科学院北京协和医学院药用植物研究所,北京 100193
研究氧化芍药苷在正常和抑郁大鼠血浆、尿液、粪便中代谢产物的差异,并推测其主要的代谢途径。选取Wistar大鼠,复制慢性应激抑郁大鼠,分别连续ig给予正常和抑郁大鼠氧化芍药苷水溶液3 d,收集大鼠血清、尿液和粪便;利用超高效液相色谱-四级杆飞行时间质谱(UPLC-Q-TOF/MS)技术结合UNIFI分析平台鉴定氧化芍药苷在正常和抑郁模型大鼠体内的原型成分及代谢产物。在正常和抑郁大鼠血浆中均检测到氧化芍药苷原型成分,且在抑郁大鼠血浆中的相对含量是正常大鼠血浆的10倍;在抑郁大鼠血浆、尿液和粪便中分别鉴定出4、13、2个代谢产物,在正常大鼠血浆、尿液和粪便中分别鉴定出1、12、3个代谢产物,其中11个共有代谢产物,主要发生的代谢途径为氧化、去饱和等I相代谢反应,甲基化、葡萄糖醛酸化、乙酰化等II相代谢反应。氧化芍药苷ig给药后主要以原型成分进入体内,且抑郁大鼠血浆中原型成分的相对含量较正常大鼠高10倍;在抑郁和正常大鼠中的代谢产物有差异,其中葡萄糖醛酸化为正常大鼠体内特有的代谢途径,乙酰化为抑郁大鼠体内特有的代谢途径。推测氧化芍药苷可能是以原型成分为主发挥药效作用,通过尿液和粪便以原型或代谢产物排泄。
氧化芍药苷;抗抑郁;代谢产物;代谢途径;芍药苷
抑郁症是一种慢性情绪障碍类疾病,其主要的临床表现为厌食、快感消失、注意力不集中等,具有高发病率和高自杀率等特点。现今全世界抑郁症患者约有3.5亿,患病率约为5%[1-2],严重威胁人类的生命健康。抑郁症的发病机制复杂,多种因素可导致抑郁症的发生和发展,治疗抑郁症的药物包括单胺类神经递质调节剂(如氟西汀)、5-羟色胺再摄取抑制剂(如舍曲林)等[3],但长期使用这些药物易产生耐药性,不良反应也很明显[4]。因此,目前市场上的抗抑郁症药物远远不能满足患者的需求。近年来,天然产物来源的小分子药物,因其疗效显著、不良反应小等优势,已成为药物开发的重要来源[5]。
氧化芍药苷是一种来源于芍药、牡丹等药用植物中的单萜类小分子化合物[6-8],研究发现氧化芍药苷具有明确的抗抑郁活性[9-10]。药物进入体内发挥药效的物质可能是其原型成分,也可能是其代谢产物,因此研究药物体内代谢过程对其药效成分的筛选具有重要意义[11]。采用单次口服给予正常小鼠氧化芍药苷,经HPLC-DAD-ESI-IT-TOF-MSn从小鼠血浆中鉴定到原型成分及其代谢产物[12]。但病理状态与正常动物的体内微环境不同,其对药物的代谢情况也存在差异[13-15]。因此,基于病理状态的动物模型考察药物代谢更能直观的反映药物进入体内的动态过程。
因此,本研究采用超高效液相色谱四级杆飞行时间质谱(UPLC-Q-TOF/MS)技术结合UNIFI软件研究氧化芍药苷在抑郁大鼠体内的代谢产物及其代谢途径,并与正常大鼠体内的代谢过程进行比较,以期为研究氧化芍药苷的体内作用机制提供科学依据。
1 仪器与材料
1.1 仪器
ACQUITY TM UPLC®超高效液相色谱串联SYNAPT G2 HDMS高分辨质谱联用系统(美国Waters公司);ET3301A型全自动氮吹浓缩仪(上海欧陆科仪有限公司);S0200-230V-EU型涡旋混合仪(美国Labnet公司);MassLynx TM工作站(美国Waters公司,Version 4.1);96孔正压提取装置(美国Waters公司)。
1.2 试剂及材料
质谱级甲醇、乙腈(美国Thermo Fisher公司);质谱级甲酸(美国Thermo Fisher公司);水为超纯水;戊巴比妥钠(中国医药公司上海化学试剂公司,批号65-06-24);氧化芍药苷(oxypaeoniflorin,批号201912,质量分数≥98%)由中国医学科学院药用植物研究所国家中药化合物库提供,其化学结构见图1。

图1 氧化芍药苷的化学结构
1.3 动物及给药
雄性Wistar大鼠,SPF级,体质量180~200 g,购于维通利华实验动物有限公司,所有大鼠在动物房中适应性饲养7 d,饲养条件:温度20~25 ℃,湿度(50±10)%,保持12 h照明与12 h黑暗交替循环,实验前8 h禁食,自由饮水。本研究涉及的动物实验已得到中国医学科学院药用植物研究所动物伦理委员会的批准(动物实验伦理审批文号SLXD-20220124015)。
2 方法
2.1 分组及给药
参照已发表文献中的动物分组及给药剂量[10,16-18],选取大鼠9只,随机分成空白对照组(=3)、正常给药组(=3)、抑郁模型给药组(=3);首先参照课题组前期报道的方法复制慢性不可预知应激(CUMS)抑郁大鼠模型[19];待造模成功后,选取正常和抑郁大鼠各3只,通过ig给予0.6 mg/mL(40 mg/kg)的氧化芍药苷溶液,每天1次,连续3 d;空白对照组大鼠给予同体积的蒸馏水。
2.2 生物样本的采集及处理
2.2.1 尿液和粪便 连续给药3 d后,通过代谢笼收集各组大鼠的尿液和粪便样本。粪便样本置于70 ℃烘箱烘干水分,转入研钵中碾碎。精密称取粪便样本粉末约0.8 g,置于25 mL具塞锥形瓶中,加入8 mL 50%甲醇溶液,超声辅助提取30 min,静置放冷,加50%甲醇溶液补足溶剂,摇匀,取出1 mL溶液,保持4 ℃、13 000 r/min离心15 min,取上清液,待测;取尿液样本1mL,保持4 ℃、13 000 r/min离心15 min,取上清,待测。
2.2.2 血浆 采集完尿液和粪便后,麻醉大鼠,通过大鼠腹主动脉取血,置于含有肝素钠的采血管中,静置1 h,保持4 ℃、3 500 r/min下离心15 min,取上清液,即得血浆样本。精密移取200 µL加入到Ostro 96孔板中,再加入3倍体积的乙腈溶液(含1%甲酸),然后采用正压仪器对样品进行前处理处理,收集滤液,并采用氮气挥干溶剂,再用100 μL 60%甲醇水溶液复溶,保持4 ℃下13 000 r/min离心10 min,取上清,待测。
2.3 色谱质谱条件
2.3.1 色谱条件 色谱柱为ACQUITY UPLC HSS T3(100 mm×2.1 mm,1.8 μm);流动相为0.1%甲酸水溶液(A)-0.1%甲酸乙腈(B);梯度洗脱程序为0~4 min,1%~4% B;4~6 min,4%~12% B;6~16 min,12%~23% B;16~18 min,23%~50% B;18~20 min,50%~99% B;体积流量为0.3 mL/min;检测波长为210~400 nm;进样量为5 µL;柱温为40 ℃。
2.3.2 质谱条件 采用Waters SYNAPT G2 HDMS系统,氮气作为质谱ESI(电喷雾离子化,Electrospray ionization)离子源的雾化锥孔气;电喷雾电离:负离子模式;毛细管电压:2.1 kV;锥孔电压:40 V;萃取锥孔电压:3 V;离子源温度:100 ℃;脱溶剂气温度:400 ℃;反向锥孔气流50 L/h;脱溶剂气体积流量600 L/h;碰撞气体积流量0.5 mL/min;扫描时间0.5 s;扫描时间间隔0.02 s;质荷比/50~1 200;数据采集形式:Continuum;灵敏性:Normal;动态范围:Extended;采用亮氨酸-脑啡肽进行精确质量校正(锁定质量数:负离子模式下/554.261 5)。
2.4 统计分析
采集各组大鼠血液、尿液、粪便样品的质谱数据,并采用MassLynx 4.1软件进行预处理,然后结合UNIFI软件进行分析。依次设定目标筛选设置、特定分析设置和氧化芍药苷可能的转化途径,包括I相代谢和II相代谢途径(表1),通过质谱碎片离子和精确质量数对相应的化合物进行滤过、筛选和鉴定,代谢产物准分子离子峰的预测值设定为小于1×10−5的质量偏差范围。

表1 体内代谢产物加合离子信息
3 结果
3.1 血浆、尿液和粪便样本的UPLC-Q-TOF/MS分析
按“2.2”项下样品处理方法,采用“2.3”项下UPLC-Q/TOF-MS分析条件,分析空白样品以及正常和抑郁组大鼠给与氧化芍药苷后血浆、尿液和粪便样品的质谱图(图2、3)。
3.2 氧化芍药苷在正常和抑郁大鼠体内代谢产物的鉴定
因氧化芍药苷在质谱负离子模式下的离子化响应较好,故本实验仅对其原型及代谢产物负离子的质谱数据进行分析。首先将采集到的负离子模式下血浆、尿液和粪便样本数据导入到UNIFI软件中,然后导入氧化芍药苷信息(C23H28O12,/495.150 3)作为母体化合物,参照表1中可能的加合离子,并与空白样品对比扣除干扰,根据碎片离子信息、准确度、理论碎片、响应度对代谢产物数据进行鉴定。结果从正常大鼠样品和抑郁大鼠样品中均鉴定到原型成分,同时还在正常大鼠血浆、尿液和粪便中分别鉴定出1、12、3个代谢产物(图4),在抑郁大鼠血浆、尿液和粪便中分别鉴定出4个、13个和2个代谢产物(图5),2组有11个相同的代谢产物,推测的代谢途径见图6、7,鉴定结果见表2。
3.2.1 氧化芍药苷原型成分的鉴定 在正常和抑郁大鼠血浆、尿液中均鉴定到氧化芍药苷原型成分(MA0),其在抑郁大鼠血浆中的相对含量(相对峰面积)是正常大鼠血浆的10倍(图8),但其在抑郁大鼠尿液中的相对含量要低于正常大鼠。MA0的准分子离子峰质荷比为/495.150 3(ESI−),分子式为C23H28O12,特征碎片离子/137是蒎烷结构与苯甲酸基团发生裂解所致,接着蒎烷骨架连接的葡萄糖残基发生断裂,产生特征碎片离子/165,通过与对照品比对,确定MA0为氧化芍药苷原型。
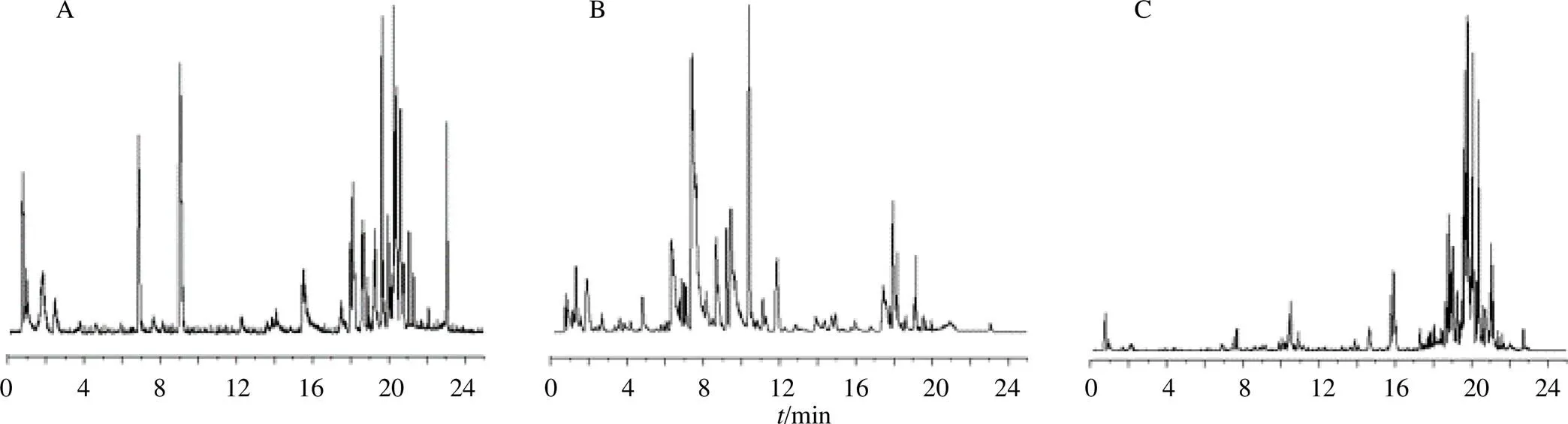
图2 空白血浆(A)、尿液(B)、粪便(C) 样本的质谱基峰离子(BPI) 图
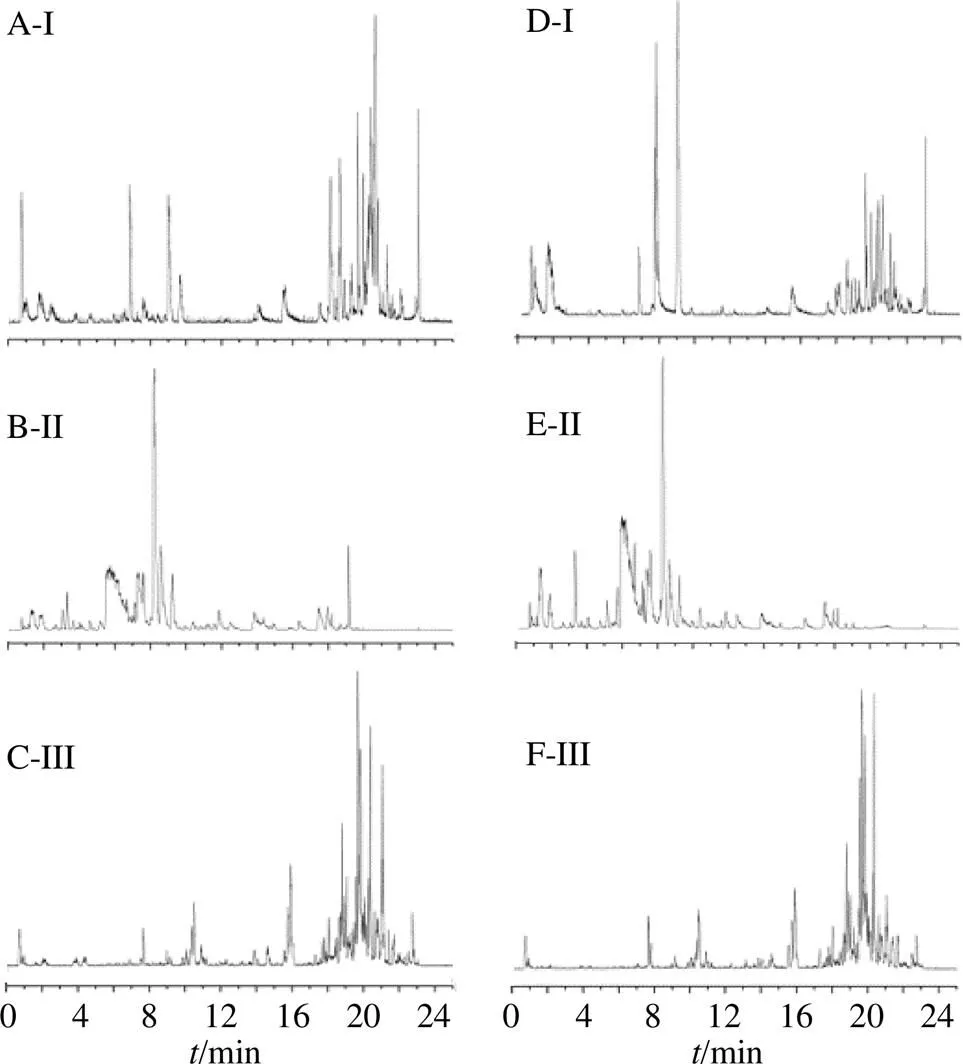
图3 正常大鼠 (A~C)和抑郁大鼠 (D~F) ig氧化芍药苷后血浆(I)、尿液(II) 和粪便 (III) 样本的质谱基峰离子图
3.2.2 氧化芍药苷在大鼠血浆中代谢产物的鉴定 在抑郁大鼠血浆中鉴定到4个代谢产物(MB10~MB12、MB16),在正常大鼠血浆中鉴定到1个(MA6)代谢产物,其中代谢产物MA6是相同的代谢产物。
MA6的准分子离子峰/671.183 7(ESI−),通过元素组成推测分子式为C29H36O18,比氧化芍药苷多17,在ESI-MS质谱图中,出现/495为氧化芍药苷的特征离子,因此,本实验推测MA6为氧化芍药苷葡糖醛酸化的II相代谢产物。MB10的准分子离子峰/179.055 6(ESI−),分子式为C6H12O6,比氧化芍药苷少316,初步推测代谢产物MB10是由氧化芍药苷发生葡萄糖负离子I相代谢反应产生的。MB11的准分子离子峰/407.099 7(ESI−),通过元素组成推测分子式为C18H18O8,依据ESI-MS质谱图产生的碎片离子/245,推测MB11是由氧化芍药苷丢失1分子葡萄糖后发生氧化去饱和及甲基化I相、II相结合代谢反应而产生的代谢产物。MB12的准分子离子峰/527.138 0(ESI−),通过元素组成推测其分子式为C23H28O14,较氧化芍药苷多32,初步推测氧化芍药苷发生了2×氧化代谢反应。MB16的准分子离子峰/523.145 7(ESI−),通过元素组成推测分子式为C24H28O13,参考ESI-MS产生的质谱碎片离子推测其可能为氧化芍药苷脱去1分子甲基后发生乙酰化反应产生的代谢产物。
3.2.3 氧化芍药苷在大鼠尿液中代谢产物的鉴定 在抑郁大鼠尿液中鉴定到13个代谢产物,在正常大鼠尿液中鉴定到12个代谢产物,其中9个代谢产物(MA1、MA2、MA4、MA6、MA8、MA10、MA11、MA14、MA15)为共有代谢产物。3个代谢产物(MA9、MA12、MA13)只在正常大鼠尿液中鉴定到,4个代谢产物(MB2、MB4、MB8、MB14)只在抑郁大鼠尿液中鉴定到,其中代谢产物MA1、MA12及MB14的鉴定结果如下。
MA1的准分子离子峰/716.222 3(ESI−),通过元素组成推测分子式为C26H43N3O18S,比氧化芍药苷多221,再依据ESI-MS质谱图中产生的特征碎片离子/385、122,因此,推测可能为氧化芍药苷脱去1分子C7H4O2,继而发生水合及谷胱甘肽I相、II相结合代谢反应而产生的代谢产物。MA12的准分子离子峰/391.122 6(ESI−),通过元素组成推测分子式为C16H24O11,据ESI-MS质谱图中碎片离子/350、292推测可能为氧化芍药苷脱去1分子C7H4O2后发生氧化反应而产生。MB14的准分子离子峰质荷比为/439.121 3(ESI−),比氧化芍药苷少56,参考质谱碎片离子/304、145,推测可能是氧化芍药苷丢失1分子葡萄糖后发生水合与乙酰化I相、II相结合代谢反应而产生的代谢产物。

图4 正常大鼠口服氧化芍药苷后的代谢产物在负离子模式下的提取离子色谱图
3.2.4 氧化芍药苷在大鼠粪便中代谢产物的鉴定 在抑郁大鼠粪便中鉴定到2个代谢产物(MA3、MA5),在正常大鼠粪便中鉴定到的3个代谢产物(MA3、MA5、MA7),其中MA3与MA5是二者共有的代谢产物。
MA3的准分子离子峰/377.088 2(ESI−),通过元素组成推测分子式为C18H18O9,比氧化芍药苷少118,质谱图产生特征碎片离子/165,推测其可能为氧化芍药苷丢失1分子葡萄糖,接着发生氧化、氧化去饱和、甲基化反应产生的代谢产物。
MA5的准分子离子峰/391.161 5(ESI−),通过元素组成推测分子式为C17H28O10,比氧化芍药苷少104,质谱图产生碎片离子/124,推测可能为氧化芍药苷先脱去1分子C7H4O3,接着发生水合及甲基化代谢反应而产生的代谢产物。
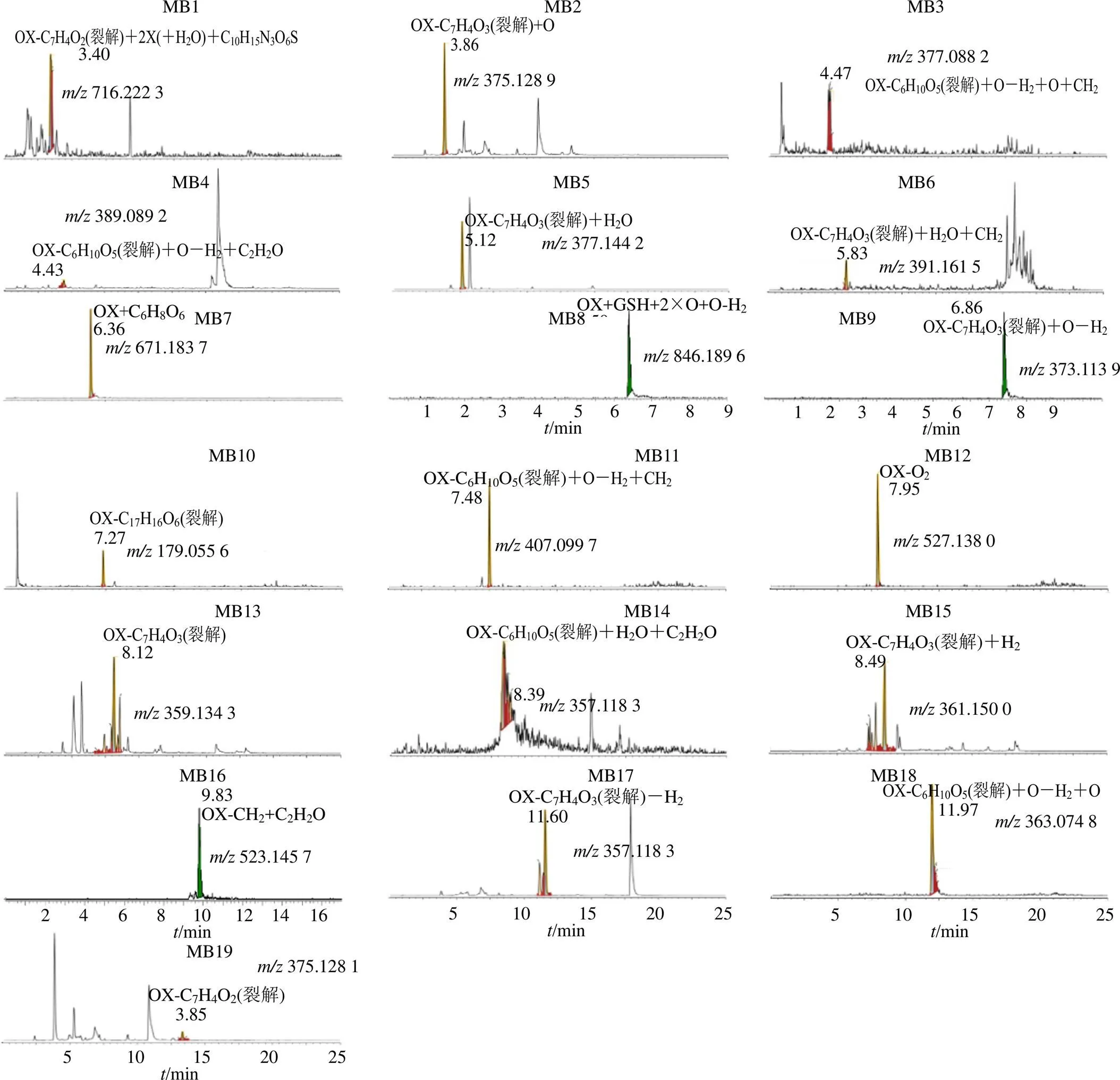
图5 抑郁大鼠口服氧化芍药苷的代谢产物在负离子模式下的提取离子色谱图
4 讨论
本研究基于UPLC-Q-TOF/MS技术结合UNIFI分析平台研究氧化芍药苷在正常和抑郁大鼠血浆、尿液和粪便中的原型成分及代谢产物,并推测可能的代谢途径。本研究发现正常和抑郁大鼠口服给药氧化芍药苷后体内代谢过程存在显著差异,特别是在血浆中的代谢。虽然在正常大鼠和抑郁大鼠的血浆中均能检测到氧化芍药苷的原型成分(MA0),但在抑郁大鼠血浆中MA0的相对含量较高,约为正常大鼠血浆中的10倍。另外,在正常大鼠血浆中仅检测到氧化芍药苷的1个葡萄糖醛酸化代谢产物(MA6),而在抑郁大鼠血浆中检测到氧化芍药苷的4个II相代谢产物(MB10~MB12、MB16)。因此,推测氧化芍药苷可能是以原型成分为主发挥药效作用,检测到血浆代谢产物的药效作用有待进一步确证。
本研究也尝试针对大鼠血浆、尿液和粪便样本的检测方法,主要包括色谱质谱方法进行了初步考察,结果发现血浆中的原型成分和葡萄糖醛酸化代谢产物(如MA0、MA6)同时也在尿液中检测到,考虑到相同代谢产物在色谱质谱检测中的保留行为一致,因此本研究采用相同的色谱质谱方法对正常和抑郁大鼠口服氧化芍药苷后的血浆、尿液和粪便中代谢产物进行检测。另外,虽然本研究推测氧化芍药苷进入体内后可能是以原型成分为主发挥药效作用,但其体内代谢产物对其药效同样具有贡献作用。本实验中氧化芍药苷的代谢产物鉴定仅根据其产生的碎片离子及药物体内代谢过程可能的加和离子信息进行推测,因此,后续实验有必要针对相对含量较高的代谢产物进行富集,分离制备,结构表征及活性确证。
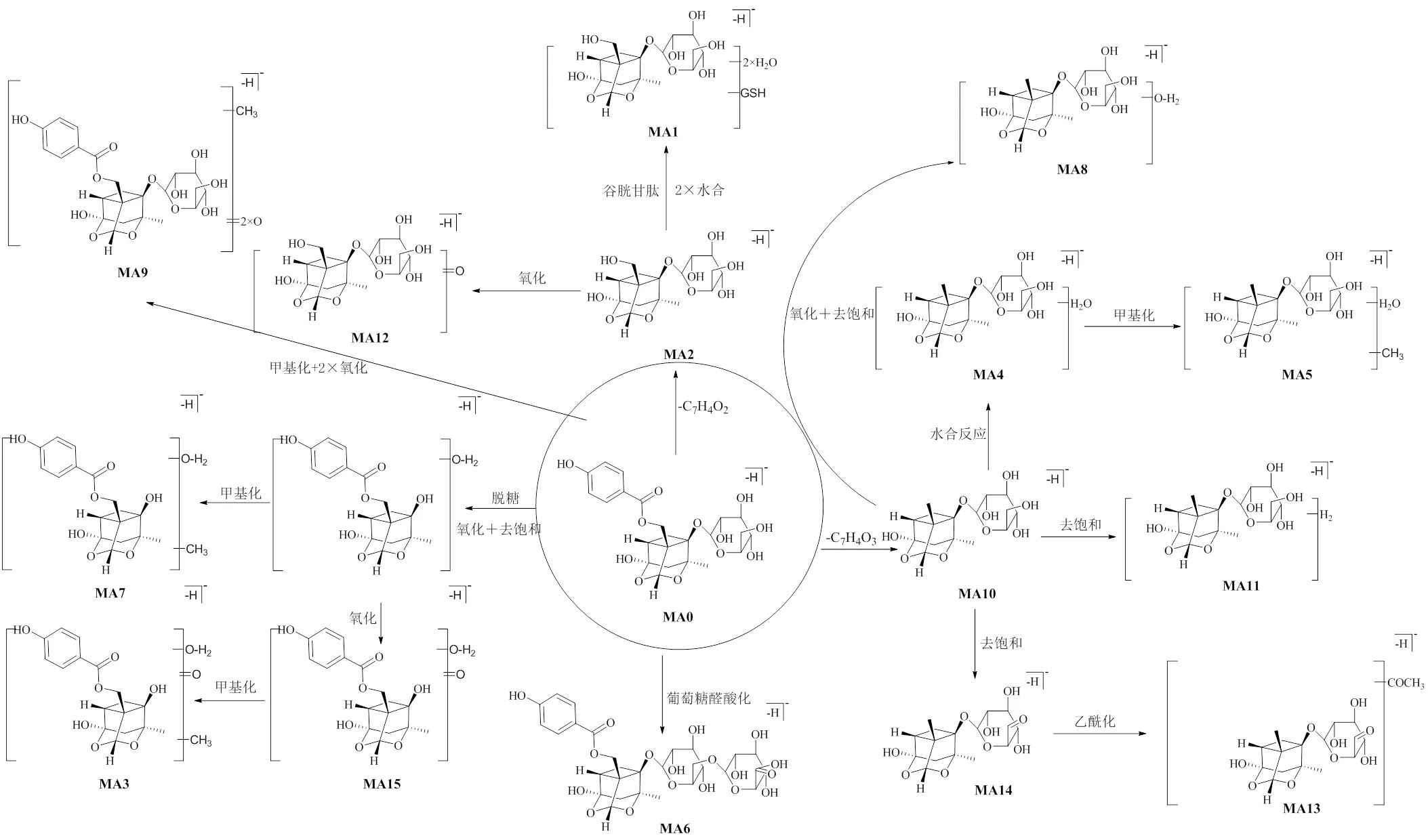
图6 正常大鼠口服氧化芍药苷 (MA0) 的代谢产物及代谢途径
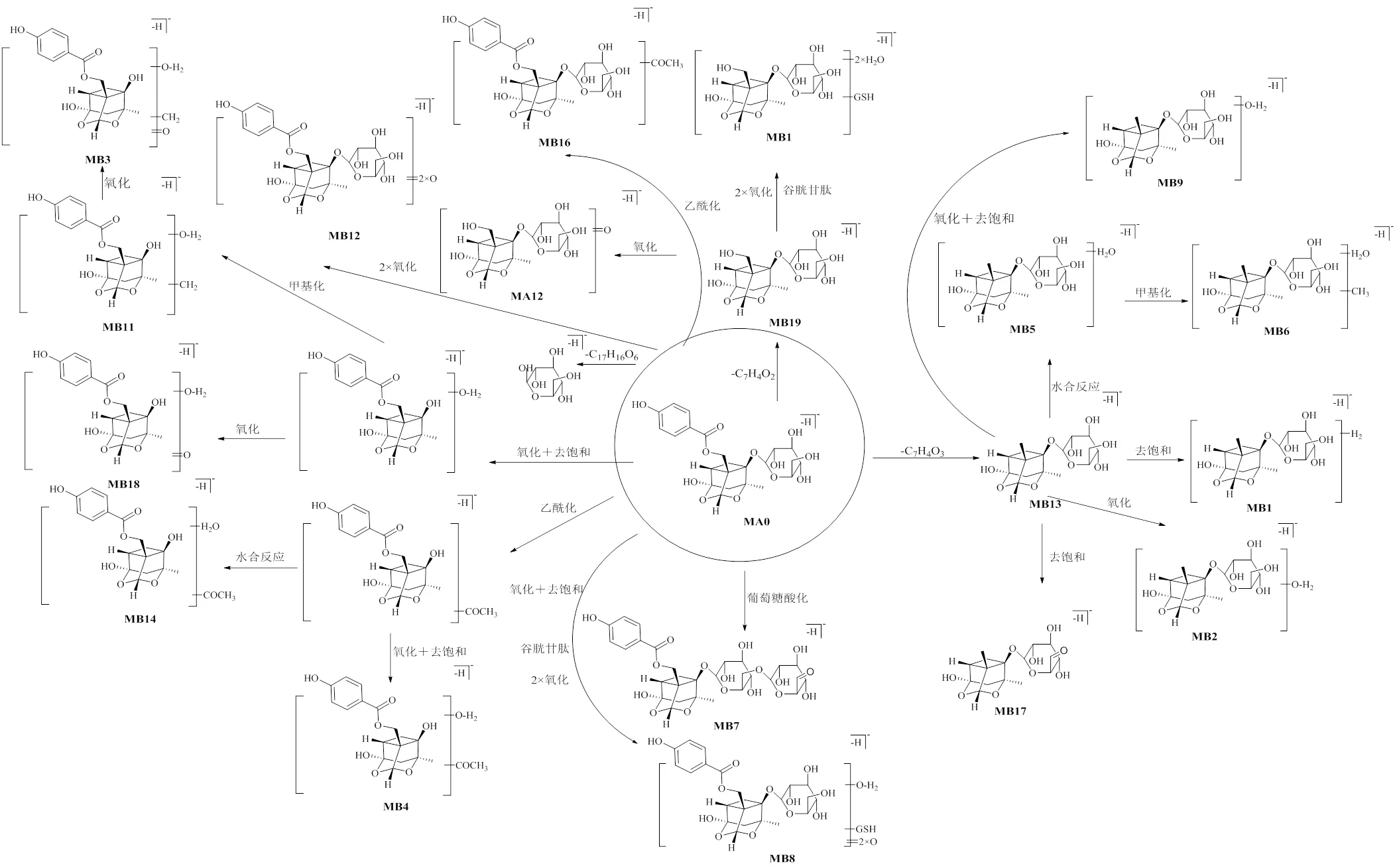
图7 抑郁大鼠口服氧化芍药苷(MA0) 的代谢产物及代谢途径
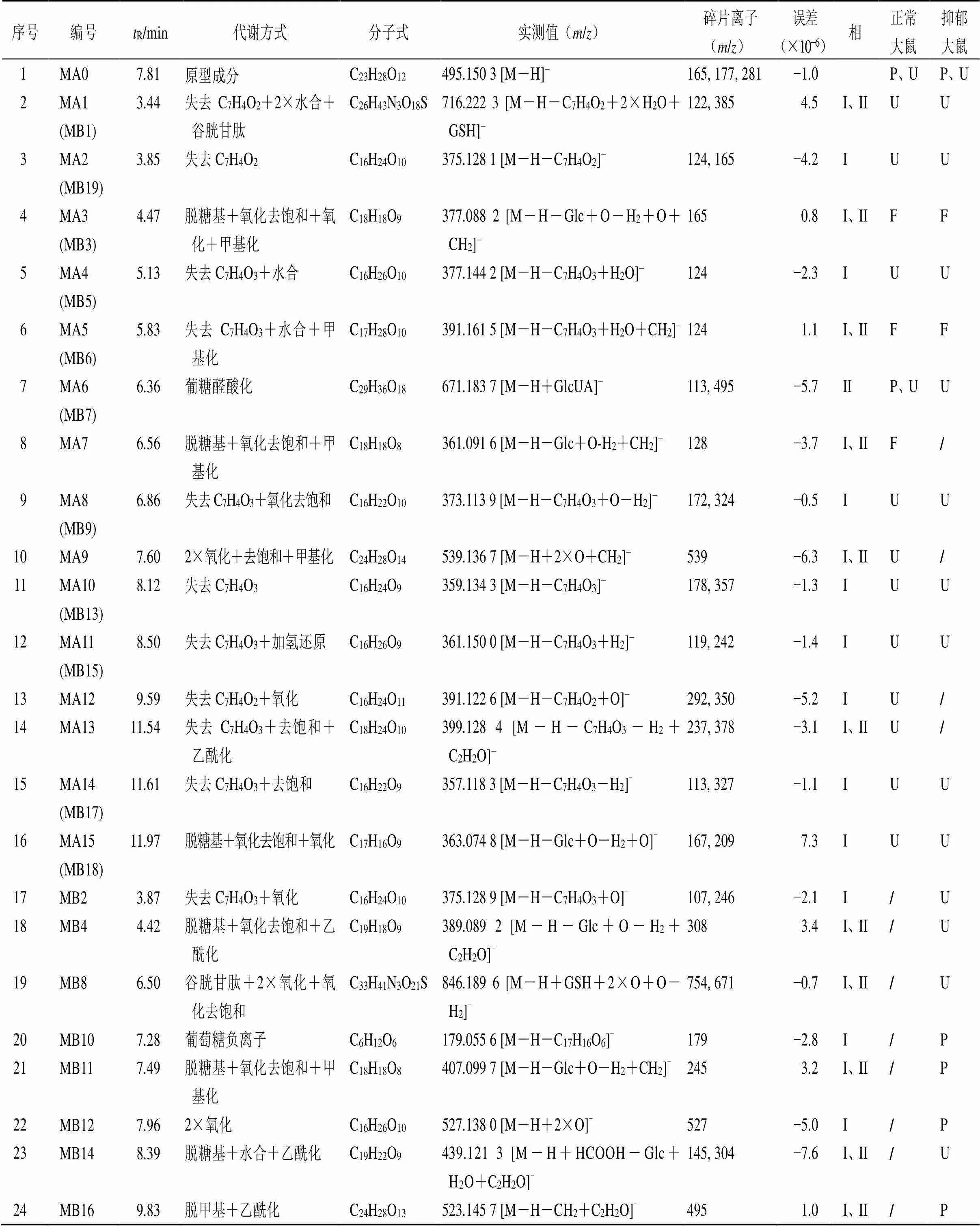
表2 氧化芍药苷在正常和抑郁大鼠体内的代谢产物鉴定结果
/为未检测到代谢产物,P:血浆,U:尿液,F:粪便。
/No metabolites were detected; P: plasma; U: urine; F: feces.

图8 氧化芍药苷(MA0) 在正常组与模型组的血浆与尿液中相对含量差异
利益冲突 所有作者均声明不存在利益冲突
[1] Yang B, Liu Z R, Wang Q,. Pharmacokinetic comparison of seven major bioactive components in normal and depression model rats after oral administration of Baihe Zhimu Decoction by liquid chromatography–tandem mass spectrometry [J]., 2018, 148: 119-127.
[2] 宋振光, 周小青, 颜冬梅, 等. 中药抗抑郁有效成分及其作用机制研究进展 [J]. 中国中药杂志, 2022, 47(5): 1184-1189.
[3] 张峰, 秦雪梅, 杜冠华, 等. 抗抑郁药物的体内代谢研究进展 [J]. 药学学报, 2017, 52(12): 1791-1800.
[4] Monteggia L M, Malenka R C, Deisseroth K. Depression: The best way forward [J]., 2014, 515(7526): 200-201.
[5] Atanasov A G, Waltenberger B, Pferschy-Wenzig E M,. Discovery and resupply of pharmacologically active plant-derived natural products: A review [J]., 2015, 33(8): 1582-1614.
[6] Tong N N, Zhou X Y, Peng L P,. A comprehensive study of three species ofstem and leaf phytochemicals, and their antioxidant activities [J]., 2021, 273: 113985.
[7] Yang S S, Zhang X Y, Dong Y Q,. Cleavage rules of mass spectrometry fragments and rapid identification of chemical components ofusing UHPLC-Q-TOF-MS [J]., 2021, 32(5): 836-849.
[8] 刘洁, 卢超, 冯若冰, 等. 一测多评法同时测定牡丹皮中7个成分含量 [J]. 中药材, 2023, 46(1): 150-155.
[9] 张雅婷, 蔡皓, 段煜, 等. 基于炮制与配伍探究四逆散在抑郁模型大鼠体内代谢成分的差异 [J]. 中草药, 2021, 52(23): 7244-7258.
[10] 段红允. 氧化芍药苷联合运动对抑郁症大鼠的抗抑郁作用及其机制 [J]. 分子植物育种, 2023, 21(18): 6178-6184.
[11] Chen Z K, Yan D Y, Zhang M,. MetNC: Predicting metabolitesfor natural compounds [J]., 2022, 10: 881975.
[12] Zhang J, Lv Y, Zhang J,. Metabolism ofand its 14 constituents in mice [J]., 2022, 13: 995641.
[13] Wu L Y, Xing L, Zou Y K,. UPLC-QTOF-MS based comparison of rotundic acid metabolic profiles in normal and NAFLD rats [J]., 2022, 13(1): 38.
[14] Yang L, Liang J, Zheng Q,. A comparative study of serum pharmacochemistry of Kai-Xin-San in normal and AD rats using UPLC-LTQ-orbitrap-MS [J]., 2022, 16(1): 30.
[15] Gan L, Ji J, Wang L,. Identification of the metabolites in normal and AA rat plasma, urine and feces after oral administration offlavonoids by LC-Q-TOF-MS spectrometry [J]., 2020, 177: 112856.
[16] Yu M, Kong X Y, Chen T T,.metabolism combined network pharmacology to identify anti-constipation constituents inMill [J]., 2024, 319(Pt 1): 117200.
[17] 任慧, 郭盛, 张祎盈, 等. 补肺活血胶囊大鼠体内代谢产物鉴定及代谢途径分析 [J]. 中草药, 2023, 54(4): 1051-1063.
[18] Fan G H, Zhu T Y, Wang R,. Oxypaeoniflorin prevents acute lung injury induced by lipopolysaccharide through the PTEN/AKT pathway in a Sirt1-dependent manner [J]., 2021, 2021: 6878026.
[19] 于猛, 贾红梅, 张宏武, 等. 柴胡疏肝散对抑郁模型大鼠粪便代谢物组和肠道菌群的调控作用 [J]. 国际药学研究杂志, 2020, 47(3): 229-235.
Comparative study on metabolites of oxypaeoniflorin in normal and depressed rats
JIN Zhao1, ZHENG Dahua2, HE Haoqi2, YU Meng2, ZOU Zhongmei2
1. School of Pharmacy, Zunyi Medical University, Zunyi 563000, China 2. Institute of Medicinal Plant Development, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100193, China
To compare the difference of oxypaeoniflorin metabolites in plasma, urine and feces between normal and depressed rats, and to deduce its main metabolic pathways.Wistar rats were selected to establish the model of chronic stress depression in this experiment, and oxypaeoniflorin aqueous solution was given to normal and depressed rats respectively by gavage for 3 d. The serum, urine and feces were collected and UPLC-Q-TOF/MS combined with UNIFI analysis platform was used to identify the prototype component and metabolites of oxypaeoniflorin in normal and depressed rats.The prototype component of oxypaeoniflorin were detected in plasma from both normal and depressed rats, and the relative content in plasma of depressed rats was ten times higher than that in normal rats; four, 13 and two metabolites were identified in plasma, urine and feces of depression rats, and one, 12 and three in normal rats, respectively. Among them, 11 metabolites were detected in both depressed mice and normal rats. The metabolic pathways of oxypaeoniflorin include oxidation and desaturation in phase I metabolic reactions or methylation, glucuronidation and acetylation in phase II metabolic reactions.Oxypaeoniflora enters the body mainly as a prototype after intragastric administration in rats, and the relative content of prototype components in plasma of depressed rats was ten times higher than that in normal rats. In addition, the metabolites of oxypaeoniflorin were different in depressed and normal rats, and glucuronidation metabolism occurred mainly in normal rats, whereas acetylation metabolism occurred mainly in depressed rats. Therefore, we speculated that the prototype of oxypaeoniflorin should be responsible for its therapeutic effect, which excreted as prototype or metabolite through urine and feces.
oxypaeoniflorin; anti-depression; metabolites; metabolic pathways; paeoniflorin
R284.1
A
0253 - 2670(2024)09 - 2887 - 09
10.7501/j.issn.0253-2670.2024.09.004
2024-01-12
国家自然科学基金资助项目(82073991);中国医学科学院医学与健康科技创新工程项目(2021-I2M-1-071)
金 朝(1998—),硕士研究生,研究方向为中药质量与控制。E-mail: jzz09032022@163.com
通信作者:邹忠梅,博士生导师,研究员,研究方向为中药药效物质基础。E-mail: zmzou@implad.ac.cn
于 猛,副研究员,研究方向为中药药效物质基础。E-mail: myu@implad.ac.cn
[责任编辑 王文倩]

