二仙汤抗骨质疏松有效组分的指纹图谱、多成分含量测定及其镇痛和调节骨代谢作用研究
刘 燕,刘玉玲,沈 燚,杜金蔓,赵琦明,叶欣园,张泉龙,秦路平,张巧艳
二仙汤抗骨质疏松有效组分的指纹图谱、多成分含量测定及其镇痛和调节骨代谢作用研究
刘 燕,刘玉玲,沈 燚,杜金蔓,赵琦明,叶欣园,张泉龙,秦路平*,张巧艳*
浙江中医药大学药学院,浙江 杭州 310053
建立二仙汤抗骨质疏松有效组分的指纹图谱及多成分含量测定方法,为基于二仙汤的抗骨质疏松组分中药的研制奠定基础。HPLC指纹图谱检测采用Agilent ZorBax Extend C18色谱柱(250 mm×4.6 mm,5 μm);流动相为乙腈- 0.1%磷酸水溶液(含0.025%十二烷基硫酸钠),梯度洗脱:0~30 min,4%~30%乙腈;30~50 min,30%~50%乙腈;50~60 min,50%~90%乙腈;体积流量1 mL/min;柱温25 ℃;检测波长270 nm。运用“中药色谱指纹图谱相似度评价系统”进行相似度评价;通过对照品比对,对共有峰进行指认。样品含量测定的梯度洗脱调整为0~25 min,10%~18%乙腈;25~35 min,18%~19%乙腈;35~40 min,19%~25%乙腈;40~50 min,25%~32%乙腈;50~60 min,32%~55%乙腈;并测定8种有效成分的含量。以小鼠醋酸扭体和成骨细胞和破骨细胞为模型评价二仙汤有效组分的镇痛和对骨代谢的调控作用。建立了二仙汤有效组分的HPLC指纹图谱,确定了16个共有峰,16批样品与对照指纹谱比较的相似度均在0.9以上。指认出其中8个共有峰(1、4、10~12、13、15、16号峰),分别为新芒果苷、芒果苷、阿魏酸、仙茅苷、朝藿定B、淫羊藿苷、盐酸巴马汀和盐酸小檗碱。含量测定的线性关系、重复性、稳定性、精密度及加样回收率考察符合要求。二仙汤抗骨质疏松有效组分在小鼠醋酸扭体模型上具有显著的镇痛作用,并可促进成骨细胞的形成和骨基质矿化,抑制破骨细胞的骨吸收。建立的二仙汤抗骨质疏松有效组分HPLC指纹图谱及多成分含量测定方法可准确、高效、全面的对其质量进行评价,为其质量控制提供依据。
二仙汤;骨质疏松;指纹图谱;多成分含量测定;高效液相色谱法;新芒果苷;芒果苷;阿魏酸;仙茅苷;朝藿定B;淫羊藿苷;盐酸巴马汀;盐酸小檗碱;镇痛;质量控制
中药方剂是中医临床用药的主要形式,是遵循中医药理论,将2味或2味以上的中药饮片配伍而成的,具有多成分、多靶点整合调节人体机能的作用特点,在多因素复杂性疾病的防治中显示出明显的优势[1]。然而,由于中药材化学成分复杂,方剂的药效物质和作用机制不清楚,影响中药疗效的稳定发挥和对中药方剂作用规律的认识,进而阻碍中药产品质量的提升和中医药现代化的进程。因此,阐明中药方剂发挥作用的有效成分和机制,制备有效组分,研究有效组分的质量控制,对于安全、有效、稳定、可控的新型中药的创制具有重要意义。
二仙汤是张伯讷教授创制的著名方剂,由淫羊藿、仙茅、知母、黄柏、巴戟天和当归组成,具有温肾阳、补肾精、泻肾火、调理冲任之功效,用于肾阴、肾阳不足而虚火上炎之更年期综合征、高血压、肾炎、肾盂肾炎,尿路感染及闭经等病症[2]。近年研究发现二仙汤具有调节免疫、抗氧化及雌激素样活性,常用于治疗更年期综合征、骨质疏松症和卵巢早衰等疾病[3-6]。前期研究发现二仙汤能够调控去卵巢骨质疏松大鼠的骨代谢,增加骨密度,改善骨组织微结构的退化,显示出良好的抗骨质疏松作用[7]。进一步以成骨细胞和破骨细胞为模型,筛选其抗骨质疏松的有效成分,发现二仙汤中淫羊藿黄酮、仙茅酚苷、知母黄酮和皂苷、黄柏生物碱、巴戟天蒽醌和环烯醚萜苷及当归阿魏酸均有显著的调节成骨细胞和破骨细胞功能的作用。为此,本实验富集制备了二仙汤抗骨质疏松的有效组分,明确了其在去卵巢骨质疏松大鼠的确切作用。本实验研究了二仙汤有效组分的指纹图谱及多成分的含量测定方法,观察其在醋酸扭体小鼠模型,体外成骨细胞和破骨的作用,为基于二仙汤的抗骨质疏松组分中药的研制提供科学的依据。
1 仪器、材料和动物
1.1 仪器
Agilent 1100型系列高效液相色谱仪,美国Agilent公司;Bio-Tex ELx 800型全自动定量绘图酶标仪,美国Fisher公司;SW-CJ-2FD型双人单面净化工作台,苏州净化有限公司;MCO-15AC型CO2恒温培养箱,日本Sanyo生物医学电器公司;CKX41型倒置相差显微镜,日本Olympus公司。
1.2 材料
对照品新芒果苷,批号130715,质量分数≥98%,购于北京北纳创联生物技术研究院;对照品芒果苷,批号MUST-13110201,质量分数≥98%,购于北京恒元启天化工技术研究院;对照品阿魏酸(批号0773-9910)、仙茅苷(批号110771-201105)、盐酸巴马汀(批号110732-200506),质量分数≥98%,均由中国食品药品鉴定研究院提供;对照品朝藿定B,批号110809,质量分数≥98%,由四川省维克奇生物科技有限公司提供;对照品淫羊藿苷,批号145760,质量分数≥98%,购于南京泽郎医药科技有限公司;对照品盐酸小檗碱,批号20130412,质量分数≥98%,购于大连美仑生物技术有限公司。
二仙汤处方6味中药饮片,购于上海雷允上药业有限公司,经浙江中医药大学药学院张巧艳教授鉴定分别为小檗科淫羊藿属植物淫羊藿Maxim.的干燥叶、石蒜科仙茅属植物仙茅Gaertn.的干燥根茎、百合科知母属植物知母Bge.的干燥根茎、芸香科黄檗属植物黄皮树Schneid.的干燥树皮、茜草科巴戟天属植物巴戟天How的干燥根和伞形科当归属植物当归(Oliv.) Diels的干燥根。结合资源考证优选药材产地,最终确定6味药材的产地如下:淫羊藿为甘肃陇南、仙茅为四川宜宾、知母为河北安国、黄柏为四川荥经、当归为甘肃岷县、巴戟天为广东肇庆。
制备指纹图谱研究的16批样品由3批药材制备而成,其中1~5批样品由第1批药材制备而成,6味药材的批号分别为淫羊藿20180501、仙茅20180502、知母20180503、黄柏20180504、当归20180505、巴戟天20180506;6~11批样品由第2批药材制备而成,6味药材的批号分别为淫羊藿20180601、仙茅20180602、知母20180603、黄柏20180604、当归20180605、巴戟天20180606;12~16批样品由第3批药材制备而成,6味药材的批号分别为淫羊藿20180701、仙茅20180702、知母20180703、黄柏20180704、当归20180705、巴戟天20180706。16批样品依次编号为S1~S16。
制备3批含量测定样品的药材批号分别为淫羊藿20200601、仙茅20200602、知母20200603、黄柏20200604、当归20200605、巴戟天20200606。所有药材参照《中国药典》2020年版进行鉴定,均符合要求。参考本课题组前期研究[8],制备二仙汤抗骨质疏松有效组分,用于指纹图谱和主要化学成分的含量测定研究。
UMR-106细胞和RAW264.7细胞购自美国ATCC细胞库;特级胎牛血清、DMEM培养基(Dulbecco’s modified Eagle’s medium)为美国Gibco公司产品;RANK-L、M-CSF、考马斯亮蓝G-250和地塞米松均购自美国Sigma公司;乙腈、甲醇,色谱纯,国药集团化学试剂有限公司;水,娃哈哈纯净水,杭州娃哈哈集团有限公司;牛血清白蛋白(bovine serum albumin,BSA)、β-甘油磷酸钠、抗坏血酸、甲醛、固蓝BB、硝酸银、硫代硫酸钠等其他试剂均为国产分析纯试剂。
1.3 动物
雌性ICR小鼠50只,购自浙江中医药大学实验动物中心,许可证号SCXK(浙)2020-0061,动物饲养于浙江中医药大学实验动物研究中心,室温(25±2)℃,相对湿度45%~50%,可自由进食饮水。本研究中所有实验动物的使用严格遵守浙江中医药大学伦理规定(批准号:IACUC-20200420-04)。
2 方法与结果
2.1 二仙汤抗骨质疏松有效组分的制备
6味中药按处方比例混匀,按每克药材加8 mL 50%乙醇提取3次,每次2 h,滤过,合并滤液,即为粗提液。提取液减压浓缩到相对密度为1.23 g/mL,滤过,滤液加蒸馏水稀释到相对密度为1.08 g/mL,即为待上柱纯化样品液。将样品液按1个树脂床体积倍数(BV)的上样量通入装有ZTC-1大孔树脂的色谱柱中,依次用水、50%乙醇和95%乙醇洗脱,收集50%乙醇洗脱部分,减压浓缩成相对密度为1.25 g/mL的浸膏,60 ℃干燥,粉碎,得棕黄色粉末,即为二仙汤抗骨质疏松有效组分。
2.2 二仙汤抗骨质疏松有效组分指纹图谱研究
2.2.1 色谱条件 Agilent ZorBax Extend C18色谱柱(250 mm×4.6 mm,5 μm);流动相为乙腈-0.1%磷酸水溶液(含0.025%十二烷基硫酸钠),梯度洗脱:0~30 min,4%~30%乙腈;30~50 min,30%~50%乙腈;50~60 min,50%~90%乙腈;进样量20 μL;体积流量1 mL/min;柱温25 ℃;检测波长270 nm。
2.2.2 对照品溶液的制备 精密称取新芒果苷16.20 mg、芒果苷10.00 mg、阿魏酸3.50 mg、仙茅苷1.60 mg、朝藿定B 1.25 mg、朝藿定C 3.00 mg、淫羊藿苷3.38 mg,盐酸小檗碱5.00 mg和盐酸巴马汀5.00 mg分别置于5 mL的量瓶中,新芒果苷、盐酸小檗碱和盐酸巴马汀分别用50%甲醇定容,其他均用甲醇定容至刻度,摇匀,分别配制成质量浓度为3.24 mg/mL的新芒果苷、2.00 mg/mL的芒果苷、0.70 mg/mL的阿魏酸、0.32 mg/mL的仙茅苷、0.25 mg/mL的朝藿定B、0.60 mg/mL的朝藿定C、0.675 mg/mL的淫羊藿苷、1.00 mg/mL的盐酸小檗碱和1.00 mg/mL的盐酸巴马汀储备液,经0.45mm微孔滤膜滤过,备用。
2.2.3 供试品溶液的制备 取二仙汤有效组分约50 mg,精密称定后置于5 mL量瓶中,加入4%乙腈-0.1%磷酸水溶液(含0.025%十二烷基硫酸钠)定容,超声溶解后微孔滤膜滤过,备用。
2.2.4 精密度试验 取同一份供试品溶液,连续进样6次,以对照品淫羊藿苷作为参照峰,计算16个主要色谱峰的相对保留时间和相对峰面积,结果16个主要色谱峰相对保留时间的RSD均小于1.0%,相对峰面积的RSD均小于5.0%,各色谱图的相似度值不低于0.99,表明仪器的精密度良好。
2.2.5 稳定性试验 取同一份供试品溶液,分别于0、2、4、8、12、24 h进行检测,以对照品淫羊藿苷作为参照峰,计算16个主要色谱峰的相对保留时间和相对峰面积,结果16个主要色谱峰相对保留时间的RSD均小于2.0%,相对峰面积的RSD均小于5.0%,各色谱图的相似度值不低于0.99,表明供试品溶液在24 h内稳定。
2.2.6 重复性试验 取同一批供试品,按“2.1.2”项下方法平行制备6份供试品溶液,进行检测,以对照品淫羊藿苷作为参照峰,计算16个主要色谱峰的相对保留时间和相对峰面积,结果16个主要色谱峰的相对保留时间的RSD均小于1.0%,相对峰面积的RSD均小于5.0%,各色谱图的相似度值不低于0.99,表明方法的重复性良好。
2.2.7 指纹图谱的建立、共有峰标记及其归属 利用“中药色谱指纹图谱相似度评价软件(2012版)”以S1为参照图谱,采用平均数法,时间窗宽度0.1 min,经多点校正,生成二仙汤抗骨质疏松有效组分色谱叠加图及共有模式对照指纹图谱(图1)。分析得到16批供试品的色谱峰,按照色谱峰的保留时间从小到大,选取16个峰面积较大的为共有峰。

图1 16批二仙汤抗骨质疏松有效组分的HPLC指纹图谱叠加图及其对照指纹图谱(R)
通过加入对照品,观察对应峰面积的变化,指认出8个色谱峰,结合各药材化学成分研究的文献资料[9],确定1号峰为新芒果苷,4号峰为芒果苷,1、4号峰归属于知母药材;10号峰为阿魏酸,归属于当归药材;11号峰为仙茅苷,归属于仙茅药材;12号峰为朝藿定B,13号峰为淫羊藿苷,12、13号峰归属于淫羊藿药材;15号峰为盐酸巴马汀,16号峰为盐酸小檗碱,15、16号峰归属于黄柏药材。
2.2.8 相似度评价 将16批二仙汤抗骨质疏松有效组分按“2.2.3”项下方法制备供试品溶液,以“2.2.1”项下色谱条件对样品进行检测,并用中药指纹图谱相似度评价系统2012版软件分别对16批样品的指纹图谱进行数据处理,生成对照指纹图谱,16批二仙汤抗骨质疏松有效组分与对照指纹图谱比较的相似度分别为0.979、0.962、0.968、0.970、0.971、0.986、0.981、0.987、0.986、0.986、0.974、0.971、0.928、0.918、0.971、0.962,从上述结果可以看出,各批次二仙汤抗骨质疏松有效组分间化学成分的差异较小。
2.3 二仙汤抗骨质疏松有效组分的含量测定
2.3.1 色谱条件 色谱柱为Agilent ZorBax Extend C18柱(250 mm×4.6 mm,5 μm);流动相为乙腈-0.1%磷酸水(含有0.025%十二烷基硫酸钠),梯度洗脱:0~25 min,10%~18%乙腈;25~35 min,18%~19%乙腈;35~40 min,19%~25%乙腈;40~50 min,25%~32%乙腈;50~60 min,32%~55%乙腈;进样量20 μL,体积流量1 mL/min;柱温25 ℃;检测波长270 nm。混合对照品和样品的色谱图见图2。
2.3.2 线性关系考察 精密量取“2.1.2”项下的各对照品溶液适量于5 mL量瓶中,加入初始流动相定容得混合对照品溶液(新芒果苷162.0 μg/mL,芒果苷200.0 μg/mL,阿魏酸35.0 μg/mL,仙茅苷64.0 μg/mL,朝藿定B 50.0 μg/mL,淫羊藿苷135.0 μg/mL,盐酸巴马汀20.0 μg/mL,盐酸小檗碱20.0 μg/mL),等比例稀释成6个质量浓度梯度。分别精密吸取上述对照品溶液,按“2.3.1”项下色谱条件进样分析,记录色谱峰面积。以峰面积为纵坐标(),质量浓度为横坐标(),绘制标准曲线,进行线性回归,得回归方程新芒果苷=9.074 8-21.982,2=0.999 4,线性范围5.1~162.0 μg/mL;芒果苷=11.109-41.696,2=0.999 6,线性范围6.3~200.0 μg/mL;阿魏酸=29.101+9.421 4,2=0.999 4,线性范围1.1~35.0 μg/mL;仙茅苷=12.065+1.485 1,2=0.999 8,线性范围2.0~64.0 μg/mL;朝藿定B=25.743+8.830 3,2=0.999 8,线性范围1.6~50.0 μg/mL;淫羊藿苷=24.081-8.375 8,2=0.999 6,线性范围4.2~135.0 μg/mL;盐酸巴马汀=72.459-23.380,2=0.998 6,线性范围0.6~20.0 μg/mL;盐酸小檗碱=63.802-8.101 5,2=0.999 2,线性范围0.6~20.0 μg/mL。

1-新芒果苷;2-芒果苷;3-阿魏酸;4-仙茅苷;5-朝藿定B;6-淫羊藿苷;7-盐酸巴马汀;8-盐酸小檗碱。
2.3.3 检测限和定量限实验 精密吸取对照品溶液,采用倍比稀释的方法,检测限按照信噪比(/)大于3,定量限按照/大于10的要求检测。新芒果苷、芒果苷、阿魏酸、仙茅苷、朝藿定B、淫羊藿苷、盐酸巴马汀、盐酸小檗碱的检测限分别为0.96、0.87、0.23、0.56、0.35、0.48、0.23、0.20 μg/mL,定量限分别为2.60、3.12、0.86、1.60、1.20、1.42、0.56、0.53 μg/mL。
2.3.4 精密度试验 精密量取已知浓度的混合对照品溶液。按“2.3.1”项色谱条件测定,同一天连续进样6针测定日内精密度,每天进样1针,连续进样6 d,测定日间精密度,所得样品峰面积RSD<3%,表明日内精密度和日间精密度符合要求。
2.3.5 稳定性试验 取二仙汤抗骨质疏松有效组分,分别在0、2、4、8、12 h进样测定,计算新芒果苷、芒果苷、阿魏酸、仙茅苷、朝藿定B、淫羊藿苷、盐酸巴马汀、盐酸小檗碱的峰面积RSD分别为2.78%、0.75%、2.91%、2.78%、1.04%、0.90%、3.90%、3.75%,表明在12 h内样品溶液中上述各化合物较为稳定。
2.3.6 重复性试验 取二仙汤抗骨质疏松有效组分,分别配制6份供试品溶液,按“2.3.1”项下方法进样,记录各对照品峰面积,计算新芒果苷、芒果苷、阿魏酸、仙茅苷、朝藿定B、淫羊藿苷、盐酸巴马汀、盐酸小檗碱质量分数的RSD分别为1.25%、4.08%、0.88%、3.57%、1.71%、2.78%、2.08%、1.96%,表明本测定方法重复性良好。
2.3.7 加样回收率试验 分别称取6份等量的已知含量的二仙汤抗骨质疏松有效组分,加入不同量的对照品,按样品制备方法操作制备供试品,按“2.3.1”项下色谱条件,测定8种指标成分的含量,计算新芒果苷、芒果苷、阿魏酸、仙茅苷、朝藿定B、淫羊藿苷、盐酸巴马汀、盐酸小檗碱的平均加样回收率分别为102.2%、98.9%、99.4%、100.8%、100.0%、99.4%、101.2%、98.1%,RSD分别为2.37%、1.33%、2.84%、1.64%、1.89%、3.27%、2.10%、2.54%,表明本法回收率良好,符合要求。
2.3.8 含量测定 取各供试品溶液,按“2.3.1”项下色谱条件进样分析,每份样品平行测3份,记录色谱峰面积,计算二仙汤抗骨质疏松有效组分中各成分的含量,结果见表1、2。从表1可以看出,3批二仙汤抗骨质疏松有效组分中新芒果苷的平均质量分数为8.29%,芒果苷的平均质量分数为3.63%,阿魏酸的平均质量分数为0.32%,仙茅苷的平均质量分数为0.84%,朝藿定B的平均质量分数为3.91%,淫羊藿苷的平均质量分数为3.64%,盐酸巴马汀的平均质量分数为1.94%,盐酸小檗碱的平均质量分数为2.85%。表2为室温放置24个月的样品,16批样品中二仙汤抗骨质疏松有效组分中主要有效成分的含量都有不同程度的降低,以黄柏小檗碱类成分的含量降低的最为明显。

表1 3批二仙汤抗骨质疏松有效组分中主要成分的含量测定结果
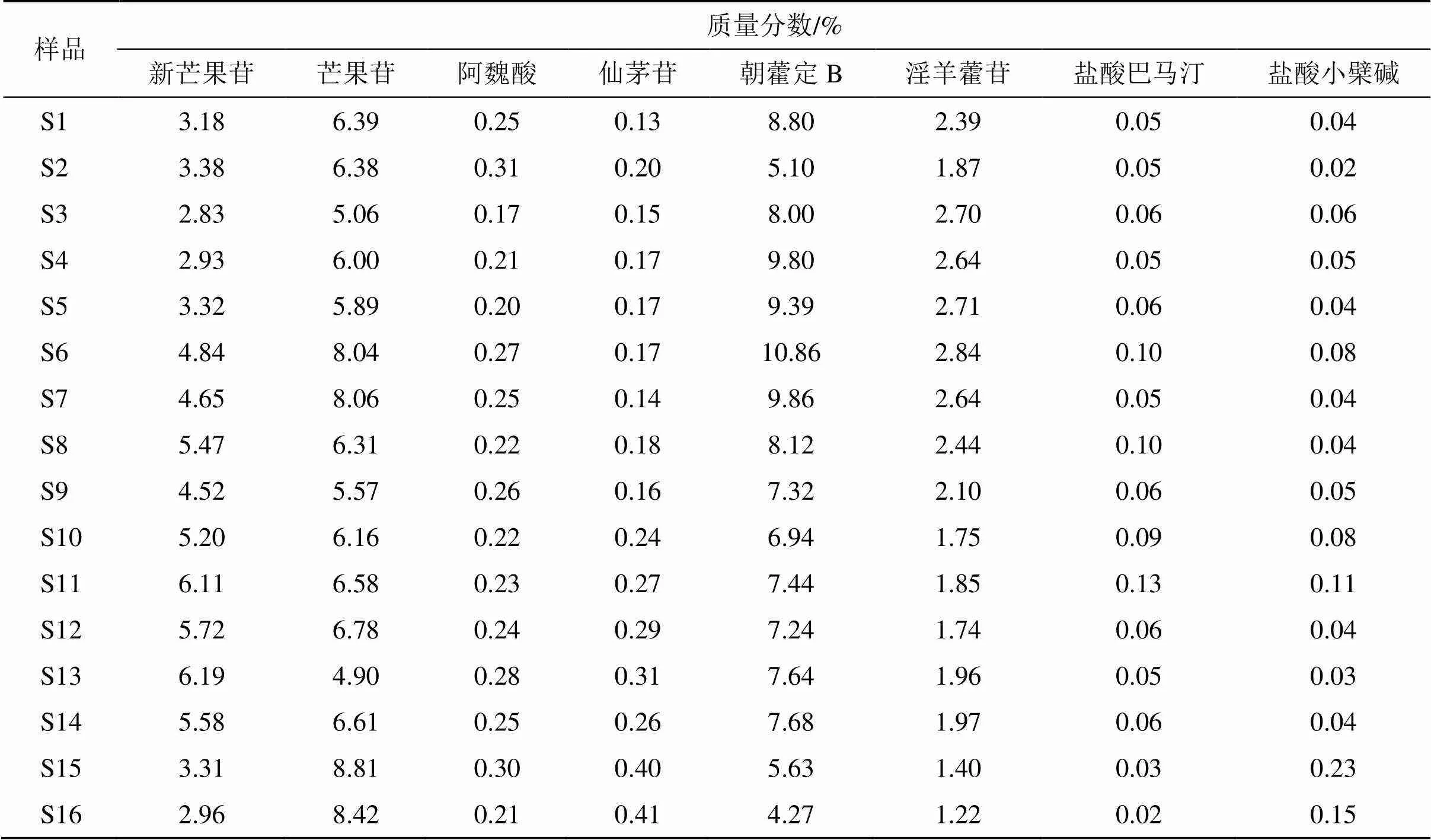
表2 16批二仙汤抗骨质疏松有效组分放置24月后主要成分的含量测定结果
2.4 二仙汤抗骨质疏松有效组分的镇痛作用

抑制率=(对照组小鼠扭体数-给药组小鼠扭体数)/对照组小鼠扭体数
结果如表3所示,消炎痛组小鼠扭体次数比对照组小鼠显著降低(<0.01),抑制率为68.5%。二仙汤抗骨质疏松有效组分低、中、高剂量组小鼠扭体次数均比正常对照组减少,抑制率分别为17.1%、26.9%和35.4%,中、高剂量组小鼠扭体次数与对照组比较有显著性差异(<0.05、0.01),表明二仙汤抗骨质疏松有效组分具有较好的镇痛作用。
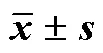
表3 二仙汤抗骨质疏松有效组分对小鼠的镇痛作用(, n = 10)
与对照组比较:*<0.05**<0.01。
*< 0.05**< 0.01control group.
2.5 二仙汤抗骨质疏松有效组分对成骨细胞的作用
将UMR-106成骨细胞用含l0%胎牛血清的DMEM培养基配制成浓度为3×104/mL的细胞悬液,以每孔100 μL的体积接种于96孔培养板中,于37 ℃、5% CO2培养箱中培养24 h后给药,阴性对照组只加含10%血清的DMEM培养基,其余各组分别加入含二仙汤提取物5、10、20 µg/mL的培养基,继续培养48 h和72 h,MTT法检测成骨细胞的增殖。按照上述方案处理成骨细胞,培养至6 d时,按照试剂盒说明书检测碱性磷酸酶(alkaline phosphatase,ALP)的活性,以每孔中每mg蛋白释放的对硝基苯酚的nmol数表示ALP的活性。
UMR-106成骨细胞按每孔1×105的细胞数接种于24孔板内,用含10%胎牛血清的DMEM培养基培养24 h,换含0.1% BSA的新鲜DMEM使细胞适应,12 h后换终浓度为1.0 nmol/L的含药骨结节诱导培养基(0.1%白蛋白,10.0 nmol/L地塞米松,0.01 mol/L β-甘油磷酸钠和50 μg/mL抗坏血酸以及10%胎牛血清的DMEM培养基),其中二仙汤抗骨质疏松有效组分的质量浓度分别为5、10、20 µg/mL,每3天换液1次,连续培养观察14 d后进行骨结节染色。倒置相差显微镜200倍下观察并计数每孔内20个随机视野内骨结节的数量,以红色结节和边界清晰为准,取平均值,结果以骨结节数目/孔表示[10]。骨形成受2个不同的过程调控,即新的成骨细胞的形成和成骨细胞产生骨基质的活性。碱性磷酸酶是骨重建过程中的关键酶,能够促进骨基质的矿化[11-12]。如表4所示,二仙汤抗骨质疏松有效组分在5、10、20 μg/mL的质量浓度下作用48 h和72 h,显著促进UMR-106成骨细胞的增殖;作用6 d后,显著增加成骨细胞碱性磷酸酶活性;作用12 d后,显著增加成骨细胞骨钙结节的形成,这些结果表明二仙汤抗骨质疏松有效组分通过增加成骨细胞的数目、成骨细胞的活性和促进骨基质的矿化增加骨质的形成。
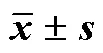
表4 二仙汤抗骨质疏松有效组分对成骨细胞增殖、碱性磷酸酶活性和骨钙结节形成的影响(, n = 8)
与对照组比较:*<0.05**<0.01。
*< 0.05**< 0.01control group.
2.6 二仙汤抗骨质疏松有效组分对破骨细胞的作用
将RAW264.7细胞培养在含25 ng/mL的核刺激因子-κB受体配体(receptor activator for nuclear factor kappa B ligand,RANKL)和30 ng/mL的巨噬细胞集落刺激因子(macrophage-stimulating factor,MCSF)的DMEM培养基中72 h,即分化为多核的抗酒石酸酸性磷酸酶(tartrateresistant acid phosphatase,TRAP)染色阳性的破骨细胞。将1×105/mL RAW264.7细胞悬浮于含25 ng/mL RANKL和30 ng/mL MCSF的DMEM培养基中,接种于96孔板内,每孔100 µL,于37 ℃、5% CO2培养箱中培养72 h,换含质量浓度为5、10、20 µg/mL的二仙汤提取物的培养基,继续培养48 h和72 h,进行破骨细胞增殖测定,以评价二仙汤抗骨质疏松有效组分对破骨细胞是否有细胞毒作用。

破骨细胞抗酒石酸酸性磷酸酶的活性与破骨细胞的骨吸收活性直接相关[13]。如表5所示,二仙汤抗骨质疏松有效组分的质量浓度在5~20 μg/mL内抑制破骨细胞抗酒石酸酸性磷酸酶的活性,在10、20 μg/mL的质量浓度下作用72 h时,抑制率分别达到30.9%和47.4%。
RAW264.7细胞在RANKL和MCSF的诱导下分化为破骨细胞,成熟破骨细胞吸收骨基质,在骨片上形成吸收陷窝。用5、10、20 μg/mL的二仙汤抗骨质疏松有效组分处理破骨细胞12 d,与对照组相比,骨片表面形成的骨吸收陷窝的面积分别减少21.4%、24.8%和36.9%。这些结果表明二仙汤抗骨质疏松有效组分在5、10、20 μg/mL的质量浓度下,剂量相关性降低破骨细胞的骨吸收作用。
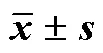
表5 二仙汤抗骨质疏松有效组分对由RAW264.7细胞诱导的破骨细胞抗酒石酸酸性磷酸酶活性和骨吸收陷窝面积的影响(, n = 8)
与对照组比较:*<0.05**<0.01。
*< 0.05**< 0.01control group.
3 讨论
二仙汤是临床治疗妇女更年期综合征和骨质疏松症的常用方剂[14-16]。本实验在前期对其抗骨质疏松有效成分和有效组分研究的基础上,研究了二仙汤抗骨质疏松有效组分的化学指纹图谱和主要有效成分的含量测定方法,并进一步明确了其镇痛和对成骨细胞和破骨细胞功能的调控作用,为二仙汤方剂的质量控制及将其研制成抗骨质疏松的创新药物奠定了基础。本研究建立了二仙汤抗骨质疏松有效组分的指纹图谱,对流动相(甲醇-水、甲醇-0.1%磷酸水溶液、乙腈-水、乙腈-0.1%磷酸水溶液)进行考察,发现乙腈-0.1%磷酸水溶液洗脱能力较好,色谱分离较好;采用紫外-可见分光光度计在200~400 nm波长下对二仙汤抗骨质疏松有效组分样品进行扫描,270 nm波长下出峰数量较多且峰形良好;对柱温进行了考察,发现柱温在23~25 ℃时分离度良好;对体积流量、不同酸浓度等耐用性进行了考察,体积流量在0.8~1.2 mL/min,酸浓度在0.8%~1.2%对色谱峰无明显影响,最后优选甲醇-0.1%磷酸水溶液为流动相梯度洗脱,柱温25 ℃,体积流量1 mL/min,波长270 nm的色谱条件。
中药指纹图谱技术是目前公认的天然药物质量控制的有效方式之一,突破以单一指标或几个化学成分评价药品质量的局限,可以较为全面的反映中药所含化学成分的种类和数量[17-19]。骨质疏松症是由于参与骨重建的成骨细胞的骨形成和破骨细胞骨吸收的平衡被破坏,使得骨吸收大于骨形成,导致骨丢失和骨质疏松症的发生[20-21]。
二仙汤由淫羊藿、仙茅、知母、黄柏、当归和巴戟天6味中药组成[22]。淫羊藿黄酮、仙茅酚苷、知母黄酮和皂苷、黄柏小檗碱和当归有机酸、巴戟天蒽醌和环烯醚萜苷为其相应药材的活性成分,也有研究表明上述化学成分对成骨细胞和破骨细胞的功能均有显著的调控作用,为二仙汤抗骨质疏松的有效成分[23-26]。本研究在前期制备二仙汤抗骨质疏松有效组分的基础上,研究建立了其指纹图谱,并进一步建立了多成分的含量测定方法,为二仙汤有效组分的质量控制奠定了基础。二仙汤抗骨质疏松有效组分指纹图谱研究中,确认了16个共有峰,以表征有效组分的含量,并通过加入对照品比对,指认了8个共有峰的化学结构,明确了其归属药材。我们也试图进一步明确16个共有峰中其余8个共有峰的归属,但是由于6味药材所含化学成分复杂,采用相同的色谱方法和条件获得的6味药材单独HPLC图谱,与对照指纹图谱比对时发现不同的药材会具有相同色谱保留时间,尚没有明确每个共有峰的确切的归属药材。
另外,由于HPLC-DAD分析技术在灵敏度和对无紫外吸收的皂苷类成分检测方面的不足,本研究所建立的指纹图谱和含量测定方法尚不能表征二仙汤中含量较低的化学成分及知母皂苷类成分的结构类型和含量。因此,后续有必要进一步应用UPLC-MS等技术鉴定共有峰所代表的化学成分结构,以明确每个共有峰的归属药材,并对含量较低及无紫外吸收的皂苷类成分进行定性和定量分析,以全面控制二仙汤有效组分的质量。
骨质疏松症是由于骨代谢紊乱导致的骨丢失,其临床表现为腰腿疼痛。课题组前期研究表明二仙汤抗骨质疏松有效组分能够增加维甲酸和去卵巢诱导的骨质疏松大鼠的骨密度,改善骨组织微结构,显示出良好的抗骨质疏松作用。
本研究进一步观察了二仙汤抗骨质疏松有效组分在醋酸扭体小鼠的镇痛作用及对成骨细胞和破骨细胞功能的调控作用,结果表明二仙汤有效组分能够有效缓解醋酸扭体小鼠的疼痛反应,增加成骨细胞的形成、分化和骨矿化结节形成,抑制破骨细胞的形成、分化和骨吸收作用,进一步确证了其对骨代谢的调控作用及对骨质疏松临床症状的缓解作用。后续有必要深入研究二仙汤抗骨质疏松有效组分的化学组成、多成分多靶点调控骨代谢的机制及其临床应用的安全性,为将其研制成新型抗骨质疏松症的组分中药奠定基础。
利益冲突 所有作者均声明不存在利益冲突
[1] Zhao L, Zhang H, Li N,. Network pharmacology, a promising approach to reveal the pharmacology mechanism of Chinese medicine formula [J]., 2023, 309: 116306.
[2] Li J Y, Jia Y S, Chai L M,. Effects of Chinese herbal formula Erxian decoction for treating osteoporosis: A systematic review [J]., 2017, 12: 45-53.
[3] Ma Z, Wei Y, Zhang L,. GCTOF-MS combined LC-QTRAP-MS/MS reveals metabolic difference between osteoarthritis and osteoporotic osteoarthritis and the intervention effect of Erxian decoction [J]., 2022, 13: 905507.
[4] Wong K Y, Zhou L, Yu W,. Water extract of Er-xian decoction selectively exerts estrogenic activities and interacts with SERMs in estrogen-sensitive tissues [J]., 2021, 275: 114096.
[5] Yang L, Fan L, Wang K,. Analysis of molecular mechanism of Erxian decoction in treating osteoporosis based on formula optimization model [J]., 2021, 2021: 6641838.
[6] 吴雨蒙, 王莹, 吴琪, 等. 二仙汤对过氧化氢诱导的成骨细胞蛋白组学及PI3K信号通路的影响 [J]. 中国中药杂志, 2021, 46(15): 3934-3942.
[7] 沈燚, 朱露林, 张奇, 等. 二仙汤抗骨质疏松有效组分对去卵巢大鼠骨丢失的治疗作用 [J]. 中国药学杂志, 2021, 56(22): 1803-1809.
[8] 张建花, 沈燚, 何玉琼, 等. 二仙汤抗骨质疏松有效组分对维甲酸致骨丢失大鼠的影响 [J]. 第二军医大学学报, 2018, 39(2): 165-170.
[9] 祝峥. 二仙汤抗骨质疏松药理作用及蛋白质组学研究 [D]. 沈阳: 沈阳药科大学, 2011.
[10] 沈燚, 祝峥, 张奇, 等. 淫羊藿苷对UMR-106成骨细胞和RAW264.7细胞诱导的破骨细胞蛋白质组学的影响 [J]. 中国药学杂志, 2019, 54(4): 268-273.
[11] Abuna R P F, Almeida L O, Souza A T P,. Osteoporosis and osteoblasts cocultured with adipocytes inhibit osteoblast differentiation by downregulating histone acetylation [J]., 2021, 236(5): 3906-3917.
[12] Dirckx N, Moorer M C, Clemens T L,. The role of osteoblasts in energy homeostasis [J]., 2019, 15(11): 651-665.
[13] Oh J H, Karadeniz F, Lee J I,. Fruits exert antiosteoporotic properties in bone marrow-derived mesenchymal stromal cells via regulation of adipocyte and osteoblast differentiation [J]., 2021, 2021: 8851884.
[14] Hu J, Yao Y, Huang J,. Erxian decoction modulates Th17/Treg cells differentiation through LFA-1/ICAM-1/STAT3 pathway in menopausal dry eye disease [J]., 2022, 215: 108890.
[15] Wang N, Xin H, Xu P,. Erxian decoction attenuates TNF-α induced osteoblast apoptosis by modulating the Akt/Nrf2/HO-1 signaling pathway [J]., 2019, 10: 988.
[16] Zhang L, Li J, Chen Q,. Erxian decoction, a famous Chinese medicine formula, ameliorate depression-like behavior in perimenopausal mice [J]., 2021, 21(12): 2203-2212.
[17] Zhang H, Liu X, Chen Y,. An intelligent extraction approach of feature information from three-dimensional DAD chromatogram for integrated quality control of traditional Chinese medicines:root as an example [J]., 2023, 15(21): 2665-2676.
[18] 韩美欣, 张晨阳, 佟红娜, 等. HPLC指纹图谱和UPLC-Q-TOF-MS方法对芪冬颐心口服液中成分研究 [J]. 中草药, 2022, 53(24): 7679-7685.
[19] 郭正红, 陈山, 何琪, 等. HPLC指纹图谱和多成分定量结合化学模式识别法评价黔钩藤质量 [J]. 药物评价研究, 2023, 46(3): 583-591.
[20] Clynes M A, Gregson C L, Bruyère O,. Osteosarcopenia: Where osteoporosis and sarcopenia collide [J]., 2021, 60(2): 529-537.
[21] Song S S, Guo Y, Yang Y,. Advances in pathogenesis and therapeutic strategies for osteoporosis [J]., 2022, 237: 108168.
[22] Wang J, Lu H X, Wang J. Cannabinoid receptors in osteoporosis and osteoporotic pain: A narrative update of review [J]., 2019, 71(10): 1469-1474.
[23] 刘波, 刘志文, 王莹, 等. 二仙汤改善去卵巢大鼠学习记忆能力的海马蛋白质组学研究 [J]. 中国中药杂志, 2018, 43(14): 2991-2998.
[24] Li M, Zhang N D, Wang Y,. Coordinate regulatory osteogenesis effects of icariin, timosaponin B II and ferulic acid from traditional Chinese medicine formulas on UMR-106 osteoblastic cells and osteoblasts in neonatal rat calvaria cultures [J]., 2016, 185: 120-131.
[25] Wei P, Jiao L, Qin L P,. Effects of berberine on differentiation and bone resorption of osteoclasts derived from rat bone marrow cells [J]., 2009, 7(4): 342-348.
[26] Xue L M, Jiang Y P, Han T,. Comparative proteomic and metabolomic analysis reveal the antiosteoporotic molecular mechanism of icariin fromMaxim. [J]., 2016, 192: 370-381.
Establishment of fingerprint and content determination of multi-components for antiosteoporotic active fraction from Er-xian decoction and research on its analgesic and bone metabolism regulating effects
LIU Yan, LIU Yuling, SHEN Yi, DU Jinman, ZHAO Qiming, YE Xinyuan, ZHANG Quanlong, QIN Luping, ZHANG Qiaoyan
School of Pharmaceutical Sciences, Zhejiang Chinese Medical University, Hangzhou 310053, China
To establish the fingerprint and multi-component content determination method of antiosteoporotic active fraction from Er-xian decoction, and lay a foundation for the development of antiosteoporotic component Chinese medicine based on Er-xian decoction.A Agilent ZorBax Extend C18column (250 mm × 4.6 mm, 5 μm) was selected for HPLC fingerprint detection; the mobile phase is consist of acetonitrile-0.1% aqueous phosphoric acid solution (containing 0.025% sodium dodecyl sulfate); gradient elution: 0—30 min, 4%—30% acetonitrile; 30—50 min, 30%—50% acetonitrile; 50—60 min, 50%—90% acetonitrile; flow rate is 1 mL/min; column temperature is 25 ℃; detection wavelength is 270 nm. The “” was used to evaluate the similarity; the common peaks were identified by comparison with reference compounds. The gradient elution for content determination was adjusted to: 0—25 min, 10%—18% acetonitrile; 25—35 min, 18%—19% acetonitrile; 35—40 min, 19%—25% acetonitrile; 40—50 min, 25%—32% acetonitrile; 50—60 min, 32%—55% acetonitrile and the contents of eight active components were determined. The analgesic effect of the effective components of Er-xian decoction and the regulation of bone metabolism were evaluated in mice with acetic acid twist body, osteoblasts and osteoclasts.The HPLC fingerprints of active fraction from Er-xian decoction were established, and 16 common peaks were identified. The similarity of 16 batches of samples comparison with reference fingerprint was more than 0.9. Eight common peaks (peaks 1, 4, 10—12, 13, 15, 16) were identified as neomangiferin, mangiferin, ferulic acid, curculigoside, epimedin B, icariin, palmatine hydrochloride and berberine hydrochloride. The linear relationship, repeatability, stability, precision and recovery in content determination meet the requirements. The antiosteoporotic active fraction from Er-xian decoction had a significant analgesic effect in the mouse acetate twist body model, and increased the formation of osteoblasts and mineralization of bone matrix, and inhibited the bone resorption of osteoclasts.The established HPLC fingerprint and multi-component content determination method of antiosteoporotic active fraction from Er-xian decoction could accurately, efficiently and comprehensively evaluate its quality, and provide a basis for its quality control.
Er-xian decoction; osteoporosis; fingerprint; multicomponent determination; high-performance liquid chromatography; neomangiferin; mangiferin; ferulic acid; curculigoside; epimedin B; icariin; palmatine hydrochloride; berberine hydrochloride; analgesia; quality control
R283.6
A
0253 - 2670(2024)09 - 2923 - 10
10.7501/j.issn.0253-2670.2024.09.007
2023-10-17
国家自然科学基金项目(82374099);国家自然科学基金项目(81973534)
刘 燕,女,硕士研究生,研究方向为中药活性成分及其作用。E-mail: 2587175184@qq.com
通信作者:张巧艳,教授,从事中药活性成分及其作用机制研究。E-mail: zqy1965@163.com
秦路平,教授,从事中药品质评价和资源开发利用研究。E-mail: lpqin@zcmu.edu.cn
[责任编辑 郑礼胜]

