中药有效成分调节机体脂代谢作用的研究进展
杨玉涛,张冠宇,杨丹凤,张永强,张 莉,武 帅,李 曦*,周玉枝
·综 述·
中药有效成分调节机体脂代谢作用的研究进展
杨玉涛1, 2,张冠宇2,杨丹凤2,张永强2,张 莉2,武 帅2,李 曦2*,周玉枝1*
1. 山西大学中医药现代研究中心,山西 太原 030006 2. 军事科学院军事医学研究院,天津 300050
脂质代谢作为机体重要且复杂的生命过程,对生命活动具有重要意义。脂代谢的紊乱可直接引发酮症、脂肪肝、肥胖等代谢性疾病。中药因多靶点、多途径、不良反应相对较少等优点被广泛应用于脂代谢方面的研究,且中药在治疗肥胖等与脂质代谢紊乱相关的疾病方面历史悠久、临床疗效确切。通过对近年来中药有效成分在调节脂肪组织结构和功能方面的研究进行整理归纳,为中药药理学研究及中药的新药开发、老药新用提供新思路。
中药;脂代谢;脂肪组织;脂肪细胞;丹参酮I;黄芩苷;小檗碱
全球疾病负担报告显示,近20年内代谢性疾病发病率均有所增加,对全球健康构成了极大威胁[1],而代谢性疾病发病率与机体脂肪含量密切相关。脂肪组织不仅储存、提供能量,而且可及时根据机体变化做出反馈,通过影响食物摄取、葡萄糖调节、炎症反应等来调控全身能量代谢[2],是内分泌系统的重要一环,在维持机体能量稳态的过程中扮演着重要的角色。
研究表明,利用药物调节脂质生成、运输和分解功能,改善脂质代谢紊乱,可作为防治代谢相关疾病的有效方法[3]。目前已发现多种中药有效成分可影响脂代谢,改善脂肪代谢紊乱。本文根据中药化学成分的结构类型,对近年报道的中药有效活性成分调节脂肪细胞结构和功能的研究进行整理归纳,为中药调节脂代谢相关研究、新药研发、老药新用提供思路。
1 脂肪组织类型、分布及功能
脂肪组织根据功能和形态的不同主要分为白色脂肪组织(white adipose tissue,WAT)和棕色脂肪组织(brown adipose tissue,BAT)。WAT根据分布位置不同分为皮下脂肪组织(subcutaneous adipose tissue,sWAT)和内脏脂肪组织(visceral adipose tissue,vWAT)。其中,sWAT主要分布在腹部、臀部和大腿;vWAT围绕着内部器官,主要在网膜、肠系膜、腹膜后等部位[4]。WAT具有储能、隔热、缓冲及分泌多种脂肪因子的作用[5]。BAT主要分布在成人颈部、锁骨、纵隔、椎旁和肾周区域[6],通过其含有的高密度线粒体和线粒体内膜上特异表达的解偶联蛋白1(uncoupling protein 1,UCP1)实现非颤栗产热。此外,BAT也具有分泌脂肪因子功能。UCP1激活后,导致驱动三磷酸腺苷合成的电化学梯度短路产生解偶联,将化学能以热量的形式释放,改变细胞内三磷酸腺苷/二磷酸腺苷的值,提高代谢底物氧化速率[7],同时加速脂质运输,进而调节脂质代谢[8]。WAT受到某些外界刺激如寒冷、运动等影响时,会产生与BAT结构和功能相似的米色脂肪组织(beige adipose tissue,BeAT)[9],该过程称为WAT的棕色化,亦可用于促进脂肪代谢,调节能量平衡。
2 中药有效成分在脂代谢方面的作用
中药在治疗各种疾病方面积累了丰富的实践经验,中药多成分、多靶点的特点使其在防治疾病过程中发挥独特的作用。目前,中药在增强瘦素敏感性、调节脂肪代谢、提高基础代谢和改善代谢疾病方面已有报道[10-11],中药有效成分可以对脂质吸收、脂质合成、脂质分解和脂质运输等脂代谢环节发挥调节作用[12],本文对近年来有关中药有效成分与脂代谢的相关性研究进行梳理。
2.1 醌类化合物
醌类化合物根据结构的不同分为苯醌、萘醌、菲醌、蒽醌及衍生物,其中菲醌和蒽醌及其衍生物生理活性较为广泛,研究较多。菲醌主要分布于唇形科植物中,蒽醌主要分布在蓼科、豆科、茜草科植物中[13]。
2.1.1 丹参酮I、隐丹参酮 脂溶性菲醌结构的丹参酮是丹参中主要的有效成分,包括丹参酮I、丹参酮IIA、隐丹参酮等[14],具有心脏保护、抗氧化、抗炎、抗肿瘤等生理活性[15-16]。其中,丹参酮I可以上调高脂饮食诱导的肥胖小鼠BAT中PR结构域蛋白16(PR domain containing 16,PRDM16)表达。PRDM16作为转录辅激活蛋白激活过氧化物酶体增殖物激活受体γ共激活剂-1α(peroxisome proliferative activated receptor γ coactivator-1α,PGC-1α),进一步上调棕色脂肪特异基因、细胞死亡诱导DFFA样效应物A(cell death-inducing DFFA like effector A,)、碘甲腺原氨酸脱碘酶2(iodothyronine deiodinase 2,)表达。还可通过上调PGC-1α逐级激活线粒体转录因子A(mitochondrial transcription factor A,)、核因子E2相关因子2(nuclear factor E2 related factor 2,Nrf2)等诱导线粒体生物发生的相关基因,激活BAT。丹参酮I可增强小鼠胚胎成纤维3T3-L1细胞来源脂肪细胞的线粒体发生和脂肪酸氧化相关基因表达,诱导WAT棕色化,增加体内、外腺苷酸活化蛋白激酶(adenosine phosphate activated protein kinase,AMPK)磷酸化[17],进一步降低过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ,PPARγ)、脂肪酸合酶(fatty acid synthase,FASN)水平,抑制脂肪生成[18]。
隐丹参酮可通过AMPKα、p38丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)和Smad家族蛋白信号传导,抑制小鼠胚胎成纤维C3H/10T1/2细胞脂肪生成,并促进线粒体生物发生,使C3H/10T1/2细胞分化为具有棕色脂肪细胞特征的脂肪细胞[19]。隐丹参酮还可通过AMPK/沉默调节蛋白1(sirtuin 1,SIRT1)/PGC-1α信号通路减少紫外线辐射诱导的线粒体功能障碍,促进线粒体生物合成[20]。
2.1.2 大黄素 大黄素是一种天然蒽醌衍生物,存在于大黄、虎杖、芦荟、决明子等中药中,具有抗癌、抗炎、抗菌、抗病毒等作用[21]。大黄素可上调高脂饮食诱导的肥胖小鼠sWAT中肿瘤坏死因子(tumor necrosis factor,TNF)受体超家族成员9(TNF receptor superfamily 9,Cd137),跨膜蛋白26(transmembrane protein 26,TMEM26)和T盒转录因子1(T-box transcription factor 1,TBX1)等BeAT标志物的表达,促进sWAT棕色化;提高BAT中UCP1,各种转运蛋白脂肪酸转运蛋白血小板糖蛋白4(platelet glycoprotein 4,CD36)和脂肪酸结合蛋白4(fatty acid-binding protein 4,FABP4)的水平,加速脂肪酸的运输和消耗,增强高脂饮食小鼠BAT活性,特异性改变sWAT和BAT中甘油磷脂和鞘脂的质量分数,改善脂质代谢紊乱[22]。除了增加脂质消耗外,大黄素还可通过降低甾醇调控元件结合蛋白1(sterol regulatory element binding transcription factor 1,SREBP1)水平,下调其下游分子FASN表达,减少肝脏中脂肪的生成和积累[23]。11β-羟基类固醇脱氢酶1型(11β-hydroxysteroid dehydrogenase,11β-HSD1)作为氧化还原酶参与皮质醇和皮质酮转换,在脂肪内高表达,被敲除后可以改善高血糖、高血脂,促进机体代谢[24]。大黄素作为11β-HSD1抑制剂可以抑制其在C57BL/6J小鼠脂肪中的活性,降低三酰甘油、总胆固醇水平,减轻体质量和sWAT的质量分数。综上,大黄素具有改善代谢紊乱,治疗代谢综合征的潜在价值[25]。
2.1.3 贯叶金丝桃素 贯叶金丝桃素是贯叶连翘的主要有效成分,也是中成药疏肝解郁胶囊中的组成成分,抗抑郁作用明显,且不良反应小[26]。贯叶金丝桃素可以与肥胖群体脂肪组织中表达的二氢脂酰胺-乙酰基转移酶结合,激活AMPK/PGC-1α/ UCP1途径,上调高脂饮食诱导的肥胖小鼠、瘦素基因纯合突变小鼠脂肪组织中的等产热基因的表达,增加sWAT、BAT线粒体传递链蛋白丰度并提高机体耗氧量。停止干预3周后,小鼠体质量仍保持在相对稳定的平台期,有较持久的抗肥胖作用。综上,贯叶金丝桃素可以促使sWAT棕色化、激活BAT缓解肥胖引发的代谢紊乱[27]。
2.2 苯丙素类
苯丙素类化合物包括简单苯丙素、木脂素、香豆素等多种天然芳香族化合物,多数研究表明该类化合物具有抗血管生成、抗病毒等生物活性[28]。
2.2.1 厚朴酚 厚朴具有广谱抗菌、抗肿瘤、抗炎等作用,含有挥发油、生物碱等多种活性成分。其中最主要的活性成分是联苯型木脂素厚朴酚、和厚朴酚[29]。在脂代谢方面,厚朴酚通过介导AMPK、PPARγ和蛋白激酶A(protein kinases A,PKA)途径上调3T3-L1细胞中、、、棕色脂肪标志基因的表达促进3T3-L1细胞棕色化;同时,激活AMPK可抑制SREBP1转录活性使其靶基因等成脂标志物蛋白水平下降;增强肉碱棕榈酰转移酶1(carnitine palmitoyltransferase 1,CPT1)、长链酰基辅酶A合成酶1、SIRT1脂肪酸氧化、线粒体生物发生标志物蛋白的表达。表明厚朴酚在抑制脂肪积累和合成的同时具有促进脂肪分解的能力。此外,厚朴酚还可以减少活性氧的产生和释放,抑制3T3-L1细胞氧化应激的发生[30]。
2.2.2 和厚朴酚 和厚朴酚能够抑制高脂饮食诱导的小鼠类固醇-酰基转移酶1上调,下调CCAAT增强子结合蛋白α(CCAAT/enhancer binding protein α,C/EBPα)表达,减少脂肪生成;上调sWAT和vWAT中UCP1、CPT1、乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACC)的表达,促进WAT棕色化[31]。和厚朴酚通过细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)提高3T3-L1细胞中UCP1、PGC-1α、PRDM16的表达水平诱导其棕色化,增加酰基辅酶A氧化酶1(acyl-CoA oxidase 1,ACOX1)、CPT1脂肪氧化相关蛋白水平;促进激素敏感性脂肪酶(hormone-sensitive triglyceride lipase,HSL)和围脂滴蛋白磷酸化,促进脂质水解,维持代谢平衡[32]。
2.2.3 五味子乙素 五味子中木脂素类化合物占总成分质量分数的2%~8%,五味子乙素是其中的主要成分之一[33],具有抗肿瘤、抗氧化、抗炎、保肝等药理作用[34]。五味子乙素通过抑制PPARγ、C/EBPα、FASN脂肪特异性调控因子的表达减少3T3-L1细胞脂质生成和积累,使HSL磷酸化,促进三酰甘油水解为甘油和脂肪酸,上调脂肪酸氧化标志基因、;增加AMPK磷酸化和产热标志物UCP1、PRDM16、PGC-1α的水平,促使其棕色化,增加能量消耗,减少脂肪生成来改善脂质代谢[35]。五味子乙素可显著增加高脂饮食小鼠体内PKA介导的HSL磷酸化,并降低三酰甘油、二酰甘油、一酰甘油水平,上调sWAT中、、超长链酰基辅酶A脱氢酶等脂质氧化基因表达,促进脂肪酸氧化,调节脂肪代谢[36]。
2.3 黄酮类化合物
黄酮类化合物是一类以C6-C3-C6为基本碳架的化合物,大多以糖苷的形式存在,根据结构分成多个亚型。黄酮类化合物已被研究证实具有抗肿瘤[37]、抗高血脂、抗氧化[38]、抗骨关节炎[39]的作用,黄酮醇类化合物主要有芦丁、槲皮素、水飞蓟宾等。
2.3.1 芦丁 芦丁作为一种天然黄酮苷类成分,易从豆科植物槐L.干燥花蕾中提取得到[40],具有抗炎、抗氧化、镇痛、保护神经的作用[41],可治疗毛细血管脆性引起的出血症,目前已有成药用于临床。芦丁可呈剂量相关性上调C3H/10T1/2细胞中产热相关基因、、和线粒体生物发生相关基因、的表达;减少高脂饮食诱导的肥胖小鼠、瘦素受体基因纯合突变小鼠体质量增加,增加其耗氧量。芦丁作为一种SIRT1激活剂,可通过SIRT1/PGC-1α/Tfam信号通路,增加机体BAT活性,上调BAT中产热相关基因、、,脂肪酸氧化相关基因、中链脂酰辅酶A脱氢酶(medium chain acyl-CoA dehydrogenase,)的表达。还可以上调高脂饮食小鼠中sWAT的产热基因、BeAT标志基因、线粒体生物标志基因的表达,促进sWAT棕色化[42]。此外,Hu等[43]研究发现芦丁还可通过激活BAT显著改善脱氢表雄酮诱导的大鼠多囊卵巢综合症引起的胰岛素抵抗和卵巢功能障碍,为相关疾病的临床治疗提供一种新的选择。
2.3.2 槲皮素 槲皮素作为一种黄酮醇类化合物,可由芦丁经过胃肠道中的葡萄糖苷水解得到[44]。槲皮素可上调高脂饮食小鼠脂肪组织中产热基因和线粒体生物发生基因的表达,促进肾上腺素能受体β3表达,并通过其下游PKA增加p38 MAPK磷酸化水平,进一步激活转录因子2(activating transcription factor 2,ATF2)、环磷腺苷效应元件结合蛋白(cAMP-response element binding protein,CREB)磷酸化水平,激活多种靶基因转录;同时槲皮素还可通过调节AMPK提高SIRT1蛋白水平,促使PGC-1α去乙酰化,增加PGC-1α和UCP1的表达[45]。
2.3.3 水飞蓟宾 水飞蓟宾是菊科植物水飞蓟(L.) Gaertn.的主要有效成分,具有保肝、抗肿瘤的作用。在细胞水平研究中,水飞蓟宾以剂量相关性抑制3T3-L1细胞中FABP4、C/EBPα的表达,从而抑制其分化为成熟的脂肪细胞;在动物水平研究中,水飞蓟宾通过激活AMPKα信号降低围脂滴蛋白、FASN水平,抑制斑马鱼体内脂质积累[46]。蛋白组学研究发现水飞蓟宾可以降低高脂饮食小鼠vWAT脂质合成和转运相关蛋白的表达,上调还原型辅酶I的表达,改善线粒体功能障碍,增加能量消耗,进而改善体内脂质代谢[47]。水飞蓟宾可以通过影响人脂肪组织间充质干细胞中SIRT1、PPARα、PGC-1α的表达,提高UCP1的水平。其在提高产热功能促进脂肪细胞棕色化的同时还具有一定的抗炎作用,可降低脂肪组织中促炎因子TNF-α和白细胞介素-6(interleukin-6,IL-6)表达,改善炎症损伤导致的胰岛素抵抗[48]。
2.3.4 黄芩苷 黄芩苷是从唇形科植物黄芩Georgi.的干燥根中提取分离得到的主要有效成分,具有抗菌、抗病毒、抗炎、抗肿瘤、抗氧化等药理作用[49]。Zhang等[50]研究发现黄芩苷可以通过增加静息状态下的产热,并减缓寒冷环境下的体温下降,从而增强小鼠寒冷条件下的适应能力。黄芩苷可上调肝脏中脂肪酸分解的相关基因、脂肪酰辅酶A脱氢酶的表达,减轻高脂饮食诱导的小鼠肝脂肪变性。黄芩苷还可上调BAT中产热相关基因、、、、的表达,激活BAT;抑制高脂饮食造成的vWAT中脂肪细胞增大,上调产热相关基因表达,促进vWAT棕色化。黄芩苷以剂量相关性提高C3H/10T1/2细胞中产热相关蛋白的表达水平、促进AMPK的磷酸化,并通过AMPK/PGC-1α途径调节转录。此外,也有研究表明黄芩苷可使sWAT培养的原代脂肪细胞中ERK1/2磷酸化,进而使产热基因、表达上调,促进产热,提高代谢率改善代谢紊乱[51]。
除上述中药有效成分外,山柰中的山柰酚、芸香科柑橘属中广泛存在的川陈皮素、甘草中的甘草查耳酮A、葛根中的葛根素均属于黄酮类化合物(表1),可降低全身及内脏脂肪含量,改善肝脏脂肪变性,降低脂肪组织内的炎症水平。
2.4 萜类化合物
萜类化合物根据所含异戊二烯单位个数的不同分为半萜、单萜、倍半萜、二萜、三萜、四萜类,具有抗微生物、抗癌、降血压、抗高血脂、抗炎、抗氧化、抗寄生虫、免疫调节等生理活性[65]。
2.4.1 栀子苷 栀子苷是从茜草科植物栀子Ellis.中提取得到的一种环烯醚萜类化合物,属于单萜,具有神经保护、保肝、抗炎、抗氧化、抗抑郁、调节免疫、抗血栓等生理活性[66]。在脂肪代谢方面,栀子苷可下调小鼠BAT和sWAT中产热基因、、的表达,负调节脂肪组织的产热能力,降低小鼠的体温和耐寒力。栀子苷可下调3T3-L1细胞中产热基因的表达,减少线粒体氧气消耗率,抑制机体产热,进而对脂肪细胞的产热能力起到反向调节作用[67]。
2.4.2 青蒿素衍生物 青蒿素是一种具有过氧基团的倍半萜内酯,具有抗菌、抗真菌、抗病毒、抗肿瘤等生理活性,可以治疗疟疾。此外,通过青蒿素衍生物合成的双氢青蒿素、蒿甲醚、青蒿琥酯等均具有较好生物活性或溶解性[68]。蒿甲醚和双氢青蒿素通过激活p38 MAPK/ATF2轴,使蛋白激酶B(protein kinase B,Akt)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)通路失活诱导脂肪棕色化。蒿甲醚可以剂量相关性提高C3H/10T1/2细胞、C57BL/6J小鼠sWAT原代脂肪细胞中产热蛋白UCP1、PGC-1α、PRDM16和线粒体膜蛋白上的电子转运蛋白细胞色素C氧化酶的水平,分化成的细胞具有棕色脂肪细胞特征。蒿甲醚还可抑制高脂饮食诱导的小鼠体质量增加,通过提高sWAT中UCP1的水平,提升小鼠产热能力,增强小鼠在4 ℃环境下体温保持能力。双氢青蒿素也具有和蒿甲醚相似的作用,可提高C3H/10T1/2细胞中UCP1、PGC-1α的表达水平,诱导其棕色化[69]。

表1 中药有效成分调控脂质代谢的作用机制
2.4.3 三七皂苷 三七皂苷是五加科植物三七(Burk.) F. H. Chen的主要成分之一,具有心脏保护、抗动脉粥样硬化、增强β淀粉样蛋白降解、抗骨质疏松、抗癌等药理作用[70]。三七皂苷通过调节肠道微生物群激活瘦素-AMPK/ STAT3途径的信号促进肥胖小鼠和C3H/10T1/2细胞中AMPKα、信号传导转录激活因子3(signal transducer and activator of transcription 3,STAT3)的磷酸化。三七皂苷还可上调高脂饮食小鼠脂肪组织中的产热相关基因表达,增加UCP1、PRDM16蛋白的水平,同时减小高脂饮食小鼠sWAT、vWAT、BAT中脂肪细胞的尺寸,促进BAT产热和WAT棕色化[71]。
2.4.4 人参皂苷 人参皂苷是五加科植物人参C. A. Mey.中重要的三萜皂苷类成分,具有抗氧化、降血压、改善心脏功能、抑制血小板凝聚等作用。人参中大约有200种人参皂苷,其中包括含量较多的人参皂苷Rb1、人参皂苷Rg1和含量较少的人参皂苷Rg3、人参皂苷Rh2[72]。人参皂苷Rb1可通过AMPK通路以剂量相关性的方式提高3T3-L1细胞和sWAT中产热标志UCP1、PRDM16和PGC-1α的蛋白水平,促进3T3-L1细胞和sWAT的棕色化[73]。人参皂苷Rg3可通过增加AMPK磷酸化,上调BeAT细胞特异性标志基因、的表达,上调脂肪生成相关基因、,肪酸氧化基因的表达,减少脂滴积累,进而白色脂肪细胞棕色化,影响脂质代谢[74]。人参茎叶提取得到的皂苷可以剂量相关性方式抑制高脂饮食诱导的小鼠血清中瘦素增加,升高血清中高密度脂蛋白胆固醇水平,降低低密度脂蛋白胆固醇、总胆固醇、三酰甘油水平,缓解肥胖引起的血脂代谢紊乱,同时下调成脂相关标志基因、上调脂肪组织中的产热相关标志基因的表达,加速游离脂肪酸的运输和氧化,增加能量消耗[75]。
此外,薄荷中的薄荷醇,藏红花的有色成分藏红花素,桔梗的主要有效成分桔梗皂苷D,柴胡中的柴胡皂苷A、D,积雪草中的羟基积雪草苷,绞股蓝中的绞股蓝苷等(表1)均属于萜类成分,通过激活AMPK通路,抑制脂肪合成代谢,促进脂肪分解代谢,进一步维持脂肪代谢稳态。
2.5 生物碱
生物碱是存在于自然界中的一类含氮碱性有机化合物,基于杂环性质可分为杂环生物碱、非杂环生物碱。杂环生物碱包括吡啶类、莨菪烷类、喹啉类生物碱、异喹啉类生物碱等[76],具有抗病毒、抗肿瘤、抗氧化、保护心血管等生理活性[77]。
2.5.1 小檗碱 小檗碱作为一种天然的五环异喹啉生物碱是许多天然药物的有效活性成分,根茎中占8%~9%,也是黄连的主要有效成分。现代药理研究表明,小檗碱是改善炎症性肠胃病等相关疾病的最有效天然产物之一[78]。Zhang等[79]通过小檗碱干预瘦素受体基因纯合突变小鼠4周后,发现小鼠耗氧量和二氧化碳产生量均显著增加,维持体温的能力增强,表明小檗碱可以增加能量消耗并促进适应性产热。同时,小檗碱可显著增强BAT活性并使sWAT棕色化,增加线粒体数量,提高UCP1、PGC1-α的含量和AMPK蛋白磷酸化水平,上调产热标志基因的表达。AMPK被激活后可抑制高脂饮食诱导的小鼠vWAT中转化生长因子-β1/Smad3信号传导,下调纤维化基因表达,减少vWAT中促炎巨噬细胞浸润,缓解组织纤维化[80]。小檗碱可直接与线粒体中SIRT3结合增强其活性,调控线粒体代谢;抑制脂肪细胞中TNF-α介导的炎症反应和细胞外基质异常沉积,缓解脂肪组织炎症,促进脂肪组织重塑[81]。Wu等[82]发现小檗碱可通过AMPK/PRDM16轴促进棕色脂肪细胞分化抑制PRDM16启动子DNA去甲基化活性,促进PRDM16的转录,增加BAT产热和全身能量消耗。
2.5.2 苦参碱 苦参碱是吡啶衍生物中喹诺里西啶类生物碱中的一种,具有广泛的药理活性,如抗肿瘤、镇痛、抗纤维化、抗病毒、抗心律失常、提高免疫力等[83]。在脂代谢方面,通过ig苦参碱于高脂饮食诱导的小鼠6周,小鼠血浆中三酰甘油、游离脂肪酸水平显著增加,同时提高耗氧量和二氧化碳产生率,增加能量消耗,并且在寒冷环境下有一定保持体温的能力。此外,苦参碱处理后的高脂饮食小鼠BAT脂滴尺寸减小,线粒体DNA拷贝数增加,表明苦参碱对于维持体温、增加适应性产热有一定效果。苦参碱将热休克因子1(heat shock factor 1,HSF1)富集到PGC-1α的启动子区域,激活HSF1/PGC-1α轴,使棕色脂肪标志基因、生物发生基因、脂肪酸氧化相关基因上调,促使BAT中的产热程序的激活,增加sWAT棕色化,从而缓解代谢紊乱[84]。
3 结语与展望
中药的多效性在临床应用中更能体现标本兼治的优势,使中药与多种疾病的相关性研究日益增多。在醌类、苯丙素类、黄酮类、萜类、生物碱类等各类中药活性成分中,均存在具有上调产热基因表达、增加线粒体数量和活性、提升耗氧量,促进脂肪酸氧化、适应性产热作用的中药有效成分(图1)。提示中药活性成分可能是改善代谢紊乱的潜在治疗方案之一。
但是目前关于中药和脂质代谢相关性的研究尚处于探索初期,主要体现在2个方面。(1)缺乏细胞间、器官间相互作用的研究。脂肪组织不只有脂肪细胞,还包含脂肪祖细胞、免疫细胞、内皮细胞、平滑肌细胞、周细胞、神经元、施万细胞在内的多种细胞类型。虽然脂肪细胞在维持能量稳态方面有重要作用,但其他类型的细胞也可响应温度和饮食等外界刺激,并通过广泛的细胞串扰来调节脂肪组织的功能,影响脂肪组织的更新、扩张和重塑。此外,脂肪组织和其他脏器如肌肉、肝脏等释放的多种细胞因子可以靶向相应器官,调节机体产热及代谢[85-86]。而目前大多数药物和脂肪代谢的相关研究只基于脂肪组织本身,忽略了机体的整体性。(2)中药活性成分复杂,靶点不明确,难以深入探究其分子机制,影响中药的现代化国际化发展。
基于以上问题,未来研究中,首先可以采用多组学联合分析对基因组、转录组、蛋白组、代谢组等数据进行整合分析,从更多层次和角度整体反映组织器官受到药物干预后的状态更利于药物靶点的发现和药效的评价。其次中药活性成分大多作用于蛋白质,而其与蛋白质间的相互作用可以采用分子对接技术进行预测,分子靶点“钩钓”技术进行筛选,表面等离子共振技术、荧光共振能量转移技术、生物膜干涉技术等多种技术手段进行验证,确定其与蛋白质结合的结构域或氨基酸位点。最后可以针对中药有效成分的结构进行修饰改造,或借助各种制剂工艺各种药物载体,增强中药小分子化合物的稳定性、改善中药的溶解性、增加中药与给药部位的接触面积提高生物利用度,将中药制成纳米颗粒运送到指定位置从而实现药物传递,借助新的研究技术和手段实现药物功能的最大化,达到药物与病灶部位的最后一公里。目前,已有研究证明疏水活性成分槲皮素、小檗碱可加到纳米乳液中以提高溶解度和生物利用度,隐丹参酮、姜黄素可以通过叶酸或SP94靶向肽修饰的聚合物纳米颗粒增强其靶向能力[87]。此外,由于现阶段的体外研究大多基于啮齿动物的BAT展开,成年人的BAT较少,且结构和功能上更类似于小鼠的BeAT而非BAT[88],因此已报道的活性成分能否在人体内有效发挥药理活性仍缺乏充分依据,有待进一步研究。
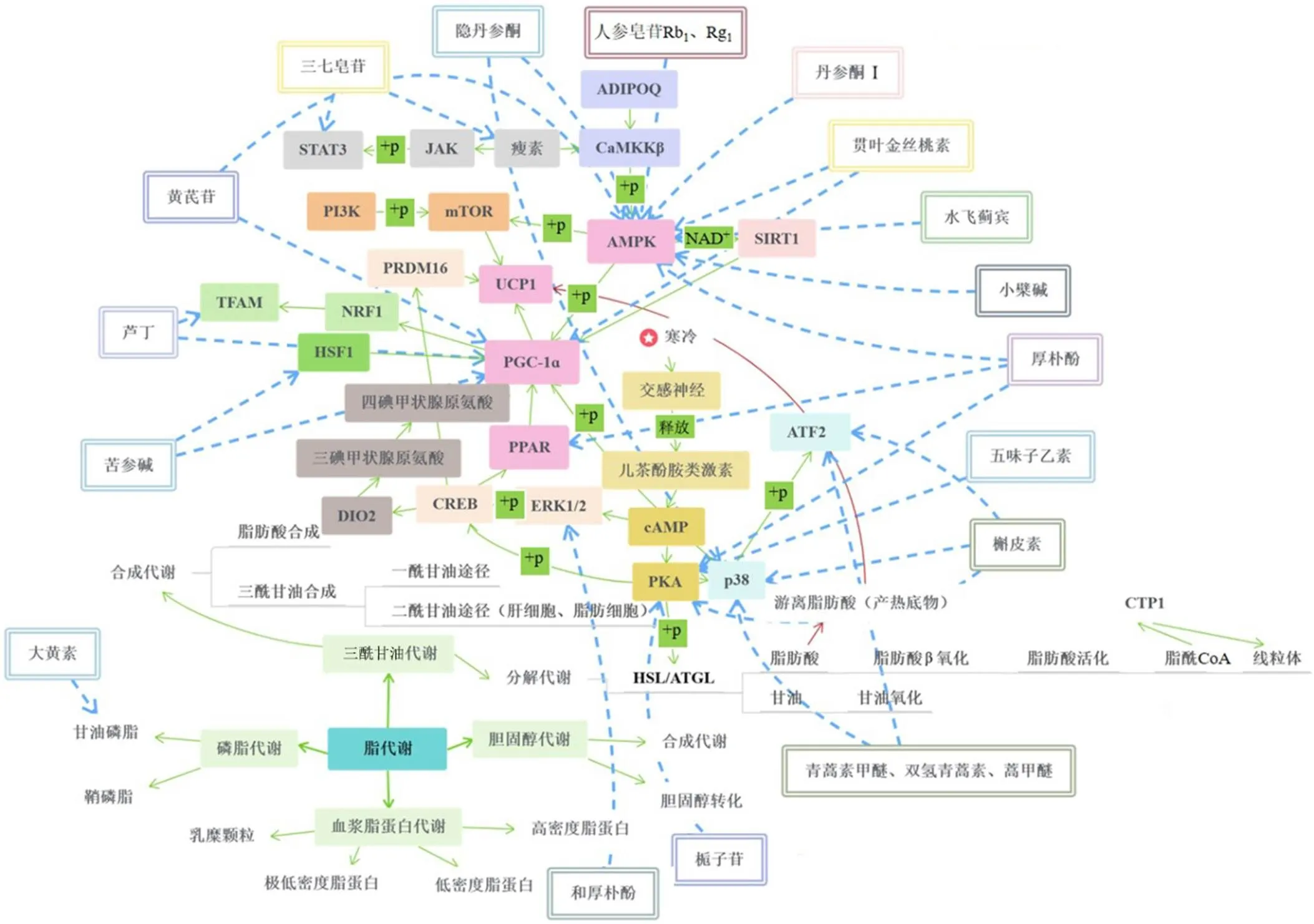
图1 中药有效成分调节脂质代谢的作用机制
利益冲突 所有作者均声明不存在利益冲突
[1] Chong B, Kong G, Shankar K,. The global syndemic of metabolic diseases in the young adult population: A consortium of trends and projections from the Global Burden of Disease 2000-2019 [J]., 2023, 141: 155402.
[2] Sakers A, De Siqueira M K, Seale P,. Adipose-tissue plasticity in health and disease [J]., 2022, 185(3): 419-446.
[3] Nawrocki A R, Scherer P E. Keynote review: The adipocyte as a drug discovery target [J]., 2005, 10(18): 1219-1230.
[4] Chusyd D E, Wang D H, Huffman D M,. Relationships between rodent white adipose fat pads and human white adipose fat depots [J]., 2016, 3: 10.
[5] Ouchi N, Parker J L, Lugus J J,. Adipokines in inflammation and metabolic disease [J]., 2011, 11(2): 85-97.
[6] Ouellet V, Routhier-Labadie A, Bellemare W,. Outdoor temperature, age, sex, body mass index, and diabetic status determine the prevalence, mass, and glucose-uptake activity of 18F-FDG-detected BAT in humans [J]., 2011, 96(1): 192-199.
[7] Fedorenko A, Lishko P V, Kirichok Y. Mechanism of fatty-acid-dependent UCP1 uncoupling in brown fat mitochondria [J]., 2012, 151(2): 400-413.
[8] Chondronikola M, Volpi E, Børsheim E,. Brown adipose tissue activation is linked to distinct systemic effects on lipid metabolism in humans [J]., 2016, 23(6): 1200-1206.
[9] Sidossis L, Kajimura S. Brown and beige fat in humans: Thermogenic adipocytes that control energy and glucose homeostasis [J]., 2015, 125(2): 478-486.
[10] 廖劲松. 中药治疗单纯性肥胖机理研究进展 [J]. 新中医, 2019, 51(6): 40-43.
[11] 高海云, 徐闯, 崔一喆, 等. 中药调控3T3-L1脂肪细胞增殖、分化和糖脂代谢的研究进展 [J]. 吉林大学学报: 医学版, 2020, 46(4): 881-887.
[12] Fan Q J, Xu F R, Liang B,. The anti-obesity effect of traditional Chinese medicine on lipid metabolism [J]., 2021, 12: 696603.
[13] 赵建国, 彭新君, 高星. 现代分析技术在醌类化合物中的应用 [J]. 时珍国医国药, 2005, 16(2): 140-141.
[14] 王庆伟, 杨频, 张立伟. 丹参酮的有效分离 [J]. 山西大学学报: 自然科学版, 1994, 17(3): 294-298.
[15] Jiang Z Q, Gao W, Huang L Q. Tanshinones, critical pharmacological components in[J]., 2019, 10: 202.
[16] Li Z B, Zou J, Cao D,. Pharmacological basis of tanshinone and new insights into tanshinone as a multitarget natural product for multifaceted diseases [J]., 2020, 130: 110599.
[17] Jung D Y, Suh N, Jung M H. Tanshinone 1 prevents high fat diet-induced obesity through activation of brown adipocytes and induction of browning in white adipocytes [J]., 2022, 298: 120488.
[18] Jung D Y, Kim J H, Jung M H. Anti-obesity effects of tanshinone I fromBunge in mice fed a high-fat diet through inhibition of early adipogenesis [J]., 2020, 12(5): 1242.
[19] Imran K M, Rahman N, Yoon D,. Cryptotanshinone promotes commitment to the brown adipocyte lineage and mitochondrial biogenesis in C3H10T1/2 mesenchymal stem cells via AMPK and p38-MAPK signaling [J]., 2017, 1862(10 Pt A): 1110-1120.
[20] Guo K K, Liu R, Jing R R,. Cryptotanshinone protects skin cells from ultraviolet radiation-induced photoaging via its antioxidant effect and by reducing mitochondrial dysfunction and inhibiting apoptosis [J]., 2022, 13: 1036013.
[21] 王玉, 杨雪, 夏鹏飞, 等. 大黄化学成分、药理作用研究进展及质量标志物的预测分析 [J]. 中草药, 2019, 50(19): 4821-4837.
[22] Cheng L, Zhang S F, Shang F,. Emodin improves glucose and lipid metabolism disorders in obese mice via activating brown adipose tissue and inducing browning of white adipose tissue [J]., 2021, 12: 618037.
[23] Tzeng T F, Lu H J, Liou S S,. Emodin, a naturally occurring anthraquinone derivative, ameliorates dyslipidemia by activating AMP-activated protein kinase in high-fat-diet-fed rats [J]., 2012, 2012: 781812.
[24] 邹显彤, 纪立农. 11β-羟基类固醇脱氢酶1型在代谢综合征中的作用 [J]. 中国糖尿病杂志, 2015, 23(4): 378-380.
[25] Feng Y, Huang S L, Dou W,. Emodin, a natural product, selectively inhibits 11beta-hydroxysteroid dehydrogenase type 1 and ameliorates metabolic disorder in diet-induced obese mice [J]., 2010, 161(1): 113-126.
[26] Zirak N, Shafiee M, Soltani G,.in the treatment of psychiatric and neurodegenerative disorders: Current evidence and potential mechanisms of action [J]., 2019, 234(6): 8496-8508.
[27] Chen S Z, Liu X X, Peng C,. The phytochemical hyperforin triggers thermogenesis in adipose tissue via a Dlat-AMPK signaling axis to curb obesity [J]., 2021, 33(3): 565-580.
[28] 王红芳. 苯丙素类化合物与葫芦脲相互作用的分析应用 [D]. 太原: 山西大学, 2013.
[29] 殷帅文, 何旭梅, 郎锋祥, 等. 厚朴化学成分和药理作用研究概况 [J]. 贵州农业科学, 2007, 35(6): 133-135.
[30] Parray H A, Lone J, Park J P,. Magnolol promotes thermogenesis and attenuates oxidative stress in 3T3-L1 adipocytes [J]., 2018, 50: 82-90.
[31] Ding Y N, Zhang L L, Yao X F,. Honokiol alleviates high-fat diet-induced obesity of mice by inhibiting adipogenesis and promoting white adipose tissue browning [J]., 2021, 11(6): 1493.
[32] Lone J, Yun J W. Honokiol exerts dual effects on browning and apoptosis of adipocytes [J]., 2017, 69(6): 1357-1365.
[33] 任伟光, 张翠英. 五味子的研究进展及质量标志物(Q-Marker) 的预测分析 [J]. 中草药, 2020, 51(11): 3110-3116.
[34] Ma M Y, Wei N, Yang J R,. Schisandrin B promotes senescence of activated hepatic stellate cell via NCOA4-mediated ferritinophagy [J]., 2023, 61(1): 621-629.
[35] Lee K, Lee Y J, Kim K J,. Gomisin N fromameliorates lipid accumulation and induces a brown fat-like phenotype through AMP-activated protein kinase in 3T3-L1 adipocytes [J]., 2020, 21(6): 2153.
[36] Kwan H Y, Wu J H, Su T,. Schisandrin B regulates lipid metabolism in subcutaneous adipocytes [J]., 2017, 7(1): 10266.
[37] Constantinescu T, Mihis A G. Two important anticancer mechanisms of natural and synthetic chalcones [J]., 2022, 23(19): 11595.
[38] Noureddine B, Mohamed B, Alami M I,. Antihyperlipidemic and antioxidant activities of flavonoid-rich extract of(L.) Lam. fruits [J]., 2021, 11(17): 7788.
[39] 杨泓毅, 林龙飞, 刘宇灵, 等. 黄酮类化合物抗骨关节炎机制研究进展 [J]. 中草药, 2023, 54(24): 8290-8300.
[40] 中国药典 [S]. 一部. 2020: 155-168.
[41] 李珂, 冯亚莉, 曹瑞梅, 等. 芦丁的结构修饰及生物活性研究进展 [J]. 中草药, 2021, 52(20): 6413-6424.
[42] Yuan X X, Wei G, You Y L,. Rutin ameliorates obesity through brown fat activation [J]., 2017, 31(1): 333-345.
[43] Hu T, Yuan X X, Ye R C,. Brown adipose tissue activation by rutin ameliorates polycystic ovary syndrome in rat [J]., 2017, 47: 21-28.
[44] Manach C, Morand C, Demigné C,. Bioavailability of rutin and quercetin in rats [J]., 1997, 409(1): 12-16.
[45] Pei Y, Otieno D, Gu I,. Effect of quercetin on nonshivering thermogenesis of brown adipose tissue in high-fat diet-induced obese mice [J]., 2021, 88: 108532.
[46] Suh H J, Cho S Y, Kim E Y,. Blockade of lipid accumulation by silibinin in adipocytes and zebrafish [J]., 2015, 227: 53-62.
[47] Wang F, Chen S C, Ren L P,. The effect of silibinin on protein expression profile in white adipose tissue of obese mice [J]., 2020, 11: 55.
[48] Barbagallo I, Vanella L, Cambria M T,. Silibinin regulates lipid metabolism and differentiation in functional human adipocytes [J]., 2015, 6: 309.
[49] 龙宇, 向燕, 谭裕君, 等. 黄芩苷药理作用及新剂型的研究进展 [J]. 中草药, 2019, 50(24): 6142-6148.
[50] Zhang Y Q, Zhang Z Z, Zhang Y W,. Baicalin promotes the activation of brown and white adipose tissue through AMPK/PGC1α pathway [J]., 2022, 922: 174913.
[51] Li H D, Tang S Y. Baicalin attenuates diet-induced obesity partially through promoting thermogenesis in adipose tissue [J]., 2021, 15(5): 485-490.
[52] Kim H L, Park J, Jung Y,. Platycodin D, a novel activator of AMP-activated protein kinase, attenuates obesity in db/db mice via regulation of adipogenesis and thermogenesis [J]., 2019, 52: 254-263.
[53] Lim S H, Lee H S, Han H K,. Saikosaponin A and D inhibit adipogenesis via the AMPK and MAPK signaling pathways in 3T3-L1 adipocytes [J]., 2021, 22(21): 11409.
[54] Jiménez-Ortega E, Braza-Boïls A, Burgos M,. Crocetin isolated from the natural food colorant saffron reduces intracellular fat in 3T3-L1 adipocytes [J]., 2020, 9(11): 1648.
[55] Gu M, Luo L, Fang K. Crocin inhibits obesity via AMPK-dependent inhibition of adipocyte differentiation and promotion of lipolysis [J]., 2018, 12(6): 587-594.
[56] Sun B J, Hayashi M, Kudo M,. Madecassoside inhibits body weight gain via modulating SIRT1-AMPK signaling pathway and activating genes related to thermogenesis [J]., 2021, 12: 627950.
[57] McKie G L, Medak K D, Shamshoum H,. Topical application of the pharmacological cold mimetic menthol stimulates brown adipose tissue thermogenesis through a TRPM8, UCP1, and norepinephrine dependent mechanism in mice housed at thermoneutrality [J]., 2022, 36(3): e22205.
[58] Liu X, Huang Y, Liang X,. Atractylenolide III fromKoidz promotes the activation of brown and white adipose tissue through SIRT1/PGC-1α signaling pathway [J]., 2022, 104: 154289.
[59] Zhang X X, Hou X L, Xu C Y,. Kaempferol regulates the thermogenic function of adipocytes in high-fat-diet-induced obesity via the CDK6/RUNX1/UCP1 signaling pathway [J]., 2023, 14(18): 8201-8216.
[60] Bian Y F, Lei J Q, Zhong J,. Kaempferol reduces obesity, prevents intestinal inflammation, and modulates gut microbiota in high-fat diet mice [J]., 2022, 99: 108840.
[61] Kou G N, Li P Y, Hu Y C,. Nobiletin activates thermogenesis of brown and white adipose tissue in high-fat diet-fed C57BL/6 mice by shaping the gut microbiota [J]., 2021, 35(2): e21267.
[62] Lee H S, Lim S M, Jung J I,.extract ameliorates high-fat diet-induced obesity in C57BL/6N mice by upregulating SIRT1 [J]., 2019, 11(10): 2475.
[63] Liou C J, Lee Y K, Ting N C,. Protective effects of licochalcone A ameliorates obesity and non-alcoholic fatty liver disease via promotion of the SIRT-1/AMPK pathway in mice fed a high-fat diet [J]., 2019, 8(5): 447.
[64] Noh JW, Yang HK, Jun MS,. Puerarin attenuates obesity-induced inflammation and dyslipidemia by regulating macrophages and TNF-alpha in obese mice [J]., 2022, 10(1): 175.
[65] ai Shi Min S, Liew S Y, Chear N J Y,. Plant terpenoids as the promising source of cholinesterase inhibitors for anti-AD therapy [J]., 2022, 11(2): 307.
[66] Gao S T, Feng Q. The beneficial effects of geniposide on glucose and lipid metabolism: A review [J]., 2022, 16: 3365-3383.
[67] Li Y, Zhang K L, Liu J X,. Geniposide suppresses thermogenesis via regulating PKA catalytic subunit in adipocytes [J]., 2021, 464: 153014.
[68] Posadino A M, Giordo R, Pintus G,. Medicinal and mechanistic overview of artemisinin in the treatment of human diseases [J]., 2023, 163: 114866.
[69] Lu P, Zhang F C, Qian S W,. Artemisinin derivatives prevent obesity by inducing browning of WAT and enhancing BAT function [J]., 2016, 26(10): 1169-1172.
[70] Xu C C, Wang W W, Wang B,. Analytical methods and biological activities ofsaponins: Recent trends [J]., 2019, 236: 443-465.
[71] Xu Y, Wang N, Tan H Y,.saponins modulate the gut microbiota to promote thermogenesis and beige adipocyte reconstruction via leptin-mediated AMPKα/STAT3 signaling in diet-induced obesity [J]., 2020, 10(24): 11302-11323.
[72] Kim J H. Pharmacological and medical applications ofand ginsenosides: A review for use in cardiovascular diseases [J]., 2018, 42(3): 264-269.
[73] Park S J, Park M, Sharma A,. Black ginseng and ginsenoside Rb1promote browning by inducing UCP1 expression in 3T3-L1 and primary white adipocytes [J]., 2019, 11(11): 2747.
[74] Kim K, Nam K H, Yi S A,. Ginsenoside Rg3induces browning of 3T3-L1 adipocytes by activating AMPK signaling [J]., 2020, 12(2): 427.
[75] Chen G L, Li H J, Zhao Y,. Saponins from stems and leaves ofprevent obesity via regulating thermogenesis, lipogenesis and lipolysis in high-fat diet-induced obese C57BL/6 mice [J]., 2017, 106(Pt A): 393-403.
[76] Bhambhani S, Kondhare K R, Giri A P. Diversity in chemical structures and biological properties of plant alkaloids [J]., 2021, 26(11): 3374.
[77] 王宏, 刘月, 杨梁钰, 等. 生物碱类化合物抗病毒活性及其机制研究进展 [J]. 中草药, 2022, 53(9): 2839-2850.
[78] Habtemariam S. Berberine pharmacology and the gut microbiota: A hidden therapeutic link [J]., 2020, 155: 104722.
[79] Zhang Z G, Zhang H Z, Li B,. Berberine activates thermogenesis in white and brown adipose tissue [J]., 2014, 5: 5493.
[80] Wang L J, Ye X, Hua Y Y,. Berberine alleviates adipose tissue fibrosis by inducing AMP-activated kinase signaling in high-fat diet-induced obese mice [J]., 2018, 105: 121-129.
[81] Li D, Yang C, Zhu J Z,. Berberine remodels adipose tissue to attenuate metabolic disorders by activating sirtuin 3 [J]., 2022, 43(5): 1285-1298.
[82] Wu L Y, Xia M F, Duan Y N,. Berberine promotes the recruitment and activation of brown adipose tissue in mice and humans [J]., 2019, 10(6): 468.
[83] Lin Y D, He F M, Wu L,. Matrine exerts pharmacological effects through multiple signaling pathways: A comprehensive review [J]., 2022, 16: 533-569.
[84] Li C, Xu Y H, Hu Y T,. Matrine counteracts obesity in mice via inducing adipose thermogenesis by activating HSF1/PGC-1α axis [J]., 2022, 177: 106136.
[85] Shamsi F, Wang C H, Tseng Y H. The evolving view of thermogenic adipocytes - ontogeny, niche and function [J]., 2021, 17(12): 726-744.
[86] Wang S F, Liu Y F, Chen J Q,. Effects of multi-organ crosstalk on the physiology and pathology of adipose tissue [J]., 2023, 14: 1198984.
[87] Wei D H, Yang H, Zhang Y,. Nano-traditional Chinese medicine: A promising strategy and its recent advances [J]., 2022, 10(16): 2973-2994.
[88] Wu J, Boström P, Sparks L M,. Beige adipocytes are a distinct type of thermogenic fat cell in mouse and human [J]., 2012, 150(2): 366-376.
Effects of active compounds of traditional Chinese medicine in regulating lipid metabolism in body
YANG Yutao1,2, ZHANG Guanyu2, YANG Danfeng2, ZHANG Yongqiang2, ZHANG Li2, WU Shuai2, LI Xi2, ZHOU Yuzhi1
1.Modern Research Center for Traditional Chinese Medicine, Shanxi University, Taiyuan 030006, China 2.Military Medical Sciences Academy, Tianjin 300050, China
As an important and complex process, lipid metabolism is of vital importance to life activities. Disorders of lipid metabolism might cause metabolic diseases such as ketosis, fatty liver and obesity. Traditional Chinese medicine (TCM) has been widely used in the study of lipid metabolism due to its advantages of multi-targets, multi-pathways and relatively low adverse reactions. Furthermore, it has a long history in treatments of diseases related to lipid metabolism disorders, and its clinical efficacy is reliable. According to the structural classification of active components of TCM, this review summarizes the recent researches of TCM on regulating the structure and function of adipose tissues, so as to provide new ideas for the subsequent new medicine development and repurposing.
traditional Chinese medicine; lipid metabolism; adipose tissue; adipocyte; tanshinone I; baicalin; berberine
R285
A
0253 - 2670(2024)09 - 3127 - 10
10.7501/j.issn.0253-2670.2024.09.026
2023-12-09
杨玉涛,女,硕士研究生,研究方向为中药活性成分筛选。E-mail: 1571167297@qq.com
通信作者:周玉枝,教授,博士生导师,从事中药药效物质基础及作用机制研究。E-mail: zhouyuzhi@sxu.edu.cn
李 曦,副研究员,研究生导师,从事极端环境习服适应能力提升技术研究。E-mail: woshiliulangdeyu@163.com
[责任编辑 赵慧亮]

