芍药苷对糖尿病周围神经病变状态下线粒体输入途径蛋白TOM20的作用
刘东齐,闫仕祺,刘浩龙,杨鑫伟*
芍药苷对糖尿病周围神经病变状态下线粒体输入途径蛋白TOM20的作用
刘东齐1,闫仕祺1,刘浩龙2,杨鑫伟1*
1. 首都医科大学中医药学院,中医络病研究北京市重点实验室,北京 100069 2. 首都医科大学附属北京朝阳医院,北京 100020
探究芍药苷对糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)大鼠坐骨神经和高糖环境下雪旺细胞(Schwann cells,SCs)线粒体输入途径蛋白线粒体外膜转位酶20(translocase of outer mitochondrial membrane 20,TOM20)的影响。以25、100、150 mmol/L葡萄糖分别干预RSC96雪旺细胞株12、24、48 h,用高内涵分析法检测TOM20和线粒体硫氧还蛋白2(mitochondrial thioredoxin 2,Trx2)的表达;设置对照组(给予25 mmol/L葡萄糖)、TOM20 siRNA组、TOM20 siRNA+芍药苷24 h组和TOM20 siRNA+芍药苷48 h组,转染TOM20 siRNA后给予10 mmol/L芍药苷分别干预24、48 h,利用Western blotting检测TOM20和Trx2蛋白表达;设置对照组(给予25 mmol/L葡萄糖)、高糖组(给予150 mmol/L葡萄糖)和芍药苷组(给予150 mmol/L葡萄糖和10 mmol/L芍药苷),利用高内涵分析法检测TOM20和Trx2蛋白表达。制备DPN大鼠模型,给予白芍总苷后,利用免疫荧光法检测大鼠坐骨神经中TOM20和Trx2蛋白表达。高内涵分析结果显示,150 mmol/L葡萄糖干预12、24 h后,TOM20和Trx2蛋白表达水平均显著降低(<0.05、0.01),且2种蛋白的表达变化存在相关性。与对照组比较,高糖组TOM20和Trx2蛋白表达均显著降低(<0.01);与高糖组比较,芍药苷组TOM20和Trx2蛋白表达均显著升高(<0.01)。Western blotting结果显示,与对照组比较,TOM20 siRNA组TOM20和Trx2蛋白表达水平均显著降低(<0.05、0.01);与TOM20 siRNA组比较,芍药苷干预24、48 h后TOM20和Trx2蛋白表达水平均显著升高(<0.05、0.01)。与对照组比较,模型组大鼠坐骨神经中TOM20和Trx2蛋白表达均显著降低(<0.01);与模型组比较,白芍总苷组TOM20和Trx2蛋白表达均显著升高(<0.01)。芍药苷能够通过上调SCs以及大鼠坐骨神经中TOM20蛋白的表达,促进Trx2蛋白的线粒体输入,从而有效对抗线粒体氧化应激干预DPN。
芍药苷;雪旺细胞;糖尿病周围神经病变;线粒体膜外转位酶20;线粒体硫氧还蛋白
根据国际糖尿病联盟的最新数据显示,目前全球有5.37亿成人患有糖尿病,其中至少50%的患者会发展为糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)[1]。DPN患者表现为神经性疼痛、肢体感觉丧失以及足溃疡和下肢截肢的风险增加,但目前临床上仍缺少针对DPN发病机制的有效疗法[2]。现今使用的主流抗氧化应激药物α-硫辛酸虽具有较好的疗效,但有可能提高2型糖尿病患者细胞对胰岛素的敏感度,导致患者的血糖过低[3]。故而阐明DPN的发病机制,寻找更为有效的治疗药物是目前亟待解决的问题。
脱髓鞘是DPN的主要病理改变之一,而雪旺细胞(Schwann cells,SCs)作为周围神经系统髓鞘形成细胞,在维持周围神经结构和功能方面发挥至关重要的作用[4-5]。现代研究认为,氧化应激所引起的SCs线粒体功能障碍是DPN的主要发病机制之一[6-7]。线粒体蛋白由99%的核编码蛋白和1%的线粒体编码蛋白组成。其中线粒体基因组编码内膜氧化磷酸化机制的几个疏水核心亚基,而核编码蛋白则面向所有4个线粒体亚室(外膜、膜间空间、内膜和基质)。大多数核编码的线粒体前蛋白是通过氨基末端前序定向途径这一线粒体蛋白输入机制进入线粒体。前体蛋白在端导向序列线粒体靶向信号肽的作用下,依次通过线粒体外膜转位酶(translocase of outer mitochondrial membrane,TOM)复合物和线粒体内膜转位酶(translocase of inner mitochondrial membrane,TIM)复合物转运至线粒体基质。其中,定位于线粒体外膜的TOM20,被认为是线粒体蛋白输入的启动子[8-10]。线粒体硫氧还蛋白2(mitochondrial thioredoxin 2,Trx2)在抗氧化应激和维持线粒体功能方面发挥重要作用。Trx2是一种小分子(相对分子质量约1.2×104)的氧化还原蛋白,能够直接清除线粒体中的活性氧(reactive oxygen species,ROS)。同时,Trx2的线粒体相互作用网络(目前已鉴定出53个蛋白)参与线粒体完整性、线粒体内蛋白质合成与折叠、氨基酸和脂质代谢、糖酵解、三羧酸循环和氧化磷酸化等[11]。而线粒体中的Trx2蛋白依赖于TOM20介导的线粒体蛋白输入机制转运至线粒体基质,而后通过线粒体蛋白加工发挥抗氧化应激等功能[12-14]。
课题组前期研究证实,芍药苷能够通过上调核因子E2相关因子2的核转位,增加血红素氧合酶1、γ‐谷氨酰半胱氨酸合成酶表达,从而降低高糖环境下SCs氧化应激,纠正线粒体动力学失衡,升高SCs线粒体膜电位,通过改善线粒体结构和功能发挥抗细胞凋亡作用[15-16]。进一步研究发现,芍药苷及白芍总苷(芍药苷质量分数>90%)能够增加DPN大鼠坐骨神经和高糖环境下SCs中成熟型Trx2和前体Trx2的表达,直接或间接降低氧化应激,改善线粒体功能,降低坐骨神经脱髓鞘,改善大鼠的神经传导速度,干预DPN[17]。现代药理学研究表明,芍药苷具有抗炎、抗氧化、止痛、促进SCs增殖以改善周围神经功能等作用,具有治疗DPN的潜力,但其作用机制尚未阐明[18-19]。课题组通过SCs线粒体的4D-label free蛋白组学筛选发现,在高糖环境下TOM20表达降低。本研究重点探究芍药苷是否通过TOM20依赖的线粒体输入途径介导Trx2的线粒体输入和加工,从而发挥改善线粒体功能而干预DPN。
1 材料
1.1 动物和细胞
SPF级雄性SD大鼠,体质量180~220 g,8周龄,购自维通利华动物技术有限公司,许可证号SCXK(京)2021-0003,饲养于首都医科大学实验动物中心国家标准实验室[SYXK(京)2019-00207)]。动物实验经首都医科大学伦理委员会批准(批准号AEEI-2022-191)。
RSC96细胞株(货号CL-0199)购自武汉普诺赛生命科技有限公司。
1.2 药品与试剂
芍药苷(批号B21148,质量分数≥98%)购自上海源叶生物科技有限公司;白芍总苷胶囊(国药准字H20055058,批号210609)购自宁波立华制药有限公司;链脲佐菌素(streptozotocin,STZ,批号242-648-8,质量分数>98%)购自北京克尔慧科技有限公司;TOM20 siRNA(批号P202302230043)购自广州锐博生物技术有限公司;-葡萄糖(批号G8270)、DAPI(批号D9542)购自美国Sigma公司;DMEM高糖培养基(批号PM150210)购自武汉普诺赛生命科技有限公司;澳洲胎牛血清(批号10099-141)购自美国Gibco公司;0.25%胰酶(批号T1360)、青链霉素混合液(批号P1400)、PBS缓冲液(批号P1020-500)、高效RIPA组织/细胞快速裂解液(批号R0010)、PMSF(批号R0100)、蛋白上样缓冲液(含DTT,批号P1015)、封闭用驴血清(批号SL050)、抗荧光衰减封片剂(含DAPI,批号S2110)购自北京索莱宝科技有限公司;Triton®X-100(批号0694-100 mL)、牛血清白蛋白(批号0332-100G)购自美国Amresco公司;重组TOM20抗体(批号ab186735)、重组Trx2抗体(批号ab185544)、Alexa Fluor®488标记的猴抗兔IgG二抗(批号150061)、Alexa Fluor®594标记的猴抗小鼠IgG二抗(批号150108)购自英国Abcam公司;S-100β多克隆抗体(批号15146-1-AP)、FlexAble CoraLite®Plus 488兔IgG抗体标记试剂盒(批号KFA001)、FlexAble CoraLite®Plus 555兔IgG抗体标记试剂盒(批号KFA002)、FlexAble CoraLite®Plus 647兔IgG抗体标记试剂盒(批号KFA003)购自美国Proteintech公司;蛋白酶抑制剂(批号4693116001)、磷酸酶抑制剂(批号4906845001)购自瑞士Roche公司;SDS-PAGE凝胶配制试剂盒(批号P0012A)、SDS(批号ST627)购自Beyotime公司;Tris(批号1115GR500)、甘氨酸(批号1275GR500)购自BioFroxx公司;脱脂奶粉(批号232100)购自美国BD公司;三色预染蛋白标准品(批号A3A2362)购自艾科瑞生物公司;超敏发光液(批号WBKLS0100)购自美国Millipore公司;异氟烷(批号2022101601)购自瑞沃德生命科技有限公司。
1.3 仪器
DV215CD型电子天平(美国OHAUS公司);AC2-4E1型二级生物安全柜(新加坡ESCO公司);INC153型二氧化碳培养箱(德国Memmert公司);PowerPac™基础电泳仪电源、Mini-PROTEAN®Tetra电泳槽、Trans-Blot®转印槽(美国Bio-Rad公司);FUSION FX凝胶&化学发光成像分析系统(法国Vilber公司);ULT-2186-4-V49型超低温冰箱(美国Thermo Fisher Scientific公司);3K15型低温离心机(美国Sigma公司);Eppendorf ThermoMixer®C恒温混匀仪(德国Eppendorf公司);Allegra X-30型冷冻离心机(美国Beckman公司);TE300型倒置荧光显微镜(日本Nikon公司);DHG-9245A型电热恒温鼓风干燥箱(上海恒一精密仪器有限公司);Opera Phenix Plus高内涵筛选系统(美国PerkinElmer公司);Matrx VIP 3000®Veterinary Vaporizer气体麻醉机(美国Midmark公司)。
2 方法
2.1 体外实验
2.1.1 细胞培养 RSC96细胞用DMEM完全培养基,于37 ℃、5% CO2的细胞培养箱中培养。
2.1.2 高内涵分析 取对数生长期的RSC96细胞,制备成细胞悬液。用DMEM完全培养基将细胞密度调整至4×104个/mL,按100 μL/孔接种于96孔板中,于37 ℃、5% CO2培养箱中培养24 h。吸弃培养基,加入不同浓度(25、100、150 mmol/L)葡萄糖分别干预12、24、48 h。
另取接种RSC96细胞的96孔板,设置对照组、高糖组和芍药苷组,对照组加入25 mmol/L葡萄糖干预24 h,高糖组和芍药苷组加入150 mmol/L葡萄糖干预24 h,芍药苷组同时加入10 mmol/L芍药苷干预24 h。
吸弃培养基,加入4%多聚甲醛室温固定并用PBS缓冲液浸洗细胞。0.1% Triton-X 100/PBS冰浴上透膜,PBS缓冲液浸洗细胞。加入3%牛血清白蛋白/PBS封闭,分别滴加TOM20和Trx2一抗,4 ℃孵育16 h;PBS缓冲液浸洗细胞。滴加相应荧光二抗,室温孵育2 h,PBS缓冲液浸洗细胞。加入DAPI工作液,室温孵育,用PBS缓冲液浸洗细胞。每孔加入新鲜PBS缓冲液。96孔板送至清华大学药学院药物活性筛选平台,应用Opera Phenix高内涵筛选系统对目标蛋白进行定量分析。利用SPSS软件对2种蛋白进行相关性分析。
2.1.3 细胞转染 将对数生长期的RSC96细胞,制备成细胞悬液,用DMEM基础培养基将细胞密度调整至2.5×105个/mL。取4个6 cm的培养皿,分别加入3.8 mL DMEM完全培养基和200 μL细胞悬液,分别标记为对照组、TOM20 siRNA组、TOM20 siRNA+芍药苷24 h组、TOM20 siRNA+芍药苷48 h组,于37 ℃、5% CO2培养箱中培养24 h。前期预实验结果表明,100 nmol/L siRNA干预72 h阻断效果最佳。根据TOM20 siRNA说明书制备终浓度为100 nmol/L的转染复合物,随后避光孵育15 min。吸弃培养皿中培养基,各组加入3.716 mL DMEM基础培养基,TOM20 siRNA组、TOM20 siRNA+芍药苷24 h组、TOM20 siRNA+芍药苷48 h组分别加入284 μL转染复合物,对照组加入含25 mmol/L葡萄糖的284 μL DMEM基础培养基。37 ℃、5% CO2培养箱中培养24 h后,每组加入0.4 mL胎牛血清。TOM20 siRNA+芍药苷24 h组、TOM20 siRNA+芍药苷48 h组分别于加入转染复合物后24、48 h加入0.4 μL 10 mmol/L芍药苷。待TOM20 siRNA干预72 h后进行后续实验。
2.1.4 Western blotting检测TOM20及Trx2蛋白表达 按“2.1.3”项下方法处理细胞并给药,收集细胞,加入裂解液提取蛋白,蛋白样品经12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,加入5%脱脂牛奶,室温封闭2 h,加入TBST洗涤液,于摇床上振荡洗膜;分别加入Trx2、TOM20和β-actin一抗,孵育16 h,加入TBST洗涤液于摇床上振荡洗膜。加入相应二抗孵育1 h,加入TBST洗涤液于摇床上振荡洗膜。滴加发光液显影,用Image J软件进行定量分析。
2.2 体内实验
2.2.1 大鼠造模 造模前检测大鼠空腹血糖,剔除血糖不符合要求的大鼠后,随机分为对照组(8只)和造模组(16只)。用0.1 mol/L无菌枸橼酸缓冲液(pH 4.4)配制成1% STZ的溶液,造模组大鼠ip STZ(60 mg/kg)。1周后空腹血糖≥16.7 mmol/L视为高血糖模型造模成功,连续饲养12周。期间每2周测定1次大鼠空腹血糖,空腹血糖≥25.5 mmol/L的大鼠sc胰岛素以降低死亡率。每4周测定鼠尾热敏感性和足底机械敏感性,监测周围神经病变情况。高血糖持续12周,以热痛阈值、坐骨神经传导速度及坐骨神经病理变化脱髓鞘形成确定DPN模型造模成功。
2.2.2 分组及给药 将成模大鼠随机分为模型组和白芍总苷(5.6 mg/kg)组,每组8只。白芍总苷以生理盐水配制成质量浓度为2 mg/mL的药液,白芍总苷组ig药液,对照组和模型组ig等体积的生理盐水,1次/d,连续给药12周。大鼠末次给药1 h后,采用气体麻醉机,异氟烷气体麻醉,随后立刻进行坐骨神经传导速度测试,腹主动脉取血后大鼠自然死亡,取大鼠坐骨神经进行后续检测。
2.2.3 免疫荧光法测定坐骨神经中TOM20及Trx2蛋白表达 取大鼠坐骨神经进行石蜡包埋切片,切片厚度5 μm。各组随机选取9只大鼠,每只制备1个坐骨神经组织切片,组织切片经脱蜡、水化后,使用微波法进行抗原修复。采用驴血清室温封闭1 h,配制TOM20、Trx2以及S-100β抗体染料混合物,4 ℃孵育过夜(16 h以上),滴加含DAPI封片剂室温孵育,送至首都医科大学医学实验与测试中心形态学研究测试室,应用荧光显微镜(倒置)于40倍镜下观察坐骨神经组织的形态并拍照,每个样本随机选取6个不同区域,用Image J软件计算荧光强度并进行共定位分析。TOM20以红色荧光为阳性表达,激发波长为555 nm;Trx2以绿色荧光为阳性表达,激发波长为488 nm;S100β以紫色为阳性表达,激发波长为647 nm。
2.3 统计学分析

3 结果
3.1 高糖环境对RSC96细胞中TOM20和Trx2蛋白表达的影响
为确定高糖浓度对RSC96细胞TOM20及Trx2蛋白表达的影响,RSC96细胞给予不同浓度(25、100、150 mmol/L)葡萄糖分别干预12、24、48 h。如图1所示,与25 mmol/L葡萄糖组比较,给予高糖干预12、24 h,150 mmol/L葡萄糖组Trx2和TOM20蛋白表达水平均显著降低(<0.05、0.01)。给予高糖干预24 h,100 mmol/L葡萄糖组Trx2蛋白表达水平显著降低(<0.05)。而给予高糖干预72 h后,与25 mmol/L葡萄糖组比较,100、150 mmol/L葡萄糖组Trx2和TOM20蛋白表达水平均无显著差异。表明一定程度的葡萄糖浓度及适当的干预时间能显著影响RSC96细胞线粒体内Trx2及TOM20蛋白的表达量,其中以150 mmol/L葡萄糖干预24 h的影响最为显著。进一步对24 h组的Trx2和TOM20数据进行相关性分析,发现Trx2和TOM20在高糖环境下的表达具有相关性(相关系数为0.790,<0.01)。
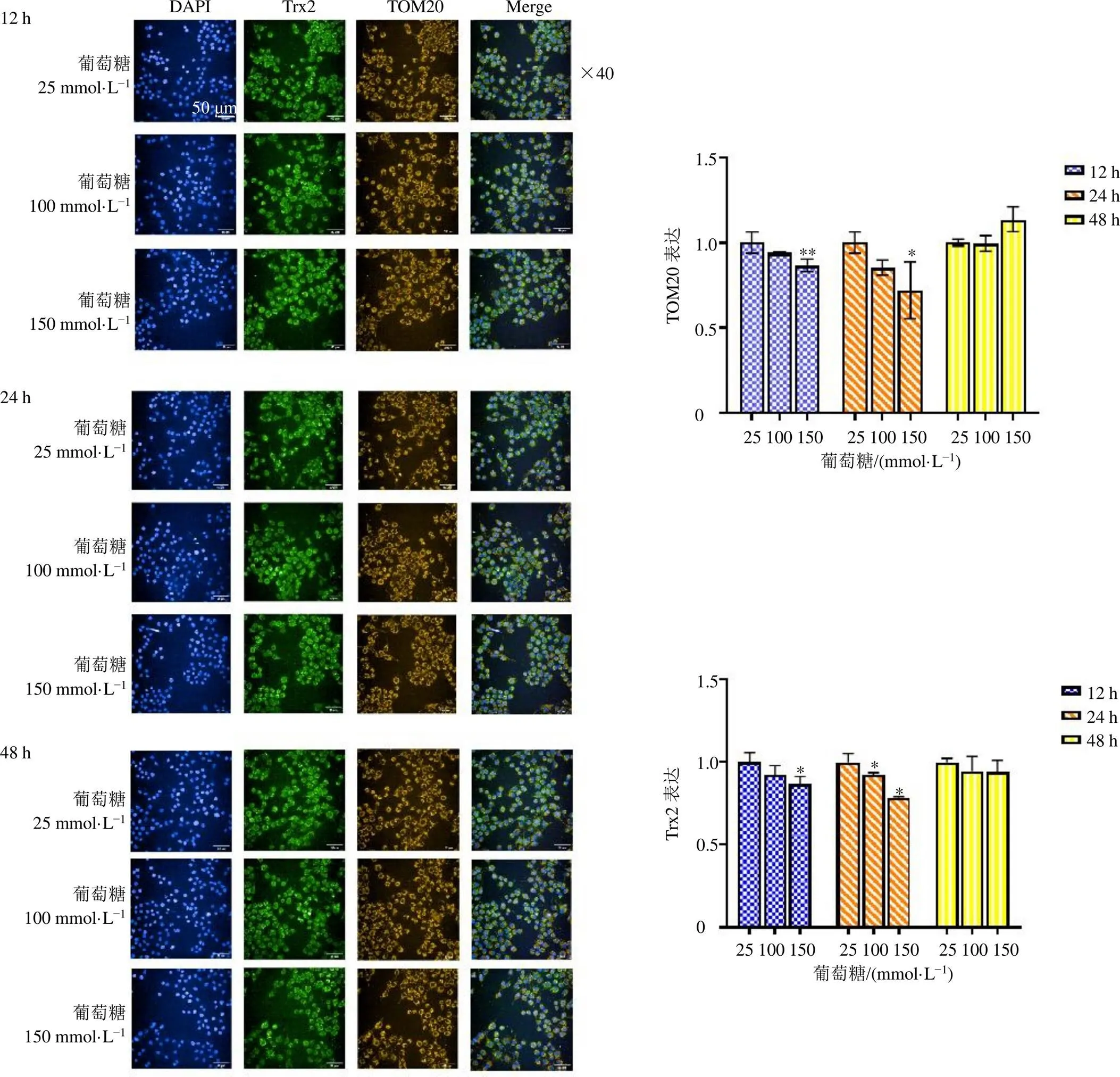
与同时间点25 mmol·L−1葡萄糖组比较:*P<0.05 **P<0.01。
3.2 TOM20调节RSC96细胞的Trx2线粒体输入及芍药苷的调节作用
为进一步确定Trx2的线粒体输入机制是否与TOM20有关以及芍药苷是否通过上调TOM20蛋白的表达来促进Trx2的线粒体输入,采用TOM20 siRNA降低TOM20的表达,并观察Trx2的表达。如图2所示,与对照组比较,TOM20 siRNA组TOM20和Trx2蛋白表达水平显著降低(<0.05、0.01)。而与TOM20 siRNA组比较,芍药苷干预24、48 h后,Trx2和TOM20蛋白表达水平均显著升高(<0.05、0.01)。表明Trx2的线粒体输入可能与TOM20蛋白有关,且芍药苷能通过上调TOM20蛋白的表达量来促进TOM20蛋白的线粒体输入。
3.3 芍药苷对高糖环境下RSC96细胞中TOM20和Trx2表达的影响
如图3所示,与对照组比较,高糖组TOM20和Trx2蛋白表达水平均显著降低(<0.01);与高糖组比较,芍药苷组TOM20和Trx2蛋白表达水平均显著升高(<0.01)。表明芍药苷能够促进高糖环境下RSC96细胞中TOM20蛋白的表达,从而增加Trx2线粒体蛋白输入。
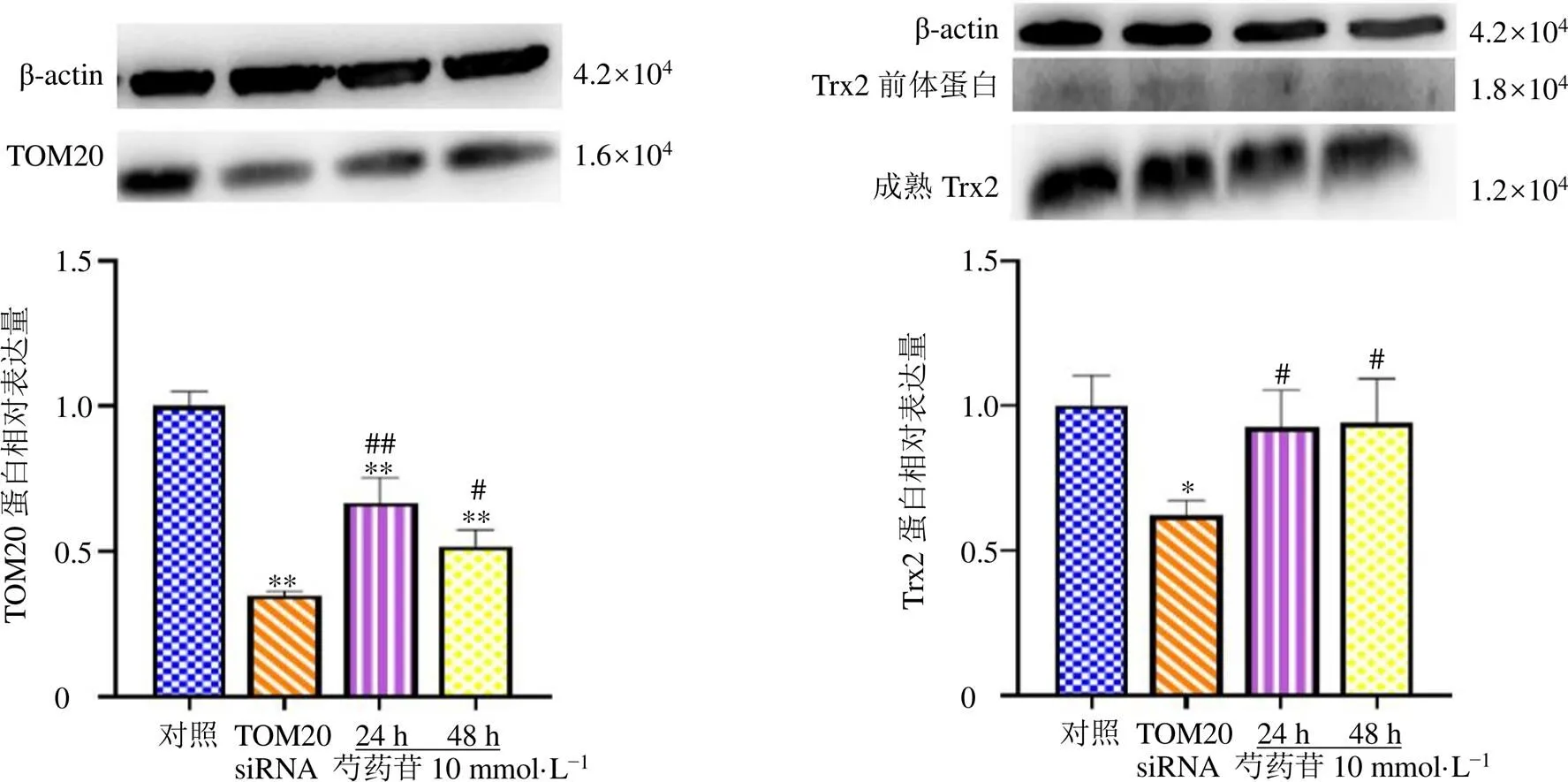
与对照组比较:*P<0.05 **P<0.01;与TOM20 siRNA组比较:#P<0.05 ##P<0.01。

与对照组比较:**P<0.01;与高糖组比较:##P<0.01。
3.4 白芍总苷对DPN大鼠坐骨神经中TOM20和Trx2表达的影响
为验证芍药苷增加DPN大鼠坐骨神经中Trx2的线粒体运输是否通过调控TOM20蛋白的表达,选取DPN大鼠坐骨神经进行免疫荧光三标法,其中S-100β蛋白作为SCs标记物。如图4所示,与对照组比较,模型组TOM20及Trx2蛋白表达均显著降低(<0.01);与模型组比较,白芍总苷组TOM20及Trx2蛋白表达均显著升高(<0.01)。表明白芍总苷能够促进DPN大鼠坐骨神经TOM20蛋白的表达,从而增加Trx2的线粒体运输。
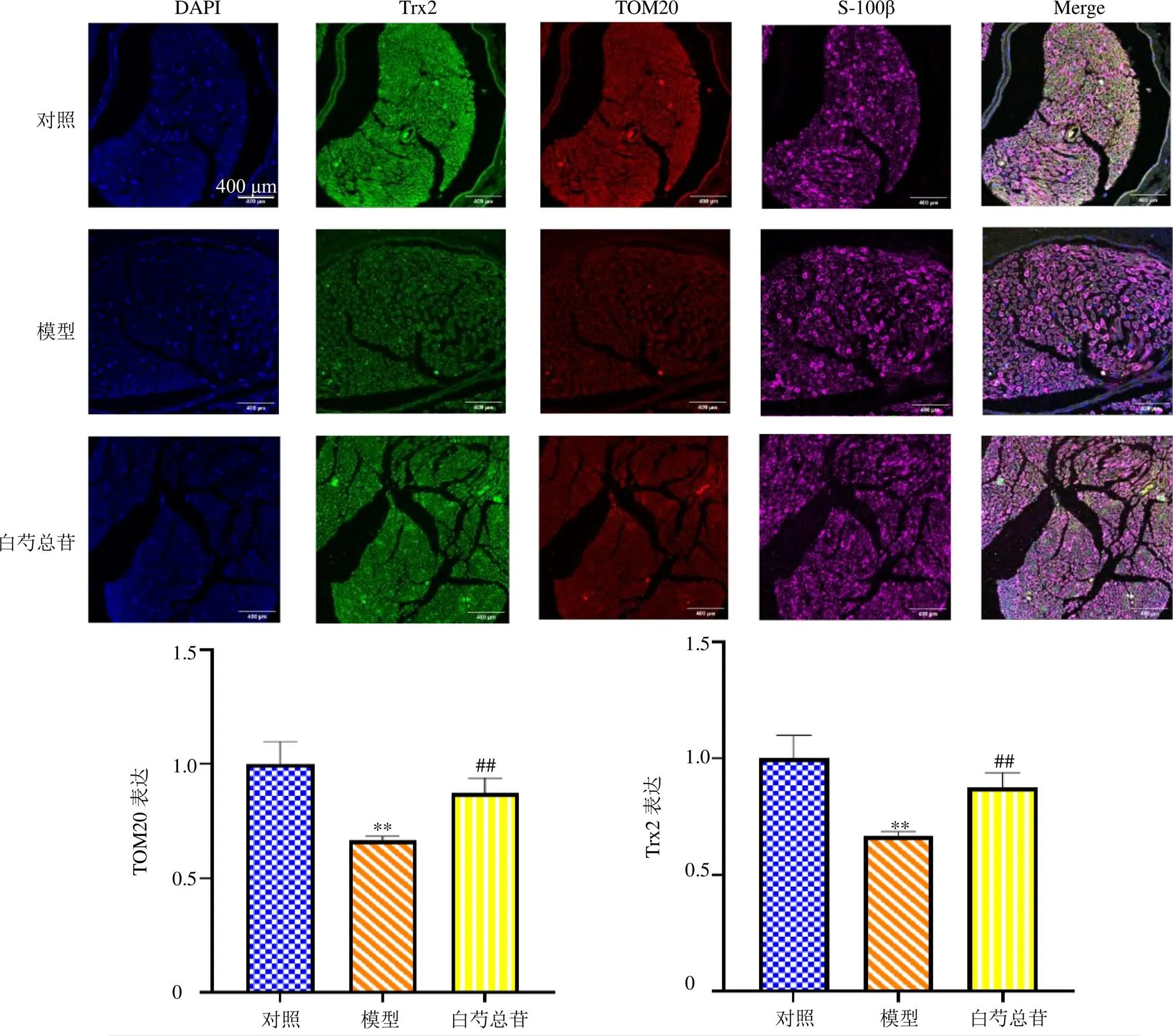
与对照组比较:**P<0.01;与模型组比较:##P<0.01。
4 讨论
高糖环境诱导的线粒体氧化应激,被认为是导致SCs凋亡,坐骨神经脱髓鞘,最终引发DPN的主要发病机制之一。本研究结果表明,芍药苷具有通过上调SCs以及大鼠坐骨神经中TOM20蛋白的表达,促进Trx2的线粒体输入从而降低氧化应激,干预DPN的潜在价值。
在阐明了芍药苷能够通过上调TOM20蛋白的表达来促进Trx2的线粒体输入后,进一步对TOM20依赖的线粒体输入途径或其影响线粒体功能的作用机制进行分析。研究发现,糖尿病小鼠在乙醛脱氢酶2(aldehyde dehydrogenase-2,)基因在过表达和敲减的情况下会影响TOM20蛋白的表达量,但对于正常小鼠则没有影响[20];Zhu等[21]通过建立脓毒症小鼠模型,利用免疫荧光法检测细胞中TOM20蛋白的含量,发现在蛋白激酶Cα(protein kinase Cα type,PRKCA)过表达的情况下能够促进脓毒症患者的线粒体自噬,主要表现为TOM20蛋白与微管相关蛋白轻链3(microtubule-associated protein light chain3,LC3)蛋白的共定位以及表达量增加;You等[22]利用香烟提取物处理BEAS-2B细胞,发现泛素特异性蛋白水解酶19(ubiquitin carboxyl-terminal hydrolase 19,USP19)敲低的细胞中TOM20蛋白表达升高,从而降低了FUNDC1和LC3-II/I的表达,提高了细胞存活率。
根据前期SCs线粒体蛋白质组学的结果,已鉴定SCs线粒体蛋白1 072个,其中高糖环境诱导的差异蛋白392个,包括348个蛋白的表达显著上调,44个蛋白的表达显著降低。在课题组前期组学结果中,也观测了USP19、ALDH2、PRKCA蛋白的表达发生了显著性变化。而对于芍药苷是否通过调控这几种蛋白的表达来影响TOM20蛋白尚未可知,是可以进一步探索的问题。同时,在查阅文献以及STRING数据库时发现线粒体动力相关蛋白1(dynamin-related protein 1,Drp1)[23]、FUNDC1[24]、NR1D1[25]、PINK1[26]等蛋白也能够一定程度上调控TOM20蛋白的表达,但比较遗憾的是课题组前期组学数据中尚未观测到以上几种蛋白或是并未出现显著性差异。究其原因可能是SCs线粒体提取与鉴定、线粒体蛋白定位等的复杂性。
TOM20除了作为线粒体输入蛋白,还主要作为检测线粒体自噬以及细胞衰老的标志物。Li等[27]通过LC3‐II/I和p62在TOM20和LAMP1之间的表达和共定位,证实了线粒体去乙酰化酶sirtuin 3(SIRT3)显著调节肝纤维化中的线粒体自噬。Victorelli等[28]证实了线粒体外膜通透性增加是细胞衰老的重要特征,而在辐射诱导的衰老细胞以及复制性衰老细胞中,细胞色素C与TOM20蛋白的共定位减少。大量研究表明,线粒体可以通过自噬来消融受损的线粒体,以起到抑制线粒体ROS氧化应激的作用[29]。本研究发现,高糖环境下TOM20蛋白的表达显著降低,故而认为SCs在高糖环境下氧化应激可能也与线粒体自噬减弱有关。
利益冲突 所有作者均声明不存在利益冲突
[1] Ogurtsova K, Guariguata L, Barengo N C,. IDF Diabetes Atlas: Global estimates of undiagnosed diabetes in adults for 2021 [J]., 2022, 183: 109118.
[2] Tesfaye S, Sloan G, Petrie J,. Comparison of amitriptyline supplemented with pregabalin, pregabalin supplemented with amitriptyline, and duloxetine supplemented with pregabalin for the treatment of diabetic peripheral neuropathic pain (OPTION-DM): A multicentre, double-blind, randomised crossover trial [J]., 2022, 400(10353): 680-690.
[3] 甘兆义, 李春妮, 韦雄丽, 等. 糖尿病周围神经病变的早期诊断及治疗进展 [J]. 中国卫生标准管理, 2023, 14(11): 194-198.
[4] Eid S A, Rumora A E, Beirowski B,. New perspectives in diabetic neuropathy [J]., 2023, 111(17): 2623-2641.
[5] Morgenstern J, Groener J B, Jende J M E,. Neuron-specific biomarkers predict hypo-and hyperalgesia in individuals with diabetic peripheral neuropathy [J]., 2021, 64(12): 2843-2855.
[6] Eftekharpour E, Fernyhough P. Oxidative stress and mitochondrial dysfunction associated with peripheral neuropathy in type 1 diabetes [J]., 2022, 37(7/8/9): 578-596.
[7] Gonçalves N P, Vægter C B, Andersen H,. Schwann cell interactions with axons and microvessels in diabetic neuropathy [J]., 2017, 13(3): 135-147.
[8] Schäfer J A, Bozkurt S, Michaelis J B,. Global mitochondrial protein import proteomics reveal distinct regulation by translation and translocation machinery [J]., 2022, 82(2): 435-446.
[9] Song J Y, Herrmann J M, Becker T. Quality control of the mitochondrial proteome [J]., 2021, 22(1): 54-70.
[10] Fatima N U, Ananthanarayanan V. Mitochondrial movers and shapers: Recent insights into regulators of fission, fusion and transport [J]., 2023, 80: 102150.
[11] Chasapis C T, Makridakis M, Damdimopoulos A E,. Implications of the mitochondrial interactome of mammalian thioredoxin 2 for normal cellular function and disease [J]., 2019, 137: 59-73.
[12] Chen C F, Wang K, Zhang H F,. A unique SUMO-interacting motif of Trx2 is critical for its mitochondrial presequence processing and anti-oxidant activity [J]., 2019, 10: 1089.
[13] Murcha M W, Elhafez D, Millar A H,. The-terminal extension of plant mitochondrial carrier proteins is removed by two-step processing: The first cleavage is by the mitochondrial processing peptidase [J]., 2004, 344(2): 443-454.
[14] Murphy M P. Mitochondrial thiols in antioxidant protection and redox signaling: distinct roles for glutathionylation and other thiol modifications [J]., 2012, 16(6): 476-495.
[15] 朱晏伯, 李潇, 朱笳悦, 等. 芍药苷对高糖环境下雪旺细胞线粒体动力学的影响[J]. 中国糖尿病杂志, 2022, 30(3): 214-220.
[16] Yang X W, Yao W J, Shi H T,. Paeoniflorin protects Schwann cells against high glucose induced oxidative injury by activating Nrf2/ARE pathway and inhibiting apoptosis [J]., 2016, 185: 361-369.
[17] Yang X W, Li X, Zhu Y B,. Paeoniflorin upregulates mitochondrial thioredoxin of Schwann cells to improve diabetic peripheral neuropathy indicated by 4D label-free quantitative proteomics [J]., 2022, 2022: 4775645.
[18] 陈佳, 李伟, 刘征, 等. 基于GEO数据库的DPN相关靶点挖掘及与芍药苷分子对接研究 [J]. 广东药科大学学报, 2020, 36(4): 514-518.
[19] 张育贵, 张淑娟, 边甜甜, 等. 芍药苷药理作用研究新进展[J]. 中草药, 2019, 50(15): 3735-3740.
[20] Zhang Y M, Zou R J, Abudureyimu M,. Mitochondrial aldehyde dehydrogenase rescues against diabetic cardiomyopathy through GSK3β-mediated preservation of mitochondrial integrity and parkin-mediated mitophagy [J]., 2023: mjad056.
[21] Zhu Q J, Wang J, Li Y,. PRKCA promotes mitophagy through the miR-15a-5p/PDK4 axis to relieve sepsis-induced acute lung injury [J]., 2023, 91(1): e0046522.
[22] You Y J, Wang H J, Wang Q,. Silencing USP19 alleviates cigarette smoke extract-induced mitochondrial dysfunction in BEAS-2B cells by targeting FUNDC1 [J]., 2023, 18(1): 20230798.
[23] Wu H X, Li G D, Chen W W,. Drp1 knockdown represses apoptosis of rat retinal endothelial cells by inhibiting mitophagy [J]., 2022, 124(1): 151837.
[24] Peng H, Fu S Z, Wang S Y,. Ablation of FUNDC1-dependent mitophagy renders myocardium resistant to paraquat-induced ferroptosis and contractile dysfunction [J]., 2022, 1868(9): 166448.
[25] Yu B, Pan J B, Yu F Y. The combination of nuclear receptor NR1D1 and ULK1 promotes mitophagy in adipocytes to ameliorate obesity [J]., 2022, 11(1): 202-212.
[26] Roise D, Horvath S J, Tomich J M,. A chemically synthesized pre-sequence of an imported mitochondrial protein can form an amphiphilic helix and perturb natural and artificial phospholipid bilayers [J]., 1986, 5(6): 1327-1334.
[27] Li R X, Wang Z C, Wang Y,. SIRT3 regulates mitophagy in liver fibrosis through deacetylation of PINK1/NIPSNAP1 [J]., 2023, 238(9): 2090-2102.
[28] Victorelli S, Salmonowicz H, Chapman J,. Apoptotic stress causes mtDNA release during senescence and drives the SASP [J]., 2023, 622(7983): 627-636.
[29] Cai J, Guan H, Li D,. New insights into microalgal astaxanthin’s effect on lambda-cyhalothrin-induced lymphocytes immunotoxicity in: Involving miRNA-194-5p-FoxO1-mediated-mitophagy and pyroptosis [J]., 2023, 141: 109046.
Effect of paeoniflorin on TOM20 of mitochondrial import pathway in diabetic peripheral neuropathy
LIU Dongqi1, YAN Shiqi1, LIU Haolong2, YANG Xinwei1
1. Beijing Key Laboratory of Traditional Chinese Medicine Research on Collaterals, School of Traditional Chinese Medicine, Capital Medical University, Beijing 100069, China 2. Beijing Chao-Yang Hospital, Capital Medical University, Beijing 100020, China
To investigate the effect of paeoniflorin (PF) on the protein involved in mitochondrial import pathway mitochondrial translocase of outer mitochondrial membrane 20 (TOM20) in the sciatic nerve of diabetic peripheral neuropathy (DPN) rats and high glucose environment of Schwann cells (SCs).RSC96 cells was used to intervene with 25, 100 and 150 mmol/L glucose for 12, 24 and 48 h, respectively, and the expressions of TOM20 and mitochondrial thioredoxin 2 (Trx2) were detected by high content analysis; Control group (25 mmol/L glucose), TOM20 siRNA group, TOM20 siRNA + paeoniflorin 24 h group, and TOM20 siRNA + paeoniflorin 48 h group were set up. After transfection with TOM20 siRNA, 10 mmol/L paeoniflorin was given for 24, 48 h, respectively, Western blotting was used to detect TOM20 and Trx2 protein expressions; Control group (25 mmol/L glucose), high glucose group (150 mmol/L glucose), and paeoniflorin group (150 mmol/L glucose + 10 mmol/L paeoniflorin) were set up, high connotation analysis was used to detect TOM20 and Trx2 protein expressions. DPN rat model was prepared and given total glucosides of paeony, immunofluorescence was used to detect TOM20 and Trx2 protein expressions in sciatic nerve of rats.The results of high content analysis showed that after 12, 24 h of 150 mmol/L glucose intervention, TOM20 and Trx2 protein expressions were significantly decreased (< 0.05, 0.01), and there was a correlation between the expressions of the two proteins. Compared with control group, TOM20 and Trx2 protein expressions in high glucose group were significantly decreased (< 0.01); Compared with high glucose group, TOM20 and Trx2 protein expressions in paeoniflorin group were significantly increased (< 0.01). The results of Western blotting showed that compared with control group, TOM20 and Trx2 protein expressions in TOM20 siRNA group were significantly decreased (< 0.05, 0.01); Compared with TOM20 siRNA group, TOM20 and Trx2 protein expressions were significantly increased after intervention with paeoniflorin for 24, 48 h (< 0.05, 0.01). Compared with control group, TOM20 and Trx2 protein expressions were significantly decreased in sciatic nerve of rats in model group (< 0.01); Compared with model group, TOM20 and Trx2 protein expressions were significantly increased in total glucosides of paeony group (< 0.01).Paeoniflorin can effectively counteract mitochondrial oxidative stress by up-regulating the expression of TOM20 protein in SCs as well as rat sciatic nerve and promoting the mitochondrial input of Trx2, which has therapeutic potential for the treatment of DPN.
paeoniflorin; Schwann cells; diabetic peripheral neuropathy; translocase of outer mitochondrial membrane 20; mitochondrial thioredoxin
R285.5
A
0253 - 2670(2024)09 - 2987 - 09
10.7501/j.issn.0253-2670.2024.09.013
2023-11-18
国家自然科学基金面上项目(82174184);北京市教育委员会科技计划一般项目(KM202210025021);北京市科学技术协会青年人才托举工程(BYESS2023386);国家自然科学基金青年项目(82204826)。
刘东齐(2001—),男,硕士研究生,研究方向为中药防治糖尿病周围神经病变的机制研究。E-mail: 15801564517@163.com
通信作者:杨鑫伟(1989—),女,副教授,硕士生导师,从事中药及复方药效和作用机制研究。E-mail: yxw0226@ccmu.edu.cn
[责任编辑 李亚楠]

