腹腔镜手术治疗直径5~10 cm 胃肠道间质瘤的临床研究*
宁伟伟
(1 遵义医科大学附属医院消化病医院 贵州遵义 563000;2 遵义医科大学附属医院 贵州遵义 563000)
胃肠道间质瘤(GIST)是一种起源于胃肠道间叶组织的消化道常见肿瘤,多发于胃部,占总发病率的50%~70%,中老年群体为高发人群,鲜有40 岁以下患者,发病率在性别方面,差异无统计学意义[1]。GIST 发病初期无特异性临床表现,不同位置及体积的患者症状也不同,主要为胃肠道出血、吞咽困难等、腹痛。虽然该病在消化道肿瘤中占比较少,但其形态多样,既可呈现为良性,也可呈现为恶性,现临床对鉴别良恶性缺乏统一判定标准。目前,临床主要依据GIST 的直径、有丝分裂状况、病灶位置等信息评估其危险性,以指导临床制定有效的方案。由于GIST 放化疗灵敏度较低,且靶向药物治疗仍处于发展阶段,故手术已成为最佳治疗方案,切除肿瘤周围≥2 cm 组织为降低复发率及预防转移的共识[2]。大部分GIST 直径<2 cm 患者倾向于良性,因此临床建议肿瘤直径<5 cm 患者首选腹腔镜手术治疗。既往,临床在治疗5 cm≤肿瘤直径≤10 cm 的患者多采用开腹手术治疗,可起到根除作用,但其产生的创伤性较大[3]。随着腹腔镜技术发展日益成熟,已有研究证实,腹腔镜手术治疗直径5~10 cm GIST 患者的可行性,但对其治疗的有效性及安全性尚存在一定争议[4]。本研究旨在分析腹腔镜手术治疗大直径(5~10 cm)GIST 的临床价值。现报道如下:
1 资料与方法
1.1 一般资料 收集2021 年1 月至2023 年5 月我院收治的68 例GIST 患者资料,按照手术方式不同分为对照组(34 例)和观察组(34 例)。对照组男19例,女15 例;年龄42~68 岁,平均(55.36±3.52)岁;肿瘤直径5~10 cm,平均(6.89±1.02)cm;美国国立卫生研究院(NIH)危险分级:中度20 例,高度14例;肿瘤区域:胃部18 例,直肠7 例,小肠9 例。观察组男17 例,女17 例;年龄40~69 岁,平均(55.75±3.18)岁;肿瘤直径5~10 cm,平均(6.93±1.10)cm;NIH 危险分级:中度22 例,高度12 例;肿瘤区域:胃部19 例,直肠8 例,小肠7 例。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经医院医学伦理委员会审核批准(伦理号:2020000114)。
1.2 入选标准 纳入标准:符合西医[5]诊断标准;经临床影像学检查及术后病理检查确诊;肿瘤直径5~10 cm;符合手术指征;卡氏功能(KPS)评分>80分;临床资料及随访资料完整。排除标准:术前已发生远处转移;伴凝血功能障碍;合并全身感染性疾病;伴严重肝肾功能不全;既往有腹部手术史;合并其他恶性肿瘤;合并免疫系统疾病。
1.3 手术方法 观察组行腹腔镜手术治疗:指导患者呈平卧位,实施常规消毒后进行气管插管全麻,自脐下方进针,建立12~15 mmHg 人工气腹,在脐下方作长1 cm 手术切口,将其作为观察孔,操作孔范围在锁骨左右两边中线肋缘向下3~4 cm 处,具体位置可根据肿瘤体积、位置状况决定,经30°腹腔镜仔细观察腹腔内部状况,选取相应的切除方式切除肿瘤及周边2 cm 组织,并将切除组织标本送至病理科检查。对照组行开腹手术治疗:患者呈平卧位,全身麻醉后在腹中区域作长10~15 cm 切口,逐层剖腹后依据病灶具体位置选取相应切除方式,切除肿瘤及周边2~3 cm 组织,其余与观察组等同。两组术后均行常规引流、预防感染、胃肠减压等治疗,开始排气后准予进食流质食物,鼓励患者尽早下床活动,术后均接受随访。
1.4 观察指标(1)围术期指标:手术时间、引流时间、排气时间、住院时间及术中出血量。(2)并发症发生情况:如吻合口瘘、肠梗阻、术后出血、切口感染等。(3)炎症反应和免疫功能指标:分别抽取于术前、术后3 d 清晨抽取患者空腹静脉血5 ml,并进行离心处理,平均分为2 部分放置于抗凝管内,分别用于测定炎症反应指标[血清白介素-6(IL-6)、C 反应蛋白(CRP)]水平及免疫功能[免疫球蛋白G(IgG)、免疫球蛋白A(IgA)、免疫球蛋白M(IgM)]水平。(4)生活质量:参照生活质量评定问卷(GQOLI-74)[6]评估术前、术后1 个月患者生活质量,包括4 个维度,各个维度总分均为100 分,分数与生活质量成正比。
1.5 统计学方法 采用SPSS23.0 软件进行数据处理,计量资料以()表示,采用独立样本t检验,计数资料以%表示,采用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组炎症介质水平比较 术后3 d,两组IL-6、CRP 水平较术前高,但观察组低于对照组(P<0.05)。见表1。
表1 两组炎症介质水平比较()
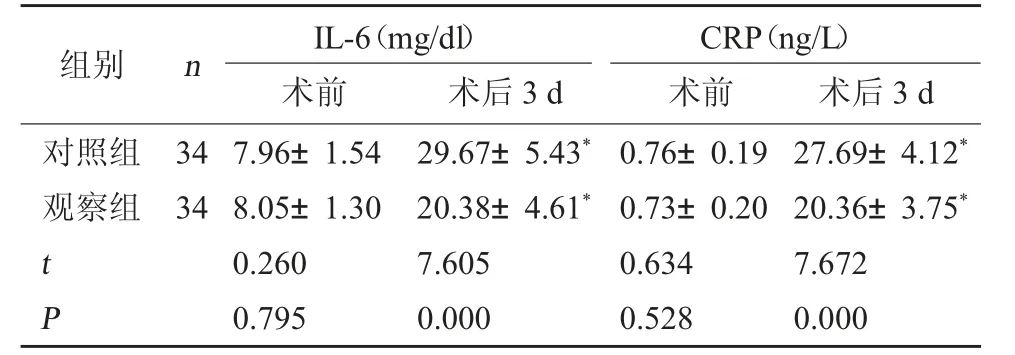
表1 两组炎症介质水平比较()
注:与本组术前相比,*P<0.05。
2.2 两组围术期指标比较 观察组手术时间、引流时间、排气时间、住院时间短于对照组,术中出血量低于对照组(P<0.05)。见表2。
表2 两组围术期指标比较()
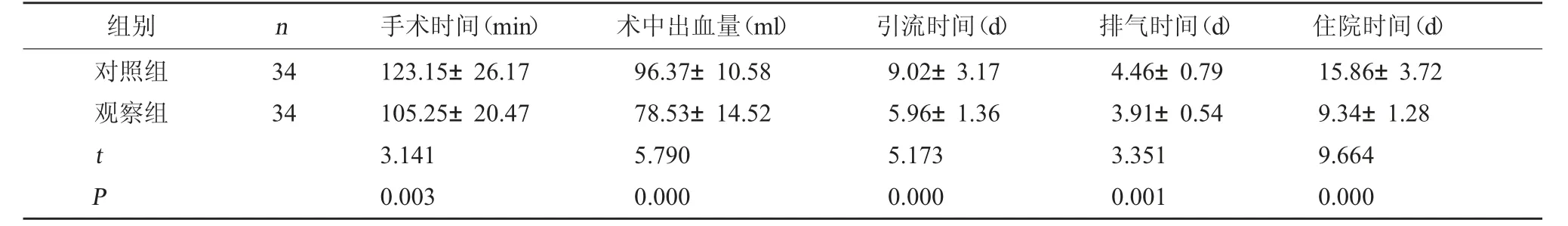
表2 两组围术期指标比较()
2.3 两组免疫功能指标比较 术前两组免疫功能指标比较,差异无统计学意义(P>0.05);两组术后3 d 的IgG、IgA、IgM 水平较治疗前低,但观察组高于对照组(P<0.05)。见表3。
表3 两组免疫功能指标比较(g/L,)
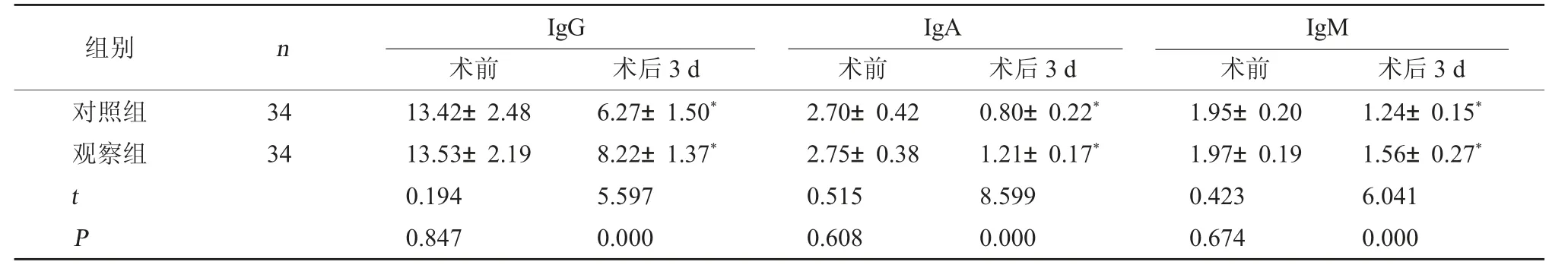
表3 两组免疫功能指标比较(g/L,)
注:与本组术前相比,*P<0.05。
2.4 两组生活质量评分比较 术前两组生活质量评分比较,差异无统计学意义(P>0.05);两组术后1个月的生活质量评分较术前高,且观察组高于对照组(P<0.05)。见表4。
表4 两组生活质量评分比较(分,)
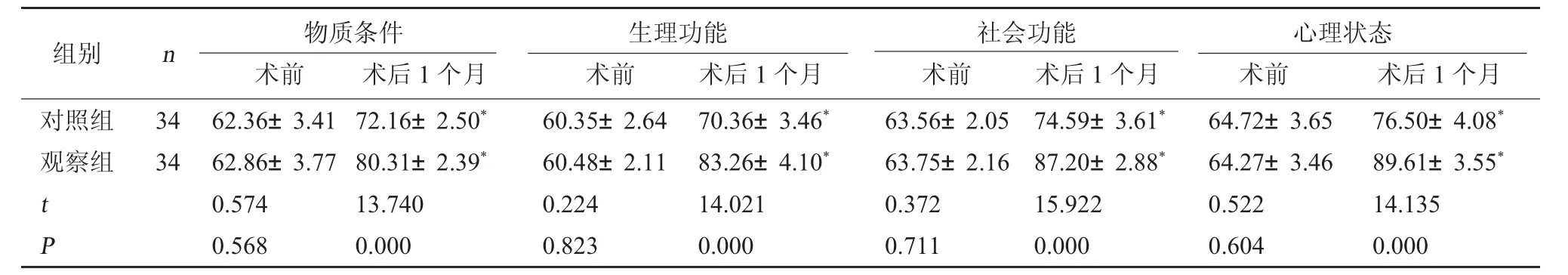
表4 两组生活质量评分比较(分,)
注:与本组术前相比,*P<0.05。
2.5 两组并发症发生情况比较 观察组并发症发生率低于对照组(P<0.05)。见表5。
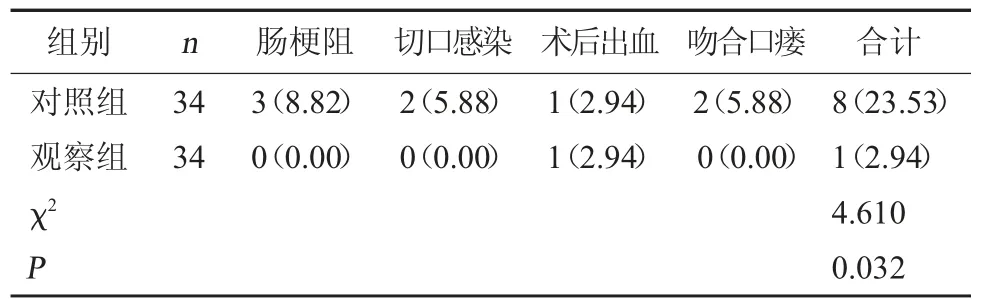
表5 两组并发症发生情况比较[例(%)]
3 讨论
GIST 患者早期症状不明显,缺乏特异性表现,故主要经免疫组化及影像学检查确诊,近年诊出率呈流行趋势。目前,开腹手术、内镜黏膜下剥离术及腹腔镜均为常用的治疗方案,其中内镜黏膜下剥离术在减少手术创伤性及促进术后身体恢复方面具有优势,但其仅适用于直径<2 cm GIST 的患者[7]。开腹手术治疗可直接起到根治作用,但其手术切口大,会增加手术创伤性,诱发术后并发症,部分患者无法耐受,导致其临床应用存在一定局限性[8]。腹腔镜技术在治疗直径<5 cm 的GIST 患者中效果已得到广泛认可,且具有明显的微创优势,但对于其能否有效治疗直径>5 cm 的患者尚存在一定争议。
随着临床对GIST 患者腹腔镜技术不断深入研究,其适应证逐渐增加,病灶体积已不属于严格禁忌证范围。既往,有相关指南指出腹腔镜手术不可用于GIST 临床治疗中,而近年国内外均有研究指出,直径>5 cm 的GIST 患者经腹腔镜手术治疗效果良好,建议对于位置可观的肿瘤采取腹腔镜手术治疗[9]。因此,临床已逐渐打破腹腔镜手术治疗GIST 患者的限制。本研究结果显示,观察组手术时间、引流时间、排气时间、住院时间短于对照组,术中出血量低于对照组,并发症发生率低于对照组(P<0.05)。这提示腹腔镜手术治疗直径5~10 cm 的GIST 效果明显,可有效缩短治疗时间,促进术后身体快速恢复。开腹手术操作切口较大,需逐层切开,加之术中组织牵拉,导致手术创伤性较大,不仅会增加出血量,还会延长术后恢复时间,且对于5~10 cm 肿瘤,其切除时需更谨慎,增加手术操作时间[10]。腹腔镜手术无须采取大切口,观察孔与操作孔最大长度仅为4 cm,可有效减轻手术创伤性,并且术中在腹腔镜直视下进行操作,不仅有助于精准切除病灶组织,还可减轻对周围血管的损伤性,微创优势显著[11]。另外,腹腔镜手术切口小、术中操作对肠道刺激小,故术后发生肠梗阻、切口感染等并发症风险性更小[12]。
炎症反应变化可在一定程度上反应手术应激状况,适度的应激反应可提升机体应对防御能力,但严重的应激反应可过度增强丘脑下部-垂体前叶-肾上腺皮质功能及交感神经兴奋,导致机体各项生命体征波动,降低机体免疫功能。IL-6 是一种具有诸多生物活性的细胞因子,主要由单核巨噬细胞、辅助型T 细胞2 产生,在调节炎免疫应答、炎症反应、细胞增殖分化等方面发挥重要作用。CRP 主要由肝脏产生,在健康人体中CRP 表达较低,但当机体处于感染状态或应激状态时,肝脏组织即可合成大量CRP[13]。本研究结果显示,术后3 d,两组IL-6、CRP 水平均高,但观察组低于对照组;两组术后3 d 的IgG、IgA、IgM 水平较治疗前低,但观察组高于对照组(P<0.05)。这表明腹腔镜手术治疗直径5~10 cm 的GIST 对机体炎症反应及免疫功能影响比开腹手术小,利于减轻手术应激反应。究其原因可能与腹腔镜手术仅需打孔操作,无须长切口,创伤性小存在密切关联[14]。免疫系统与神经刺激有一定的关联,故手术对神经刺激越小,免疫系统产生的波动也会减小[15]。本研究结果还显示,两组术后1 个月的生活质量评分较术前高,且观察组高于对照组(P<0.05)。这提示腹腔镜手术治疗患者生活质量更高。综上所述,腹腔镜手术治疗直径5~10 cm GIST 可有效缩短治疗周期,降低术后并发症发生率,减轻手术应激反应,提高患者生活质量。

