血浆抗凝血酶Ⅲ、D-二聚体、纤维蛋白原降解产物联合检测在突聋患者诊断和治疗中的临床分析
谌祎玮,王 宁,肖旭平,周建波
湖南省人民医院耳鼻喉咽喉头颈外科,湖南 长沙 410005
2019年,美国耳鼻咽喉头颈外科基金会更新了突发性聋(SHL)的临床实践指南[1]。SHL 中听力损失可以是传导性、感音神经性或混合性。突发感音神经性聋(SSNHL)是SHL 的一个亚型,SSNHL 作为耳鼻喉科常见急症,其发病率呈逐年上升趋势[2],常伴随耳鸣、眩晕、耳闷胀感、听觉过敏、耳周感觉异常,严重影响患者生活质量,部分患者还会面临一定程度的精神心理方面问题,如焦虑、抑郁、睡眠障碍等[3]。SSNHL病因与发病机制目前尚不明确,多与炎症反应和微循环障碍相关。其中内耳微循环障碍学说的观点被大部分学者接受,认为由于多因素导致内耳血管痉挛、栓塞、出血等,引起局部毛细血管扩张、组织水肿、缺血缺氧、代谢紊乱等,进而导致SSNHL 的发生。因此,改善内耳微循环是治疗SHL 的关键[4]。因此,本研究通过对血浆抗凝血酶Ⅲ(AT-Ⅲ)、D-二聚体(D-dimer)、纤维蛋白原降解产物(FDP)的联合分析,探讨微血栓形成在SSNHL中的临床价值,从而为临床的治疗及疾病的预后提供理论支持。现将结果报告如下。
1 资料与方法
1.1 一般资料
选取2021 年1 月—2022 年5 月湖南省人民医院收治的60 例SHL 患者作为突聋组,另选70 例同期住院治疗的鼻中隔偏曲、声带息肉、耳前瘘管、成人鼾症中听力正常患者作为对照组。突聋组男33例,女27例;年龄20~69岁,平均年龄(45.25±3.38)岁;发病时间1 周~1 个月;根据治疗前的纯音听阈结果参照国内2015年指南分型意见将突聋组患者分为:低频下降型(低频组)12例、高频下降型(高频组)18 例、平坦型和全聋型(统称为全频型,全频组)30例。
对照组男41 例,女29 例;年龄32~66 岁;平均年龄(44.66±4.58)岁。两组患者一般资料具有可比性(P>0.05)。本研究经医院伦理委员会审批通过。
纳入标准:突聋组患者均符合SSNHL诊断标准;突聋组患者在入院前均未接受过治疗;所有患者1 个月内未服用过抗血小板、抗凝和溶栓类药物;所有患者自愿参加本次研究,且患者及家属均签署知情同意书。
排除标准:心、脑、肝、肾、自身免疫性疾病,恶性肿瘤,重症肝病,可能导致凝血功能异常的血液系统疾病。
1.2 方法
两组患者均禁食禁饮8 h,抽取静脉血2 mL,离心后分离出血浆冷冻待检。采用发色底物法检测血浆AT-Ⅲ活性水平,采用免疫比浊检测血浆D-Dimer、FDP 含量。观察两组患者的血浆AT-Ⅲ、D-Dimer、FDP水平。
1.3 统计学方法
应用SPSS 22.0 软件进行统计分析。计量资料以均数±标准差(±s)表示,经正态性检验与方差齐性检验后,正态分布且方差齐性的计量资料,组间比较行LSD-t检验,组内比较行单样本t检验,偏态分布的数据用秩和检验。计数资料以例数和百分比(%)表示,组间比较采用χ2或Fisher检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者实验指标情况
突聋组D-dimer、FDP 水平低于对照组,AT-Ⅲ高于对照组,差异有统计学意义(P<0.05),见表1。
表1 两组患者实验指标情况(±s)
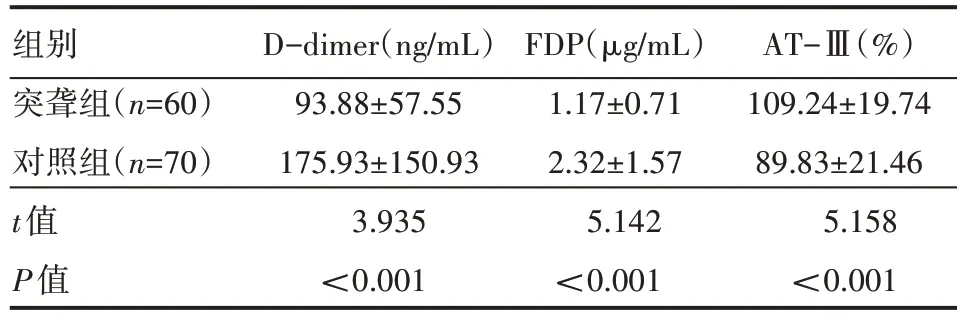
表1 两组患者实验指标情况(±s)
组别突聋组(n=60)对照组(n=70)t值P值D-dimer(ng/mL)93.88±57.55 175.93±150.93 3.935<0.001 FDP(μg/mL)1.17±0.71 2.32±1.57 5.142<0.001 AT-Ⅲ(%)109.24±19.74 89.83±21.46 5.158<0.001
2.2 各组实验指标情况
高频组、全频组D-dimer、FDP 水平高于对照组、低频组,AT-Ⅲ水平低于对照组、低频组,差异有统计学意义(P<0.05),见表2。
表2 各组实验指标情况(±s)
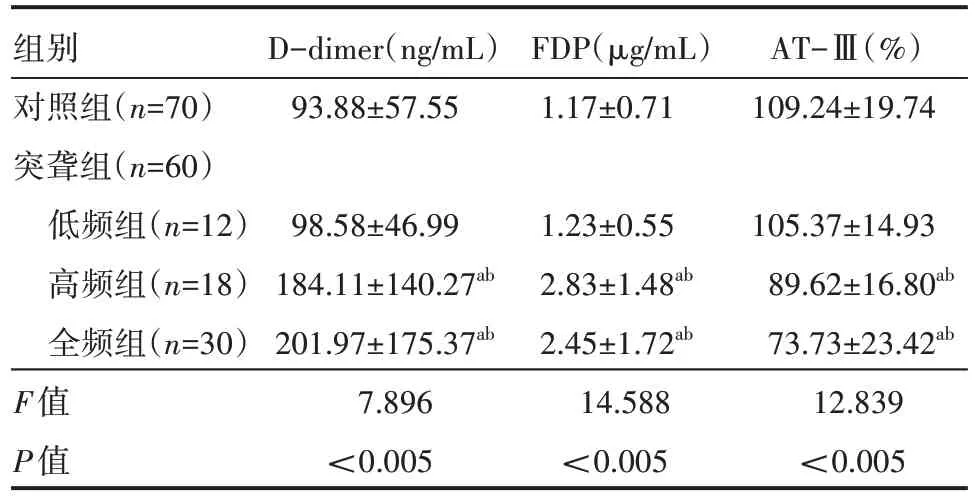
表2 各组实验指标情况(±s)
a表示与对照组比较,P<0.05;b表示与低频组比较,P<0.05。
组别对照组(n=70)突聋组(n=60)低频组(n=12)高频组(n=18)全频组(n=30)F值P值D-dimer(ng/mL)93.88±57.55 FDP(μg/mL)1.17±0.71 AT-Ⅲ(%)109.24±19.74 98.58±46.99 184.11±140.27ab 201.97±175.37ab 7.896<0.005 1.23±0.55 2.83±1.48ab 2.45±1.72ab 14.588<0.005 105.37±14.93 89.62±16.80ab 73.73±23.42ab 12.839<0.005
3 讨论
SHL 是指在不明原因的情况下发生的听力损失,常在3 d 内出现的急性感音神经性听力下降,是耳内科的常见病、多发病。SHL 起病急、病程短,患者主观感受较强,部分患者伴有耳鸣、眩晕、耳闷,甚至出现焦虑、抑郁等心理症状,严重影响患者的生活及工作,近年来随着生活压力的增加,SHL 的发病率逐年上升。目前,SSNHL 病因及发病机制暂不明确,可能与内耳血管痉挛、病毒感染、血管微循环因素、传染性疾病、自身免疫性内耳疾病等有关[6],而现有的治疗方案主要是通过改善内耳微循环来进一步挽救听力。
中华医学会发布了《突发性聋诊疗指南(2015)》[7],按照听力损失的类型,将SHL 分为低频型、高频型、平坦型及全聋型。不同类型的发病机制也不同。低频下降型SSNHL 多以轻、中度听力损失为主,下降频率主要集中在1 000 Hz 及以下,其主要发病机制可能与内耳膜迷路积水[8]、螺旋韧带供血障碍相关,因该类型主要损失耳蜗顶周毛细胞,此处正常代谢耗氧量较少,且血供较蜗底丰富,耐受力较好,故该类型患者预后较好。高频下降型SSNHL主要表现为2 000 Hz及以上频率的听力受损,多数患者伴有严重的耳鸣,在疾病发生早期,耳鸣较为明显,常可掩盖听力损失,从而延误治疗时机,其治疗总体有效率是所有类型中最低的,可能与该听力区域存在螺旋韧带局部供血障碍、Corti 器的缺氧[9]导致外毛细胞(最多50 dB 听力损失)或者内毛细胞(至少60 dB 听力损失)损伤。毛细胞损伤是不可逆的,在治疗中恢复较为困难,故及时就诊早期治疗尤为关键。所有频率均受损的SSNHL根据听力下降程度可分为平坦型及全聋型,其中平坦下降型损伤较全聋型轻,但目前两者的主要发病机制多与血管痉挛、血管栓塞、血栓形成相关[9],故治疗靶点一致,都致力于解决微循环障碍。目前各类型发病机制仍不能完全阐明,其治疗及预防上有一定难度,但内耳微循环障碍是比较公认的病因之一[10]。耳蜗位于颞骨内,为迷路动脉的末梢动脉,血供非常单一。当迷路动脉出现血栓栓塞、血管痉挛等急性病变时,不能及时有效地形成侧支循环代偿,内耳微循环会出现障碍,在缺血缺氧的情况下,血管内皮细胞受损、氧自由基增加,进一步导致内耳毛细胞、蜗神经损害,从而出现听力下降、耳鸣、眩晕、耳闷等症状。本研究通过对AT-Ⅲ、D-dimer、FDP 的联合分析,探讨微血栓形成在SSNHL中的临床价值。
D-dimer是交联纤维蛋白相关的一种特异性降解产物,其分子量约62 ku,在体内半衰期约3 h,主要经肾脏排泄与网状内皮系统破坏。正常机体内,纤溶酶和抑制酶处于动态平衡,当出现急性血栓时,由于凝血和纤维蛋白溶解系统的双重激活,D-dimer 值会升高,是体内早期血栓形成的重要指标之一,也是目前血液高凝状态和纤溶亢进的重要指标。D-dimer 常用酶联免疫吸附、胶体金免疫过滤检测、乳胶颗粒凝集等方法来检测,简单、快速且有较高的敏感性,在血栓形成性疾病、溶栓治疗评估、心脑血管疾病的发生中有重要诊断价值[11]。
FDP 是在纤溶亢进时,在纤维蛋白溶解酶的作用下所产生的产物,包括Fg降解产物、非交联纤维蛋白,是纤溶亢进的标志性指标,FDP 增高反应纤溶功能亢进。有研究[12]结果表明,FDP 可以调节炎症细胞的粘连和趋附,刺激血管内皮细胞和血液中单核细胞、白细胞、可溶性粘附分子和细胞因子的表达增加,进而导致一系列炎性反应,损耗毛细胞内外环境,引起毛细胞损伤,导致全血黏稠度增加、血液流变学改变,进而微血管血栓形成,从而参与突聋发生。
AT-Ⅲ是体内重要的天然抗凝蛋白,主要由肝细胞、血管内皮细胞合成的丝氨酸蛋白酶抑制物,维生素K 依赖的可抑制凝血酶活性,血浆中抗凝血酶活性基本来源于AT-Ⅲ,是重要的生理性抗凝物。血栓前状态或者血栓形成性疾病时,由于消耗过多,常引起AT-Ⅲ偏低,从而影响血液流变学及血液粘滞度。
突聋组患者D-dimer、FDP 水平高于对照组,AT-Ⅲ水平低于对照组,与国内相关研究[13]结果类似。低频组各项指标与对照组相比,差异无统计学意义,这可能是低频下降型突聋主要病因为耳蜗顶转毛细胞水肿受损,该处毛细胞代谢消耗氧量较低,且血供较为丰富,所以对缺血缺氧耐受性较好,故血栓相关性指标无明显改变,不建议常规使用改善血液循环类药物[14]。高频下降型患者主要是蜗底毛细胞受损,该区域毛细胞比较脆弱,容易受到缺血缺氧环境影响,耳蜗毛细胞损伤为不可逆性。本研究结果表示,尽早使用溶栓类药物,可降低血液黏稠度,尽早实现血流再灌注,减轻毛细胞损伤,保护神经细胞。全频组患者有不同程度的微循环障碍、血管痉挛、血栓形成,故个体化药物使用,在治疗上加用溶栓类药物,可以有效地增加血流灌注量、改善局部缺血缺氧状态,对控制病情、缓解症状有一定的临床意义,能为患者听力的挽救赢得时间。
综上所述,目前突发性耳聋发病机制尚不明确,但内耳微循环障碍是目前较为公认的原因之一。故AT-Ⅲ、Ddimer、FDP联合检测方便快捷,准确度较高,可为临床上不同类型患者溶栓治疗提供理论依据,进而制定个体化诊疗方案,使用改善微循环、溶栓类药物,以获得更好的临床疗效。但本研究上需要样本量有限,且没有比较治疗前后AT-Ⅲ、D-dimer、FDP 等指标的变化,尚需要多中心大样本的研究。

