细粒棘球绦虫胞外囊复合物2蛋白的生物信息学分析*
张婷婷,钱炳硕,王明霞,朱明星
1.宁夏医科大学临床医学院,宁夏 银川 750004;2.宁夏医科大学总医院,宁夏 银川 750004;3.宁夏医科大学基础医学院,宁夏 银川 750004;4.宁夏医科大学科技中心,宁夏 银川 750004;5.宁夏常见传染病防治重点实验室,宁夏 银川 750004
细粒棘球蚴病又称囊型包虫病,中间宿主由于误食了细粒棘球绦虫(Eg)的虫卵而感染该病[1-2]。胞外囊复合物2(EXOC2)是一种多蛋白复合物,是胞外囊泡极化靶向细胞膜上特定对接位点所必需的,相关研究[3-4]显示外囊功能丧失在酵母、秀丽隐杆线虫、果蝇、小鼠及多个细胞系中都是致命的,但是EXOC2 在Eg 感染中的作用目前尚未有系统性研究。本研究利用生物信息学的方法对Eg EXOC2 蛋白进行分析,旨在了解EXOC2 在Eg 生物功能及免疫诊断方面的价值,现将结果报告如下。
1 材料与方法
1.1 氨基酸序列获取
登录NCBI 数据库检索并下载EgEXOC2 蛋白的氨基酸序列,该蛋白的序列号为XP_024353820.1。
1.2 蛋白质理化性质的预测
利用蛋白质在线分析网站Protparam 工具预测EXOC2的理化性质,包括氨基酸组成、等电点、半衰期、不稳定系数及GRAVY 值等。使用ProtScale 数据库分析蛋白质的疏水性并进行验证,其中>0 表示疏水性,<0 表示亲水性。
1.3 进化树的构建
利用MEGA 11.0 软件构建秀丽隐杆线虫、Eg、圆头虫、人、小鼠、线虫、威得利纤毛虫、单色微丝虫、裂尾蚴、血吸虫、紫圆线虫、鼠类圆线虫等12种生物的系统进化树。
1.4 信号肽、蛋白跨膜区及结构域的预测
利用SignalIP-5.0 在线数据库预测该蛋白的信号肽,使用TMHMM-2.0 数据库预测蛋白质的跨膜区。使用SMART在线数据库分析该蛋白的结构域。
1.5 蛋白质抗原表位预测
使用ABCPred 数据库和IEDB 数据库预测该蛋白的优势B 细胞表位,使用IEDB 数据库和SYFPEITHI 数据库预测蛋白的优势T细胞表位。
1.6 蛋白相互作用关系预测
使用STRING 在线数据库预测与该蛋白相互作用的其他蛋白。
1.7 相互作用基因的筛选及GO和KEGG富集分析
利用R 软件“clusterProfiler”包和“ggplot2”包对差异基因进行GO 功能和KEGG 通路富集分析,以可视化条形图和气泡图的方式呈现。
1.8 磷酸化及修饰位点预测
利用NetPhos-3.1 在线数据库预测该蛋白的磷酸化位点,使用motif_scan数据库预测蛋白修饰位点。
2 结果
2.1 EXOC2的理化性质分析
使用ProtParam对蛋白质的理化性质进行分析,EXOC2的分子量为123 874.86;由1 117个氨基酸组成,包含66个酸性氨基酸,96 个碱性氨基酸;理论等电点为7.86;分子式为C5446H8686N1552O1662S43;原子总数为11 524;半衰期为30 h;不稳定系数为60.21,表明该蛋白结构稳定;GRAVY值为-0.625,说明该蛋白为亲水性蛋白,见表1。

表1 EXOC2的理化性质
2.2 亲/疏水性分析
使用ProtScale数据库预测该蛋白的亲/疏水性,该蛋白在第812 个氨基酸处疏水性最强,最大值为2.444,在第109 个氨基酸处亲水性最强,其最小值为-3.098,由结果可知,该蛋白大部分氨基酸具有亲水性质,其中亲水性强的部分可能存在抗原表位,见图1。
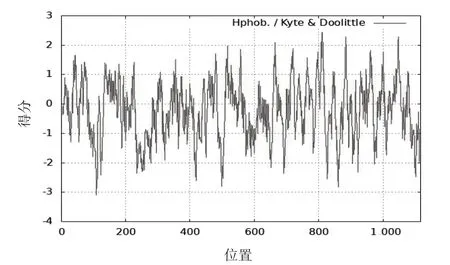
图1 EXOC2亲水性预测分析
2.3 EXOC2进化树的构建
进化树结果显示,EXOC2 在生物进化上与紫圆线虫、裂尾蚴、血吸虫和鼠圆线虫的亲缘关系较近,与威得利纤毛虫和人的亲缘关系较远,见图2。
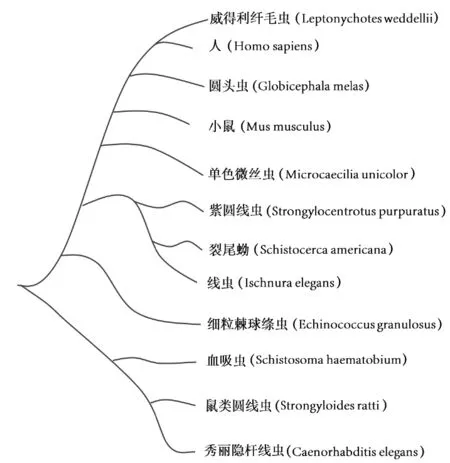
图2 EXOC2进化树
2.4 蛋白质的信号肽、跨膜结构区及蛋白质结构域的预测
信息学预测显示该蛋白不含信号肽序列,也不存在跨膜区。
2.5 蛋白优势表位分析
利用在线数据库预测该蛋白的B 细胞表位,得到的B细胞表位肽有11 条。使用IEDB 预测软件预测长度>10 个氨基酸的区域位于100-115、539-540、851-866、896-911、988-992、704-749。利用SYFPEITHI 在线分析软件的表位预测功能分析蛋白的HLA-A0201 限制性(9aa)细胞毒性T 细胞(CTL)表位,筛选出预测分值>25 的表位肽,共13 条;分析蛋白的HLA-DRB1*0401 和HLADRB1*0701 限制性(15aa)辅助性T 细胞(Th)表位,筛选出预测分值>26 的肽段,并通过IEDB 在线网站预测HLA-DRB1*0401 限制性Th 表位,筛选出评分较高的细胞表位,分别取交集,得到HLA-A0201 优势表位氨基酸区域为697-698、821-824,HLA-DRB1*0401限制性Th表位氨基酸区域为821-823、920-930,HLA-DRB1*0701 限制性Th 表位氨基酸区域为270-275、920-922,见图3、表2、表3、表4、表5。
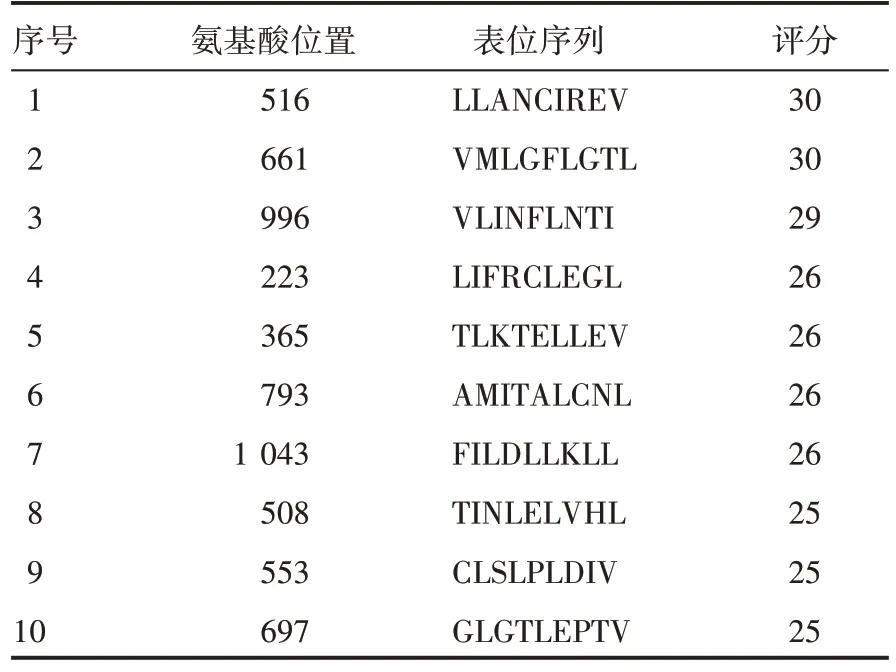
表2 HLA-A0201限制性CTL表位

表3 HLA-DRB1*0401限制性Th表位
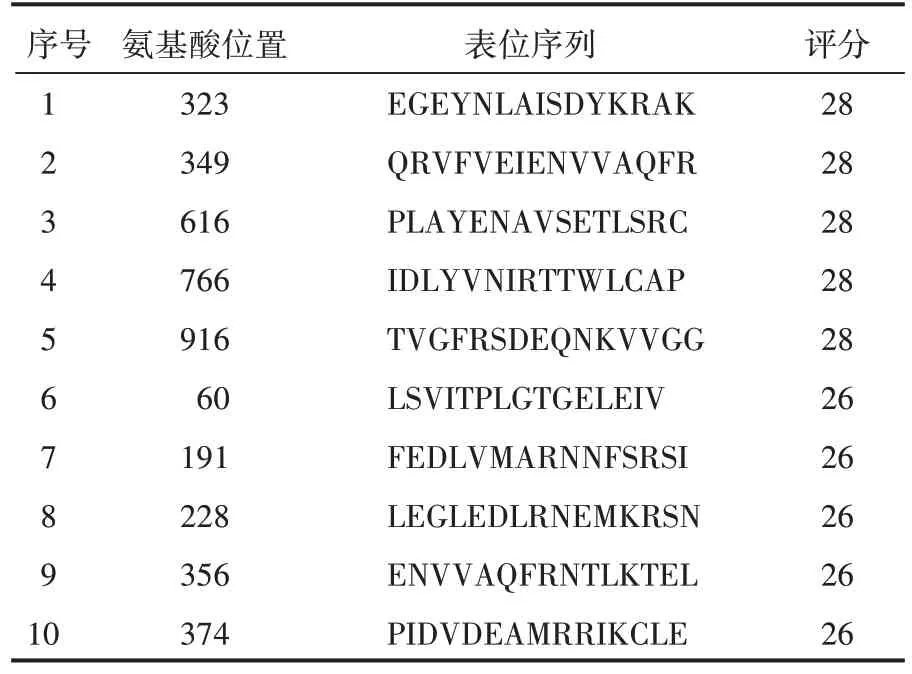
表4 HLA-DRB1*0401限制性Th表位
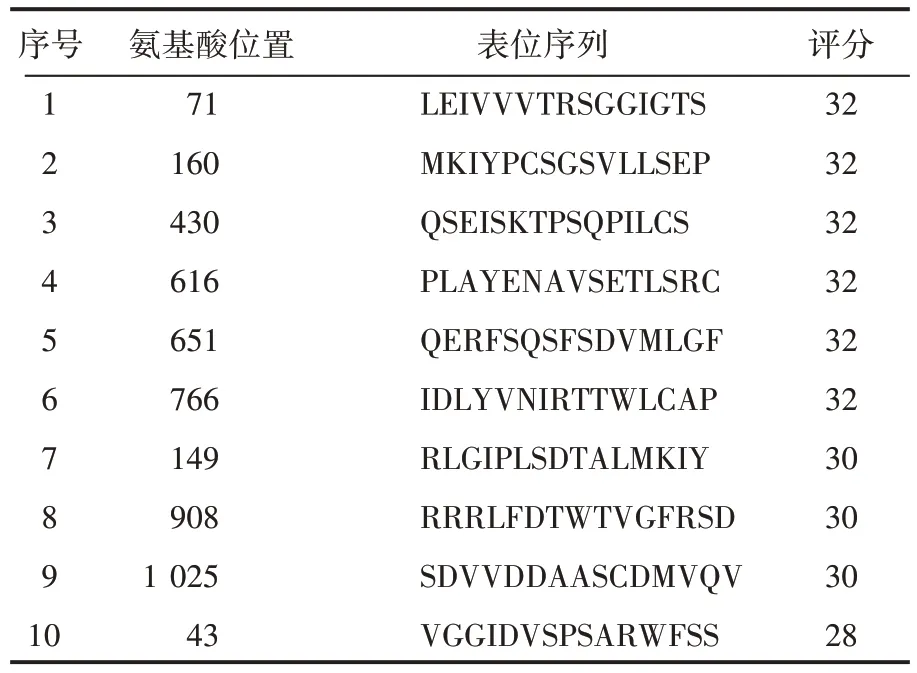
表5 HLA-DRB1*0701限制性Th表位

图3 EXOC2优势B细胞表位结构域预测
2.6 蛋白二级结构分析
SOMPA 在线软件分析显示,在蛋白的二级结构中a-螺旋占45.84%,β-转角占13.56%,延伸连占13.7%。无规则卷曲占36.62%,以a-螺旋为主,见图4。

图4 EXOC2蛋白二级结构预测
2.7 蛋白相互作用关系预测
通过在线数据库对EXOC2 进行蛋白相互作用网络分析,发现其与EXOC5、EXOC6、EXOC3等EXOC蛋白家族及Ras相关蛋白密切相关。
2.8 相互作用基因的筛选及GO和KEGG富集分析
利用R 软件“clusterProfiler”包和“ggplot2”包对差异基因进行GO 功能和KEGG 通路富集分析。生物学过程中与EXOC2 相关程度最高的是蛋白单泛素化,RNA 3'末端加工,染色体正向调控,大分子甲基化等;细胞定位中与EXOC2 相关程度最高的是转录延伸复合物因子,双链断裂位点等;分子功能中与EXOC2相关程度最高的是GTP酶激活剂活性,3' - 5'外切酶活性,基础转录机制结合,基础RNA 聚合酶II 转录机制结合,外切酶活性等。KEGG富集到的通路主要有内吞作用、同源重组、内分泌等因子调节钙重吸收、Hedgehog信号通路等。
2.9 磷酸化及修饰位点分析
结果显示,EXOC2 蛋白共有81 个丝氨酸磷酸化位点,33个酪氨酸磷酸化位点,10个苏氨酸磷酸化位点。MotifScan 分析EXOC2 蛋白共有70 个翻译后修饰位点,包括1 个酰胺化位点、5 个N-糖基化位点、4 个cAMP 和cGMP 依赖性蛋白激酶磷酸化位点、25 个酪蛋白激酶II 磷酸化位点、14个N-豆蔻酰化位点、20个蛋白激酶C磷酸化位点和1个酪氨酸激酶磷酸化位点,见图5。
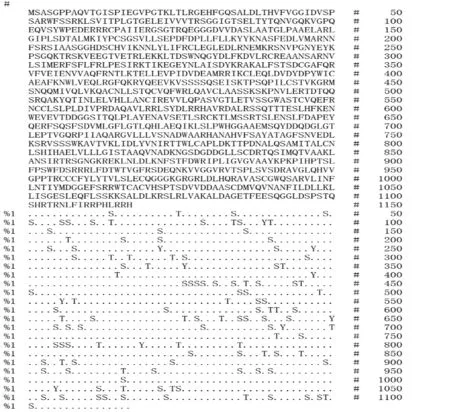
图5 EXOC2的磷酸化及修饰位点分析
3 讨论
胞外囊复合物是一种多蛋白复合物,是胞外囊泡极化靶向细胞膜上特定对接位点所必需的。在高等真核生物中,外囊复合体的组成蛋白和功能已被证明是高度保守的[4-5]。至少有8种胞外复合物成分被发现与肌动蛋白细胞骨架重塑和囊泡转运机制相互作用,这种相互作用已被证明介导成纤维细胞中丝状体的形成[6-7]。研究[8]发现,EXOC2 及其他外囊复合亚单位对神经元功能至关重要,EXOC2发生变异时会导致患者神经功能的障碍。该蛋白已被证明与GTPases 的Ral亚家族相互作用,从而通过将囊泡系在质膜上介导胞吐选择性剪接导致多个转录变体[9]。但EXOC2在Eg等寄生虫中的研究尚未见报道。
本研究利用生物信息学技术对EXOC2 蛋白进行分析,通过NCBI 获得其氨基酸序列,利用一系列在线数据库对其理化性质、同源性及抗原表位等进行了预测。这些有效信息的预测,也为EXOC2 蛋白成为包虫病抗原肽疫苗的候选分子提供了可能性。研究[10]表明,与传统疫苗相比,多肽疫苗的效果可能更安全更高效。
本研究利用生物信息学方法对EgEXOC2 蛋白的相关性质及功能进行了预测分析,发现EXOC2 蛋白具有较丰富的T、B 优势抗原表位,有可能成为抗原肽疫苗新的潜在靶点,研究结果期望能为包虫病抗原肽疫苗的研制提供一定的理论基础。

