养殖曼氏无针乌贼雄性个体繁殖特性的研究
王孟佳 ,徐开达 ,胡桂森 ,朱 凯
(1.浙江海洋大学海洋与渔业研究所,浙江舟山 316021;2.浙江省海洋水产研究所,浙江舟山 316021;3.嵊泗县海洋与渔业局,浙江嵊泗 202450)
曼氏无针乌贼Sepiella maindroni 俗称墨鱼,隶属于头足纲Cephalopoda、乌贼目Sepiida、乌贼科Sepiidae[1],广泛分布于西北太平洋至北印度洋沿岸海域,在我国主要分布于浙江和福建近海。曼氏无针乌贼在海洋食物网中起着至关重要的作用,主要捕食小型鱼类、幼鱼及少数甲壳类,同时是较高营养级别的鱼类从浮游植物等初级生产者处获取营养的桥梁,是海洋中能量传递和转换的重要通道[2]。曼氏无针乌贼作为东海“四大海产”之一,曾拥有丰富的资源量,其中浙江省历史最高年产量达6×104t[3]。但是自20 世纪70年代末以来,高强度的渔业捕捞活动、产卵场破坏、海洋环境污染等原因导致野生曼氏无针乌贼群体的资源量急剧衰退[4]。近年来,曼氏无针乌贼的人工育苗技术和增养殖技术相继得到突破,其增殖放流活动在国内陆续开展[5-7],自然海区的资源量得到了一定的恢复[8]。
繁殖力作为影响种群数量变动的重要因素之一,与其个体大小密切相关,表征其生殖机能的强弱和繁衍后代的能力[9]。研究表明,曼氏无针乌贼性腺发育时间提前且生殖期延长[10];雌性个体的卵子分批、逐个排出,逐个受精[11];缠卵腺指数与精荚复合体指数可作为曼氏无针乌贼性成熟的重要指标[12];其潜在繁殖力与精卵比相较于20 世纪80 年代均明显降低[12]。然而,这些研究集中于雌性个体,对雄性个体繁殖生物学的研究则较少涉及,尤其是雄性养殖个体较为缺乏。鉴于此,笔者以2021 年10 月采集的养殖曼氏无针乌贼雄性个体为研究对象,研究其有效繁殖力特性及其与个体生长发育的变化规律,以期揭示雄性养殖曼氏无针乌贼的繁殖模式,为进一步完善其渔业繁殖生物学研究提供基础资料,并为该物种的繁育优化和资源养护提供参考。
1 材料与方法
1.1 材料
曼氏无针乌贼养殖样本采自浙江省舟山市西轩岛养殖场,孵化时间为2021 年8 月,均为F1受精卵在人工繁育条件下培养成熟的个体,初孵幼体开口时投喂卤虫无节幼体,14 d 左右投喂海区活糠虾幼体,20日龄后,开始进行死饵驯食,少量多次投喂死糠虾,投饵量视摄食情况酌情增减。采集时间为2021 年10月,室内养殖设置条件如下:养殖池底质为水泥地,pH 为7.8~7.9,盐度为30~31,水温为26.5~27 ℃。采样方法为每隔3 d 从养殖池中随机采样1 次,每次随机采集6 尾.样本并立即放于冰箱(-20 ℃)冷冻保存,样本采集次数为38 次。样本总数为228 尾,其中雄性151 尾,雌性77 尾。
1.2 生物学测定
在实验室常温解冻后,对曼氏无针乌贼养殖群体进行生物学测定,记录每尾样本的胴背长(mantle length,ML)、体质量(body weight,BW)、性别、性腺成熟度、性腺质量,其中雄性个体记录的性腺组织质量包括精荚复合体质量(spermatophoric complex weight,SC)和精巢质量(gonadosomatic weight,GW)。胴背长的测定精确到1 mm,体质量的测定精确到0.1 g,精荚复合体和精巢质量的测定精确到0.01 g。性腺成熟度依据ARKHIPKIN,et al[13]划分为Ⅰ-Ⅷ个等级,其中,Ⅰ期、Ⅱ期为未发育期,无精荚形成;Ⅲ期为生理性发育期,精荚开始形成;Ⅳ-Ⅵ期为成熟期,精荚逐渐积累;Ⅶ期为排精期,精荚开始外排;Ⅷ期为繁殖后期。鉴定结果显示,实验样本的性腺成熟等级为Ⅰ-Ⅶ期,未发现Ⅷ期样本。由于雄性个体精荚囊中自生理性发育期(Ⅲ期)开始可见有早期成型的精荚,选取性腺成熟度为Ⅲ-Ⅶ期的样本进行精荚计数,其中,生理性发育期(Ⅲ期)样本6 尾、成熟期(Ⅳ-Ⅵ期)样本33 尾(其中Ⅳ、Ⅴ、Ⅵ期分别为6、14、13 ind.)和排精期(Ⅶ期)样本12 尾,并选取成熟期(Ⅳ-Ⅵ期)雄性个体样本进行繁殖力分析。测定的性成熟度参数包括精荚囊长度(spermatophoric sac length,ScL)、精荚囊质量(spermatophoric sac weight,ScW)、精荚数、精荚质量(spermatophore weight,SW)和精荚长度(spermatophore length,SL)。精荚数量采用质量法获得,用AL204 电子天平(精度0.000 1 g、量程0~210 g)称出全部精荚和30 条精荚的质量,二者比值的30 倍即精荚总数。Ⅲ-Ⅶ期的每尾雄性样本各取30 条精荚分别测量其长度和质量,用Digimizer Image Analysis 软件测定精荚长度。其中,精荚囊长度精确到1 mm,精荚长度精确到0.01 mm,精荚囊质量精确到0.001 g,精荚质量精确到0.000 1 g。
1.3 数据分析
用频率分布法计算曼氏无针乌贼雄性个体的胴背长和体质量组成[14]。胴背长组间距设为10 mm,体质量组间距设为20 g。利用幂函数计算胴背长与体质量的关系:
式中:a、b 为估算参数;BW 为体质量,g;ML 为胴背长,mm。
性腺成熟系数(gonadosomatic index,GSI)、精荚复合体指数(spermatophoric complex index,SCI)的计算公式为:
式中:SC 为精荚复合体质量,g;GW 为性腺质量,g。
乌贼繁殖力的定义为有效繁殖力(effective fecundity,EF)和相对有效繁殖力(relative effective fecundity,REF)。雄性个体的有效繁殖力为精荚囊中的精荚数量(条),相对有效繁殖力为有效繁殖力与胴背长或体质量的比值[9]。
利用线性函数、幂函数、指数函数分别拟合精荚囊长度与精荚囊质量,精荚长度与精荚质量,有效繁殖力、相对有效繁殖力与胴背长、体质量关系。选择相关系数(R2)最大作为最优模型[15-16]。利用单因素方差分析法对各成熟度间的精荚复合体指数、精巢成熟系数、精荚长度、精荚质量等的差异性进行检验。
2 结果与分析
2.1 各成熟度个体胴背长、体质量的变化
养殖曼氏无针乌贼雄性个体的胴背长随体质量的增加而增加,二者符合幂函数关系:BW=0.002 4 ML2.332(n=151,R2=0.831,P<0.05)(图1)。其中,所有雄性样本个体的胴背长范围为32~102 mm,平均值为(70.97±13.48) mm;体质量范围为5.3~128.7 g,平均值(52.17±21.33) g。且随着样本成熟度的增加,胴背长、体质量都呈现出逐渐增加的趋势,未发育期(Ⅱ期)到生理性发育期(Ⅲ期)的增长尤为明显,未发育个体与发育个体之间的差异显著(表1)。另外,本次采集的样本中,养殖曼氏无针乌贼雄性个体达到性成熟的最小胴背长为44 mm,Logistic 曲线拟合结果显示,雄性个体的50%性成熟胴背长ML50为47 mm(图2)。
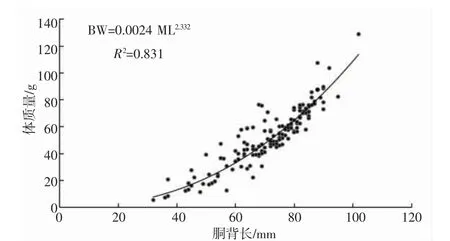
图1 养殖曼氏无针乌贼雄性个体胴背长与体质量关系Fig.1 Relationship between mantle length and body weight of the male cultured S.maindroni
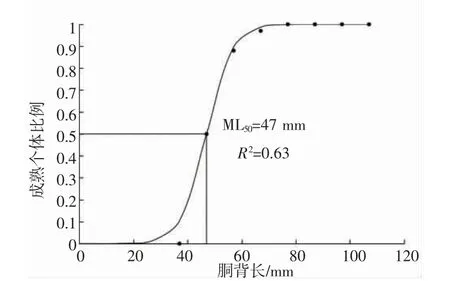
图2 养殖曼氏无针乌贼雄性个体初次性成熟的胴背长Fig.2 Mantle length at first maturity in male cultured S.maindroni
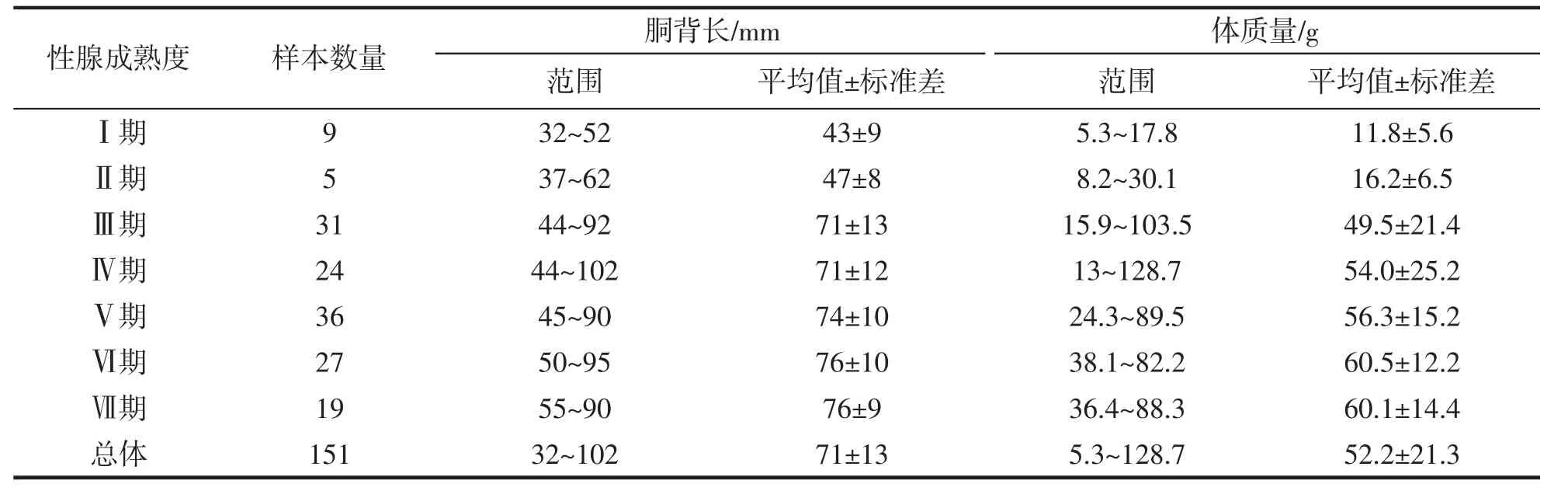
表1 养殖曼氏无针乌贼雄性不同性腺成熟度个体的胴背长和体质量Tab.1 The mantle length and body weight of the male cultured S.maindroni with different gonadal maturity
2.2 精荚囊
养殖曼氏无针乌贼雄性个体Ⅲ-Ⅶ期的精荚囊长度分别为(39.17±3.93) mm、(37.33±6.45) mm、(39.07±7.62) mm、(41.69±5.94) mm、(41.08±5.57) mm;Ⅲ-Ⅶ期的精荚囊质量分别为(0.52±0.15) g、(0.57±0.11) g、(0.72±0.25) g、(1.01±0.30) g、(0.65±0.15) g,精荚囊质量随着性腺成熟度的增加呈现出先增加后减少的趋势,在Ⅲ-Ⅵ期逐渐增加,Ⅶ期略有下降。各成熟度个体间的精荚囊长度无显著性差异(ANOVA:F=0.502,P>0.05),精荚囊质量差异性显著(ANOVA:F=6.613,P<0.05)。另外,精荚囊质量随着精荚囊长度的增加逐渐增加,二者符合线性函数方程:ScW=0.026 2 ScL-0.334 2,R2=0.396 (图3)。精荚囊的长度、质量与胴背长和体质量间的关系不显著,具体分布见图4、5。
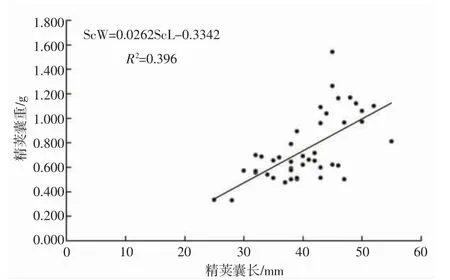
图3 养殖曼氏无针乌贼雄性精荚囊长与精荚囊重的关系Fig.3 The relationship between the length and weight of spermatophoric sac of the male cultured S.maindroni

图4 养殖曼氏无针乌贼雄性精荚囊长与胴背长、体质量的关系Fig.4 The relationship between the length of spermatophoric sac and mantle length and body weight of the male cultured S.maindroni
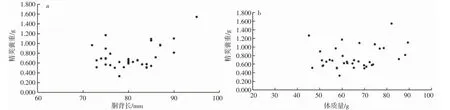
图5 养殖曼氏无针乌贼雄性精荚囊重与胴背长、体质量的关系Fig.5 The relationship between the weight of spermatophoric sac and mantle length and body weight of the male cultured S.maindroni
2.3 精荚复合体指数、精巢成熟系数
随着成熟度的增加,养殖曼氏无针乌贼雄性个体的精荚复合体指数呈现出先增加后减少的趋势,从生理性发育期至成熟期逐渐增加,排精期略有下降;精巢成熟系数从生理性发育期至排精期呈现出逐渐增加的趋势(表2)。其中,精荚复合体指数为1.09%~4.00%,平均值为2.10%±0.66%;精巢成熟系数为1.87%~3.64%,平均值为2.79%±0.42%。经Pearson 相关分析,精荚复合体指数与精巢成熟系数显著相关(P<0.05)。生理性发育期(Ⅲ期)、成熟期(Ⅳ-Ⅵ期)、排精期(Ⅶ期)的精荚复合体指数间、精巢成熟系数间均存在显著性差异(精荚复合体指数ANOVA:F=9.196,P<0.05;精巢成熟系数ANOVA:F=8.053,P<0.05)。
表2 养殖曼氏无针乌贼雄性的精荚复合体指数和精巢成熟系数Tab.2 Spermatophoric complex index and gonadosomatic index of the male cultured S.maindroni
2.4 繁殖力
养殖曼氏无针乌贼雄性个体的有效繁殖力为125~3 824 条精荚,平均值为(1 216.21±903.08)条精荚,各成熟度个体间的有效繁殖力存在显著差异(ANOVA:F=12.056,P<0.01),Ⅳ-Ⅵ期迅速增长并在Ⅵ期时达到最大(表3)。养殖曼氏无针乌贼雄性个体的胴背长相对有效繁殖力为1.71~56.24 条·mm-1,平均值为(15.51±12.15)条·mm-1,各成熟度个体间的胴背长相对有效繁殖力差异性显著(χ2=844.445,P<0.01)(表3)。养殖曼氏无针乌贼雄性个体的有效繁殖力、胴背长相对有效繁殖力随胴背长、体质量的变化见图6、7。
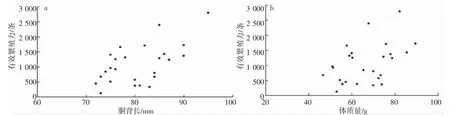
图6 养殖曼氏无针乌贼雄性有效繁殖力与胴背长、体质量的关系Fig.6 The relationship between effective fecundity and mantle length and body weight of the male cultured S.maindroni
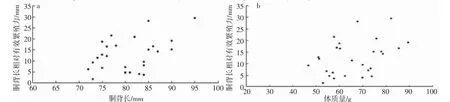
图7 养殖曼氏无针乌贼雄性胴背长相对有效繁殖力与胴背长、体质量的关系Fig.7 The relationship between the relative effective fecundity by ML and mantle length and body weight of the male cultured S.maindroni

表3 养殖曼氏无针乌贼雄性的有效繁殖力和胴背长相对有效繁殖力Tab.3 The effective fecundity and relative effective fecundity by ML of the male cultured S.maindroni
2.5 精荚长度、精荚质量
养殖曼氏无针乌贼雄性个体的精荚长度为1.74~12.87 mm,平均值为(5.37±1.67) mm;精荚质量为0.000 1~0.002 6 g,平均值为(0.000 4±0.000 4) g,总体上,随着精荚长度的增加,精荚质量逐渐增大(图8)。各成熟度个体间的精荚长度、精荚质量差异不显著(精荚长度,ANOVA:F=1.009,P>0.05;精荚质量,ANOVA:F=3.172,P>0.05)(表4),但均在Ⅶ期时达到最大。另外,精荚长度、精荚质量与胴背长、体质量间的相关性也不显著(精荚长度与胴背长:F=2.331,P>0.05;精荚长度与体质量:F=3.934,P>0.05;精荚质量与胴背长:F=2.130,P>0.05;精荚质量与体质量:F=1.955,P>0.05)。
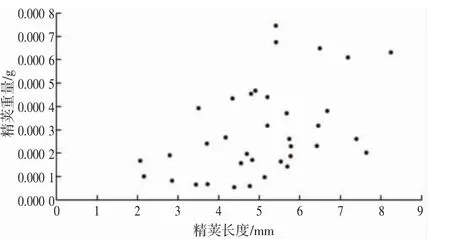
图8 养殖曼氏无针乌贼雄性精荚长度与质量的关系Fig.8 The relationship between length and weight of spermatophore of the male cultured S.maindroni

表4 养殖曼氏无针乌贼雄性不同性腺成熟度个体的精荚长度和精荚质量Tab.4 The length and weight of spermatophore between different maturity stages of the male cultured S.maindroni
3 讨论
笔者研究发现,养殖曼氏无针乌贼雄性个体的精巢质量在Ⅳ期时最高,Ⅴ-Ⅵ期逐渐下降。一方面,精巢质量与个体大小呈密切正相关关系,养殖群体所处的环境条件稳定、饵料充足[17],部分个体性成熟时间提前,如该研究中曼氏无针乌贼雄性个体的初次性成熟胴背长仅47 mm,成熟个体的部分小型化是精巢平均质量下降的原因之一;另一方面,曼氏无针乌贼的性腺是一次性发育成熟,生精小管和精子发育的异步性可以有效保证精巢内成熟精子的大量蓄积(Ⅳ期),随后,成熟精子经过输精管、精囊并以精荚的方式暂时贮藏在精荚囊内,精巢质量随精子的转移逐渐下降[17-18];另外,该研究中精荚囊随着性腺成熟度的增加而生长,在Ⅵ期时达到最大,此结果与南海鸢乌贼中型群雄性精荚囊的发育趋势一致[9],精荚囊的变化趋势也可印证Ⅴ-Ⅵ期精巢平均质量的下降。同时,雄性个体的精荚复合体指数在Ⅲ-Ⅵ期逐渐增长,Ⅶ期时有所下降。这可能与头足类精荚的形成过程相关[18]。曼氏无针乌贼精荚的形成是一个持续的过程,生理性发育期到成熟期(Ⅲ-Ⅵ期)是精荚形成并积累的阶段,而排精期(Ⅶ期)的曼氏无针乌贼在交配过程中,雄性个体会将精荚经茎化腕或者生殖系统的终端器送至雌性个体的纳精囊中[19],伴随着精荚的外排,精荚复合体指数下降。此外,曼氏无针乌贼的精巢成熟系数和精荚复合体指数均小于10%,这与枪乌贼科的巴塔哥尼亚枪乌贼Doryteuthis gahi[20]、柔鱼科的鸢乌贼Sthenoteuthis oualaniensis[21]等较相似,说明不同种属头足类的繁殖发育过程具有一定的相似性。
鱼类繁殖力是维护种族延续,对外界环境长期适应的结果,与种群数量变动及其补充过程密切相关[9,22]。头足类雄性的繁殖力用精荚复合体和精荚囊中所有精荚的数量表示[23]。笔者的研究中,养殖曼氏无针乌贼雄性个体的有效繁殖力随性腺发育显著增加,其有效繁殖力的平均值为(1 216.21±903.08)条精荚,远大于雌性养殖群体(194.4±103.53)粒[24],精卵比约为6.25:1[12,25]。这可能与曼氏无针乌贼的繁殖策略有关。有研究表明,曼氏无针乌贼雌雄交配并不总是遵循“一对一”原则,重复交配和多雄交配现象经常发生,且乌贼卵子分批、逐个产出、逐个受精,当卵子经过受精部位时,有大量精团附着并不断释放精子保证卵子得以受精[11,17],这都要求精荚数大于甚至远大于卵子数。同时,不同环境条件下头足类的繁殖力存在差异。笔者的研究中,已达性成熟的雄性养殖曼氏无针乌贼(Ⅵ期)的平均繁殖力为1 767 条精荚,远小于2021 年舟山市沿岸海域定制张网捕捞的雄性曼氏无针乌贼成熟个体的平均繁殖力2 769 条精荚[12],这可能与环境因子相关。BARBERD,et al[26]发现养殖过程中水温和饵料等会干扰生殖细胞的正常生长,使养殖的曼氏无针乌贼的繁育周期发生变化;TAYLOR,et al[27]发现光照周期可通过影响水产动物体内的激素水平进而影响其生长发育和繁育节律。环境因素的变化使乌贼的繁殖力出现适应性改变。
笔者的研究中养殖曼氏无针乌贼雄性个体的有效繁殖力在Ⅵ期时达到最大,为3 824 条精荚。其最大有效繁殖力远高于同一科(乌贼科)下其他属种,如耳乌贼属大西洋耳乌贼Sepiola atlantica 的最大有效繁殖力为1 243 条精荚[28],乌贼属虎斑乌贼Sepia pharaonis 的最大有效繁殖力为580 条精荚[29]。这可能与这些属种的体型大小和生存环境相关。首先,在头足类雄性繁殖力的研究中发现,有效繁殖力的大小取决于成年雄性的体型,曼氏无针乌贼雄性个体的胴背长可达200 mm[30],大西洋耳乌贼雄性个体的胴背长可达210 mm[28],虎斑乌贼雄性个体的胴背长可达250 mm[29],体型较小者携带的精荚数量更多;其次,头足类的繁殖力可能与其生存环境相关,在进入海洋中上层水域的过程中(虎斑乌贼[29]:1~110 m;大西洋耳乌贼[30]:1~50 m;曼氏无针乌贼[31]:10 m 左右),环境可预测性的降低会导致死亡率增加,为维持后代的绵延,从而呈现出繁殖力的差异。笔者的研究还显示,雄性曼氏无针乌贼的精荚长度、质量与性腺成熟度、胴背长、体质量间的关系不显著。但总体上,精荚长度和质量随着性腺发育逐渐增长,并在排精期(Ⅶ期)达到最大。其中,精荚长度平均为胴背长的2.46%~10.59%,此结果与菱鳍乌贼科的菱鳍乌贼Thysanoteuthis rhombus[29]和柔鱼科的鸢乌贼[9]等的不一致。表明不同种属头足类配子的大小发育具有差异性。
综上所述,养殖曼氏无针乌贼雄性个体性腺的发育趋势、精荚复合体指数的变化趋势分别与精子的转移、精荚的装配密切相关;不同生存环境会导致个体繁殖力的差异;不同种头足类配子的发育也具有差异性。

