盐度渐变对日本囊对虾非特异性免疫酶、ATPase 酶和抗氧化酶活力的影响
陈 鑫,何 杰,张东旭,俞学军,平洪领,张 涛,史会来,李 彬
(1.浙江海洋大学水产学院,浙江舟山 316022;2.浙江海洋大学海洋与渔业研究所,浙江省海洋水产研究所,浙江舟山 316021)
日本囊对虾Penaeus japonicus 属甲壳纲、十足目、对虾科、对虾属,广泛分布在我国沿海、日本北海道以南、东南亚、澳大利亚北部、非洲东部及红海等地区[1]。日本囊对虾肉质鲜美,营养丰富,耐干露,经济价值高,是我国重要的对虾养殖品种之一。近年来,随着日本囊对虾养殖业的发展,对其生物学特性、繁育、养殖等各方面的研究日趋增多[1-7]。
我国日本囊对虾养殖主要集中在福建及广东沿海地区,然而每年受台风暴雨的影响,养殖水域的盐度发生大幅度变化,导致大量对虾死亡[8-9]。盐度作为水产养殖中重要的水体环境指标之一,与甲壳动物生长、发育、免疫等息息相关[5-6,10-11]。斑节对虾Penaeus monodon[6]、凡纳滨对虾Litopenaeus vannamei[12]、日本沼虾Macrobrachium nipponense[13]等相关的研究结果表明盐度的变化会对虾机体的代谢、免疫、渗透等功能产生显著影响,当外界盐度发生变化时,对虾机体会通过多种调节机制以适应外界环境的变化,其中,酶活力是重要的调节方式之一[14-15]。在养殖过程中,剧烈的盐度变化会破坏对虾的渗透压平衡,在养殖过程中,剧烈的盐度变化会破坏对虾的渗透压平衡,影响虾类的代谢和能量收支平衡,导致对虾的免疫机能显著降低,影响虾的存活[6,16],严重时会导致较高的死亡率[17]。因此,养殖期间水体盐度的稳定是虾类养殖成败的关键,也是虾类维持机体内环境平衡和进行正常生理活动的重要保障,对病害的免疫调控具有重要意义。
目前,国内外研究多聚焦于盐度骤变角度[17-18],盐度渐变相关研究较少[15];而盐度渐变对日本囊对虾相关酶活力影响方面的研究亦未见报道。在实际养殖生产实践中,养殖水体盐度变化很难发生骤增骤减情况,台风等极端天气带来的暴雨影响下,养殖水体盐度变化在一定程度上也是逐渐降低的渐变过程。因此,为探究台风暴雨天气养殖水体盐度的变化对日本囊对虾抗氧化酶、非特异性免疫酶和ATPase 酶活力的影响,笔者采用盐度渐变处理的方式,测定了各实验条件下日本囊对虾超氧化物歧化酶(SOD)、碱性磷酸酶(AKP)、酸性磷酸酶(ACP)、多酚氧化酶(PPO)、ATPase(包括Na+/K+-ATPase 和总ATPase(T-ATPase),活力及总蛋白含量的变化,从而为日本囊对虾健康养殖及资源保护提供理论支撑。
1 材料与方法
1.1 材料
试验于浙江省海洋水产研究所实验室内进行,试验所用日本囊对虾均取自于浙江省海洋研究所实验基地养殖塘,原初水体盐度26。选择结构完整、体色鲜明、活力较好、规格大小均匀,体长(8±0.4) cm 的日本囊对虾作为实验材料,实验前暂养7 d。
1.2 方法
以养殖自然海水(盐度26)为基础,通过向自然海水中不断添加淡水实现盐度渐变,以模拟台风天气降雨及台风过后换水引起的养殖水体盐度变化。渐变试验设置4 个盐度梯度,盐度梯度幅度为4 个盐度[19-20],分别为26、22、18 和14,其中26 为正常海水的盐度,为对照组;每个盐度梯度下设3 个平行。
试验在直径1.2 m、深0.8 m 的圆桶中进行,每桶放虾60 只。其中,盐度组22、18、14 的圆桶对应的装置有24 h 排水量分别为40、80 和120 L 的排水管,用于降盐处理。实验开始前,26、22、18、14 4 个盐度组对应桶内自然海水(26)水体为260、220、180 和140 L;同时打开22、18、14 盐度组的排水管,添加淡水缓慢降盐,开始试验。第2 h,同时关闭进水管,降盐停止,适应至72 h 后,采取逐渐换水的方式,盐度逐渐恢复,时长24 h。
1.3 样品采集
试验开始后,在0、6、12、24、48、72、96 和120 h 时记录各桶日本囊对虾的死亡情况并随机取样,每次取样时从每个桶内迅速捞出5 尾虾,用1 mL 无菌注射器从每1 尾擦拭干净的虾的头胸甲2/3 处插入,在心脏中抽取血淋巴液1 mL 置于1.5 mL 离心管中,此过程在碎冰上进行,每组平行中的日本囊对虾的血淋巴样品为1 个单独样本,4 ℃条件下过夜,随后取出凝固的血淋巴并捣碎,冷冻离心机4 ℃条件下5 000 r·min-1离心10 min,吸取上清液于1.5 mL 离心管中,-80 ℃冰箱保存,待检。
1.4 样本检测
非特异性免疫酶、ATPase 酶和抗氧化酶酶活性检测均采用南京建成生物工程研究所生产的试剂盒,步骤均严格按照试剂盒说明书操作。采用磷酸苯二钠法测定碱性磷酸酶(alkaline phosphatase,AKP)活性;采用可见分光光度法测定酸性磷酸酶(acid phosphatase,ACP)活性;采用分光光度计法多酚氧化酶测定多酚氧化酶(polyphenol oxidase,PPO)活性;采用黄嘌呤氧化酶法测定超氧化物歧化酶(superoxide dismutase,SOD)活性;采用南京建成生物工程研究所研制的ATP 酶试剂盒测定Na+/K+-ATP 酶活性;采用考马斯亮蓝法(南京建成试剂盒)测定总蛋白含量,以牛血清蛋白为标准。
1.5 数据处理与统计分析
实验数据用Excel 和SPSS 26.0 软件进行统计和分析,结果以平均值±标准差来表示。不同盐度组间采用独立样本T 检验方法进行比较,组内数据采用单因素方差分析和LSD 检验,P<0.05 为差异显著。
2 结果与分析
2.1 盐度渐变对日本囊对虾死亡率的影响
盐度渐变下日本囊对虾累计死亡率趋势如图1所示,日本囊对虾总体累计死亡率随盐度胁迫强度的加强而上升,累计死亡率与盐度胁迫总体呈正相关趋势,盐度渐变胁迫下各组累计死亡率为14>18>22>26。在盐度渐变胁迫的第6 h,14、18 盐度组最先出现死亡;渐变胁迫12 h,22 盐度组开始出现死亡,累计死亡率为14>18>22。各盐度渐变组的累计死亡率自12 h 始表现出明显的逐渐升高趋势,且随着胁迫时间的延长而增速加快,第72 h,14 盐度组的累计死亡率达30%,增速较快;18 盐度组累计死亡率达26%,增速仅次于14 盐度组;22 盐度组累计死亡率为22%,增速平缓;至96 h 随着盐度恢复至初始盐度值后死亡率增长终止。分析结果表明,日本囊对虾累计死亡率与盐度的变化息息相关,低盐渐变胁迫下,日本囊对虾的渗透盐度呈高渗调节,盐度越低则偏离等渗盐度越大,造成日本囊对虾机体用于免疫的耗能越多,死亡发生率越大。
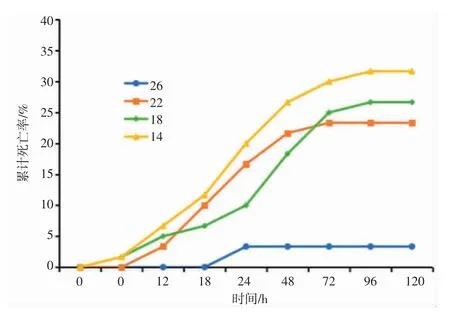
图1 不同盐度下日本囊对虾随时间变化的累计死亡率Fig.1 Cumulative mortality of P.japonicus in different salinity over time
2.2 盐度渐变对日本囊对虾血清蛋白含量的影响
由图2 可知,在0~24 h 盐度渐变过程中,22 盐度组日本囊对虾的血清蛋白含量在12 h 内总体平稳,变化幅度不大;12 h 始,血清蛋白含量开始呈总体下降趋势,在24 h 降至目标盐度后,血清蛋白含量呈现出随着胁迫时间的延长而不断下降的特点,并在72 h 降至最低值;18 盐度组血清蛋白含量自0 h 始开始呈下降趋势,至24 h 降至目标盐度后下降趋势减缓,在24~72 h 内血清蛋白含量变化不大;14 盐度组血清蛋白含量自0 h 始呈现随着胁迫时间的延长而不断降低的变化趋势,并在72 h 降至最低值。72 h,14、18、22 盐度组血清蛋白含量与对照组均有显著性差异(P<0.05),且各盐度组在72 h 均显著低于0 h(P<0.05)。72 h后,随着盐度回升,各盐度处理组的日本囊对虾血清蛋白含量均呈现逐渐升高的趋势。分析结果表明,盐度渐变过程中,日本囊对虾血清蛋白含量受盐度胁迫强度及时长的影响显著(P<0.05),总体呈现出盐度渐变胁迫强度越强,血清蛋白含量变化幅度越大的特点;渐变胁迫过程中,日本囊对虾血清蛋白含量与胁迫时间呈负相关。

图2 盐度渐变对日本囊对虾血清蛋白质含量的影响Fig.2 Effect of salinity gradient on protein content in serum of P.japonicus
2.3 盐度渐变对日本囊对虾血清ACP 活力的影响
由图3 可知,22、18 盐度组日本囊对虾血清ACP 活力具有“降低—升高—降低—升高”的变化趋势,14 盐度组血清ACP 活力具有“降低—升高”的变化趋势;72 h 后随着盐度逐渐恢复至原初浓度,各盐度组血清ACP 活力均有所上升,呈诱导趋势。0~24 h,22、18 和14 盐度组血清ACP 活力随着盐度的逐渐降低而降低;24~72 h,14 盐度组血清ACP 活力随着胁迫时间的延长呈抑制趋势;在24 h 和72 h,各盐度组血清ACP 活力均显著低于对照组(P<0.05);22 盐度组在24 h 达到最低值,18 和14 盐度组在72 h 达到最低值,其中14 盐度组96 h 的ACP 活力与72 h 比上升显著(P<0.05)。分析结果表明,日本囊对虾血清ACP 活力具有明显的盐度相关性和时间相关性,盐度梯度上表现为盐度组14<18<22<26,在渐变胁迫过程中,ACP 活力随时间的延长呈下降趋势。
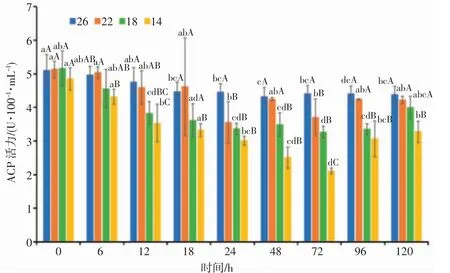
图3 盐度渐变对日本囊对虾血清ACP 活力的影响Fig.3 Effect of salinity gradient on ACP activity in serum of P.japonicus
2.4 盐度渐变对日本囊对虾血清AKP 活力的影响
由图4 可知,盐度渐变胁迫后,22、18 和14 盐度组日本囊对虾血清AKP 活力具有先下降后上升的趋势。22 盐度组在18 h 达到最低值,后随着时间的增加而逐渐上升,总体变化幅度不大,与对照组差异不显著(P>0.05);18 盐度组的AKP 活力在18 h 显著高于其他组(P<0.05),72 h 达到最低值,显著低于对照组(P<0.05),而后随着盐度的逐渐恢复而逐渐上升;14 盐度组血清AKP 活力在18~96 h 均显著低于对照组(P<0.05),且在48 h 达到最低值,之后随时间的增加而逐渐上升。分析结果表明,日本囊对虾血清AKP 活力与盐度胁迫强度和胁迫时间整体成负相关,且随着盐度的恢复,血清AKP 活力均有所上升,呈诱导趋势。
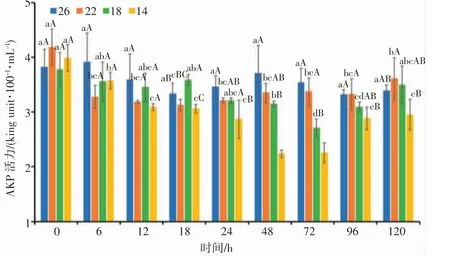
图4 盐度渐变对日本囊对虾血清AKP 活力的影响Fig.4 Effect of salinity gradient on AKP activity in serum of P.japonicus
2.5 盐度渐变对ATPase(包括Na+/K+-ATPase 和T-ATPase)活力的影响
由图5 可知,14 盐度组的日本囊对虾血清Na+/K+-ATPase 活力显著高于其它盐度组(P<0.05),整体呈先升高后降低的趋势;22、18 盐度组的日本囊对虾血清Na+/K+-ATPase 活力均呈“升高—降低—升高”的变化趋势。22 盐度组酶活力在18 h 和48 h 分别达到最高值和最低值,18 盐度组酶活力在48 h 和72 h 达到最低值和最高值,14 盐度组酶活力在0 h 和72 h达到最低值和最高值。盐度渐变过程中,22、18盐度组Na+/K+-ATPase 活力总体呈波动性下降趋势,均在48 h 酶活力达到最低值,与对照组无显著性差异(P>0.05);14 盐度组酶活力随着时间的增加而逐渐升高,表现为单峰曲线变化,在72 h 达到最高值,与其它盐度组的差异显著(P<0.05)。24~48 h,各盐度的Na+/K+-ATPase 活力十分平稳,无明显变化。72 h 后随着盐度的逐渐恢复,血清Na+/K+-ATPase 活力呈上升趋势。分析结果表明,低盐胁迫强度越大,日本囊对虾Na+/K+-ATPase 活力的时间变化趋势越明显。
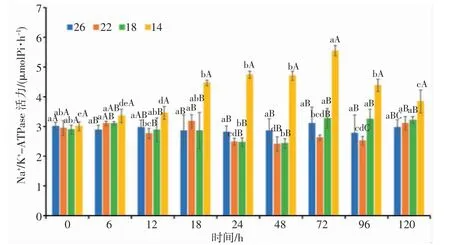
图5 盐度渐变对日本囊对虾血清Na+/K+-ATPase 活力的影响Fig.5 Effect of salinity gradient on Na+/K+-ATPase activity in serum of P.japonicus
由图6 可知,22 盐度组血清T-ATPase 活力变化整体呈波动性升降,升降幅度不大,24 h T-ATPase 活力达到最高值,与对照组无显著性差异(P>0.05)。18、14 盐度组T-ATPase 活力均呈先上升后下降的趋势,均表现为单峰曲线变化,18 盐度组T-ATPase 活力在48 h 达到最高值,显著高于对照组(P<0.05);14 盐度组T-ATPase 活力在12~96 h 均显著高于其它盐度组(P<0.05),并在72 h 达到最高值,与组内各时段的酶活力相比具有显著性差异(P<0.05)。24 h 盐度渐变结束,14 盐度组血清T-ATPase 活力显著高于其它盐度组(P<0.05)。盐度胁迫24~72 h,各盐度组的日本囊对虾血清T-ATPase 活力表现为盐度14>18>22>26。72 h 后随着盐度逐渐恢复,22 盐度组的T-ATPase 活力缓慢上升,呈诱导趋势,18、14 盐度组T-ATPase 活力均有所下降,呈抑制趋势。分析结果表明,日本囊对虾TATPase 活力与盐度胁迫强度和胁迫时间总体呈正相关,在一定时间范围内,T-ATPase 活力随胁迫时间的延长而升高。

图6 盐度渐变对日本囊对虾血清T-ATPase 活力的影响Fig.6 Effect of salinity gradient on ATPase activity in serum of P.japonicus
2.6 盐度渐变对超氧化物歧化酶的影响
由图7 可知,盐度渐变过程中,盐度胁迫时长对日本囊对虾SOD 活力影响显著(P<0.05),各盐度处理组SOD 活力均表现出随时间的延长而逐渐降低的抑制趋势。降盐0~24 h、胁迫24~72 h 和盐度渐复的72~120 h 3 个时段内,22 盐度组的SOD 活力始终高于18、14 盐度组,3 个盐度处理组的SOD 活力表现为盐度22>18>14;降盐18 h 和24 h,各盐度处理组的SOD 活力显著低于对照组(P<0.05),组间SOD 酶活力差异显著。盐度胁迫至72 h,各盐度处理组的SOD 活力均达到最低值。72 h 后,随着盐度的逐渐恢复,各盐度处理组的SOD 活力表现均有所上升,呈诱导趋势。分析结果表明,日本囊对虾SOD 活力与盐度胁迫强度之间呈负相关,低盐胁迫的强度越强,随着时间的延长,其SOD 活力与对照组的差异越显著(P<0.05)。
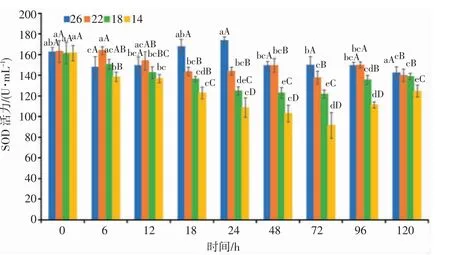
图7 盐度渐变对日本囊对虾血清SOD 活力的影响Fig.7 Effect of salinity gradient on SOD activity in serum of P.japonicus
2.7 盐度渐变对日本囊对虾血清PPO 活力的影响
由图8 可知,22 盐度组的日本囊对虾血清PPO 活力0~6 h 表现稳定,6 h 开始总体呈“降低—升高—降低—升高—降低”的变化趋势,在18~24 h 变化幅度显著(P<0.05),24 h PPO 活力达到最高值;18 盐度组的PPO 活力0~6 h 表现稳定,6 h 开始呈“升高-降低-升高-降低”的变化趋势,盐度胁迫24~72 h,随着胁迫时间的延长PPO 活力呈上升趋势,72 h 达到最高值,与对照组差异显著(P<0.05);14 盐度组的PPO 活力呈先升高后降低的变化趋势,呈单峰曲线变化。降盐开始至48 h,PPO 活力随时间延长逐渐升高,24~48 h 上升幅度显著(P<0.05),48 h 达到峰值后逐渐下降。72 h,18、14 盐度组PPO 活力显著高于对照组(P<0.05),72 h 后随着盐度的逐渐恢复,各盐度处理组的PPO 活力总体呈下降趋势,下降幅度渐缓。分析结果表明,日本囊对虾血清PPO 活力受盐度胁迫强度和胁迫时间的影响显著,盐度胁迫强度越强,血清PPO 活力的变化趋势越明显。
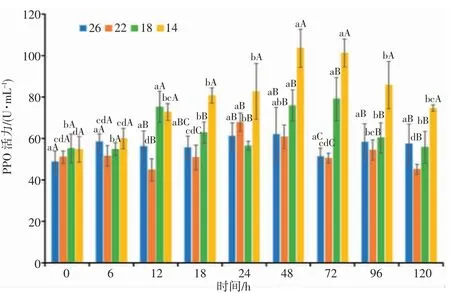
图8 盐度渐变对日本囊对虾血清PPO 活力的影响Fig.8 Effect of salinity gradient on PPO activity in serum of P.japonicus
3 讨论
3.1 盐度渐变对日本囊对虾死亡率的影响
盐度是水产养殖中的关键环境因素之一,日本囊对虾具有一定的广盐性,主要通过离子调节和渗透调节来适应盐度的变化,但在不同盐度环境下的生长率、存活率等也不尽相同,日本囊对虾的存活受盐度影响较大。在养殖过程中,盐度作为影响虾类正常生理活动的重要因子之一,当盐度发生改变,机体的免疫功能会受到影响,盐度过高或过低会引起机体产生一系列的生理生化反应,此过程中免疫机能大大降低,严重时甚至会导致较高的死亡率[11,19,21]。潘鲁青等[22]研究了不同盐度对日本囊对虾仔虾的生长发育的影响,结果表明随着向低盐度变化仔虾的存活率和增重率明显下降。蒋湘等[23]研究盐度对日本囊对虾生长与存活率的影响,结果表明日本囊对虾生长的最适盐度为17~32,盐度为27 条件下存活率最高,低盐度下的存活率与高盐度和中间盐度相比最低。水柏年[24]研究日本囊对虾虾苗对若干环境因子的适应性研究,结果表明日本囊对虾虾苗适应盐度范围为18~30。杨其彬等[25]在盐度对斑节对虾存活率的研究结果表明最适盐度为20~30。笔者的研究中盐度渐变胁迫下各盐度组日本囊对虾的累计死亡率呈现出随着盐度逐渐降低以及胁迫时间的延长而上升,截至96 h 各盐度组恢复至正常盐度时,盐度渐变胁迫下各组累计死亡率为14>18>22>26,14 盐度渐变胁迫死亡率最高,18 盐度组死亡率次之,在22~26 盐度内存活率较高。盐度胁迫24~72 h,各盐度处理组的日本囊对虾死亡率随胁迫时间的增加而上升,单位时间内14 盐度组死亡率增加幅度最大。笔者的研究与以上研究结果基本一致,发现低盐度胁迫对日本囊对虾死亡率具有显著影响,环境盐度越低机体损伤越大,随着向低盐度的递变日本囊对虾存活率明显下降,且随着胁迫时间的延长死亡率也随之上升。总体而言,在24 h 盐度渐变至14 h,日本囊对虾出现了较高的死亡率,说明盐度渐变后对虾需要进行渗透调节到一个新的渗透平衡状态,当超出了对虾的渗透调节能力时引起死亡。因此,在日本囊对虾的养殖管理中尽量保持水体盐度的稳定,做好养殖管理,降低因台风天气带来的盐度变化过大而导致伤亡。
3.2 盐度渐变对日本囊对虾非特异性免疫酶的影响
水生动物的生理代谢指标会受到诸多因素的影响,如温度、盐度、饱食、生长、溶氧,这些指标可以反映动物机体的健康程度和生理反应[26]。该研究中主要测定了血清总蛋白、酸性磷酸酶(ACP)和碱性磷酸酶(AKP)的活性。血液蛋白质的主要生理功能是维持胶体渗透压,具有运输、免疫、修补组织和缓冲等作用,血清中蛋白质含量与机体的免疫代谢和能量运输息息相关,能促进蛋白质的合成[27]。该研究中,日本囊对虾的血清蛋白质含量受盐度渐变胁迫的影响呈现出明显的盐度相关性和时间相关性,各盐度处理组的血清蛋白质含量波动幅度表现为盐度组14>18>22>26,且14、18 盐度组的蛋白质含量自盐度渐变0 h 始即表现出逐渐下降的趋势,并在72 h 达到最低值,22 盐度组则是盐度渐变12 h 后开始出现下降趋势,说明低盐胁迫下日本囊对虾血清蛋白质含量受盐度胁迫强度影响显著,盐度越低,日本囊对虾机体内外的渗透压力越大,机体血清蛋白质含量的下降幅度越大。72 h,各盐度处理组的血清蛋白质含量均几近最低值,与对照组差异显著(P<0.05),说明在盐度渐变胁迫中,日本囊对虾血清蛋白质含量的变化具有明显的时间相关性,且与胁迫时间呈负相关,这与叶建生等[28]在盐度突变对凡纳滨对虾血清蛋白含量影响的研究结果中所发现的血清蛋白含量呈现随时间逐渐下降趋势,且盐度突变值越大,血清蛋白含量越低的研究结果具有一致性。72 h 后,各盐度处理组的血清蛋白质含量随着盐度的恢复而逐渐回升,回升幅度依次为盐度组22>18>14,其中,14 盐度组的血清蛋白质含量回升幅度明显低于18、22 盐度组(P<0.05),说明盐度渐变幅度越大,对机体免疫造成的胁迫性损伤越大,当盐度恢复至对照盐度时,盐度渐变幅度大的日本囊对虾机体恢复速度要远慢于盐度渐变幅度小的。
酸性磷酸酶(ACP)和碱性磷酸酶(AKP)是衡量机体免疫机能和代谢状况的重要指标,在蛋白(酶)的去磷酸化过程中起着十分重要的作用[29-30],机体中这两种磷酸酶的含量越高,机体的免疫功能越强。它们不仅参与一些营养物质的消化、吸收、运输,而且还是生物体内重要的解毒体系[31],能通过产生水解酶体系对侵入体内的异物等进行破坏和消除,从而在甲壳类的生存生长过程中发挥着重要作用。因此,该研究通过对ACP 和AKP 活性的探讨分析有助于了解盐度对日本囊对虾的营养物质消化、吸收、运输以及生物体内抗氧化系统的影响。刘存歧等[32]研究了金属离子对中国对虾体内AKP 活力的影响中发现AKP 活力随外界环境因子发生改变,认为其高低变化可以作为判断机体免疫能力的衡量指标。在该研究中,日本囊对虾血清磷酸酶活力表现出具有明显的盐度相关性和时间相关性,各盐度组磷酸酶活力总体均呈现出先下降后升高的趋势,22 盐度组ACP 和AKP 活力分别在24、18 h 降至最低值,18 盐度组ACP 和AKP 活力分别在72、48 h 降至最低值,14 盐度组磷酸酶活力均在72 h 降至最低值,与对照组差异显著(P<0.05),各盐度组的磷酸酶活性在18~72 h 先后达到最低值,低盐度显著降低了日本囊对虾的非特异性免疫功能,此时段内日本囊对虾机体损伤较大,由此推测这可能也是该时段内日本囊对虾累计死亡率升高较快的原因之一。在0~72 h 的低盐渐变胁迫中,血清磷酸酶活力呈现出随盐度降低而降低的抑制性趋势,2 种酶活力总体均呈现出14<18<22 的盐度相关性。随着胁迫时间的延长,ACP 和AKP 活力显著降低,72 h 后,随着盐度的逐渐恢复,各盐度组的ACP 和AKP 活力均呈上升趋势,以14 盐度组的升高幅度最大。该研究结果表明,日本囊对虾血清磷酸酶活力受盐度影响显著,各盐度组ACP 和AKP 活力均随胁迫时间延长而呈下降趋势,低盐胁迫对磷酸酶的活力具有抑制作用,这与乔雁冰等[17]在盐度对克氏原螯虾血淋巴中ACP 和AKP 活性的影响的研究结果一致。盐度恢复后,随着盐度升高其活性也逐渐上升,这与赵玉超等[12]在高盐胁迫对凡纳滨对虾仔虾体内ACP 和AKP 活性的影响中发现随盐度升高,ACP 和AKP 的活性均逐步升高的研究结果相似。
3.3 盐度渐变对日本囊对虾ATPase 酶活力的影响
经过长期不断地进化,水生生物形成了一套依靠自身特有的平衡调控机制来适应目前的生存环境,以此来维持机体的正常代谢[33]。其中广盐性甲壳动物为了适应环境的改变,主要通过调控血淋巴的渗透压维持体内的稳态以保证维持正常的生命活动。机体血淋巴中渗透压的调节主要通过对钠离子和氯离子的调控实现[34]。离子调控主要靠鳃上皮细胞膜上的离子转运酶来实现,其中Na+/K+-ATPase 是维持机体Na+、K+离子平衡的关键酶[35]。近年来,针对不同条件下甲壳动物的Na+/K+-ATPase 活性变化已开展了大量研究,研究普遍认为Na+/K+-ATPase 对血淋巴渗透压具有重要的调节和维持作用[36-37]。李玉全等[15]在盐度变化对脊尾白虾ATPase 活力影响的研究中发现,盐度渐变对Na+/K+-ATPase 和T-ATPase 活力具有极显著影响,高盐或低盐渗透压力下机体为维持Na+、K+离子平衡所消耗的Na+/K+-ATPase 会增加,机体Na+/K+-ATPase 活力会提高。该研究中,盐度从26 渐变至22、18 的过程中,Na+/K+-ATPase 活力呈波动性下降趋势,T-ATPase 活力呈波动性上升趋势,但两者的波动幅度均不大,说明此盐度范围内对日本囊对虾造成渗透压力未超出自身承受范围,可快速调节体内Na+、K+平衡。盐度从26 渐变至14 的过程中,Na+/K+-ATPase 和TATPase 活力均呈上升趋势,Na+/K+-ATPase 活力在6 h 显著高于对照组(P<0.05),24 h 2 种酶的活力值显著高于26、22 和18 盐度组,且随时间延长与对照组差异越来越大,72 h 两种酶的活力值均达到峰值,与各盐度组差异极显著。该研究结果表明14 盐度下的对虾机体渗透压力显著增加,机体需消耗大量Na+/K+-ATPase 来维持渗透平衡,此时机体调节平衡在离子转运过程中消耗的ATP 大大增加,使得T-ATPase 活力随之升高。研究结果中发现盐度在18~26 范围内渐变对日本囊对虾造成的渗透压力较小,未超出日本囊对虾自身的耐受范围,盐度低于18 h,日本囊对虾机体渗透压力增大,这也与顾宇[6]在研究盐度对斑节对虾血淋巴渗透压和鳃丝Na+/K+-ATPase 的影响中的斑节对虾盐等渗点在盐度20 左右,在盐度20~25 的水体中有较好的适应性的研究结论具有一致性。
3.4 盐度渐变对日本囊对虾抗氧化酶活力的影响
盐度作为水产养殖中的重要环境因子,直接影响虾类的多种生理活动,盐度的波动会引起水生生物调节自身渗透压以应对环境压力,而在此过程中往往会伴随抗氧化酶活性的变化。SOD 作为动物机体重要的抗氧化酶之一,是机体抗氧化防御系统的第一道防线[38],在消除自由基、防御生物分子损伤方面发挥重要作用。相关研究[39]表明机体在受到轻度的污染胁迫时SOD 会被激活,超出一定范围后,活力呈现抑制趋势。叶建生等[28]研究表明盐度胁迫对凡纳滨对虾SOD 值影响显著(P<0.05),盐度突变值越大,SOD 活性越小。本研究中,0~72 h 盐度渐变胁迫过程中SOD 活力值均表现出随时间的延长逐渐降低的抑制趋势,日本囊对虾SOD 活力与盐度胁迫强度和胁迫时间总体呈负相关,低盐胁迫的强度越强,随着时间的延长,其SOD 活力与对照组的差异越显著,24~72 h 组间SOD 活力差异显著(P<0.05),表现为盐度14<18<22<26。这与叶建生等[28]在凡纳滨对虾上的研究结果具有一致性。此外,本研究中22、18 盐度组SOD 活力在6 h 均略高于对照组,之后均低于对照组,这与BJ?RN HENRIK HANSEN,et al[39]研究中得出的机体在受到轻度的胁迫时SOD 会被激活,超出一定范围后,活力呈现抑制趋势的结论相一致。
多酚氧化酶(PPO)是普遍存在于动植物体内的一类铜结合酶,可催化醌和单宁的合成,醌类参与细胞壁物质的合成及代谢,能与蛋白质等大分子物质形成聚合物,限制病原菌的扩展,与抗病性表达有关。甲壳动物酚氧化酶在入侵微生物的刺激下被激活,参与机体的防御反应,与机体的免疫相关[40]。相关研究[41]表明PPO 在虾类防御体外物质入侵过程中,伴随颗粒细胞的脱颗粒和酚氧化酶原的激活被释放,酶活化后可以迅速黏附到异物表面,以便达到识别和调理的功能。VARGAS-ALBORE,et al[42]在研究中发现加利福尼亚对虾幼虾的血细胞中酚氧化酶原在盐度降低时减少,酚氧化酶活力增加。叶建生等[28]在盐度突变对凡纳滨对虾PO 活性的研究中发现,血清PO 活性受低盐突变影响显著,随着盐度降低呈上升趋势,且盐度突变值越大,PO 活性上升越明显(P<0.05)。本研究中,PPO 活力受盐度渐变强度和胁迫时间的影响显著,不同盐度组间PPO 活力表现为盐度渐变的强度越大,PPO 活力随胁迫时间的变化趋势越明显,且组间差异明显(P<0.05),各盐度组间PPO 活力变化幅度表现为14>18>22>26;各盐度组内PPO 活力变化亦具有明显的时间性特征,胁迫时长对PPO 活力有显著影响,14 盐度组PPO 变化趋势呈单峰曲线,48 h 达到峰值,18 盐度组PPO 变化趋势呈双峰曲线,72 h 达到峰值。其中,在24~72 h 胁迫时段内,14 盐度组的PPO 活力72 h与48 h 比有所下降,可能是盐度渐变幅度过大,随着胁迫时间延长使得日本囊对虾机体的渗透压力剧增和代谢加速对能量的需求增加,引起机能协调失衡和免疫防御能力降低,48 h 时胁迫压力已达到机体免疫酶承受限度的临界点,72 h 体现在PPO 活力上表现出下降趋势,但详细的内在机理尚未见报道,有待进一步研究。此外,盐度26 渐变至22、18 盐度过程中,6 h 后PPO 活力值才开始发生变化,而26 渐变至14盐度过程中,PPO 活力在0~6 h 已呈上升态势,且随着胁迫时间的延长逐渐升高,自12 h 始PPO 活力均显著高于对照组(P<0.05),72 h 14 和18 盐度组的PPO 活力显著高于对照组,表明了盐度渐变幅度越大,PPO被激活的越早,其活性变化也越显著。这些与叶建生等[28]在凡纳滨对虾上的研究结果相一致。
相关研究表明,当养殖水环境的相关理化因子发生变化幅度超过对虾的机体承受能力时,免疫系统会崩溃,各种免疫相关酶活力会发生强烈变化,严重时会造成对虾大规模死亡[12,23,25,43]。因此,在日本囊对虾的实际生产养殖中,维持养殖水环境盐度的相对稳定具有十分重要的意义。

