融多元教学法,发展化学学科核心素养
黄建军


化学是高中课程中必不可少的重要组成部分,以往教师、家长重视考试成绩,而忽视了学生化学学科核心素养的培养。核心素养的提出有效解决了传统教育中“有知识,无素养”的问题。教师在教学过程中采用多种教学方法,如情景教学、实验探究等,分析“钠及其化合物”的性质、应用,培养学生的化学学科核心素养,强化高中化学教学成效。
以“钠及其化合物”一课为例设计教学活动,运用多种教学方法创设化学课堂,培养“有知识,有素养”的人才。
一、教材分析
“钠及其化合物”是人教版高中化学第一册第二章中的一节课。《普通高中化学课程标准(2017年版2020年修订)》要求学生学习“钠及其化合物”的主要性质时,可利用真实案例、实验探究等多种方法予以探究,明确各种物质在生产生活中的实际应用。“钠”知识点难度中等,放在了化学第一册的第二章,教学内容编排符合高中学生的心理发展顺序。而从核心素养角度来看,立足宏观视角,探究微观性质,可实现高中学生宏观辨识和微观探析素养的培养;设计教学实验活动,有助于培养学生科学探究与创新意识、证据推理与模型认知素养;化学知识点的学习、应用可助力学生科学态度与社会责任心的培养。
二、学情分析
高一阶段是由初中向高中转变的重要阶段,该阶段学生对化学知识有了一定的了解,相比较于初中化学知识,高中化学知识更具抽象性,无论是在深度方面,还是在广度方面都发生了变化。高中化学实验现象的未知性、知识点的复杂性使得学生产生抵触心理。教师要基于高中学生心理发展特征,综合高中教材内容,运用多种教学方法,科学合理设计教学过程,促进学生全面发展,进而培养高中生化学学科核心素养。
三、教学目标
1.探究金属钠的物理性质和化学性质;学习研究氧化钠与过氧化钠的特点;掌握碳酸钠、碳酸氢钠的特点及用途;在学习物质性质过程中,熟练运用分类、比较等方法,深度理解氧化还原反应、离子反应相关概念。
2.以情景教学引导学生学习金属钠的物理性质,掌握钠的化学性质;以实验探究引导学生思考、实践,掌握研究物质性质的基本方法,深化实验探究在化学学科学习中的价值与作用。
3.培养学生化学学科核心素养,即宏观辨识和微观探析素养;科学探究与创新意识、证据推理与模型认知素养;科学态度与社会责任素养。树立将化学知识与生产生活相联系的意识。
四、教学重点、难点
教学重点:了解金属钠的物理性质;掌握金属钠的化学性质;建立物质研究思路与方法。
教学难点:独立操作钠与水反应实验;观察分析化学钠与水反应实验现象。
五、教学过程
(一)课程导入
教师播放关于海洋的视频,学生观看。
教师:浩瀚而富饶的海洋中蕴含80多种元素,是巨大的化学资源宝库,而钠元素是含量最高的一种元素。同学们可以从海洋中找到钠元素吗?
学生(异口同声):都是海水,没有钠元素啊。
教师:众所周知,海水是咸的,同学们知道这是为什么吗?
学生:因为海水中有海盐,所以海水是咸的。
教师:对,大家看不见的钠元素就藏在海盐中,也就是说,钠元素不是以单独形式存在于自然界中,而是以化合物形式存在,如NaCl。
(设计意图:以真实情景导入新课,激发学生探索欲望,使学生积极参与到课堂活动中,教师引导学生思考钠相关内容,认识化学知识点,削弱学生对化学学习的抵触心理。)
(二)讲授新课
探究实验一:钠的活泼性
教师:无论是在自然界中,还是在生活中,钠元素都是以化合态形式存在,那单质的钠是怎么得到的呢?让我们来看PPT。
PPT内容:英国化学家汉弗里·戴维利用电解法从物质中分解出新元素,金属钠是戴维将熔融状态下的金属氢氧化物进行电解实验所获。电解实验中发生的化学反应:4NaOH═4Na+O2↑+2H2O。
出示单质钠的保存图片。
教师:单质钠如何保存的?钠是什么颜色的?
学生A:单质钠保存在煤油中。
学生B:单质钠是银白色的,但在空气中会呈现出黄色。
教师拿出刻刀切割单质钠(金属钠切割过程中,避免用手直接接触钠,而是要用镊子夹取切割),提出问题:单质钠的硬度如何?
学生(异口同声):柔软。
教师:请一位同学总结钠的物理性质。哪位同学试一下?
学生纷纷举手。
学生:(1)颜色为银白色,与空气发生反应呈现黄色;(2)硬度较为柔软。
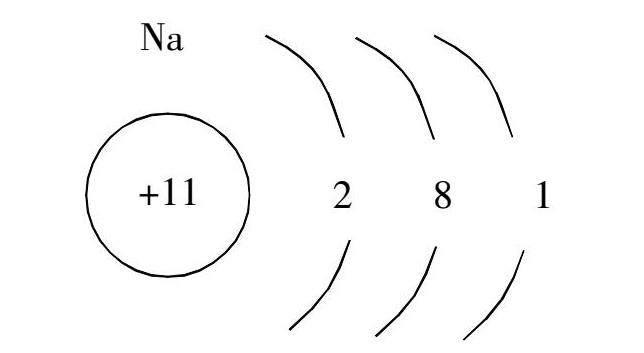
教师:为什么单质的钠无法存在于生活中?請同学们观察钠元素原子结构(展示钠元素原子结构图),并进行思考。
学生A:因为钠元素原子结构最外层电子层上只有一个电子,该电子很容易出走。
学生B:钠的化学性质非常活泼,具有还原性。
教师:在了解金属钠物理性质时,钠本身为银白色,与空气接触后,发生了颜色变化,这是为什么呢?(教师为学生演示金属钠被切割过程,引导学生观察金属钠切口处光泽和颜色的变化)
学生A:金属钠切口处颜色变暗了,说明金属钠与空气发生了化学反应。
教师:是的,金属钠的化学性质十分活泼,直接与空气中的氧气发生化学反应,在金属钠表面形成一层氧化物——氧化钠。板书(化学反应方程式):4Na+O2═ 2Na2O。
(设计意图:通过实验活动,学生能直观地看到化学实验现象,有助于学生分析、总结,进一步理解金属钠的化学性质。)
探究实验二:钠与非金属反应
教师:接下来,我们思考一个问题:金属钠暴露在空气中,会直接与氧气反应,那么将金属钠加热,会发生什么变化呢?
学生A:金属钠会熔化,与氧气形成新的物质。
学生B:金属钠与氧气直接发生化学反应形成氧化钠;在加热状态下,与氧气发生反应形成一种不同于氧化钠的物质。
教师:是的,金属钠在加热状态下与氧气发生化学反应,形成一种新的物质,即过氧化钠(Na2O2)。板书(化学反应方程式):2Na+O2 [△]Na2O2。让我们看一下过氧化钠(Na2O2)的生成过程吧(教师为学生演示化学实验活动)。
教师(实验过程演示后提问):通过观察金属钠与氧气在加热条件下的化学反应,请同学们总结一下化学实验现象。
学生A:金属钠受热后会快速熔化。
学生B:金属钠熔化后与氧气发生剧烈反应,并产生黄色火焰,随后生成一种淡黄色固体。
学生C:最后生成的淡黄色固体为过氧化钠(Na2O2)。
教师:金属钠与氧气在不同条件下发生化学反应,形成两种新的物质,即氧化钠、过氧化钠。那金属钠与其他非金属会发生什么样的反应呢?(教师为学生播放事前录制好的化学实验操作视频:金属钠与氯气发生反应的视频)
教师:总结一下金属钠与氯气发生化学反应的实验现象。
学生A:金属钠在氯气中剧烈燃烧,且火焰呈现黄色,和金属钠与氧气加热状态下产生的火焰颜色一致,但不同的是,金属钠在氯气中燃烧会产生大量的白烟。
学生B:待金属钠与氯气反应停止后,集气瓶的瓶口与瓶壁上有白色固体。
教师:同学们猜猜,白色的固体是什么物质?
学生C:是氯化钠。
教师:是的,金属钠与氯气发生化学反应后,所生成的物质为氯化钠(NaCl),也就是我们所熟知的盐,在海洋中有着丰富的存量。板书(化学反应方程式):2Na+Cl═2NaCl。
(设计意图:通过设计金属钠与氧气、氯气等非金属单质反应,形成新的化合物,引导学生猜想、验证、观察、总结化学实验,锻炼学生的科学探究与创新意识,培养证据推理与模型认知素养。)
探究实验三:钠与水反应
教师:金属钠十分活泼,其不仅与氯气、氧气等非金属单质发生化学反应,也可以与水发生反应,同学们预测一下:金属钠与水会生成什么物质呢?
学生A:金属钠与水发生反应,可能生成氢气。
学生B:金属钠与水发生反应,可能生成氧气。
教师:那让我们观察一下金属钠与水的化学反应实验。
教师准备一个烧杯,在烧杯中放入一些水,并滴入3~5滴酚酞溶液,切割绿豆大小的金属钠,直接放入水中。
教师:大家观察金属钠和水反应的实验现象。
学生A:浮在水面上。
学生B:金属钠逐渐变小。
学生C:在水面上游动。
学生D:发出“嘶嘶”的响声。
学生E:水的颜色发生变化,变成了红色。
教师:那发生这些实验现象的本质原因是什么呢?
学生A:金属钠浮在水面上,是因为金属钠的密度小于水的密度。
學生B:金属钠形状发生变化,是因为金属钠与水发生反应放热,熔点低。
学生C:金属钠在水中快速移动,是因为金属钠与水发生反应产生气体,推动钠小球游动。
学生D:会发出响声,是因为金属钠与水反应剧烈。
学生E:水溶液变红,是因为生成物呈碱性。
教师:同学们总结得非常细致,我们可以将金属钠与水反应产生的化学现象归纳为五个字,即浮、熔、游、响、红,对应金属钠与水反应产生的五种实验现象。
随后,教师利用PPT展示金属钠及其化合物在生产生活中的用途。
(设计意图:通过实验活动激发学生参与课堂学习的兴趣;设计驱动型问题,引导学生深度思考,加深学生对金属钠的认识;利用手持技术检验,通过宏观现象、曲线表征加以验证,实现学生证据推理与模型认知素养的培养。)
(三)总结梳理
学生活动:分享本节课学习的心得体会,概括本节课的知识要点以及课堂感悟。
布置作业:利用图片或者表格的形式梳理本节课的学习内容。
六、实践反思
以《普通高中化学课程标准(2017年版2020年修订)》为抓手,创新教学方法,提高学生化学核心素养。利用真实情景导入课堂,激发学生学习欲望;利用实验探究活动,锻炼学生动手操作能力、归纳总结能力;设置驱动型问题,锻炼学生思维能力,提升学生对科学本质的认知。教师在化学教学中,不仅要创新教学方法,也要融合多种教学方法,并依据教学内容科学合理地选择教学方法,激发学生学习化学、学习科学的热情,切实提高高中化学教学质量。
(作者单位:甘肃省敦煌市敦煌中学)
编辑:李琴芳
新课程·上旬2024年3期
