替诺福韦与恩替卡韦治疗代偿期乙肝肝硬化患者的效果
李艳婷 吕明
乙肝肝硬化本质上是一种弥漫性肝损伤疾病,发病率及致死率较高。代偿期乙肝肝硬化患者需要采用科学有效的药物治疗以遏制病情的进一步发展,避免病毒复制对患者生命健康产生威胁[1]。因此,在代偿期需要采取科学有效的治疗措施,以防止疾病继续发展,提高患者预后。临床中针对代偿期乙肝肝硬化的治疗方法主要以替诺福韦与恩替卡韦为主,虽然二者均具有一定临床疗效,但是从实际应用角度来看,上述2 种药物在疗效以及并发症方面依旧存在差异[2]。恩替卡韦作为一种临床工作中一类应用较为广泛的抗乙肝病毒一线药物,替诺福韦作为一类较为常用的抗病毒药物,其作用机制在于能够有效地对病毒复制产生抑制作用,还可促进缩短病程,从而达到降低患者死亡率的目的[3]。为了进一步探讨2 种药物的实际效果,本研究将患者分为2 组并分别采取不同治疗方式进行分析,现报道如下。
1 资料与方法
1.1 一般资料
选取2021 年5 月—2022 年5 月淄博市传染病医院收治的代偿期乙肝肝硬化患者70 例。纳入标准:(1)患者肝脏功能尚未严重受损。(2)患者需同意参与研究,并签署知情同意书。排除标准:(1)患者如果已经发展到失代偿期,可能会有腹腔积液、肝性脑病等严重并发症,治疗难度大,风险高。(2)同时感染其他肝炎病毒,如丙型肝炎病毒(hepatitis C virus,HCV)或丁型肝炎病毒(Hepatitis D virus,HDV)。(3)患者对研究药物过敏。(4)患者伴有严重的心脏病、肾脏病等。利用随机数字表法分为对照组与观察组,各35 例。对照组男性18 例,女性17 例;年龄50 ~70 岁,平均(55.38±4.58)岁;病程2 ~6 个月,平均(3.98±1.02)个月。观察组男性17 例,女性18 例;年龄50 ~70 岁,平均(55.54±3.87)岁;病程1 ~5 个月,平均(3.82±0.98)个月。2 组一般资料比较,差异无统计学意义(P> 0.05),具有可比性。本研究经医院医学伦理会委员批准。
1.2 方法
2 组均口服水飞蓟宾胶囊(天津天士力圣特制药有限公司,国药准字H20040299,规格:35 mg)420 mg,3 次/d;口服鳖甲煎丸(国药集团中联药业有限公司,国药准字Z42020772,规格:135 g)10 g ,3 次/d。每日服用维生素E(大同市利群药业有限责任公司,国药准字H14020834,规格:5 mg),1 次/d。
1.2.1 观察组
在上述治疗治疗基础上,口服替诺福韦(浙江苏可安药业有限公司,国药准字H20183499,规格:300 mg×30 片)300 mg,1 次/d。治疗180 d。
1.2.2 对照组
在上述基础上,口服恩替卡韦(中美上海施贵宝制药有限公司,国药准字H20052237,规格:0.5 mg)0.5 mg,1 次/d。治疗180 d。
1.3 观察指标
1.3.1 观察2 组患者临床疗效
1 级疗效:主要症状消失且肝脏纤维化弹性指数下降超过40%;2 级疗效:主要症状有所缓解且肝脏纤维化弹性指数下降超过20%;3 级疗效:主要症状未改善甚至加重且肝脏纤维化弹性指数下降<20%。总有效率=(1 级疗效+2 级疗效)例数/总例数×100%[4]。
1.3.2 观察2 组患者肝功能情况
包括谷草转氨酶、谷丙转氨酶以及肝脏储备功能量化评估分级标准(criteria for quantitative evaluation of liver reserve function,Child-Pugh)评分[5]。Child-Pugh 即为Child于1964 年根据肝硬化患者的3 项临床指标(腹腔积液、神经精神症状和营养状态)及2 项肝功能指标测定(血清胆红素和血清白蛋白),分为3 个层次(1、2、3)进行计分,5 个指标的最低分为5 分,最高分为15 分,根据计分的多少将肝功能损害程度的不同分为A(5 ~6 分,肝脏功能较好)、B(7 ~9 分,肝脏功能中等)、C(10 ~15 分,肝脏功能较差)三级,是临床上曾广泛应用的经典分级法。
1.3.3 观察2 组患者肝纤维化指标情况
包括血清层粘连蛋白、透明质酸、Ⅲ型前胶原肽。
1.3.4 乙肝病毒的脱氧核糖核酸(HBV deoxyribonucleic acid ,HBV-DNA)转阴率
观察2 组患者HBV-DNA 转阴率。
1.3.5 观察2 组血小板与天冬氨酸转氨酶和血小板比率指数(aspartate aminotransferase to platelet ratio index,APRI)指数
患者血小板与APRI 指数,评价指标包括血小板计数、天冬氨酸氨基转移酶和血小板比率指数。
1.3.6 观察2 组患者脏器形态变化
包括肝门静脉内径和脾脏厚度。
1.3.7 观察2 组患者并发症情况
包括上消化道出血、感染、肝硬化相关事件。
1.4 统计学处理
采用SPSS 24.0 统计学软件进行分析。计量资料以(±s)表示,组间比较采用两独立样本均数t检验;计数资料用n(%)表示,行χ2检验。P< 0.05 为差异有统计学意义。
2 结果
2.1 2 组临床疗效对比
观察组总有效率高于对照组(P< 0.05),见表1。

表1 观察组与对照组临床疗效对比[例(%)]
2.2 2 组肝功能对比
2 组治疗后与治疗前比较谷草转氨酶、谷丙转氨酶、Child-Pugh 评分均较低;治疗后,观察组谷草转氨酶、谷丙转氨酶、Child-Pugh 评分均低于对照组,差异有统计学意义(P< 0.05),见表2。
表2 观察组与对照组肝功能对比(±s)
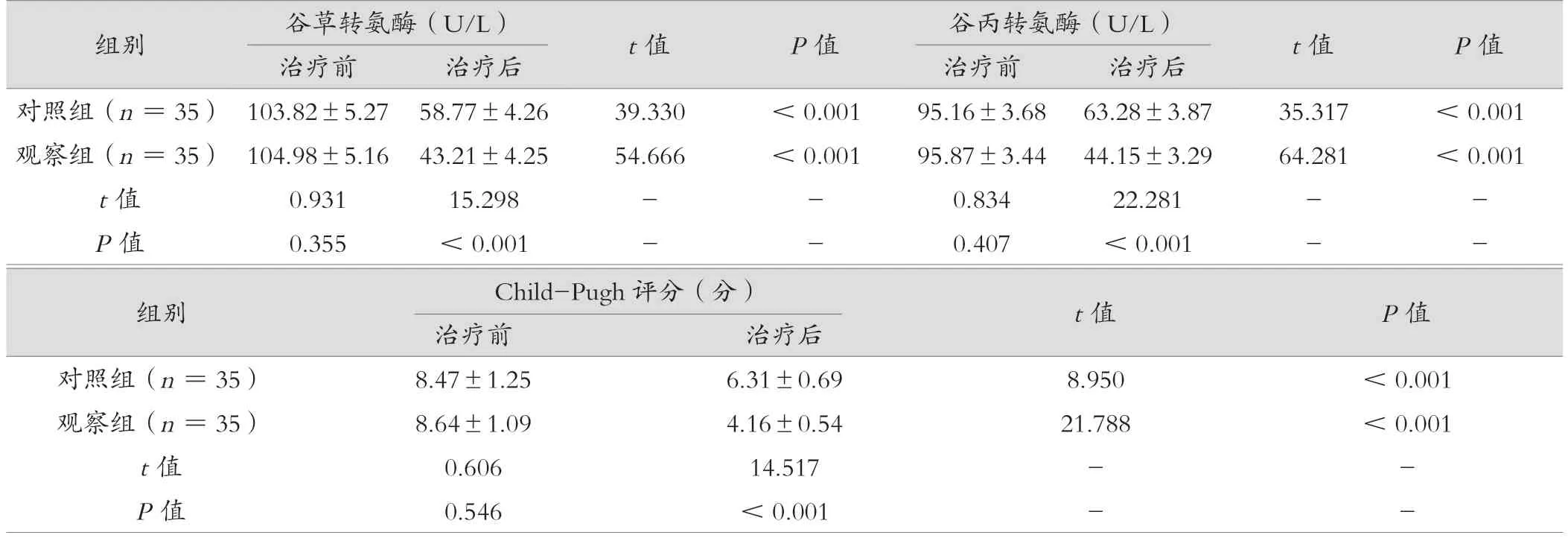
表2 观察组与对照组肝功能对比(±s)
组别谷草转氨酶(U/L)t 值P 值谷丙转氨酶(U/L)t 值P 值治疗前治疗后治疗前治疗后对照组(n =35) 103.82±5.27 58.77±4.2639.330<0.00195.16±3.68 63.28±3.8735.317<0.001观察组(n =35) 104.98±5.16 43.21±4.2554.666<0.00195.87±3.44 44.15±3.2964.281<0.001 t 值0.93115.298--0.83422.281--P 值0.355<0.001--0.407<0.001--组别Child-Pugh 评分(分)t 值P 值治疗前治疗后对照组(n =35)8.47±1.256.31±0.698.950<0.001观察组(n =35)8.64±1.094.16±0.5421.788<0.001 t 值0.60614.517--P 值0.546<0.001--
2.3 2 组肝纤维化指标对比
治疗前,2 组血清层粘连蛋白、透明质酸、Ⅲ型前胶原肽水平比较,差异无统计学意义(P> 0.05)。2 组治疗后与治疗前比较,血清层粘连蛋白、透明质酸、Ⅲ型前胶原肽均较低(P< 0.05);治疗后观察组血清层粘连蛋白、透明质酸、Ⅲ型前胶原肽均低于对照组,差异有统计学意义(P< 0.05),见表3。
表3 观察组与对照组肝纤维化指标对比(μg/L,±s)
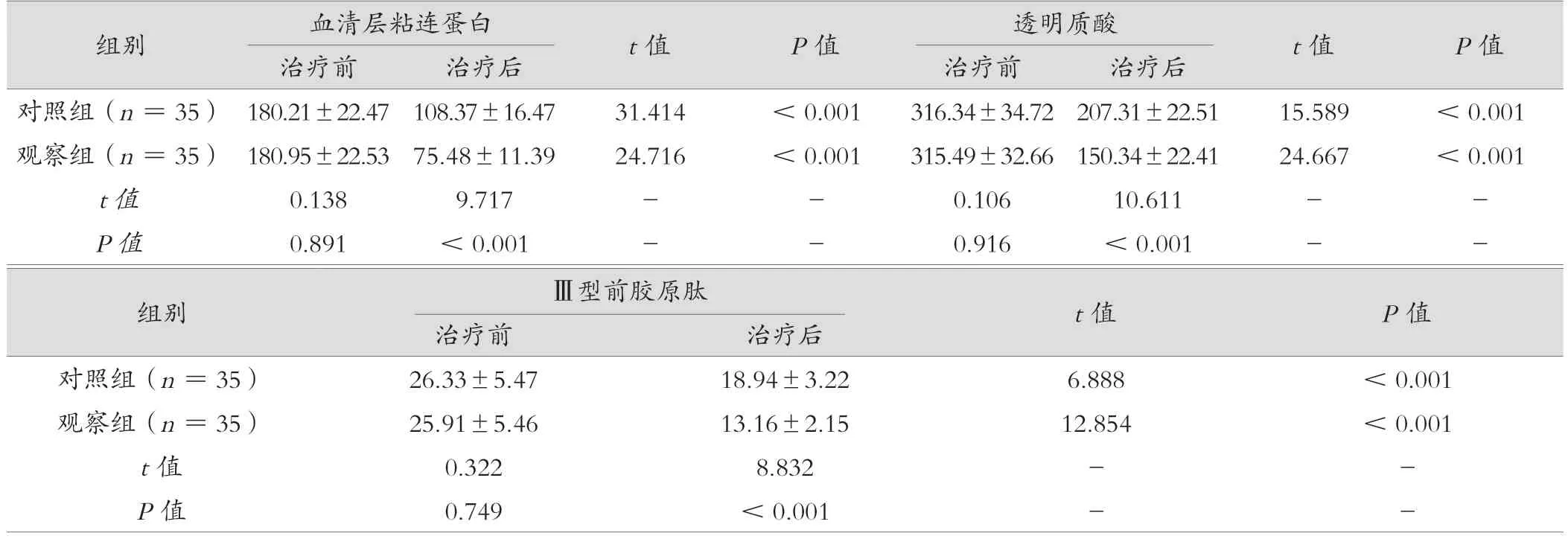
表3 观察组与对照组肝纤维化指标对比(μg/L,±s)
组别血清层粘连蛋白t 值P 值透明质酸t 值P 值治疗前治疗后治疗前治疗后对照组(n =35) 180.21±22.47 108.37±16.4731.414<0.001316.34±34.72 207.31±22.5115.589<0.001观察组(n =35) 180.95±22.53 75.48±11.3924.716<0.001315.49±32.66 150.34±22.4124.667<0.001 t 值0.1389.717--0.10610.611--P 值0.891<0.001--0.916<0.001--组别Ⅲ型前胶原肽t 值P 值治疗前治疗后对照组(n =35)26.33±5.4718.94±3.226.888<0.001观察组(n =35)25.91±5.4613.16±2.1512.854<0.001 t 值0.3228.832--P 值0.749<0.001--
2.4 2 组血小板与APRI 指数对比
2 组治疗后与治疗前相比,血小板计数较高、天冬氨酸氨基转移酶和血小板比率指数较低(P< 0.05);治疗后,观察组血小板计数较高、天冬氨酸氨基转移酶和血小板比率指数均低于对照组,差异有统计学意义(P< 0.05),见表4。
表4 观察组与对照组血小板与APRI 指数对比(±s)

表4 观察组与对照组血小板与APRI 指数对比(±s)
组别血小板计数(×109/L)t 值P 值天冬氨酸氨基转移酶和血小板比率指数t 值P 值治疗前治疗后治疗前治疗后对照组(n =35) 109.83±61.37 113.35±29.340.3060.0061.76±0.620.98±0.595.392 <0.001观察组(n =35) 111.57±58.43 127.45±20.311.5190.0031.75±0.580.72±0.428.509 <0.001 t 值0.1222.338--0.0702.124--P 值0.9040.022--0.9440.037--
2.5 2 组脏器形态变化对比
2 组治疗后与治疗前比较,肝门静脉内径较低、脾脏厚度较低(P< 0.05);治疗后,观察组肝门静脉内径较低、脾脏厚度均低于对照组,差异有统计学意义(P< 0.05),见表5。
表5 观察组与对照组脏器形态变化对比(mm,±s)
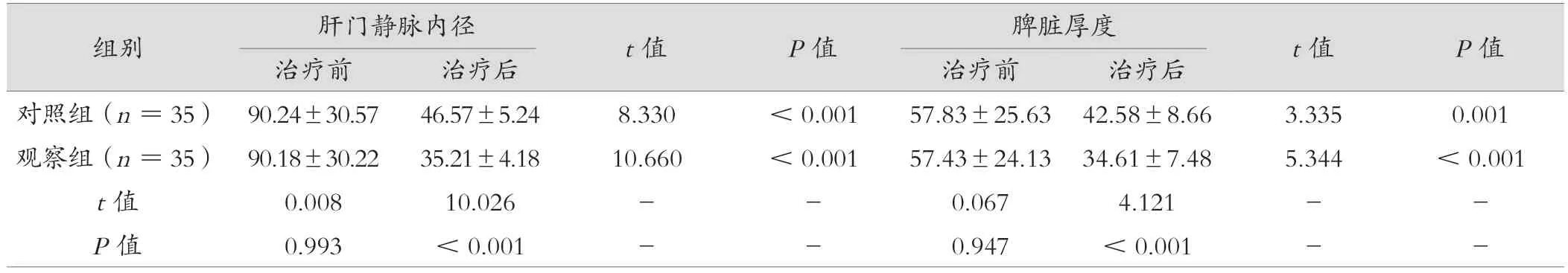
表5 观察组与对照组脏器形态变化对比(mm,±s)
组别肝门静脉内径t 值P 值脾脏厚度t 值P 值治疗前治疗后治疗前治疗后对照组(n =35) 90.24±30.5746.57±5.248.330<0.00157.83±25.63 42.58±8.663.3350.001观察组(n =35) 90.18±30.2235.21±4.1810.660<0.00157.43±24.13 34.61±7.485.344<0.001 t 值0.00810.026--0.0674.121--P 值0.993<0.001--0.947<0.001--
2.6 2 组HBV-DNA 转阴率对比
2 组治疗180 d 与治疗90 d 比较,HBV-DVA 转阴率均较高(P< 0.05);治疗后,观察组HBV-DVA 转阴率均高于对照组,差异有统计学意义(P< 0.05),见表6。
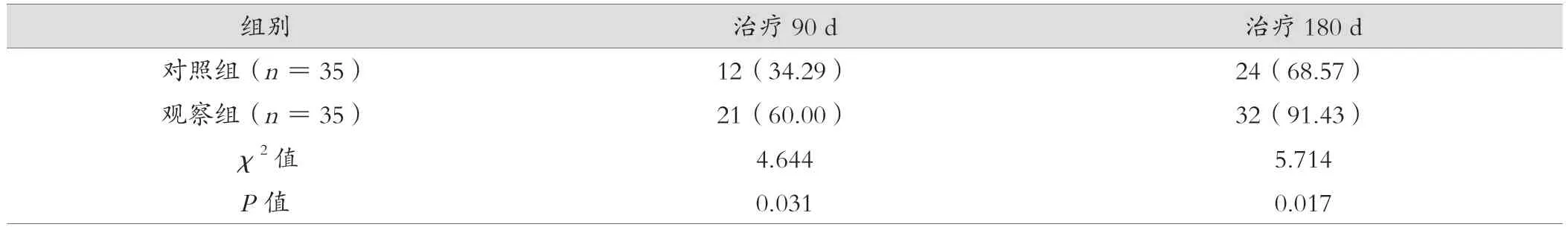
表6 观察组与对照组HBV-DNA 转阴率对比[例(%)]
2.7 2 组并发症对比
观察组并发症发生率低于对照组,差异有统计学意义(P< 0.05),见表7。

表7 观察组与对照组并发症对比[例(%)]
3 讨论
肝部疾病在我国的发生以及致死率高于其他国家[5]。近年来,由于生活环境和生活方式的变化,肝硬化的发病率呈上升趋势,已成为导致肝癌发生和发展的主要原因,严重影响了人民的生活质量[6]。
乙肝肝硬化全称叫作乙型肝炎肝硬化,是由于乙型肝炎病毒导致的。乙肝肝硬化与普通的肝硬化疾病的临床表现相似,当乙肝肝硬化患者出于代偿期时,身体普遍会出现食欲不振以及乏力等各种症状[7]。肝硬化初期没有明显的征兆,当出现轻度病变时,多数组织都可以正常进行代谢活动,因此一般不会出现不适。许多肝脏疾病的患者就是因为忽略了肝脏疾病的早期症状,导致了肝硬化的恶化。根据最新的医学数据,50%的肝硬化患者都是在肝硬化和肝癌中被发现的,这也是导致肝硬化死亡率很高的一个重要原因[8]。
代偿期乙肝肝硬化患者的主要症状包括全身症状、慢性消化不良症状等。全身症状主要包括乏力、易疲劳、体力下降等症状,少数患者可能会有面部色素沉积。慢性消化不良症状主要包括食欲减退、腹胀或有便秘、腹泻或肝部疼痛[9-10]。当患者处于长时间的体力劳动后,上述症状可能更为明显。临床调查显示,大多数患慢性肝炎或肝硬化的患者普遍会存在面部消瘦以及黝黑等症状,尤其是患者的眼眶周边皮肤相对黝黑。产生上述现象的主要原因在于当患者出现肝功能减退时,患者皮肤的黑色素生成将会显著增加[11-12]。少数患者可能会在病症发展的早期阶段出现乳房胀痛以及睾丸收缩等症状,主要原因在于肝硬化会导致患者机体内激素紊乱,雌激素增加的同时雄激素会减少,因此男性患者更易出现乳房胀痛现象,女性患者也可能会出现月经紊乱或者阴毛减少等症状[13]。根据临床显示,当患者存在长期酗酒史时,肝脏可能会出现不同程度的肿胀,通常可能会处于中度肿大。
当患者处于失代偿期时,病情会显著进展并且出现多种危重并发症,导致患者的肝功能严重受损甚至会出现肝性脑病,少数患者可能会发展为肝癌,最终出现不良结局。通常情况下,对于情况比较稳定的慢性肝病患者,应该在3 ~6 个月内对肝脏进行1 次全面的检查[14]。如果是乙肝,需要做肝功能检查、乙肝病原学检查、甲胎蛋白定量、肝脏B 超等检查,如有必要,还需要做肝脏增强 CT 扫描。一旦出现了不正常的症状,就应该去正规的医院就诊。因此为了避免患者的病情进一步发展出现不良结局,在患者代偿期期间就需要采取一系列必要的治疗措施,遏制病情进展。
临床中针对代偿期乙肝肝硬化患者的治疗方法多种多样,通常采取维生素+保肝药物+抗病毒药物。临床中保肝药物主要包括复方甘草酸苷胶囊、还原型谷胱甘肽等,能够促进肝细胞再生,降低血液中的转氨酶,改善肝功能。抗病毒药物包括拉米夫定、干扰素、阿德福韦酯以及替比夫定。本研究对2 组患者采用的药物治疗方案为替诺福韦与恩替卡韦。根据本次实验结果可以得出,观察组上述指标均优于对照组(P< 0.05),产生上述现象的主要原因体现在以下几点:对照组患者使用的恩替卡韦是最新一代抗乙肝病毒药物,恩替卡韦是目前市场上最有效的抗病毒药,比拉米夫定药效提高100 倍,而且可以在1 年内将大部分高病毒患者的感染控制到完全消失。早期作用更明显,前2 周就能降低22%,对救治重症患者特别有利。在肝脏移植患者中,可以用它来抑制病毒复制,并可以长期使用以防止再次感染引起的肝脏移植排斥反应。其主要原理为恩替卡韦作为一种鸟嘌呤核苷类药物能够对乙肝病毒的多聚酶具有显著的抑制效果,它可以被磷酸化成三磷酸酯,三磷酸酯在细胞中有15 h 的半衰期[15]。与乙型肝炎病毒多聚酶体的自然底物三磷酸-去氧鸟嘌呤核苷产生竞争性。虽然该药物具有显著疗效,但是从实际应用角度来看,恩替卡韦药物长期口服后会导致患者出现不同程度的恶心、腹泻、呕吐及胃肠胀气、头晕等症状。上述症状对患者的生活质量会产生一定影响,因具有较高的副作用,该药物并不能够作为临床最佳的长期服用药物。
本研究观察组采用的药物治疗方案为替诺福韦,该药物本质上属于核苷酸类逆转录酶抑制剂,对多种病毒均有显著的治疗效果。其原理在于:替诺福韦作为Retroptosis抑制剂是一种在体内被磷酸化后形成的类似于自然核苷的核苷酸,可与其竞争Retroptosis 结合位点,参与到 HBV DNA 链中,阻断 HBV DNA 链的延伸及合成,并对 HBV DNA 多聚酶及反转录酶的活性进行抑制。替诺福韦中的二磷酸无3'-0H 基因,所以DNA 链延长会被终止,因此病毒复制受到抑制,通过上述方式能够显著抑制病毒的复制。研究发现,替诺福韦8 年的耐药率为0,替诺福韦单一用药对肝功能、肝纤维化具有明显改善作用[15]。经口服后可迅速吸收,约0.5 ~1.5 h 后达到血浆峰浓度,生物利用度>70%。由于耐受性较好,因此患者的并发症发生风险相对较低。但替诺福韦也会对患者的肾功能和骨密度产生一定影响,TDF 对肾脏的损伤一般是轻微的,通常只会出现轻微的血清肌酐上升以及没有症状的血磷下降,停用药物或减量药物消失。严重的情况比较少见,但与药物过量或者其他危险因素有显著相关性。例如老年患者长期服药后在临床上可以出现以下症状:肾性电解质紊乱、肾小管性酸中毒。病理变化具体表现为大范围水肿,细胞坏死,空泡形成,刷状边缘萎缩。产生上述现象的主要原因为替诺福韦在近曲小管的药物浓度增加并对线粒体毒性增强,从而影响近曲小管的重吸收和分泌进程的主动转运效果。替诺福韦还会对患者成骨细胞、破骨细胞活性直接干扰,或者是间接通过干扰维生素D 的代谢影响肾功能,进而导致骨代谢异常引起骨密度减低。因此不建议年龄过大的人服用,服用过程中要定期监测肾功能和骨密度。
临床中针对代偿期乙肝肝硬化患者的检查方法主要有肝功能检查、病原学检查、影像学分析等。本研究对2 组患者治疗前后进行了一系列的检测,如谷丙转氨酶、谷草转氨酶。谷丙转氨酶又名谷氨酸转氨酶,简称谷丙转氨酶(alanine aminotransferase,ALT)。GPT 增高是肝功能不正常的一种标志。在常见的原因中,各种肝炎均可导致 GPT 升高,其主要原因为肝脏受损。有些药物会导致肝功能的损伤,比如抗肿瘤药、抗结核药等。在短期内,大量饮酒或饮食都有可能导致肝功能受损。谷草转氨酶是一种在医疗中进行肝功能检查的指标,可以用来判断肝脏有没有受到损伤。根据实验结果可以得出,观察组患者上述指标在治疗后均处于正常范围内,说明替诺福韦改善患者肝功能水平更高。
根据实验结果发现,在临床疗效、肝纤维化指标、HBV-DNA 转阴率、血小板与APRI 指数、脏器形态变化中,观察组患者的评价指标更为优异,说明替诺福韦遏制病情进展以及促进患者肝脏恢复更为显著。
综上所述,代偿期乙肝肝硬化患者接受替诺福韦与恩替卡韦均具有一定疗效,但是相比于恩替卡韦,替诺福韦更能够达到显著效果。

