Hippo信号调控先天免疫应答的研究进展
余京格,李建国,赖苏雯,朱 媛,刘志平,3,何天生,3
(1.赣南医科大学基础医学院;2.赣南医科大学第一临床医学院;3.赣南医科大学炎症与免疫中心,江西 赣州 341000)
Hippo信号通路最初是在黑腹果蝇中发现的,通过一组保守的激酶控制细胞生长和器官大小[1]。Hippo信号通路在进化上高度保守,哺乳动物中对应的同源蛋白也被鉴定出来并行使相似的功能。在哺乳动物中,Hippo信号通路的核心激酶主要包括STE20样丝氨酸/苏氨酸激酶MST1/2(Mammalian Ste20-like kinases 1/2,与果蝇Hpo蛋白同源)及其支架蛋白SAV1(Protein salvador homolog 1,与果蝇Salvador同源)、激酶LATS1/2(Large tumor suppressor 1/2,与果蝇Warts同源)及其支架蛋白MOB1A/B(Mps one binder 1A/B,与果蝇Mob同源),以及下游的辅助转录复合物YAP(Yes-associated protein,与果蝇Yki同源)和TAZ(Transcriptional co-activator with PDZ-binding motif,与果蝇Yki同源)。YAP和TAZ是不含DNA结合结构域的转录共激活因子,在正常生理状态下,YAP/TAZ入核后通过结合TEAD家族转录因子TEAD 1~4(与果蝇Sd同源)促进细胞增殖、存活和迁移,从而控制细胞生长、器官大小与体积[2]。经典Hippo信号通路在组织器官发育、细胞生长和肿瘤形成等方面发挥调控作用。Hippo信号通路还存在不依赖于YAP/TAZ转录激活因子的调控机制,即非经典Hippo信号通路,其中包括Hippo信号在先天免疫应答、自噬等方面的调控。本文主要阐述Hippo信号通路在先天免疫应答调控的最新进展,介绍Hippo信号对先天免疫细胞、抗病毒和炎症信号的调控作用,为免疫治疗策略提供参考依据。
1 经典Hippo信号与非经典Hippo信号
经典Hippo信号通路是通过系列激酶活化调节YAP/TAZ活性,从而调控下游靶基因转录水平,影响细胞生长。经典Hippo信号通路通过胞膜受体蛋白感受胞外环境的刺激信号后,MST1/2发生磷酸化,活化的MST1/2磷酸化LATS1/2激酶,活化的LATS1/2再磷酸化激活下游YAP/TAZ。磷酸化的YAP/TAZ与胞浆衔接蛋白14-3-3蛋白结合,将YAP/TAZ滞留在胞浆中并介导其泛素化降解,抑制其入核并结合转录因子TEAD,限制细胞增殖和组织生长[3]。YAP/TAZ处于恒定和快速的磷酸化与去磷酸化状态,因此,Hippo信号通路的“开关”并不是静态的,而是动态变化的。使用活细胞示踪技术分析发现,哺乳动物细胞/果蝇的YAP/Yki在细胞质和细胞核之间快速穿梭,而不是静态定位在任何一个区室中,经典Hippo信号通路就是通过调节YAP/TAZ入核速率实现控制细胞增殖与凋亡、器官大小与体积[4]。
近年来,Hippo信号除调节细胞增殖、控制器官大小等经典功能外,不依赖活化转录因子TEAD的生物学功能也逐渐被发现,并成为研究的热点。经典Hippo信号通路的研究多集中在外界环境刺激等如机械压力等调节转录活性机制,进而控制细胞增殖、器官大小与肿瘤形成等。Hippo信号分子通过上游激酶活性或结合其他信号调节分子,参与其他信号通路(如TGF-β信号、Wnt信号、先天免疫信号等)调控细胞的生物学功能,称为非经典Hippo信号。Hippo信号的激酶分子和转录共激活因子是细胞生长发育中进化保守的分子,在宿主生存和防卫过程中也发挥不可替代的功能。例如,Hippo信号分子MST1通过激酶结构域与蛋白激酶CK1ε相互作用,阻断CK1ε与Wnt信号下游中心分子DVL2结合,进而抑制Wnt/β-catenin信号通路[5]。MST1通过信号复合物Rap1-RapL参与调节淋巴细胞极性和黏附,在T淋巴细胞发育、存活、转运与归巢中都发挥着重要作用[6]。然而,在敲低MST1激酶的DC细胞中,趋化因子受体CCR7信号活化受到抑制,进而抑制依赖于CCR7活化信号的下游靶基因功能,影响DC细胞骨架重塑与迁移[7]。MST1/2激酶结合并磷酸化ROS/亲电传感器蛋白KEAP1,磷酸化的KEAP1抑制下游效应蛋白NRF2的泛素化介导蛋白酶体途径降解,减少ROS产生,参与调控巨噬细胞氧化还原稳态[8]。MST1/2激酶通过调节线粒体转运体与线粒体吞噬体来控制活性氧的产生,通过活化小G蛋白Rac1等方式参与调节免疫细胞对病原微生物的吞噬和杀伤作用[9]。
随着研究深入,Hippo信号通路的新成员及功能也逐渐被发现,如RASSF5(Ras association domain family member 5,或称RAPL/Nore1B)、NDR1/2(Nuclear Dbf2-related1/2,或 称STK38/STK38L)、NF2(Neurofibromatosis type Ⅱ,或 称Merlin)以 及MAP4Ks(MAP kinase kinase kinase kinases)。一方面,它们参与经典Hippo信号通路,参与细胞增殖、凋亡和细胞极性调控。NDR1/2蛋白可以被MST1/2磷酸化,与LATS1/2一起调节YAP/TAZ的亚细胞定位和转录活性[10]。这些激酶的组织分布决定了其组织特异功能,如在肠道上皮组织中,是NDR1/2而非LATS1/2作为YAP的生理性激酶[11]。MAP4Ks与MST平行激活下游LATS,特别在血清饥饿时,MAP4Ks激酶在调节LATS和YAP/TAZ活性比MST1/2更重要[12]。另一方面,这些新成员本身能不依赖活化TEAD,与其他蛋白质相互作用或介导靶蛋白磷酸化,直接参与信号转导和细胞代谢。如:NDR1竞争性结合TRAF3,导致IL-17信号传导增强和炎症因子产生增加。NDR2促进MEKK2的泛素化和降解,以抑制IL-17信号传导,防止过度分泌炎症因子[13]。因此,Hippo信号激酶成员和转录共激活因子除调节细胞增殖、控制器官大小等经典功能外,也不同程度参与细胞免疫稳态,如炎症反应与先天免疫应答(图1)。

图1 经典Hippo信号通路和非经典Hippo信号通路
2 Hippo信号调控先天免疫细胞功能的作用
2.1 Hippo信号调控巨噬细胞的极化以及氧化应激稳态巨噬细胞是先天免疫系统中不可或缺的成员,能够产生多种炎症和趋化因子,在抵抗病原菌感染、抗原呈递等多种免疫反应中扮演关键角色。根据分泌的炎症因子与功能,巨噬细胞主要分为M1型巨噬细胞和M2型巨噬细胞2种亚群。M1型巨噬细胞主要出现在病原体感染早期,通过分泌促炎因子TNF-α、IL-12与iNOS等促进炎症反应,增强吞噬、杀菌功能;M2型巨噬细胞通过分泌IL-10等抗炎细胞因子抑制炎症反应,参与组织修复和血管生成等过程。研究表明,Hippo信号分子能通过调控巨噬细胞极化影响肿瘤、炎症性疾病的进程。如,YAP能抑制IL-4/IL-13诱导的M2型巨噬细胞极化,并同时促进LPS/IFN-γ诱导的M1型巨噬细胞的活化,产生过量的促炎细胞因子IL-6,加剧炎症性肠病的发展[25]。在MST1/2缺失的肝细胞中,通过上调MCP1表达并导致大量具有混合M1/M2巨噬细胞浸润,加剧肝癌发展[26]。
此外,Hippo信号通路在巨噬细胞的氧化应激稳态中也发挥重要功能。在巨噬细胞杀死病原微生物的过程中,会产生大量的ROS杀死吞噬的病原微生物。Mst1/2敲除的巨噬细胞中的ROS水平上升,氧化应激水平升高。在巨噬细胞抗感染过程中,Mst1/2受刺激被募集到线粒体和吞噬体,直接参与调节ROS生成。另一方面,维持细胞的氧化还原稳态是维护巨噬细胞正常生理功能和免疫功能的重要保障。过量的ROS也会损伤巨噬细胞,Mst1/2通过调节细胞内的氧化还原状态,避免过量的ROS导致细胞损伤,有助于维持巨噬细胞的杀伤能力与存活之间的平衡。Mst1/2激酶活化后,通过调控抗氧化因子Nrf2促进其下游的抗氧化酶靶基因表达,进而降低ROS诱导的氧化损伤[8]。因此,Hippo信号通路可以影响巨噬细胞的极化、吞噬、产生细胞因子等多种生理过程,从而影响巨噬细胞的免疫功能和炎症反应等生理过程。
2.2 Hippo信号调控树突状细胞的代谢以及抗原递呈能力树突状细胞(Dendritic cell,DC)是先天免疫细胞的重要组成部分,主要负责抗原的捕获、处理、呈递和启动免疫反应,广泛分布于皮肤、黏膜和淋巴组织等。DC细胞根据进化谱系主要分为经典树突状细胞(Conventional dendritic cell, cDC)和浆细胞样树突状细胞(Plasmacytoid dendritic cell, pDC)。Hippo信号激酶MST1/2在选择性编程CD8α+cDC的功能与代谢中发挥重要功能。通过NetBID系统生物学算法分析发现,CD8α+cDC细胞中的Hippo信号通路激酶的表达量与活性比CD8α-cDC细胞明显增高,表现出更强的氧化代谢水平,并依赖MST1/2活性维持细胞能量代谢稳态和线粒体动力学[27-28]。另外,MST1缺失还影响DC介导的特异性免疫应答。DC细胞中缺失MST1/2,而非下游激酶LATS1/2与转录辅助因子YAP/TAZ会破坏CD8+T细胞的稳态及其肿瘤杀伤功能,这表明MST1/2发挥作用并不依赖经典Hippo信号路径[28]。将T细胞与特异性敲除MST1的DC细胞体外共培养,发现DC中的MST1缺失通过p38 MAPK信号通路促进IL-6表达并调节CD4+T细胞中IL-6受体与STAT3的活化,影响Th17细胞分化,加剧自身免疫性疾病模型的炎症进展[29]。因此,Hippo信号分子在DC细胞成熟、活化和抗原递呈能力方面都发挥至关重要的作用。
3 Hippo信号通路在先天免疫抗病毒信号中的调控机制
先天免疫抗病毒信号是机体抵抗病毒入侵的第一道防线,迅速识别并消灭病毒,防止感染的扩散和加重。先天免疫是一种宿主本能的非特异性防御,通过模式识别受体(Pattern recognition receptors,PRRs)识别入侵的病毒或细菌的保守分子,通过一系列信号转导产生干扰素与细胞促炎因子,抵御病原微生物入侵。不同的PRRs可识别病毒的不同类型核酸分子,如视黄酸诱导基因Ⅰ(RIG-Ⅰ)能结合并识别细胞内病毒dsRNA;环鸟苷酸-腺苷酸合成酶cGAS可识别结合dsDNA。RIG-Ⅰ通过CARD结构域结合并激活下游接头分子MAVS;cGAS结合dsDNA后催化产生cGAMP,进而激活干扰素刺激因子STING。MAVS和STING可通过IKK复合物和TBK1/IKKε激酶复合物分别激活转录因子NF-κB和IRF3,并易位至细胞核启动IFN-Ⅰ的表达。IFN-Ⅰ以自分泌和旁分泌方式与IFNα/β受体(IFNAR)结合,触发JAK激酶家族成员JAK1和Tyk-2的激活[30]。这些激酶磷酸化并激活信号转导和转录激活因子STAT1和STAT2,并与IRF9结合形成异源三聚体复合物,从而与启动子区域中的IFN刺激反应元件结合启动干扰素刺激基因ISG的转录,抑制病毒复制并触发宿主抗病毒反应[31]。
3.1 Hippo信号调控cGAS/STING抗DNA病毒信号聚谷氨酰胺结合蛋白PQBP1与cGAS结合能识别逆转录病毒DNA,从而有助于细胞对逆转录病毒的识别[32]。研究发现,在HIV-1刺激下,LATS2通过磷酸化PQBP1增强PQBP1/cGAS相互作用及cGAS的寡聚化,促进先天免疫反应[33]。STING是一种位于内质网上转膜蛋白,接收cGAS产生的第二信号分子cGAMP,触发TBK1/IRF3信号来诱导先天免疫反应以抵抗病原体感染。STING能促进人类巨细胞病毒(Human cytomegalovirus, HCMV)基因组的核内运输,在此过程中,YAP通过抑制STING的表达从而抑制HCMV在宿主细胞的早期复制[17]。Merlin/NF2是经典Hippo通路的新成员,NF2通过募集LATS使其被MST激活,从而促进激酶级联反应[34]。研究显示,NF2通过影响YAP活性增强细胞的先天免疫应答,但其FERM结构域的点突变体(如L46R、L64P和L141P)受活化的IRF3诱导成液滴状聚集体,抑制TBK1活化、IRF3的磷酸化及核易位,负调节先天免疫[35]。
3.2 Hippo信号调控RLR抗RNA病毒信号Hippo信号在RIG-Ⅰ介导抗RNA病毒反应中也具有重要的调控功能。MST4是MST1/2的同源激酶,MST4通过促进Smurf1介导的MAVS的K48连接方式的泛素化来破坏MAVS的蛋白稳定性,并抑制MAVS结合TRAF3促使MAVS的失活,下调RLR介导的IFN-Ⅰ的产生[15]。NDR2通过E3泛素连接酶TRIM25增强RIG-Ⅰ的K63连接方式的泛素化,从而促进RIG-Ⅰ介导的下游信号传导以及IFN-Ⅰ的产生,抑制病毒复制[14]。MST1通过抑制TBK1和IRF3的活化进而抑制RNA/DNA病毒诱导的先天免疫应答[36];LATS1除了参与IFN-Ⅰ上游的调控,还在IFN-Ⅰ下游的ISGs产生中发挥作用。研究发现,在IFN-Ⅰ诱导下,LATS1被Tyk2磷酸化入核,入核后的LATS1与CDK8结合并促进其磷酸化,CDK8对STAT1 Ser727位点的磷酸化促进ISGs的产生[37]。
3.3 H ippo信号调控TLR介导的先天免疫信号Hippo信号分子在TLR信号通路介导的先天免疫中具有重要作用。当巨噬细胞在细菌感染或者TLR4配体LPS刺激下,通过TLR4-Piezo1-CaMKⅡ激活Hippo信号通路关键激酶Mst1/2,进而活化Rac信号通路促进巨噬细胞吞噬和提高细菌清除能力[38]。甲型流感病毒(Influenza A virus, IAV)感染能促进YAP作为转录辅助因子直接结合到TLR3启动子区特定的TEAD结合位点,促进TLR3启动子区域的组蛋白去乙酰化抑制其转录,使TLR3表达下调阻断抗病毒先天免疫信号传导[16]。MicroRNA是一类进化上保守的内源性非编码RNA,参与转录后基因抑制[39],它们能识别特定的mRNA并导致其降解或翻译抑制。目前,miR146a已被证明通过靶向IRAK1和TRAF6抑制TRL3信号传导,并调节下游STAT1介导先天抗病毒免疫反应[40]。NDR1结合并抑制miR146a表达,解除了miR146a对STAT1翻译的抑制作用,促进抗病毒免疫反应,其蛋白下调有利于病原体逃逸[41]。当乙型肝炎病毒颗粒(Hepatitis B virus, HBV)暴露后,小鼠原代肝细胞(PMHs)通过TLR2-MyD88-IRAK4轴激活Hippo信号通路,阻止YAP核易位,增强IκBα表达进而抑制NF-κB的激活从而负调控先天免疫防御[18]。
3.4 H ippo信号分子靶定病毒结构蛋白Hippo信号通路成员通过直接靶定病毒结构蛋白,进而调控宿主抗病毒免疫反应。甲型流感病毒可以通过IAV非结构蛋白1(NS1)与YAP/TAZ的C端结构域相互作用,进而激活YAP和TAZ促进其入核,YAP/TAZ下调促炎和抗病毒细胞因子[16]。HIV-1颗粒已被证明包含至少3种细胞丝氨酸-苏氨酸激酶:ERK2/MAPK,cAMP依赖性蛋白激酶(C-PKA)的催化亚基和未鉴定的53 kDa的激酶。研究发现,NDR1和NDR2激酶可能是其中未被鉴定的53 kDa的激酶,其被包装在HIV-1颗粒中,参与HIV-1的复制。此外,NDR1和NDR2在病毒颗粒和细胞内被HIV-1蛋白酶切割,切割位点形成的截短体改变了NDR2的亚细胞定位,进而抑制了NDR1和NDR2酶活性,利于HIV-1免疫逃逸[42]。
综上所述,Hippo信号通路成员在先天免疫抗病毒中发挥至关重要的作用,通过调控多条细胞先天免疫信号途径,调控宿主对病毒的防御能力。这些成员不仅参与病毒识别和免疫应答的调节,还可以直接作用于病毒复制过程,影响病毒与宿主之间的相互作用,这对于维持细胞内环境和免疫稳态发挥不可替代的功能(图2)。
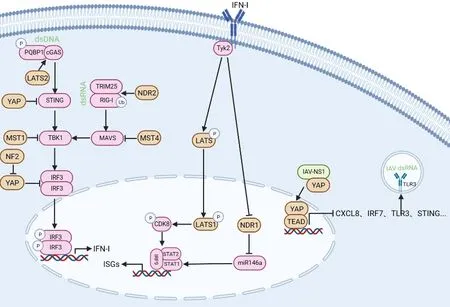
图2 Hippo信号分子调控先天免疫抗病毒信号
4 Hippo信号通路在炎症反应中的调控作用
炎症信号是机体对于感染、损伤或其他危害因素的一种防御反应,通过启动并引发一系列的炎症反应,包括白细胞浸润与炎性细胞因子产生等,最终导致受损组织修复和启动免疫防御。Toll样受体在炎症信号中发挥着重要作用,通过识别病原相关分子模式,诱导机体先天免疫应答和细胞因子产生。MyD88作为TLR的关键接头分子募集激活的IRAK激酶,E3泛素连接酶TRAF6结合IRAK,并促进TAK1和IKKγ的激活与IKKβ磷酸化,导致IκB蛋白磷酸化降解释放NF-κB,NF-κB二聚化入核促进下游炎症因子转录与表达。此外,NF-κB信号通路的激活还能促进炎症小体相关成员的转录,包括无活性的NLRP3、pro IL-1β和pro IL-18。ROS、ATP、线粒体损伤等提供NLRP3激活的第二信号,无活性的NLRP3与细胞凋亡相关斑点样蛋白ASC和pro caspase-1的发生寡聚化激活NLRP3炎症小体,促进pro caspase-1剪切成caspase-1,以及成熟IL-1β和IL-18的产生和分泌。
4.1 Hippo信号分子调控NF-κB信号转导NF-κB通过多种刺激因子(病毒、肿瘤坏死因子等)的活化诱导多种靶基因表达,产生多种细胞因子参与炎症反应。MST1可通过与IRAK1相互作用减少IRAK1泛素化,进而抑制IRAK1的活化,负调控LPS介导的NF-κB信号通路[44]。在TNF-α和IL-1β介导的炎症反应中,YAP通过与IKKα/β/γ的相互作用,抑制TAK1与IKKα的相互作用以及IKKα和IKKβ的磷酸化,进而抑制IκBα的磷酸化和降解,导致p50/p65异二聚体转位到细胞核受损;然而TAK1也能介导YAP磷酸化和泛素化促进YAP蛋白质酶体降解,这是YAP独立于Hippo-LATS信号通路的降解途径[20]。髓样细胞中的YAP过表达能促进小鼠动脉粥样硬化,且使病灶处的巨噬细胞浸润增多。IL-1β诱导巨噬细胞MyD88-IRAK4-IRAK1/2/-TRAF6通路的激活,增强了YAP的K63连接方式的泛素化,YAP的K63连接方式的泛素化削弱了其与血管蛋白AMTO的相互作用,促进YAP进入细胞核。核内的YAP促进了巨噬细胞趋化因子CCL2的转录,加剧动脉粥样硬化的进展和促进巨噬细胞在肾脏中的浸润,从而加剧肾小管肾炎[45-46]。此外,YAP参与TNF诱导的基因表达谱,TNF能增加YAP/TEAD转录活性,进而调节TNF诱导的促炎因子转录以及NF-κB活化[47]。
4.2 Hippo信号分子调控NLRP3炎症小体活化YAP作为转录共激活蛋白,通过其转录活性或独立其转录共激活功能调控先天免疫应答。一方面,YAP能进入细胞核辅助核内转录因子影响靶基因表达。使用间充质干细胞(Mesenchymal stem cell, MSCs)/巨噬细胞共培养系统发现,YAP与β-catenin在细胞核中共定位并相互作用,直接调控XBP1的活性。XBP1是NLRP3炎症小体激活的关键转录因子,其活性降低抑制NLRP3的激活,并有助于促进巨噬细胞从M1型极化成M2型,从而减轻IR模型中肝脏的损伤[48]。另一方面,YAP在不依赖其转录活性下也能调节炎症反应。E3泛素连接酶β-TrCP1促进NLRP3的K380的K27连接的泛素化修饰,导致NLRP3通过蛋白酶体途径快速降解。胞浆YAP能与NLRP3相互作用,并阻断E3泛素连接酶β-TrCP1结合NLRP3,增强NLRP3的蛋白稳定性,从而促进NLRP3炎症小体的快速活化[19]。
因此,Hippo信号通路成员在NF-κB信号转导和NLRP3炎症小体活化中都发挥调节功能,进而调控细胞因子的表达和炎症的发生,维持机体免疫稳态(图3)。这些发现不仅拓展了我们对Hippo信号通路在炎症反应中功能的理解,也为未来的治疗策略提供了新的视角。
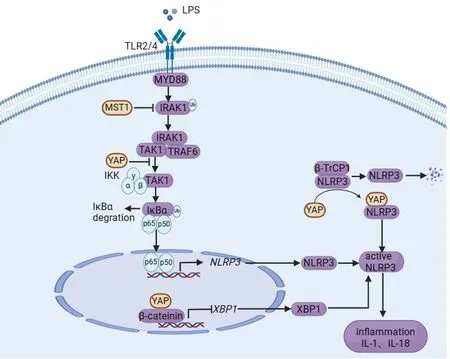
图3 Hippo信号分子调控炎症信号
5 结论与展望
Hippo信号在不同种属间高度保守,在维持细胞生理功能和免疫防御方面都发挥功能。随着研究的深入,非经典Hippo信号通路调控网络也逐渐被揭示。Hippo信号路径的保守激酶与转录共激活因子,通过结合或调节其他信号调节分子,参与细胞的多种生命活动。先天免疫应答是机体对病原体入侵的一种非特异性的防御反应,在机体免疫防御中发挥不可或缺的作用。首先,Hippo信号直接参与调控先天免疫细胞的活性,对巨噬细胞和DC细胞的活化和代谢稳态发挥调节功能。其次,Hippo信号分子通过结合干扰素信号途径蛋白或直接结合病毒蛋白,进而调控先天免疫抗病毒应答。最后,Hippo信号参与调节NF-κB活化与NLRP3炎症小体的活化,进而影响炎症反应的强度。提示Hippo信号通路在先天免疫应答抗病毒与炎症反应中具有关键作用。

