新型抗唑类耐药曲霉菌药物的研究进展
李艳 钱维世 赵非雪 褚衍彪
曲霉菌是一种广泛存在于自然界中的真菌,常见致病菌包括烟曲霉、黄曲霉、黑曲霉、土曲霉等。曲霉菌病常见于免疫力低下患者,发病率及死亡率较高,因而抗曲霉治疗尤为重要。三唑类药物是治疗曲霉菌病的一线用药[1],然而,耐唑菌株的出现限制了唑类药物的使用。临床个体通常通过两个途径获得耐唑曲霉菌株,一种途径是患有慢性曲霉菌病的患者长期应用唑类药物治疗后出现获得性耐药,另一途径是既往从未接受过唑类药物治疗的人群,当抵抗力低下时,受到环境中耐唑曲霉菌侵袭而获得[2]。唑类杀菌剂普遍用于防止农作物、水果、观赏植物等的霉变,在中国,唑类杀菌药的使用量占所有杀菌剂的三分之一以上[3],如此广泛的使用唑类抗菌剂使得环境中曲霉菌耐唑性增加。另外,病毒性肺炎增加了患者罹患真菌感染的风险,新冠疫情期间曲霉菌等真菌感染爆发[4],耐药真菌也更加有机可乘。世界范围内耐唑曲霉菌病例不断增加,由于耐药监测涉及的国家和中心以及使用的监测手段不同,具体耐药率不一,总体而言,烟曲霉对三唑的耐药率在3.2%至36.3%之间[5],而当聚合酶链式反应(Polymerase Chain Reaction,PCR)检测用于直接检测临床标本中的耐药性突变时,耐药率高达55%左右[6]。曲霉菌病死亡率较高,当出现耐唑菌株感染时,死亡率高达88%~100%[7],预后极差,有效的抗真菌治疗有助于改善预后,然而当前可用抗真菌药物十分有限,开发新的抗真菌药物迫在眉睫。目前一些极具潜力的新药已进入临床研究,本文就对唑类耐药曲霉菌病的药物治疗现状及新型抗真菌药物的研究进展进行综述。
一、耐唑曲霉菌病的药物治疗现状
耐唑曲霉菌株的快速传播给临床治疗带来了诸多挑战,由于真菌是真核生物,与人类关系更为密切,开发有效且无毒的抗真菌药物非常困难,目前市面上用于曲霉菌感染治疗的药物主要有三类:三唑类、多烯类、棘白素类[8]。三唑类药物通过抑制细胞色素P450(Cytochrome P450,CYP450)酶,尤其是CYP51(也叫甾醇14-a-去甲基酶),从而干扰麦角甾醇的合成而发挥作用。三唑类药物如伊曲康唑、伏立康唑被推荐用于曲霉菌的一线治疗,泊沙康唑、艾沙康唑则用于替代或挽救治疗[9]。使用大剂量唑类药物治疗耐唑曲霉菌感染疗效尚不清楚,但在一项回顾性队列研究中,两组使用伏立康唑治疗的侵袭性曲霉菌病患者,唑耐药组患者的死亡率比唑敏感组高出约20%[10]。Schauwvlieghe等的研究表明当泊沙康唑最低抑菌浓度<1 mg/L时,高剂量泊沙康唑(血清水平>3mg/L)是唑类耐药性侵袭性曲霉菌病患者一种可能的疗法,但仍需要对血药浓度及不良事件进行密切监测[11]。
多烯类药物能与真菌中的关键成分麦角甾醇结合,将麦角甾醇从细胞膜上去除,破坏真菌细胞的功能。两性霉素B是多烯类代表药物,但并非曲霉菌病的首选用药,常用于对唑类药物不耐受者或治疗失败时的挽救疗法[1]。根据2020年发布的欧洲医学会真菌学联盟(ECMM)/国际人类和动物真菌学学会(ISHAM)对新冠病毒相关肺曲霉菌病的研究和指南[12],如果患者对唑类药物耐药,则脂质体两性霉素B是首选药物,另外在获得伏立康唑敏感性实验前,如果患者所处地区是唑类药物耐药高发地区,支持使用两性霉素B作为初始治疗,通常需要用药至少6~12周,而脂质体两性霉素B无口服制剂且价格昂贵,增加了住院时长和医疗负担。
棘白素类通过抑制β-D-葡聚糖的合成以破坏真菌细胞壁而发挥作用。阿尼芬净属于棘白素类,一项研究表明阿尼芬净与伏立康唑合用可能对唑敏感株和耐唑烟曲霉菌株感染均有效,但对高MIC的伏立康唑耐药株可能效果不佳,联合用药的疗效可能仅取决于阿尼芬净[13],而另一项研究表明阿尼芬净单药治疗对感染易感菌株的小鼠的有效率为72%,对感染唑耐药菌株的小鼠有效率仅为45%,其用于替代治疗的价值有限[14]。
事实上,早在2015年,国际专家组(由11个国家的21名专家组成)就耐唑曲霉菌感染的管理提出了根据环境抵抗水平来选择初始治疗方法的建议:在耐药性流行率<5%的地区,建议伏立康唑作为几乎所有疑似侵袭曲霉菌病患者的初始治疗方法,如果随后发现对伏立康唑有耐药性的菌株,则应停止伏立康唑单药治疗;在耐药性流行率为5%~10%的地区,对于初始治疗的选择,大约一半的专家主张伏立康唑单药治疗,其余则支持伏立康唑与棘白素联合用药或两性霉素B单药治疗;在耐药性流行率>10%地区,不首选唑类单药治疗,而推荐唑类与棘白菌素或脂质体两性霉素B的联合治疗作为初始经验性治疗,并常规行敏感性检测,随后根据药敏结果做出决策[15]。由于初始用药方案的制订取决于患者所处地区环境抵抗水平,专家组强调取得可靠的环境耐药率的重要性。实际上,曲霉菌培养阳性率低,大多数病例培养呈阴性,无法进行表型耐药性评估,PCR法虽能弥补这一缺点,但PCR并未得到常规推广使用,且灵敏性及抗性机制谱有限[16],这也表明要获得准确的环境耐药率并非易事,同时关于环境耐药率在5%~10%时的治疗方案,专家组意见存在较大分歧,仍需要更进一步开展大量研究为指导治疗提供可靠数据。
二、新型抗真菌药物研究进展
随着曲霉菌对唑类药物抗性不断增加,使用唑类治疗耐唑曲霉菌病不仅可能会导致治疗失败,浪费资源,还会增加耐药性,现有的抗真菌药物通常受到毒副作用、药物相互作用和给药途径的限制,可用的药物十分有限且过时,迫切需要有效的药物来治疗耐唑曲霉菌感染,开发新的抗真菌药物,特别是具有抗耐唑曲霉菌活性的药物迫在眉睫,令人鼓舞的是,目前已经有多种新兴抗真菌药物正在进入临床研究阶段,与现有药物相比,这些新药在作用机制、剂型、抗菌活性等方面具有各自特点(见表1)。
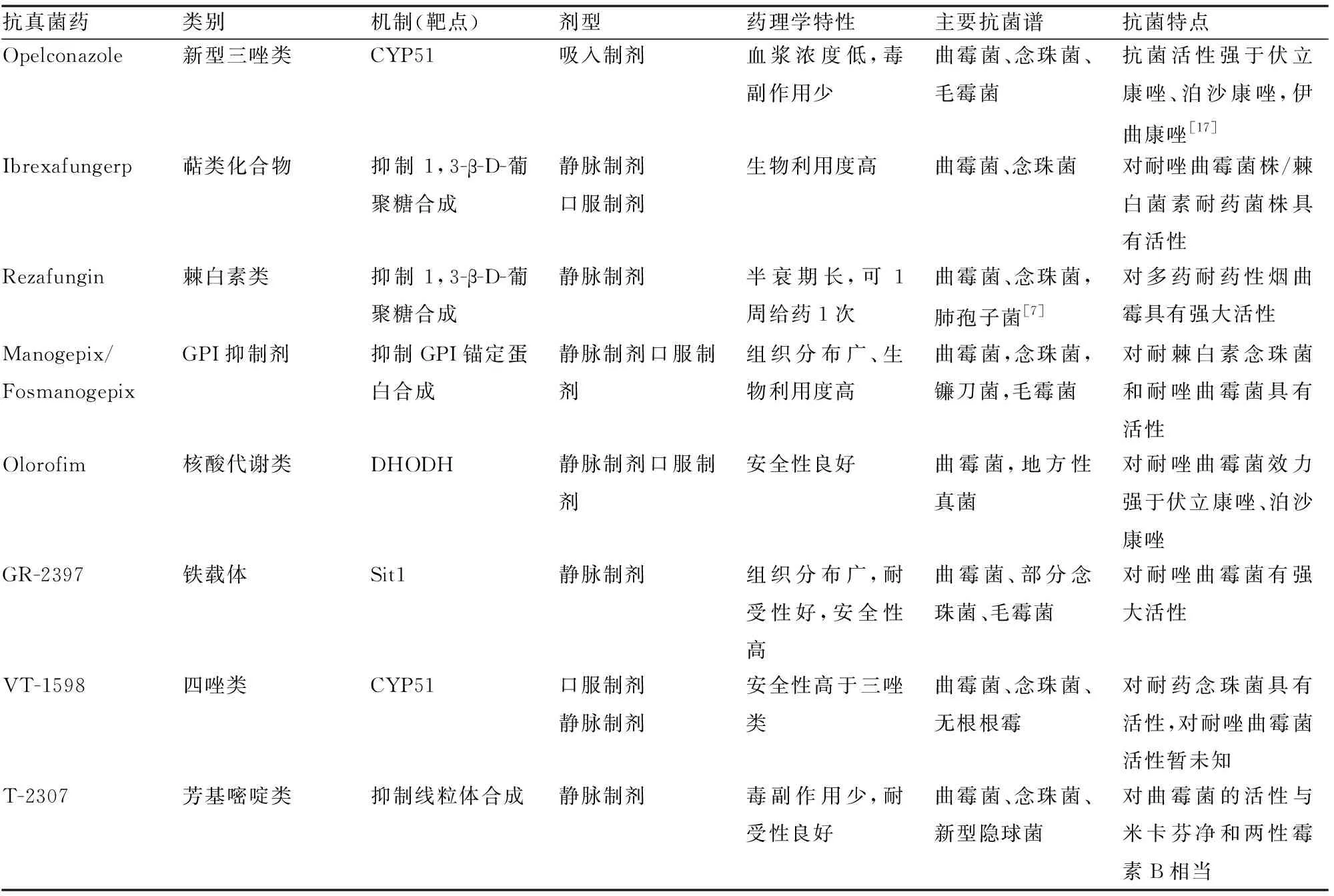
表1 几种研发中的新型抗真菌药物
1. Opelconazole(原PC945)
Opelconazole是广谱三唑的第一类吸入抗真菌药。不同于常用唑类药物,Opelconazole具有独特的吸入给药途径,更适用于肺部病灶,气道吸入后肺局部浓度增高、肺滞留时间延长,低血浆浓度使得其全身毒性作用更少,且能取得需要较高剂量的伏立康唑和泊沙康唑才能获得的效果[18]。Opelconazole对曲霉菌、念珠菌、毛霉菌等真菌有较强的抗菌活性,在96株临床分离的烟曲霉菌株,Opelconazole的效力比伏立康唑高2.5倍,与泊沙康唑相当,在烟曲霉的唑敏感和唑抗性菌株中,Opelconazole在体外表现出优于泊沙康唑、伊曲康唑和伏立康唑的疗效[17]。
2. Ibrexafungerp (原SCY-078)
Ibrexafungerp是新型三萜类抗真菌药,与棘白菌素一样,它的作用机制是抑制β-D-葡聚糖的合成,但其作用靶点只有部分和棘白素重合,这使得它对棘白菌素耐药菌株仍具有活性。Ibrexafungerp具有高度生物利用性,可以口服或静脉给药,体外研究表明其对许多曲霉菌属(包括唑耐药性菌株)具有抑菌活性,当与两性霉素B联合使用时,观察到对唑类耐药分离株的体外协同作用,当与伏立康唑或艾沙康唑联合使用时则没有观察到这种协同作用[19]。对从唑类药物治疗慢性肺曲霉菌病失败的患者中获得的一些临床分离株进行检测,发现对唑类和两性霉素B都有耐药性的分离株对Ibrexafungerp敏感[20]。
3. Rezafungin(原CD101)
Rezafungin是一种新的β-D葡聚糖合酶抑制剂,属于棘白素类抗真菌药,在结构上与阿尼芬净相似,但具有更好的安全性、稳定性、组织渗透性。由于使用胆碱胺化醚取代半胺化基团而具有较长的半衰期(约130小时),可一周给药一次,给药途径包括静脉注射、局部或皮下注射[21]。Rezafungin对包括耐唑类在内曲霉菌具有良好的活性[22],体内外研究表明它对多药耐药性烟曲霉具有强大的活性,这种体外活性也在临床耐唑烟曲霉分离株的播散性曲霉菌病小鼠模型中转化为体内疗效[23]。
4. Manogepix(APX001A,原E1210)/Fosmanogepix(APX001, 原E1211)
Manogepix是N-膦酰氧甲基前药Fosmanogepix的活性部分。Fosmanogepix通过剂抑制糖基磷脂酰肌醇(Glycosylphosphatidylinositol,GPI)锚定蛋白生物合成,从而影响真菌甘露聚糖蛋白的成熟和锚定。它对曲霉菌、念珠菌、接合菌等真菌具有广谱活性。Manogepix对许多耐药菌株,包括耐棘白素念珠菌和耐唑曲霉菌仍有效力,已被证明对唑敏感和耐药曲霉菌具有强大的体外活性,Manogepix目前处于Ⅱ期临床试验[24]。Fosmanogepix具有较高的口服生物利用度(>90%),能够在不影响血药水平的情况下切换静脉和口服剂型,良好的药物间相互作用、耐受性和广泛的组织分布,使Fosmanogepix成为治疗侵袭性真菌感染的一个有吸引力的选择,Fosmanogepix治疗侵袭性曲霉菌病和其他罕见霉菌的评估正在进行中[18, 24]。
5. Olorofim(原F901318)
Olorofim作用于一个新的靶点:二氢乳清酸脱氢酶(Dihydroorotate dehydrogenase,DHODH),通过抑制该酶而阻止嘧啶的生物合成, 最终抑制DNA合成、细胞生长和分裂。虽然人体内也存在DHODH ,但Olorofim对真菌DHODH的活性远远高于人体,能够在选择性阻止真菌嘧啶合成的同时兼顾安全性。Olorofim是一种强效的霉菌活性抗真菌剂,具有对多种丝状真菌病原体的抗真菌活性,包括曲霉菌和唑抗性的烟曲霉[25]。Buil等的研究表明Olorofim对具有内在和获得性耐药性的难治性曲霉有较强的体外活性[26]。在具有G54V突变的伊曲康唑耐药性烟曲霉分离株中,Olorofim的效力分别是伏立康唑和泊沙康唑的5-6倍,此外,在携带TR34/L98H/S297T/F495I的唑耐药曲霉菌分离菌株中,Olorofim的效力分别是伏立康唑、泊沙康唑和艾沙康唑的4、5、9倍[27],然而令人担忧的是,Olorofim可被多种CYP450同工酶清除,易发生药物间相互作用,这或许在一定程度上限制了其应用。
6. GR-2397(原VL-2397、ASP2397)
GR-2397是第一种新的类铁载体六肽抗真菌剂,在结构上类似于真菌铁载体,具有良好的安全性、耐受性以及良好的组织分布。它通过特定的铁载体铁转运蛋白1(Siderophilin transporter,Sit1)转运到真菌细胞中[28],这一新的机制赋予其快速杀伤真菌细胞的能力,用于治疗严重的真菌感染。动物实验表明在侵袭性肺曲霉菌病小鼠模型中,在治疗延迟的情况下,GR-2397的疗效优于泊沙康唑,GR-2397抗菌谱包括曲霉菌、镰刀菌和光滑念珠菌等,其对三唑耐药的曲霉菌具有强大的体内外活性[29],是治疗唑耐药曲霉菌病极具潜力的药物。
7. VT-1598
VT-1598是四唑类抗真菌药,对真菌CYP51具有高度选择性,与三唑类相比,安全性更高,不仅对念珠菌(包括耐氟康唑菌株)、隐球菌和无根根霉有活性,在播散性侵袭性曲霉菌病和肺曲霉菌病动物模型中,VT-1598还具有高度可重复的剂量依赖性抗真菌活性[30]。但它对耐唑曲霉的活性尚不清楚。
8. T-2307
T-2307是一种新型芳基胺,通过多胺转运蛋白选择性转运到真菌细胞中,并抑制线粒体功能以产生杀真菌作用[7]。T-2307对念珠菌、新型隐球菌和曲霉具有广谱抗真菌活性,其对念珠菌的活性明显高于米卡芬净和两性霉素B,对隐球菌的活性明显高于两性霉素B,对曲霉菌的活性与米卡芬净和两性霉素B相当。T-2307对氟康唑耐药和氟康唑敏感的剂量依赖性白色念珠菌菌株表现出较强的活性[31],但尚缺乏对耐唑曲霉菌菌株活性的数据。T-2307在人体Ⅰ期研究中耐受性良好,目前正在进行Ⅱ期临床前研究[32]。
三、总结与展望
总之,曲霉菌病好发于免疫力低下患者,这类患者往往病情复杂,预后差,加大了治疗难度。尽管曲霉菌的治疗方法取得一些进步,但唑类耐药率居高不下给临床管理带来了新的挑战,现有药物存在一定不足与局限性,为了降低曲霉菌唑抗性增加所带来的选择压力,积极研发不同机制的抗真菌药物成为重中之重。当前一些研发中的新型抗真菌药物在安全性、药物间相互作用、抗菌活性等方面都显示出一定优点,部分新药还具有新的作用靶点,扩宽了包括唑耐药菌株在内的抗菌谱,为耐唑曲霉菌病的治疗带来了希望,然而这些新型抗真菌药物处于初级发展阶段,仍需要进行大量研究。因此耐唑曲霉菌病的药物管理及治疗仍会是未来很长一段时间的世界性难题,新兴治疗靶点的探索仍将会是研究重点。

