非洲猪瘟病毒增殖过程中主要蛋白研究进展
赵旭阳,樊 帅,靳家鑫,张 帅,路闻龙,朱潇静,王 芮,张改平,孙爱军,庄国庆
(河南农业大学动物医学院 国家动物免疫学国际联合研究中心,郑州 450046)
非洲猪瘟病毒(African swine fever virus,ASFV)感染猪引起的非洲猪瘟(African swine fever, ASF),是一种急性、烈性、出血性、高度接触性传染病,急性感染常表现为高于41℃的发热、厌食、精神沉郁等临床症状,感染后4~15 d病死率接近100%,属于世界动物卫生组织(World Organization for Animal Health, WOAH)规定必须上报的A类动物疫病。1921年,ASF首次报道于肯尼亚,传入欧洲后在大部分国家均有发生、流行[1]。2018年8月,ASF疫情在我国首次报道并迅速蔓延,严重影响畜牧业健康发展。尽管目前已通过多项生物安全措施减少了ASF的发生,但仍缺少有效抑制或者阻断病毒复制传播的手段[2]。综述ASFV主要编码蛋白在其侵入和复制过程的作用和机理,并进一步讨论其在ASF疫苗和药物研发中的指导作用,对防控ASF发生发展,确保生猪产业健康发展有重要意义。
1 ASFV 病原学
ASFV是双股线性DNA病毒,基因组大小为170~193 kb,由一个约125 kb的保守中心区和两个可变末端组成,包含150~167个紧密排列的开放阅读框( open reading frames, ORFS),编码超过150种结构和非结构蛋白。其中位于可变区的多基因家族( multi gene f amilies, MGFS)基因决定了ASFV的基因多样性,与ASFV的毒力强弱以及免疫逃逸密切相关[3]。ASFV的基因表达与复制协调运转,保障病毒复制的顺利进行。随后,ASFV在核周微管组织中心(microtubule organizing center, MTOC)处称为“病毒工厂”的区域进行组装,经细胞质膜以“出芽”的方式释放到细胞外[4]。
2 核质大DNA 病毒
核质大DN A病毒(Nucleocytoplasmic large DNA viruses, NCLDVs)是一类有相同远古起源的DNA病毒,包括非洲猪瘟病毒科、痘病毒科、虹彩病毒科等在内的多个病毒家族。大部分NCLDVs由DNA及其结合蛋白构成核心,外包一层或多层脂质膜并具有二十面体衣壳,衣壳蛋白均存在类似双层“果冻卷”(jelly-roll, JR)的折叠结构,与壳粒形成有关[5];丝氨酸-苏氨酸蛋白激酶和酪氨酸-丝氨酸 蛋白磷酸酶在几乎所有NCLDVs中都有同源性,可能在病毒颗粒装配过程中起调节作用[6];SMT4样蛋 白酶通过类泛素化修饰(SUMOylation)在NCLDVs颗粒成熟中发挥作用[7]。NCLDVs在 DNA复制机制上也具有一定的相似性,所依赖的ATP酶在序列上高度保守[8],其究竟由共同祖先进化还是在相同或相似宿主中复制导致,仍需进一步研究。
3 ASFV 的结构与组成
ASFV具有二十面体对称结构,内部是含有DNA的类核(nucleoid)及蛋白质核心壳(core shell),向 外依次为脂质内膜(inner envelope)和蛋白质衣壳(capsid),成熟的ASFV还有脂质外囊膜(outer envelope)包裹,直径为260~300 nm[9](图1)。ASFV基因组两端的可变区域形成发卡结构,通过共价键将双股DNA连接在一起。ASFV编码的蛋白根据功能可分为参与病毒形态发生(24%)、参与病毒基因转录(19%)、维持基因组完整性(6%)、介导病毒入侵(4%)、逃避宿主免疫防御(3%)和功能未知蛋白(34%)[10]。
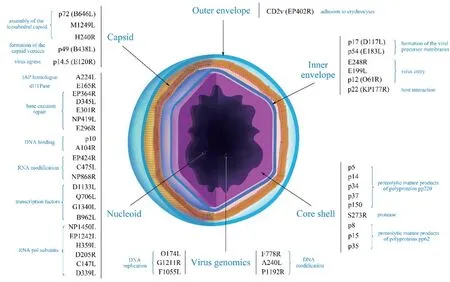
图1 ASFV 的主要结构与已知功能蛋白Fig.1 ASFV major structure and functional proteins
3.1 类核 ASFV类 核主要包括蛋白结合的病毒基因组以及一些参与复制和转录的酶或相关因子,它们共同组成直径约80 nm的电 子致密结构[4]。目前发现参与病毒类核结构的病毒蛋白主要有p10和A104R,均为DNA结合蛋白,与细菌拟核中含有的组蛋白功能相似[11];参与病毒基因组复制和转录的酶或相关因子包括RNA聚合酶亚基(NP1450L、EP1242L、H359L、D205R、C147L、D339L)、加帽酶(NP868R)、polyA聚合酶(C475L)、甲基转移酶(EP424R)和早期转录因子(D1133L、Q706L、G1340L、B962L)等[9]。
3.2 核心壳 ASFV核心壳是包裹在类核外部的一层蛋白质结构,厚约30 nm,主要源于病毒前体蛋 白pp220和pp62[4]。在病毒S273R蛋白酶作用下,pp220被水解为p150、p37、p34、p14和p5,pp62被水解为p35、p15和p8[12],这些产物约占病毒总蛋白的32%,在核心壳组装过程中起到重要作用。
3.3 内膜 ASFV内膜是一层类脂质膜结构,主要成分源自内质网(endoplasmic reticulum, ER)。参与构成内膜的病毒蛋白主要包括p54、p17、p12、E248R、E199L、p12、p22等[13]。p17和p54是一种定位于内膜上的跨膜蛋白,在ER上不断积聚导致膜塌陷并转入病毒工厂,在病毒内膜前体的形成中发挥重要作用[14]。
3.4 衣壳 ASFV衣壳直径约260 nm,其二十面体对称结构主要由12个五重对称体(pentasymmetrons)和20个三重对称体(trisymmetron),共计2760个伪六边形壳粒(pseudo-hexagonal capsomers)和12个五邻体蛋白(penton protein)组成,每个五重对称体含30个壳粒和5个五邻体蛋白,每个三重对称体含120个壳粒,壳粒间距为7.4~8.1 nm[15]。晚期蛋白p72是壳粒的主要组成成分,约占病毒颗粒总蛋白的32%,在病毒识别、结合和进入宿主细胞过程中起重要作用。
3.5 外囊膜 ASFV颗粒以“出芽”的方式从宿主细胞排出,并获得1层非二十面体对称的外囊膜。有无外囊膜的ASF V均具有感染性,说明其在感染过程中是非必需的[15]。外囊膜上特征性蛋白CD2v(EP402R)是一种包含信号肽、免疫球蛋白样结构域和跨膜区的糖蛋白,具有与T淋巴细胞表面受体CD2相似的序列特征,能够使ASFV更容易吸附在被感染细胞表面[9]。
4 ASFV 的进入与复制
ASFV通过内体-溶酶体途径(endosomelysosome pathway)进入宿主细胞,并在此过程中脱去衣壳,病毒内膜与晚期内体(late endosome)膜融合将病毒核心释放到胞质;病毒核心通过微管转至核周“病毒工厂”,利用自身编码的酶和相关因子进行早期转录,表达病毒复制早期蛋白[16];ASFV侵入宿主细胞4 h内,病毒基因组DNA复制在细胞核中启动,侵入6 h后进入细胞质复制阶段[17];随后,病毒核心在“病毒工厂”装配形成,由二十面体衣壳包裹后通过微管转运到细胞质膜出芽释放[4](图2)。
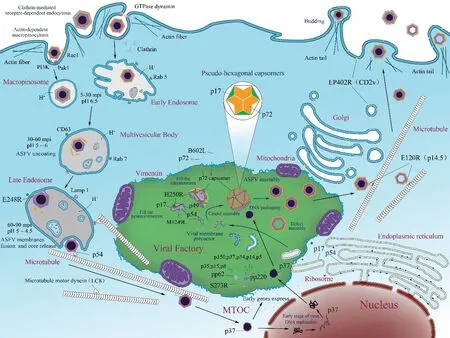
图2 ASFV 的进入和增殖Fig.2 ASFV entry and propagation
4.1 ASFV进入
4.1.1 ASFV进入过程 ASFV主要通过网格蛋白介导的受体依赖性内吞(clathrin-mediated receptordependent endocytosis)途径进入宿主细胞,也可经由巨胞饮(macropinocytosis)进入,两种方式并无明确界限,巨胞饮过程中肌动蛋白的重组和膜突起也能够辅助网格蛋白介导的内吞作用[18]。有研究表明作为巨噬细胞成熟标志的CD163可能与ASFV侵入相关[19],但Franzoni等[20]发现ASFV感染并未影响CD163表达,其是否作为受体介导ASFV感染仍需进一步论证。在适宜的温度、pH和能量供应下,有无外囊膜的ASFV颗粒均可通过内吞进入细胞,并伴随内体的酸化脱去衣壳。在胆固醇协助下病毒内膜与内体膜发生融合,病毒核心被释放至胞浆并通过微管转运至MTOC,启动早期基因的表达和基因组复制[16]。另外,ASFV还能通过膜融合等非内体途径进入细胞,但该途径进入的病毒并不具备感染能力。
4.1.2 进入相关蛋白 ASFV编码蛋白可能在病毒侵入、脱壳、转运的过程中发挥作用。结构蛋白p54能够与胞质动力蛋白LC8结合,介导病毒向核周区域运输[9]。E248R是一种存在于成熟病毒颗粒内膜上的跨膜蛋白,在ASFV感染过程中参与内体膜融合及核衣壳递送[21]。另外,针对ASFV结构蛋白p30、p54、p72的特异性抗体能在一定程度上抑制病毒的吸附[9],表明这些病毒蛋白在病毒侵入过程中也发挥了作用。
4.2 ASFV复制
4.2.1 ASFV复制过程 ASFV核心通过微管转运至细胞核周围后,在自身编码的酶和细胞因子作用下进行早期mRNA转录、翻译,并利用DNA聚合酶polB、polX等进行基因组复制。在感染4 h内,病毒在宿主细胞核中启动早期复制并形成小型复制中间体[22];感染6 h后,复制中间体转移到细胞质中组成大复制中间体,在细胞质的“病毒工厂”中进一步复制[17]。ASFV感染早期表达的蛋白会促进病毒基因组DNA复制,而当复制进入细胞质阶段,病毒基因的转录模式也发生相应转变,主要进行中、晚期蛋白的表达和修饰。目前,ASFV转录与复制不同阶段的调控机制尚不明晰,其可能是未来开发阻断ASFV复制药物的关键。
4.2.2 复制相关蛋白 在ASFV感染早期,核心壳蛋白p37介导复制过程中的DNA核质转运,其与病毒基因组一同进入宿主细胞核,完成DNA复制后再一同转移至“病毒工厂”[23]。在细胞核复制阶段,C962R基因编码的DNA引物酶在基因组的一端或两端引入单链间隙,暴露的3'-OH充当DNA聚合酶的引物启动复制,其中新生链和模板链的末端自我互补产生“头对头连接体”并折叠成自启动发夹结构[17];在细胞质复制阶段,ASFV使用自身编码的一套DNA合成酶系统保证复制的顺利进行:G1211R、E301R和F1055L基因分别编码类DNA聚合酶、类增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)蛋白和螺旋酶参与病毒复制起始,其中G1211R将DNA聚合酶结合在DNA分子上[24],E301R融合于DNA聚合酶催化区域,参与构成病毒DNA复制复合物的滑动结构[17,25],F1055L可特异性识别病毒复制起点协助C962R启动复制[26]。此外,F778R、F334L和A240L基因分别编码核糖核苷酸还原酶的大、小亚基和胸苷激酶,为细胞质阶段的复制提供原料[27-28]。在复制过程中,P1192R、EP364R、和D345L基因分别编码DNA拓扑异构酶、类ERCC4核酸酶和类λ核酸外切酶,P1192R解析病毒基因组复制中间体并参与病毒核酸的结构修饰[10],EP364R和D345L负责把聚合基因组中间体分解成单位长度[17],共同促进大复制中间体形成成熟的交联DNA。最后,组蛋白样蛋白A104R与成熟的复制产物结合并一起组装到子代病毒颗粒中,其与E199L合作保持DNA的超螺旋活性[29-30]。
碱基切除修复(base excision repair, BER)系统可修复因水解或活性氧氧化造成的DNA损伤而保证病毒基因组复制的准确性。NP419L基因编码一种低保真度DNA连接酶,能高效封闭3'端错配缺口(如C∶T缺口)导致的遗传突变,也参与催化冈崎片段连接[6,31]。O174L基因编码的pol X是目前已知最小、也是保真性最低的DNA聚合酶,可介导单碱基缺失修复,也能在小片段DNA损伤修复中发挥作用[17];E296R基因编码AP核酸内切酶,在BER机制中发挥3'→5'外切酶活性和3'双酯酶活性,参与维持基因组的高保真性[27]。E165R基因编码一种dUTP酶,能降低dUTP浓度以减小脱氧尿苷错误掺入病毒DNA的几率,是ASFV正确复制所必需的[32]。此外,上述ERCC4样核酸酶(EP364R)、类λ核酸外切酶(D345L)和PCNA样蛋白(E301R)等也共同参与了ASFV的BER机制。ASFV通过复杂的DNA合成和修复机制抵御宿主细胞的免疫清除,保障自身的复制。深入解析其中各个编码蛋白的作用原理,有助于阐明ASFV增殖和免疫逃逸机制,对于抗病毒药物研发具有深远意义。
4.3 ASFV装配
4.3.1 ASFV装配过程 ASFV的装配从ER开始,在核周MTOC区域的“病毒工厂”中进行。“病毒工厂”由ASFV诱导宿主细胞的波形蛋白纤维丝(vimentin filament)形成笼状结构搭建而成,内部缺乏细胞器,周围聚集着较多的线粒体和伴侣蛋白[33]。ASFV诱导伴侣钙蛋白酶和钙网蛋白的上调以增加ER的折叠能力,大量表达的早期病毒蛋白p54、p17等诱导ER膜塌陷成平行排列的小弯曲或开放结构,随后转入“病毒工厂”成为电子致密的病毒内膜前体[13];p72蛋白以三聚体形式构成壳粒并在病毒内膜前体凸面处以六边形排列,通过次要衣壳蛋白和p17等内膜蛋白的协助锚定在内膜,搭建出二十面体衣壳;与此同时,多聚蛋白pp220和pp62及其水解产物也以2个10 nm球状亚基在内膜前体的凹面下规则排列形成核心壳,内膜的成熟与衣壳的正确装配是核心壳组装的关键[4,34];在衣壳形成的同时,病毒基因组DNA和核蛋白体也被核心壳包装、浓缩,形成中心电子致密的类核,从二十面体的1个顶点处装配进入衣壳[35]。需要注意的是,二十面体的组装与类核的包装相互 独立,装配出现错误会导致“空”二十面体颗粒单独释放[36]。
4.3.2 装配相关蛋白 装配的初始阶段,病毒内膜蛋白p54和p17诱导ER膜塌陷形成内膜前体,它们的缺失会显著影响pp220和pp62的定位,进而阻碍病毒内膜前体的成熟及衣壳、核心壳的正确组装[4]。结构蛋白p72在细胞质中聚集并组装成壳粒,非结构蛋白B602L作为分子伴侣参与其折叠和多聚过程[37];内膜前体上的p49结合并招募壳粒,在五邻体蛋白H240R周围聚集形成五邻体核心,M1249L蛋白则与2个壳粒对结合以连接2个五邻体核心,作为“骨架”搭建出二十面体框架,决定了衣壳的大小[15];最后,三聚p72壳粒逐步填充框架,在p17等内膜蛋白的协助下锚定形成三重对称体,完成衣壳组装[4]。衣壳装配的同时,SUMO样半胱氨酸蛋白酶S273R水解 加工pp220和pp62并在病毒内膜前体的凹面处组装成核心壳,抑制S273R的表达会形成非中心电子致密的类核和不规则厚度的衣壳,导致缺陷型二十面体颗粒的组装[4,38]。另外,抑制病毒衣壳蛋白p72表达也影响前体蛋白pp220和pp62的翻译后加工过程,未加工完成的前体蛋白组装成“拉链状”异常结构,使得病毒颗粒因缺乏核心壳而不具备感染性[12]。鉴于ASFV编码蛋白p17、p49、p54、H240R、S273R等在病毒装配过程中的关键作用,针对这些蛋白研发基因缺失或亚单位疫苗,筛选有效的中和抗体或将有助于控制ASF疫情。
4.4 ASFV释放
4.4.1 ASFV释放过程 ASFV装配完成后,再次经由微管蛋白转运到细胞膜,以“出芽”的方式释放到细胞外[39]。在这一过程中,组装成熟的病毒颗粒招募常规驱动蛋白(conventional kinesin)到“病毒工厂”,ASFV颗粒被识别为“货物”从核周组装区域顺行运输到细胞质膜[40];随后,病毒颗粒诱导肌动蛋白聚合,在质膜的内表面形成特征性的肌动蛋白尾部(actin tail)推动其离开宿主细胞表面[41]。病毒感染晚期引起的细胞溶解可能是病毒释放的另一种机制,通过该途径释放的病毒颗粒没有外囊膜包被[4]。微管在ASFV的侵入和释放过程中都发挥了重要作用,而且ASFV感染能够导致微管蛋白乙酰化提高其稳定性。因此,微管解聚类药物能在一定程度上控制ASFV感染,可作为抗ASFV药物研发的方向之一。
4.4.2 释放相关蛋白 ASFV颗粒的顺行运输由微管介导。在此过程中,衣壳蛋白E120R和p72相互作用招募大量驱动蛋白,E120R与驱动蛋白轻链C端的6个四肽重复序列(tetratricopeptide-repeat, TPR)结合从而驱动病毒颗粒向质膜转运[40]。抑制E120R的表达会导致细胞内病毒颗粒保留在“病毒工厂”而无法向细胞外转运,因此E120R是病毒释放和传播所必需的。CD2v(EP402R)蛋白位于胞外病毒颗粒的 外囊膜,在细胞内则主要以89 kDa糖基化形式的全长蛋白,以及63 kDa的N端糖基化片段和26 kDa的C端非糖基化片段出现[42]。C端非糖基化片段与全长蛋白更多存在于核周病毒工厂区域的膜成分中,具有富含脯氨酸的PPPKPC重复序列,能够与肌动蛋白结合衔接蛋白SH3P7相互作用,参与囊泡运输和信号转导;而N端胞外区结构域的糖基化片段在细胞质中的分布更为分散,其依靠Ig-V结构域可与具有CD2配体的猪红细胞相结合[43]。在感染后期,CD2v蛋白大量定位于高尔基复合体膜以及与高尔基体外侧网络相容的胞内囊泡上,可能通过与网格蛋白衔接蛋白AP-1结合来影响经高尔基体的细胞运输,进而促进病毒的包装和释放[44]。
5 讨论
ASF是全球备受关注的重大动物疫病,至今为止仍缺乏有效的防控手段。ASFV具有基因组大、编码基因多、编码蛋白多样,免疫逃逸机制复杂等特点,但随着病毒蛋白功能和形态形成机制的逐渐明晰,在ASF疫苗和新药开发、疫病防控等方面也取得了一定进展。Quetglas等[45]发现,胆固醇在病毒内化过程中发挥重要作用,因此他汀类降胆固醇药物可有效抑制ASFV的体内感染;丝氨酸蛋白酶可能在病毒组装中发挥作用,Galindo等[46]发现其抑制剂也可用于对抗ASFV感染;驱动蛋白介导的微管转运在病毒侵入和排出过程中均十分重要,Hernaez等[47]表明微管解聚药物及动力蛋白抑制剂也能够有效抑制ASFV感染。可以预见的是,随着对ASFV形态形成机制的进一步了解,将会有更多针对病毒-宿主互作的抗病毒药物投入研发和生产实践。
ASFV编码蛋白众多,大多数功能未知,严重阻碍了病毒感染和复制分子机制的解析。不过随着冷冻电镜等蛋白质结构生物学技术的成熟,目前已经解析了部分ASFV编码的复制相关蛋白晶体结构信息:Liu等[48]通过测定apo-A104R和A104R-DNA复合物的结构,揭示了A104R-DNA相互作用的分子基础,并发现二苯乙烯衍生物SD1和SD4可以破坏A104R-DNA结合从而抑制ASFV在猪巨噬细胞中的复制,这为ASFV治疗药物的研发提供了新思路;在另外一些研究中,Li等[49-51]解析了ASFV dUTPase E165R的结构信息,鉴定了其活性中心(Motif II、III)及关键作用位点(S72、D91、Q120、F154),并筛选出了能特异性抑制E165R的小分子药物;在此基础上,Zhang等[52]成功制备了E165R关键结构区域(Motif V)的单克隆抗体,为设计研发特异性靶向E165R的抗体药物打下了良好基础。
6 展望
目前,我国养猪业已进入“后ASF疫情时代”。随着生物安全法的颁布实施,国内关于ASF防控的各项生物安全措施会更加严格,这有助于疫情的进一步控制。但与此同时,我国作为生猪养殖和消费大国,跨区域的生猪相关产业链的调配活动不可避免,仍存在ASF疫情扩散风险。因此,继续加深对ASFV感染和增殖过程的认知,深入解析ASFV形态的形成机制十分必要。本文对ASFV编码蛋白在其形态形成过程中的作用和机制进行全面阐述,希望有助于抑制或阻断病毒复制的药物研发和疫苗新靶点确认,为ASF防控提供帮助。
——水芹主要害虫识别与为害症状

