2012—2021 年青藏高原牦牛源沙门菌流行病学调查
班马泽郎,李天娇,周赛赛,吴 丹,卢姊豪,宋仁德,罗晓林,赵索南,马进寿,参木友,石红梅,索朗斯珠
(1.西藏农牧学院动物科学学院,林芝 860000;2.青海玉树藏族自治州畜牧兽医工作站,玉树 815400;3.四川省草原科学研究院,成都 610097;4.青海省海北畜牧兽医科学研究所,海北 812200;5.青海省大通种牛场,大通 810102;6.西藏农牧科学院草原研究所,拉萨 850000;7.甘南州畜牧工作站,甘南 747000)
沙门菌(Salmonella, SE)是引起人和动物腹泻的革兰氏阴性肠道杆菌之一。广泛分布于自然环境中,可以侵袭包括人在内的各种动物,是一种全球性的重要食源性人畜共患致病菌[1-3]。在我国自1958年甘肃丹山牧区马场暴发牦牛源SE病以来[4],四川[5]、青海[6]、西藏[7]等地均有牦牛源SE的报道。
牦牛作为青藏高原特有的物种之一,是当地农牧民经济收入的主要来源。但是近年来,青藏高原地区牦牛腹泻盛行,其中,犊牛腹泻尤为严重,在犊牛死亡率中占89%[8],而牦牛源SE是多年来引起牦牛腹泻的主要原因之一[9],给高原牦牛产业的发展造成严重影响。由于目前,青藏高原地区健康牦牛携带的SE研究较少、部分资料时间久远且对健康动物分离的SE致病性研究也少有报道,加之青藏高原地理环境恶劣、民族文化差异、牦牛生活习惯等原因,我国还尚未对青藏高原 牦牛源SE进行大规模系统的流行病学调查研究。因此,本实验对2012—2021年采集的西藏7地市、青海、甘肃、四川部分地区牦牛血清样品共1725份进行检测,结果经过统计学分析,明确牦牛 源SE在青藏高原各省区的流行情况,为后续青藏高原牦牛源SE的防控研究提供一定的参考依据。
1 材料与方法
1.1 主要试剂 牛SE酶联免疫分析购自江苏酶联实业有限公司,批号为M M-5094301,生产日期为2021年3月,有效期6个月,试剂盒保存于2℃~8℃冰箱。
1.2 血清样本来源 2012—2021年采集自青 藏高原地区牦牛血清共1725份,牦牛血清均未接种过SE疫苗,置于-80℃冰箱保存。
1.3 抗体检测和结果判定 按照牛SE酶联免疫分析(批 号:MM-5094301)说明书对血清样品进行SE抗体检测和结果判定。
1.4 数据统计分析 利用SPSS 21.0软件对检测结果进行年份、海拔、性别、地区分析,通过χ2检验,分析差异显著性,P<0.01为差异极显著,具有统计学意义;P<0.05为差异显著,具有统计学意义;P>0.05为无显著性差异,具有统计学意义。
2 结果与讨论
2.1 不同年份牦牛SE阳性率检测结果与分析 2012—2021年青藏高原地区牦牛血清SE抗体检测结果见表1,经SPSS统计分析显示:除了2012年、2016年及2018年检出的阳性率不到10.00%,其余年份检测出的阳性率均超过14.00%,其中2013年和2021年检测出的阳性率超过了46.00%(P<0.01),差异性极显著,具有统计学意义。
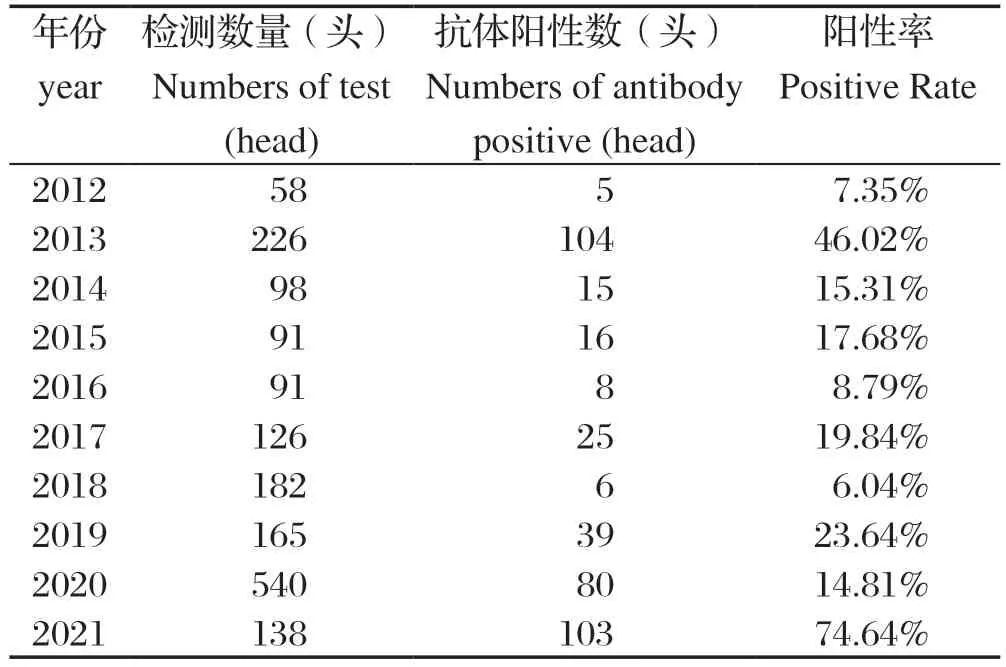
表1 不同年份青藏高原牦牛血清SE 抗体检测结果Table1 Detection results of serum SE antibody of yaks in Qinghai-Tibet Plateau in diff erent years
近几年,随着旅游业和养殖业的发展,一些传染病随着人口车辆的流动[10]和一些其他肉食品的引进[11],对牦牛的生长环境造成污染,引起牛群SE的感染,再加上牧民对牦牛源SE的防控意识比较差,这可能是近些年青藏高原地区牦牛SE血清阳性率较高的原因之一;另外,2013年和2021年牦牛血清样品大多数是在腹泻的牛群中采集,而牛群腹泻的主要原因可能是由SE感染引起的,因此,这也可能是造成SE阳性率高的原因。本次检测结果表明,近10年牦牛源SE可能一直影响着高原牦牛产业的发展。
2.2 不同海拔牦牛血清 SE阳性率检测结果与分析 通过牦牛在不同海拔感染SE阳性率的比较可知,牦牛感染SE阳性率呈随着牦牛生存环境海拔梯度的变化而变化的趋势,在海拔3900 m以上牦牛感染SE的阳性率与海拔3900 m以下相比差异性显著(P<0.05)(图1)。

图1 牦牛在不同海拔感染SE 阳性率检测结果Fig.1 Detection results of SE positive rate of yaks infected at diff erent altitudes
青藏高原不同海拔地区植被生长状况随着海拔升高植被覆盖率分布呈现下降的趋势[12]。海拔越高植被的生长周期越短,一年中除了植被生长周期阶段牦牛所采食的量相对充足外,其他大部分时间牦牛都处于半饱状态,甚至有些犊牛和瘦弱老牛因食物缺乏导致机体免疫力低下,熬不过冬天就会死亡;高海拔地区革兰氏阴性细菌[13]在低温条件下生存周期更长,牦牛一旦感染致病菌,就会在牛群中持续传播。基于以上原因,海拔越高的气候环境可能会影响SE对牦牛的感染,后期需要加强对不同海拔牦牛感染SE阳性率的检测。
2.3 青藏高原牦牛性别感染SE结果与分析 通过对4省牦牛性别 感染SE阳性率的检测可知,青藏高原总的平均阳性率分别为公(25.61%)、母(21.99%)。其中四川、甘肃、青海公牛SE阳性率均高于母牛,而西藏反之(图2)。
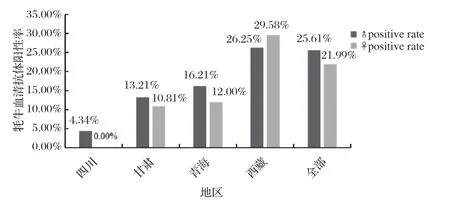
图2 各地区不同性别牦牛血清SE 抗体检出情况Fig.2 Detection of serum SE antibody in yaks of diff erent sexes in various regions
西藏地区农牧民吃酥油的习惯更为普遍,不得不延长母牦牛的使用年限,牛群中存在“老龄母牦牛多”的现象[14],公牛除用于配种外,其余的成年后与淘汰母牛一同屠宰产肉[15]。这可能是导致西藏母牛阳性率较高于公牛主要原因之一。但青藏高原牦牛性别SE总的阳性率差异性不显著(P>0.05),这与从光雷[16]研究SE对肉鸡性别的感染无显著差异性结果一致。表明SE可能对牦牛性别的感染差异性不显著。
2.4 不同地区牦牛血清SE抗体结果与分析 通过对青藏高原4省牦牛源SE抗体的检测可知。青藏高原地区牦牛源SE总的平均阳性率达到23.54%(406/1725),西藏地区(27.67%),明显高于青海(13.50%)和甘肃地区(13.33%),而四川地区阳性率最低只有1.89%。此外,甘南地区(13.33%)阳性率与詹发茂等[17]在甘肃省天祝县从3866份牦牛样中分离出581份,感染率为15.02%相比,差异性不显著(P>0.05)(表2)。青海祁连县2020年暴发的犊牛腹泻病副伤寒SE,其感染率13.54%[18]与本次检测的海北、大通、玉树的总阳性率为(13.50%)相比,差异不显著(P>0.05)。陈朝喜等[19]2014年对成都青白江牦牛屠宰场采集的473份粪便样本中分离得到36株SE,其分离率为7.61%,高于本次对四川地区的阳性率1.89%, 差异性显著(P<0.05)。但本次四川地区检测的样品量少,后期需要加强对四川地区牦牛源SE的检测。

表2 不同地区牦牛源血清SE 抗体检测结果Table 2 Detection results of SE antibody in yaks serum from diff erent regions
西藏地区1271份牦牛血清中检测出352份SE阳性,阳性率为27.67%,其中山南和阿里牦牛源SE阳性率最高,分别达到51.85%、45.28%,其次那曲SE阳性率也达到35.77%,而西藏其他地区的阳性率为10.00%~30.00%。那曲、阿里,以及山南作为西藏牦牛的主产区,牦牛养殖已成为这里的支柱产业。牦牛感染SE病后常引起免疫抑制和持续感染,且病牛临床症状不明显,不易引起兽医工作人员的注意,给养殖业带来无法估计的损失,制约着畜牧业的发展[20];SE感染可能还因地理位置、气候环境等因素存在差异[21]。落后的经济条件,使得西藏地区牦牛的养殖管理还处于传统的散养模式,再加上牧民思想观念比较陈旧,对于传染病的防控宣传措施,未引起重视,这可能是导致西藏地区牦牛源血清SE阳性率与其他3省相比较高的原因 之一,后期相关部门需要加强对基层兽医人员SE传染病的防控培训,加强对牦牛源SE区域化监测,才有利于牦牛产业的发展。
本次研究掌握了4省近十年牦牛源SE血清流行情况:牦牛感染SE阳性率呈随着牦牛生存环境海拔梯度的变化而变化的趋势;不同地区牦牛性别SE阳性率差异性不显著;西藏地区牦牛源SE阳性率最高,其次是青海和甘肃,四川地区最低。通过本次实验的研究,丰富了青藏高原不同地区牦牛源SE血清流行病学的资料,对下一步牦牛源SE病的研究和防控措施提供了有利的参考。

