腺相关病毒的衣壳装配和DNA衣壳化机制
王启钊,吕颖慧,李招发,刁勇,许瑞安
1 华侨大学分子药物学研究所,泉州 362021
2 分子药物教育部工程研究中心,泉州 362021
腺相关病毒的衣壳装配和DNA衣壳化机制
王启钊1,2,吕颖慧1,2,李招发1,2,刁勇1,2,许瑞安1,2
1 华侨大学分子药物学研究所,泉州 362021
2 分子药物教育部工程研究中心,泉州 362021
重组腺相关病毒载体 (rAAV) 是基因治疗临床应用载体的选择之一。在简述野生型AAV基因组结构和复制机制的基础上,阐述了AAV包装过程中两个主要事件:衣壳蛋白的装配和基因组DNA的衣壳化。虽然对AAV的包装机制总体上已有一定的认识,但其详细的分子机制、构效关系仍需完善和充实。AAV病毒本身相关机制的深入研究有助于改善rAAV载体的制备技术,促进rAAV基因药物研发。
腺相关病毒,装配,衣壳化,基因治疗
Abstract:Recombinant adeno-associated viral vectors (rAAV) have been widely used as gene therapy vectors in clinical trials.Here, we reviewed the genomic structures and replication mechanisms of wt-AAV. Then, the assembly of capsid and the encapsidation of genomic DNA, two major events during AAV pakaging, was discussed in detail. Although the overall pattern of virus assembly and encapsidation is known, the molecular mechanisms and the structure-function relationship involved in these processes are not well understood. Further elucidatation of these processes may improve the production technology of rAAV and develop gene drug based on rAAV.
Keywords:adeno-assoicated virus, assembly, encapsidation, gene therapy
腺相关病毒 (Adeno-associated virus,AAV) 为 细小病毒家族成员,因其为复制缺陷型病毒、基因结构简单、与寄主染色体定点整合,且迄今未发现与任何人类疾病相关,被认为是介导基因转移的理想载体。此外,AAV还具有免疫原性弱、宿主范围广、理化性质稳定、长期表达外源基因等优点[1]。在上世纪80年代重组AAV (rAAV) 载体制备方法取得进展之后,研究人员开始逐步将其应用于临床治疗研究,并证明了该载体的有效性 (http://www.abedia.com/wiley/)。然而,随着临床研究的深入,rAAV载体存在的一些问题逐渐暴露,如细胞毒性、免疫原性、整合带来的安全性、包装容量限制、产业化制备技术等[2]。理想和现实的差距促使科研人员开始重新将目光聚集于 AAV病毒本身的一些特性,以期从源头上寻找解决问题的答案。本文在简述野生型AAV基因组结构和复制机制的基础上,阐述了AAV包装过程中两个主要事件:衣壳蛋白的装配和基因组DNA的衣壳化。
1 AAV基因组结构与复制机理
1.1 AAV的基因组结构
了解AAV的基因组结构是阐明AAV复制机理与包装机制的基础。目前大多数基因治疗用 rAAV以AAV2基因组为骨架 (图1)。AAV2基因组为4 679个核苷酸的单链DNA (ssDNA),两末端为倒转重复序列 (Inverted terminal repeat,ITR),是AAV整合、复制、拯救和包装所必须的顺式作用元件,并具有转录启动子的活性。ITR序列之间为病毒编码区,含有两个开放阅读框架,目前认为可表达 4个 Rep蛋白、3个Cap蛋白及一个AAP蛋白。
AAV2 DNA两端的ITR由145个核苷酸组成,在ITR二级结构中,由3段回文结构组成T型空间结构。B-B'和C-C'构成T的顶端,A-A'构成T的长臂。ITR上有2个Rep蛋白结合位点,分别为RBE和RBE’,AAV Rep78和Rep68蛋白能结合其上。另外,ITR上还有一个末端断裂位点 (Terminal resolution site,Trs) 和一个D序列,它们在DNA的复制过程中具有非常重要的作用[3]。
AAV2 Rep基因编码至少 4种非结构蛋白:Rep78、Rep68、Rep52和Rep40。由p5启动子起始的2种mRNA翻译成Rep78和Rep68;p19启动子起始的2种mRNA翻译成Rep52和Rep40。Rep52和Rep40蛋白C末端的氨基酸序列分别与Rep78和Rep68相同 (图1)。Rep78和Rep68蛋白与AAV基因表达的正负调控有关。这两种蛋白都可与ITR中的RBE结合。Rep78/Rep68具有ATP酶和螺旋酶的功能。当其与ITR结合时又能在Trs处切割基因组DNA,使其产生缺口。这两种蛋白对于AAV生活周期的每一时期都是必需的。Rep52和 Rep40参与了病毒的装配,它们在病毒双链DNA(dsDNA) 合成中是不需要的,但在ssDNA和病毒颗粒的累积中则是必需的[4]。
一直以来,Cap基因被认为只编码衣壳蛋白,其转录从p40启动子开始,形成约2.6 kb 和2.3 kb mRNA,拼接后分别编码 3个结构蛋白 VP1、VP2和VP3,分子量分别为87、73、61 kDa,在成熟病毒颗粒中的比例大约为 1∶1∶8。VPs蛋白的 C末端具有相同的氨基酸序列,VP2的N端比VP 3多65个氨基酸,而VP1的N端比VP2还要多137个氨基酸。VP2和VP3由2.3 kb的mRNA翻译而来,而 VP1则由 2.6 kb的 mRNA翻译。VP1、VP2和VP3的起始密码子分别为 AUG(2203)、ACG(2614)和AUG(2809),其中ACG(2614) 是一个真核细胞特有的起始密码子,它的启动能力低于AUG。如果将Cap基因中的ACG(2614) 突变成AUG(2614),可提高VP2表达,但会降低VP3表达[5]。VP1 N末端的PLA2活性在 AAV感染过程中起到关键作用[6],而VP3对于AAV组装是必需的[7]。新近研究发现,Cap基因还编码另外一个蛋白,称为装配激活蛋白(Assembly-activating protein,AAP)。AAP 是由 2.3 kb mRNA上的ACG(2729) 密码子起始翻译,蛋白大小为23 kDa[8]。AAP主要定位于细胞核内,AAP不但能帮助VPs进入细胞核,并可能为VPs装配提供支架,或协助VPs进行正确折叠。
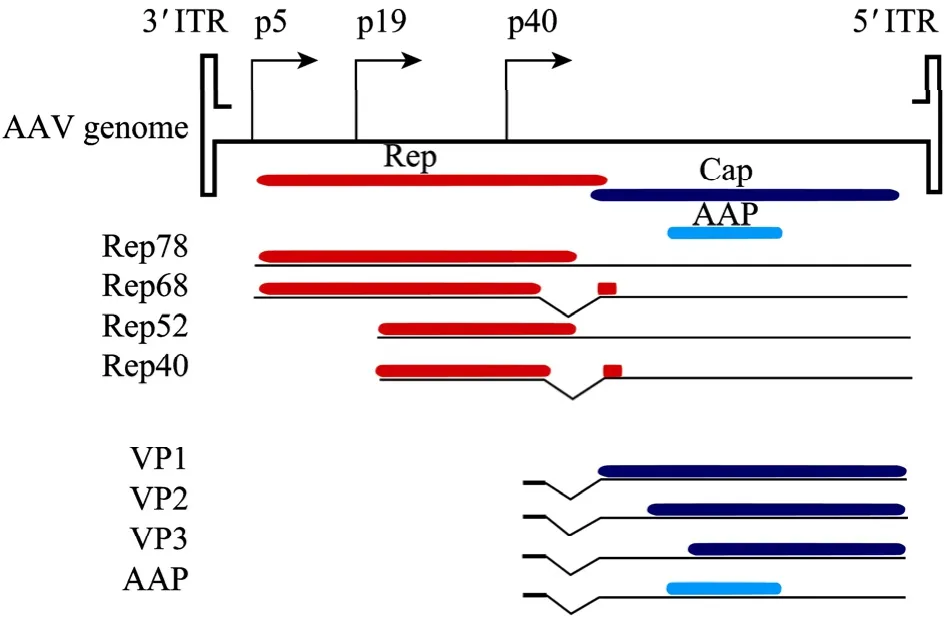
图1 AAV基因组结构Fig. 1 Genomic structure of AAV.
1.2 AAV DNA复制机理
AAV复制时,以自身3′端的序列作为引物,产生两个等长的分子 (母链/子链),两者具有一个共价连接的末端。之后,Rep78和 Rep68发挥核酸内切酶的作用,在母链Trs位点产生一个缺口。在T型结构顶端的RBE’,能维持这一结构的稳定性。新产生的-3′OH可以作为DNA聚合酶的底物,合成新的ITR序列。最后,ITR退火形成发夹结构,并将-3′OH重新置于单链取代合成的起始位点。经过新一轮的复制,可以形成一个新的 AAV病毒以及一个母链/子链共存的二聚体。如果其中一个ITR中的缺口产生失败,那么产生的AAV病毒将可以二聚体的形式稳定存在,这是构建带有双链基因组的自身互补型AAV载体的基础[3]。
除了本身基因外,AAV还需借助其他基因完成生命周期,提供基因有腺病毒 (Ad) 和单纯疱疹病毒(HSV)。以 Ad为例,E1a蛋白可激活 Ad早期基因及AAV Rep和Cap基因,并诱导寄主细胞进入S期;E1b和E4orf6的作用是形成复合物,参与AAV基因组由单链到双链的转变以及 AAV mRNA从核内运送到核外的过程;E2a是一种单链DNA结合蛋白,可以加速AAV DNA的合成过程。AVI RNA的作用则是降低干扰素效应对寄主细胞翻译的影响[4]。
2 AAV包装机制
虽然AAV的结构非常简单,人们对其复制机理也已有一定程度了解,但是目前对于AAV衣壳的装配过程以及基因组进入衣壳的过程还知之甚少。现有的 AAV包装机制模型在以下几个方面达成了基本共识。第一,ssDNA通过某种机制导入到已经形式的病毒衣壳内;第二,Rep蛋白连接ssDNA的ITR以及Cap蛋白,将ssDNA定位于衣壳表面;第三,ssDNA的移动需要Rep蛋白的螺旋酶活性和ATPase活性;第四,ssDNA进入衣壳的方向是3′−5′;第五,在衣壳五倍轴的顶端有一小孔是ssDNA进入衣壳的口袋[9]。
2.1 AAV衣壳的超级结构
对AAV衣壳结构的研究是深入了解AAV包装机制的基础。AAV颗粒直径在 20~26 nm之间 (图2),衣壳由60个衣壳蛋白亚单位构成,排列成T=1的二十面体结构 (二十面体是由20个三角形围成的凸多面体,每 5个三角形围出一个五倍顶,通过每一对相对着的五倍顶有一个五倍旋转对称轴。通过每一对相对着的三角形中心有1个三倍旋转轴;通过每一对相对着的棱的中点有1个二倍旋转轴)。二十面体的每个面由 3个衣壳蛋白分子组成 (可以全部为VP3,也可以有VP1、VP2、VP3共同构成)。三倍轴具有最多凹陷的表面区域,并且具有最高的表面接触能量,是衣壳蛋白相互交叉最多的地方,从三倍轴往下看,最大的特征是有 3个细长突起——称为三倍突起,围绕在三倍轴周围[11]。AAV衣壳中具有一个高度保守的核心亚单位,即由 8股折叠链 (A-H) 构成的 β 桶 (Eight-stranded β-barrel),β桶主要位于衣壳的内部。在 β折叠间存在 4个环(BC,EF,GH,HI,根据环所处的位置命名),约占核心亚单位序列的60%左右,这些环突起到衣壳的表面,其中GH环又可以分为3个亚环,一个衣壳蛋白分子上的一个GH亚环和与其相邻的2个衣壳蛋白分子中的各一个亚环共同形成 AAV衣壳的三倍突起,3个蛋白分子即形成3个突起[11](图2A)。三倍突起的主要作用是识别受体,其上有硫酸乙酰肝素蛋白聚糖 (HSPG) 和整合素α5β1的结合结构域[12-14]。在2个三倍突起之间为二倍轴,二重轴具有最弱的氨基酸相互作用以及最低的表面接触能量[11]。五重轴的表面接触能量介于二重轴和三重轴之间,从每个五重顶位置有一个小孔,联通病毒衣壳的内部和外部,小孔外小内大[15-16]。这个小孔在 DNA衣壳化中具有非常重要的作用,是 AAV DNA进入衣壳的地方,它参与Rep蛋白结合、衣壳蛋白装配、VP1 N末端暴露、AAV病毒感染等多个过程[6]。
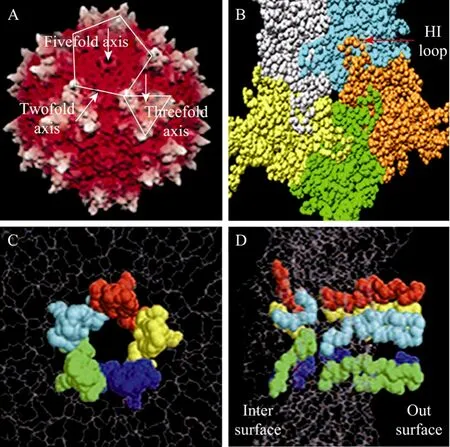
图2 AAV衣壳以及五倍轴小孔的结构Fig. 2 Structures of AAV2 capsids and the pores at fivefold symmetry axes. (A) Surface topology of the AAV2 capsid. The arrows indicate the locations of the two-, three-, and five-fold axes. (B) An arrow indicates the HI loop on an AAV2 pentamer.(C, D) Backbone models of structures of fivefold symmetryrelated VPs shown as a side view (D) and from the outside (C)of the capsid[10].
2.2 AAV衣壳蛋白装配
衣壳的装配只需要Cap基因表达就能完成[17]。衣壳蛋白的表面全部由 VP3亚单位组成,VP1和VP2的N末端位于衣壳的内部。那么,单独的VP3能形成完整的衣壳吗?
利用纯化的 VP蛋白在细胞外研究表明,单独的 VP1、VP2、VP3或 VP1、VP2、VP3混合,都能从单体聚集成寡聚体,寡聚体既可以是同源的,也可以是异源的,但是并不能形成完整的病毒样颗粒[18]。如果在VP1、VP2、VP3混合物中加入 Hela细胞提取液,则能形成病毒样颗粒,但形成的效率非常低。这一实验证明,AAV病毒样颗粒的形成依赖于Hela细胞中的某些成分,同时也证明AAV的胞外重建不能仅仅通过VPs的自组装来完成。
利用质粒系统在Hela细胞中表达VP 蛋白的研究表明,VP3单独表达时可在整个细胞中检测到VP3,且在部分细胞的细胞质中检测到由 VP3形成的小颗粒,而单独表达VP1或VP2都能在核内检测到想要的VP蛋白表达,并可见病毒样颗粒形成[19]。如果将VP3与VP1或VP2共表达,则在细胞质中的VP3降低而在核内积累。
利用杆状病毒载体在昆虫细胞系Sf9表达VP的研究表明,VP3或 VP1单独或共表达都不能形成病毒样颗粒;VP2、VP1/VP2、VP2/VP3,VP1/VP2/VP3共表达都能形成病毒样颗粒[19]。在杆状病毒体系里面,VP2似乎是衣壳蛋白装配成病毒样颗粒的关键,尽管VP2能单独形成病毒颗粒的实验中并没有完全排除VP3。然而,带有SV40 T抗原片段的VP3能单独组装成病毒样颗粒,无需VP2的参与[20]。VP2和SV40 T都具有核定位信号 (166PARKRLNF173),可能起到运送VP3进入细胞核的作用
随后,Warrington等在293细胞的研究表明中,VP3单独表达就能产生病毒样颗粒[7]。在Hela细胞中,VP3单独表达的时候也不仅仅是在细胞质中可以检测到VP3[19]。那么,在哺乳动物细胞中,VP3又是如何进入细胞核的呢?最近有关 AAP的研究也许能为这一现象提供部分解释[8]。AAP主要定位于细胞核内,可能协助VP蛋白从细胞质进入细胞核。
2.3 影响AAV衣壳装配的结构区域
AAV衣壳5倍轴上的小孔对AAV的衣壳的装配具有一定的影响。小孔由5个VP3蛋白分子像照相机快门一样围绕而成。小孔外面部分成圆柱状,内部则成漏斗状[10]。圆柱状结构从衣壳表面突起,由每个衣壳蛋白上的反向平行的β带 (β-ribbon) 组成 (VP1位置上的322~338氨基酸),这些氨基酸在靠近338这一段保守性较高,而另一端变化较大。漏斗状部分由217~223氨基酸组成,并且在各个亚型之间高度保守[10]。在221氨基酸后面插入两个酪氨酸残基可以完全抑制蛋白装配,而将322上的谷氨酸替换成丙氨酸 (E322A),则能降低衣壳的包装效率[10]。
围绕在圆柱状结构周围的是HI环 (位于βH和βI之间,653~659),这上面的侧链基团可以与其他衣壳蛋白分子上的BC环和EF环上的侧链基团发生反应[9,11]。HI环的长度可能与衣壳蛋白的正确装配有关。如果将AAV5上的HI环替换到AAV2的相应区域,衣壳就无法完成装配,AAV5上的 HI环比AAV2少一个氨基酸。
另外,VP3的C末端、N末端都可能存在影响衣壳装配的元件[21,7],其具体的氨基酸定位与装配之间的关系需要进一步研究。
2.4 AAV衣壳的装配地点
虽然目前对于 AAV完整衣壳产生之前的步骤了解还比较少,但是从其他病毒的研究我们可以总结出一定的规律。病毒衣壳的装配一般包括以下几个过程:第一,形成包装的基本单位 (五聚体);第二,5个五聚体围绕一个五聚体进行装配形成装配前体;第三,其他装配单位组装到第二步形成的装配前体上[4]。
在感染初期,衣壳蛋白可以在细胞质内积累并形成具有不同蛋白分子组成的寡聚体 (VP1∶VP2∶VP3比例不等)。虽然并不能完全排除在细胞质中合成完整衣壳蛋白的可能性,但是从具有完整衣壳蛋白的特征峰60S的变化趋势来看,衣壳的最终形成应该在细胞核内[22]。前面已经讲到,VP1和VP2 (无论是单体还是寡聚体) 主要定位于细胞核内,而单体的VP3在核内和细胞质内均匀分布,表明,VP1、VP2和 VP3在装配过程中具有不同的结构和行为。VP1和VP2上都具有核定位信号 (166PARKRLNF173),可能起到运送 VP3进入细胞核的作用[20]。然而,Grieger等对VPs上可能是核定位信号的碱性氨基酸区域 (Basic region,BR) 进行研究发现,VP1上有4个BR (BR1-4),其中3个 (BR2-4) 与VP2相同,而VP3只有BR4[23]。BR4 (307RPKRLN312) 对于病毒装配是必需的,被认为在病毒进入细胞核过程中发挥作用的 BR3 (166PARKRLNF173) 对于维持病毒的感染活性是必需的,而 BR1 (120QAKKRVL126) 和BR2 (140PGKKRPV146) 对病毒感染也有一定的作用。BR3被认为不是衣壳蛋白进入细胞所必需的,除了作为核定位信号之外,BR3还参与AAV基因组的包装过程。VP1和VP3上各有一个BR3存在,但是BR3似乎有些富余,因为只要有一个BR3存在就能保持AAV的感染和装配特性。
即使在细胞核内,也可检测到 VP蛋白单体,因此无论是在核内还是细胞质内,都可能存在一个衣壳蛋白聚合和解聚的平衡。与此相一致的是,AAV在进入细胞后,是在细胞质还是在细胞核完成脱壳一直都存在争论。AAV感染后完整的衣壳蛋白最初在核仁中发现,随后遍及整个细胞核,表明核仁的某些成分在衣壳蛋白装配过程中起到重要作用[24]。然而,AAV VPs 在细胞内究竟是如何形成完整衣壳的,还需要更多的研究[25]。
2.5 ssDNA进入衣壳的方式
病毒基因组进入病毒的两种方式如下:1) 基因组与结构蛋白相连;2) 病毒基因组通过某种机制导入到已经形成的病毒颗粒。第一种方式在具有双链基因组的病毒中较为常见,如HSV。目前普遍接受的有关 AAV病毒颗粒的形成理论认为,衣壳蛋白先组装成完整的空病毒颗粒,然后单链基因组通过某种机制导入到衣壳内部。多种 ssDNA和单链RNA (ssRNA) 病毒都是采用这一方式,如ΦX174、Φ6和小核糖核酸病毒。衣壳蛋白的组装过程比较迅速,但是 dsDNA进入衣壳的过程却相对缓慢。目前,我们还不知道为什么 AAV基因组的衣壳化(Encapsidation) 会成为限速步骤。
成熟的病毒颗粒中,有的装有 (+)ssDNA,有的装有 (-)ssDNA,这些 DNA 都有类似的 3′ITR 和5′ITR,到底是哪一端首先进入衣壳呢?King等利用DNase酶切实验表明,DNA的衣壳化从3’ITR开始,依照3′−5′的方向持续进行[26]。如果 AAV基因组的长度超过一定限度 (~5.2 kb),那么包装入病毒的DNA有很大一部分缺少5′端[27]。
2.6 AAV的包装容量
AAV2的基因组大小为4.7 kb,一般认为,AAV衣壳可以包装相当于本身基因组105%的DNA。然而,最近有报道称AAV5可以包装~9 kb的DNA[28]。在这一文章发表之后,多个研究小组进行了类似研究[27,29-30],其结果却不尽相同,后三者认为无论是哪个亚型的AAV,都不能有效包装大于其本身基因组许多的DNA。Hirsch等这些相互冲突的研究结果分析之后表明,AAV作为载体之所以能表达~9 kb的基因可能是因为 AAV基因组片段在体内重组而产生的结果[31]。以上实验再次证明,AAV衣壳的相对刚性只能容纳一定大小的DNA。
2.7 ssDNA进入衣壳的作用机制
负责DNA入壳的蛋白主要是Rep52和Rep40,当然也不能排除其他蛋白参与的可能性。Rep52的螺旋酶活性严格依赖于自由的3′端,而Rep40还可以解开平末端双链DNA。是否Rep52和Rep40同时参与了AAV ssDNA的入壳,还是只有其中一个发挥作用还有待于进一步研究。
King等提出了Rep52/40参与ssDNA入壳的3种模式[26]:第一,Rep52/40通过解螺旋作用打开3′ITR的回文结构,并依靠这一活动提供的能量推动3′ITR入壳。这一方式能比较好地解释3′ITR入壳的机制,但是不能解释后续的ssDNA如何入壳。第二,Rep52/40推动处于双链形式的 AAV基因组解链,一边解链一边将解链出来的ssDNA推入壳内。第三,3′ITR的回文结构并不直接参与DNA入壳,而是在Rep52/40推动 ssDNA入壳的同时进行新一轮的复制。这一方式将可能导致DNA入壳复合物与复制复合物的“冲突”。然而,DNA复制时单链取代并非驱动DNA入壳的直接动力,因为单链取代的方向和DNA入壳的方向不同。因此,DNA复制和入壳可能并没有机制上的直接联系。利用免疫共沉淀技术研究发现,AAV DNA、Cap以及Rep蛋白都定位于核内且相互关联,表明AAV基因组的复制与衣壳化可能同时发生。Myers和Carter在1980年的时候就提出,经过复制、单链取代产生的ssDNA与衣壳装配前体相连[32]。如果在衣壳化时没有大量衣壳的积累,dsDNA形式的基因组就不会转变成ssDNA,这就表明ssDNA的形成依赖于衣壳蛋白。
Rep40是SF3螺旋酶家族的一员,在结构上与AAA+马达蛋白相似[33]。Rep40结合DNA无需识别特殊的 DNA结构,但是单体状态的 Rep40并没有或者只有极低的ATPase活性,Rep40的激活不但需要ATP,还需要有DNA的存在。ATP能诱导Rep40发生构象变化,使之能与DNA结合,Rep40与DNA结合后,导致DNA构象的变化,这种变化反过来促进 Rep40的聚合,发挥 ATPase的功能[34]。Rep40和SV40T抗原具有很大的的相似性,可能告知我们它是以6聚体的形式发挥功能[35]。
2.8 Rep-Cap连接在ssDNA入壳过程中的作用
ssDNA被认为是通过Rep作用而定位于衣壳表面的,但是Rep和Cap的反应并不需要ssDNA的参与就能发生[24]。Rep-Cap反应可以在衣壳形成之间就开始,Rep-Cap反应不但在体内共表达的时候可以发生,就是在体外两类蛋白共孵育也能发生,只是Rep-Cap反应的效率和产物的稳定性不如体内。尽管 4种 Rep蛋白都能与 Cap发生反应,但是在Rep-Cap复合物中,Rep蛋白的数量依次为Rep52、Rep78、Rep68、Rep40。是否 4种Rep都参与了DNA的锚定以及入壳还有待于进一步研究。
那么衣壳表面的哪个部位才是Rep结合的位点呢?因为ssDNA被认为是通过五倍轴顶端的小孔进入衣壳的,研究者将注意力集中于对小孔的研究。对小孔周围的几个主要氨基酸进行突变,研究发现V221W、L336W以及D219/L336W只是降低DNA的包装效率,并不能完全阻止 DNA进入衣壳[36]。作者认为,这些突变的结果可能是导致衣壳蛋白与Rep的结合能力降低所致。T329A/T330A是所有突变中包装效率最差的,同时也是Rep-衣壳反应最差的突变体。Rep-衣壳蛋白结合能力的降低并不影响被包入衣壳DNA的完整性,突变的结果只是影响了Rep-DNA锚定衣壳的成功率。但是这些实验并不能排除小孔突变对DNA进入具有直接的影响。另外,如果将HI的多肽序列全部替换成甘氨酸序列,虽然能形成衣壳,但是这一衣壳无法包装DNA[9]。这种取代的结果是将原有HI环上与相邻亚单位EF环反应的侧链氨基酸去除,从而可能影响DNA的包装。
观察两组患者护理后的血压、甘油三酯和总胆固醇以及纤维蛋白原的变化水平。利用日常生活活动能力评分表(ADL)对两组患者护理后的日常生活能力进行评分,分值为0~100分,分数越高表示活动能力越好。
3 结论
AAV衣壳蛋白的装配和 DNA的衣壳化是rAAV制备过程中两个最为重要的过程。虽然我们对这两个过程有了总体上的认识,然而许多细节还无法知晓。例如,AAV如何能保证60个衣壳蛋白正确地装配成衣壳,Rep蛋白在衣壳装配过程中有什么作用,参与 DNA入壳的 Rep到底是哪一个或哪几个,五倍轴小孔在DNA入壳过程中到底扮演什么角色等等。AAV衣壳蛋白的装配和DNA的衣壳化的详细分子机制、构效关系仍需完善和充实。AAV病毒本身相关机制的深入研究有助于改善 rAAV载体的制备技术,促进rAAV基因药物研发。
REFERENCES
[1] Xu RA, Chen L, Xiao WD. Molecular Gene Medicine.Beijing: Peking University Press and Peking University Medical Press, 2008: 2−40.
许瑞安, 陈凌, 肖卫东. 分子基因药物学. 北京: 北京大学出版社&北京大学医学出版社, 2008: 2−40.
[2] Wang QZ, Lü YH, Xiao WD, et al. The clinical researches of recombinant adeno-associated vector. China Biotechnol, 2010, 30(1): 73−79.
王启钊, 吕颖慧, 肖卫东, 等. 重腺相关病毒载体临床实验研究. 中国生物工程杂志, 2010, 31(1): 49−53.
[3] Lü YH, Wang QZ, Xiao WD, et al. Trends in development of self-complementary adeno-associated virus vector.Chin J Biotech, 2009, 25(5): 658−664.
吕颖慧, 王启钊, 肖卫东, 等. 自身互补型腺相关病毒载体发展趋势. 生物工程学报, 2009, 25(5): 658−664.
[4] Timpe J, Bevington J, Casper J, et al. Mechanisms of adeno-associated virus genome encapsidation. Curr Gene Ther, 2005, 5(3): 273−284.
[5] Muralidhar S, Becerra SP, Rose JA. Site-directed mutagenesis of adeno-associated virus type 2 structural protein initiation codons: effects on regulation of synthesis and biological activity. J Virol, 1994, 68(1): 170−176.
[6] Grieger JC, Johnson JS, Gurda-Whitaker B, et al.Surface-exposed adeno-associated virus Vp1-NLS capsid fusion protein rescues infectivity of noninfectious wild-type Vp2/Vp3 and Vp3-only capsids but not that of fivefold pore mutant virions. J Virol, 2007, 81(15):7833−7843.
[7] Warrington Jr KH, Gorbatyuk OS, Harrison JK, et al.Adeno-associated virus type 2 VP2 capsid protein is nonessential and can tolerate large peptide insertions at its N terminus. J Virol, 2004, 78(12): 6595−6609.
[8] Sonntag F, Schmidt K, Kleinschmidt JA. A viral assembly factor promotes AAV2 capsid formation in the nucleolus.Proc Natl Acad Sci USA, 2010, 107(22): 10220−10225.
[9] DiPrimio N, Asokan A, Govindasamy L, et al. Surface loop dynamics in adeno-associated virus capsid assembly.J Virol, 2008, 82(11): 5178−5189.
[10] Bleker S, Sonntag F, Kleinschmidt JA. Mutational analysis of narrow pores at the fivefold symmetry axes of adeno-associated virus type 2 capsids reveals a dual role in genome packaging and activation of phospholipase A2 activity. J Virol, 2005, 79(4): 2528−2540.
[11] Xie Q, Bu WS, Bhatia S, et al. The atomic structure of adeno-associated virus (AAV-2), a vector for human gene therapy. Proc Natl Acad Sci USA, 2002, 99(16):10405−10410.
[12] Opie SR, Warrington KH Jr, Agbandje-McKenna M, et al.Identification of amino acid residues in the capsid proteins of adeno-associated virus type 2 that contribute to heparan sulfate proteoglycan binding. J Virol, 2003, 77(12):6995−7006.
[13] Asokan A, Hamra JB, Govindasamy L, et al.Adeno-associated virus type 2 contains an integrin alpha5beta1 binding domain essential for viral cell entry. J Virol, 2006, 80(18): 8961−8969.
[14] Levy HC, Bowman VD, Govindasamy L, et al. Heparin binding induces conformational changes in Adeno-associated virus serotype 2. J Struct Biol, 2009,165(3): 146−56.
[15] Kronenberg S, Kleinschmidt JA, Böttcher B. Electron cryo-microscopy and image reconstruction of adeno-associated virus type 2 empty capsids. EMBO Rep,2001, 2(11): 997−1002.
[16] Xie Q, Somasundaram T, Bhatia S, et al. Structure determination of adeno-associated virus 2: three complete virus particles per asymmetric unit. Acta Crystallogr D Biol Crystallogr, 2003, 59(Pt 6): 959−970.
[17] Wistuba A, Kern A, Weger S, et al. Subcellular compartmentalization of adeno-associated virus type 2 assembly. J Virol, 1997, 71(2): 1341−1352.
[18] Steinbach S, Wistuba A, Bock T, et al. Assembly of adeno-associated virus type 2 capsids in vitro. J Gen Virol, 1997, 78(Pt 6): 1453−1462.
[19] Ruffing M, Zentgraf H, Kleinschmidt JA. Assembly of viruslike particles by recombinant structural proteins of adeno-associated virus type 2 in insect cells. J Virol, 1992,66(12): 6922−6930.
[20] Hoque M, Ishizu Ken-ichiro, Matsumoto A, et al. Nuclear transport of the major capsid protein is essential for adeno-associated virus capsid formation. J Virol, 1999,73(9): 7912−7915.
[21] Ruffing M, Heid H, Kleinschmidt JA. Mutations in the carboxy terminus of adeno-associated virus 2 capsid proteins affect viral infectivity: lack of an RGD integrin-binding motif. J Gen Virol, 1994, 75(Pt12):3385−3392.
[22] Wistuba A, Weger S, Kern A, et al. Intermediates of adeno-associated virus type 2 assembly: identification of soluble complexes containing Rep and Cap proteins. J Virol, 1995, 69(9): 5311−5319.
[23] Grieger JC, Snowdy S, Samulski RJ. Separate basic region motifs within the adeno-associated virus capsid proteins are essential for infectivity and assembly. J Virol, 2006,80(11): 5199−5210.
[24] Dubielzig R, King JA, Weger S, et al. Adeno-associated virus type 2 protein interactions: formation of pre-encapsidation complexes. J Virol, 1999, 73(11):8989−8998.
[25] Bevington JM, Needham PG, Verrill KC, et al. Adenoassociated virus interactions with B23/Nucleophosmin:identification of sub-nucleolar virion regions. Virology,2007, 357(1): 102−113.
[26] King JA, Dubielzig R, Grimm D, et al. DNA helicase-mediated packaging of adeno-associated virus type 2 genomes into preformed capsids. EMBO J, 2001,20(12): 3282−3291.
[27] Wu ZJ, Yang HY, Colosi P. Effect of genome size on AAV vector packaging. Mol Ther, 2010, 18(1): 80−86.
[28] Allocca M, Doria M, Petrillo M, et al. Serotype-dependent packaging of large genes in adeno-associated viral vectors results in effective gene delivery in mice. J Clin Invest,2008, 118(5): 1955−1964.
[29] Lai Y, Yue Y, Duan D. Evidence for the failure of adeno-associated virus serotype 5 to package a viral genome > or = 8.2 kb. Mol Ther, 2010, 18(1): 75−79.
[30] Dong B, Nakai H, Xiao W. Characterization of genome integrity for oversized recombinant AAV vector. Mol Ther, 2010, 18(1): 87−92.
[31] Hirsch ML, Agbandje-McKenna M, Samulski RJ. Little vector, big gene transduction: fragmented genome reassembly of adeno-associated virus. Mol Ther, 2010,18(1): 6−8.
[32] Myers MW, Carter BJ. Assembly of adeno-associated virus. Virology, 1980, 102(1): 71−82.
[33] James JA, Escalante CR, Yoon-Robarts M, et al. Crystal structure of the SF3 helicase from adeno-associated virus type 2. Structure, 2003, 11(8): 1025−1035.
[34] Dignam SS, Collaco RF, Bieszczad J, et al. Coupled ATP and DNA binding of adeno-associated virus Rep40 helicase. Biochemistry, 2007, 46(2): 568−576.
[35] James JA, Aggarwal AK, Linden RM, et al. Structure of adeno-associated virus type 2 Rep40-ADP complex:insight into nucleotide recognition and catalysis by superfamily 3 helicases. Proc Natl Acad Sci USA, 2004,101(34): 12455−12460.
[36] Bleker S, Pawlita M, Kleinschmidt JA. Impact of capsid conformation and Rep-capsid interactions on adeno-associated virus type 2 genome packaging. J Virol,2006, 80(2): 810−820.
Capsid assembly and DNA encapsidation of adeno-associated virus
Qizhao Wang1,2, Yinghui Lü1,2, Zhaofa Li1,2, Yong Diao1,2, and Rui’an Xu1,2
1 Institute of Molecular Medicine, Huaqiao University, Quanzhou 362021, China
2 Molecular Medicine Engineering Research Center, Ministry of Education, Quanzhou 362021, China
Received: July 27, 2010; Accepted: October 9, 2010
Supported by: National S&T Major Special Project on Major New Drug Innovation (No. 2009ZX09103-643), National Science Foundation of China(No. 30900822), Natural Science Key Project of Fujian Province, China (No. 2010Y0036), Natural Science Project of Huaqiao University (No.07BS301).
Corresponding author: Qizhao Wang. Tel: +86-595-22690838; Fax: +86-595-22690516; E-mail: lyh4444@hqu.edu.cn
国家重大新药创制专项 (No. 2009ZX09103-643),国家自然科学基金 (No. 30900822),福建省重点项目 (No. 2010Y0036),华侨大学校基金 (No. 07BS301) 资助。

