抗PCV4 Cap 蛋白抗体间接ELISA 检测方法的建立
徐 鹏,吉卫龙,伊立超,张 爽,郝嘉翼,高子函,任世斌,时小双,任林柱,李 昌
(1.吉林大学动物科学学院,长春 130062;2.中国医学科学院人兽共患病毒病防控关键技术研究创新单元,中国农业科学院长春兽医研究所,长春 130122)
猪圆环病毒4型(Porcine circovirus 4, PCV4)是迄今为止发现的最小动物病毒之一,属于圆环病毒科、圆环病毒属成员[1]。首次于2019年4月,由周继勇团队从患有严重临床疾病(包括呼吸道疾病、腹泻和猪皮炎与肾病综合征)的猪群中发现的一种与其他PCV同源性较低的新型PCV4[2]。其所属的PCV病毒的病毒粒子具有直径为14~17 nm的二十面体对称、无囊膜的结构特点,遗传物质均为共价闭合的单股环状负链DNA。除PCV4外,PCV还有三种类型,分别为在PK-15细胞中被发现无致病性的猪圆环病毒1型(Porcine circovirus 1, PCV1)[3];1991年被发现的可导致断奶仔猪多系统衰竭综合征(Postweaning multisystemic wasting syndrome,PMWS)和猪皮炎与肾病综合征(Porcine dermatitis and nephropathy syndrome, PDNS)的具有致病性的猪圆环病毒2型(Porcine circovirus 2, PCV2)和2016年同样引起PMWS、PDNS的具有致病性的猪圆环病毒3型(Porcine circovirus 3, PCV3)[4-8]。
PCV4的基因组全长为1770 bp,一共包含12个开放阅读框(open reading frame, ORF),与其他PCV类似,其ORF1和ORF2是两个功能重要的开放阅读框。其中ORF1大小为891 bp,编码296个氨基酸的复制酶(Rep)蛋白,承担PCV4基因组DNA在宿主细胞中的复制功能;ORF2大小为687 bp,编码228个氨基酸的衣壳蛋白(Cap)蛋白,作为PCV4的唯一的结构蛋白含有多个抗原决定簇可以引起机体较强免疫反应。此外PCV4基因组具有代表圆环病毒复制起点的茎环基序(CAGTATTAC),与其他PCV的基因组同源性为43.2%~51.5%[2]。
近两年以来,由于PCV4的感染性和致病性,在我国湖南省、河南省、山西省、江苏省、广西壮族自治区、内蒙古自治区,韩国也都发生了PCV4的感染[2,9-16]。因此若不加以控制,PCV4将会对养猪业造成严重的威胁。此时快速有效的诊断和新型疫苗的研发尤为重要,所以许多实验室都开展了关于PCV4疫苗的构建研究,但是由于目前市场上尚未有可以检测PCV4的抗体与ELISA检测试剂盒,且大部分实验室没有分离出PCV4阳性血清,从而亟待研制一种可代替PCV4猪体阳性血清有效评价候选疫苗特异性抗体的检测方法。为此,本试验应用原核系统表达制备的PCV4 Cap蛋白作为包被抗原,建立了兔源多克隆PCV4 Cap抗体ELISA检测方法,为PCV4候选疫苗的开发提供了一种评价方法。
1 材料和方法
1.1 抗原与血清 PCV4 Cap蛋白抗体兔源阳性、阴性对照血清由吉林大学动物科学学院基因编辑实验室保存;PCV4 Cap蛋白由中国农业科学院长春兽医研究所分子病毒学与免疫学实验室制备并保存;新型冠状病毒(Severe acute respiratory syndrome coronavirus 2, SARS-Cov-2)、猪传染性胃肠炎病毒(Transmissible gastro enteritis virus, TGEV)、猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)、猪δ冠状病毒(Porcine deltacoronavirus,PDCoV)、塞内卡病毒(Seneca Valley virus,SVV)、尼帕病毒(Nipah virus, NiV)、PCV2、PCV3阳性血清由中国农业科学院长春兽医研究所分子病毒学与免疫学实验室制备并保存。
1.2 主要试剂 ELISA蛋白包被液(10×)、ELISA终止液、TMB单组分显色液均购自索莱宝科技有限公司;HRP-山羊抗兔IgG H&L、HRP-山羊抗猪IgG H&L购自碧云天生物技术有限公司。
1.3 抗原反应原性鉴定 以本研究室制备的PCV4 Cap重组蛋白(内蒙PCV4毒株,GenBank登录号为:MT882410)为阳性样品,pET-28a空载体蛋白作为阴性样品[17],使用PCV4兔源多克隆抗体作为一抗,HRP-山羊抗兔抗体作为二抗,10%的分离胶进行SDS-PAGE后,蛋白质印迹(Western blot)检测。
1.4 抗原最佳包被浓度和待检血清最佳稀释度的确定 采用方阵滴定法确定抗原最佳包被浓度和血清最佳稀释度,使用1×包被液将PCV4 Cap进行4个梯度稀释(2、4、5、8 μg/mL),100 μL/孔,每个浓度3个生物学重复包被酶标板,4℃孵育过夜。PBST震荡洗涤3次,1 min/次。加入100 μL/孔5%脱脂乳置于37℃条件下封闭60 min。PBST震荡洗涤3次,1 min/次。将待检阳性样本(PCV4 Cap兔源多克隆抗体)血清以及阴性样本血清分别稀释为1∶200、1∶400、1∶800,100 μL/孔,37℃条件下孵育60 min。每个稀释度3个生物学重复与上述蛋白包被浓度进行方阵滴定,进行12组平行实验。PBST震荡洗涤3次,1 min/次。加入1∶5000稀释的HRP-山羊抗兔IgG H&L抗体,37℃条件下孵育60 min。PBST震荡洗涤3次,1 min/次。每孔加100 μL TMB显色液,室温条件下避光孵育15 min。每孔加入50 μL ELISA终止液。即刻使用多功能酶标仪测定OD450值。以P/N值(阳性对照血清OD450均值/阴性对照血清OD450均值)大于2.1且最大时的血清稀释倍数以及抗原包被浓度确定为血清最佳稀释倍数和最佳抗原包被浓度。
1.5 最佳封闭时间的确定 按照以上确定的最优条件进行实验,使用TBST配置的5%脱脂乳进行封闭,37℃条件下分别封闭60、90、120 min,每个样品3个生物学重复,进行3组平行实验,以P/N值大于2.1且最大时确定为最佳封闭时间。
1.6 最佳待检血清孵育时间的确定 按照以上确定的最优条件进行实验,将待检的阳性血清样品和阴性血清样本分别进行37℃条件下孵育30、45、60 min,每个样品3个生物学重复,进行3组平行实验,以P/N值大于2.1且最大时确定为最佳待检血清孵育时间。
1.7 最佳酶标二抗稀释度与孵育时间的确定 按照以上确定的最优条件进行实验,将HRP-山羊抗兔IgG H&L抗体分别稀释为1∶3000、1∶5000、1∶10 000,每个稀释度3个生物学重复,并分别于37℃条件下孵育酶标板30、45、60 min,进行9组平行实验,以P/N值大于2.1且最大时确定为最佳酶标二抗稀释度与孵育时间。
1.8 最佳底物显色时间的确定 按照以上确定的最优条件进行实验,加入TMB染色液后,室温避光分别孵育5、10、15、20 min,进行4组平行实验,以P/N值大于2.1且最大时确定为最佳底物显色时间。
1.9 临界值的确定 使用建立的间接ELISA方法检测1份阳性血清(3个生物学重复)、40份阴性对照血清(各1个生物学重复),计算阴性对照孔的OD450平均值()及标准差(SD),以+3SD确定该方法的临界值。大于等于该临界值的样品可判定为阳性,反之则为阴性。
1.10 重复性试验 进行批内重复试验,将同一批次纯化的蛋白包被酶标板,取4组不同抗体水平的阳性血清样品和1组阴性血清样品,每份血清做3个生物学重复,进行间接ELISA方法检测并计算OD450的及SD和变异系数(Coeffcient variations, CV)。进行批间重复试验,用不同批次制备的4批蛋白抗原分别包被ELISA板,对4组不同阳性血清样品和1组阴性血清样品,每份血清做3个生物学重复,进行间接ELISA方法检测计算OD450的及SD和变异系数。
1.11 敏感性试验 以同一批蛋白包被酶标板,用同一批血清进行稀释,将阳性血清从1∶800开始,以2倍稀释法稀释至1∶204 800,每种血清设置3个生物学重复,评价该间接ELISA方法的敏感性。
1.12 特异性试验 按照建立的间接ELISA方法检测SARS-CoV-2、NiV、SVV、PDCoV、TGEV、PEDV、PCV2、PCV3、PCV4阳性血清,每种血清设置3个生物学重复,评价该间接ELISA方法的特异性。
2 结果
2.1 抗原反应原性鉴定 对PCV4 Cap重组蛋白进行SDS-PAGE与Western blot检测。从结果中可以看到PCV4 Cap蛋白成功表达,且浓度高,并可以与PCV4兔源多克隆抗体进行特异性反应,目的条带约27 kDa(图1A,1B),表明其具有良好反应原性。
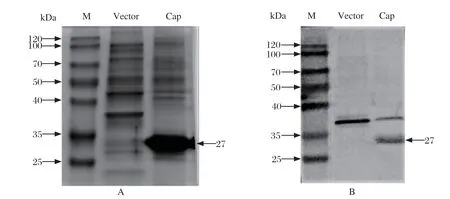
图1 PCV4 Cap 原核蛋白反应原性鉴定Fig.1 Identif ication of PCV4 Cap prokaryotic protein reactivity
2.2 抗原最佳包被浓度和血清最佳稀释度的确定 以不同浓度的抗原进行包被,以不同稀释度的血清进行孵育,进行ELISA检测。结果表明当抗原包被浓度为2 μg/mL,血清稀释度为1∶800时,P/N值(阳性对照血清OD450均值/阴性对照血清OD450均值)最大可达到20.08(表1)。因此,确定抗原最佳包被浓度为2 μg/mL,最佳待检血清稀释度为1∶800。
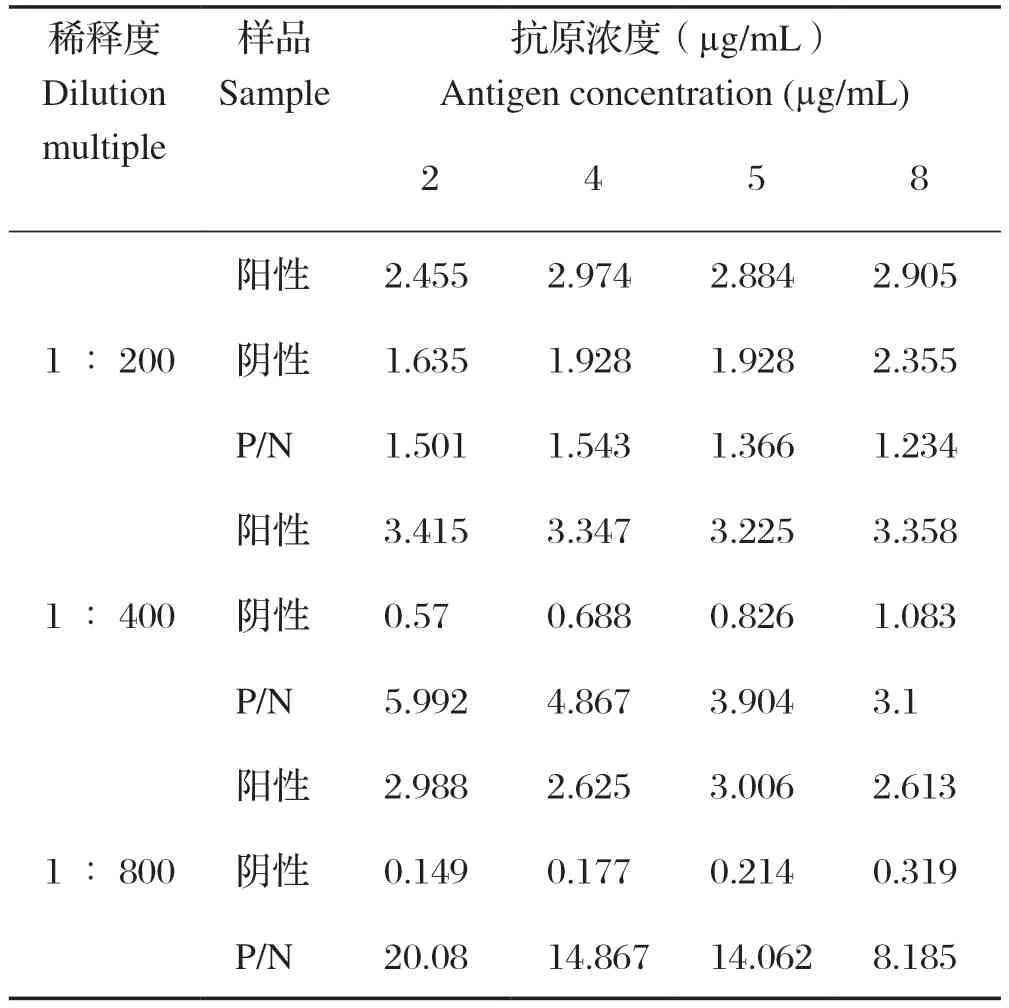
表1 最佳抗原包被浓度和血清稀释度的确定Table 1 Judgment of the coating concentration of recombinant protein and sera dilution
2.3 最佳封闭时间的确定 使用TBST配置的5%脱脂乳进行封闭,37℃条件下分别封闭60、90、120 min,进行ELISA检测,以P/N值大于2.1且最大时确定为最佳封闭时间。结果表明,三种封闭时间效果相差不大,根据时效性选择时间最短的为宜,因此最佳封闭时间为60 min(表2)。
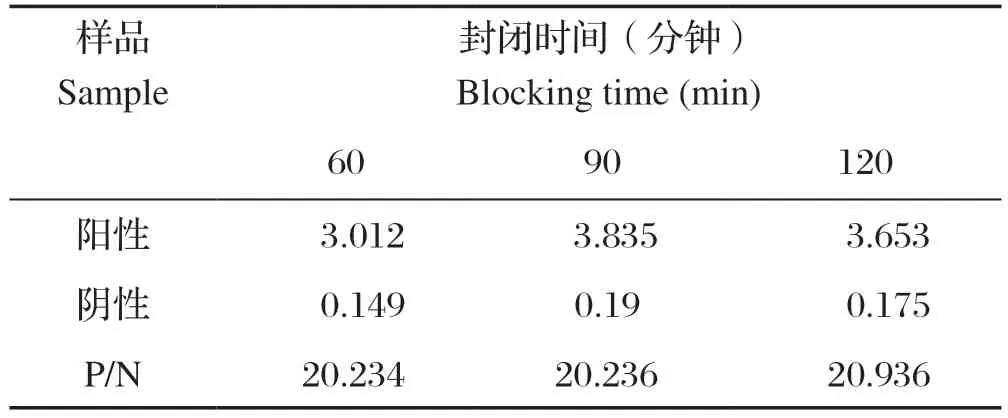
表2 最佳封闭时间的确定Table 2 Block titration results at various blocking time

表3 最佳待检血清孵育时间的结果Table3 Values of incubation time of serum to be tested
2.4 最佳待检血清孵育时间的确定 将待检的血清样品在37℃条件下分别孵育30、45、60 min,进行ELISA检测,以P/N值大于2.1且最大时确定为最佳待检血清孵育时间。结果表明,当37℃条件下孵育45 min时P/N值最高可达到32.952,因此最佳待检血清孵育时间为45 min(表2)。
2.5 最佳酶标二抗稀释度与孵育时间的确定 将山羊抗兔IgG-HRP分别稀释为1∶3000、1∶5000、1∶10 000,并在37℃条件下分别孵育酶标板30、45、60 min,进行ELISA检测。结果表明,酶标抗体的稀释倍数为1∶5000,反应时间为60 min时,P/N值最大为41.211。因此最佳酶标抗体的稀释倍数为1∶5000,最佳反应时间为60 min(表4)。

表4 酶标抗体稀释倍数与孵育时间的确定Table 4 Jadgment ofdilution multiple and incubation time of enzyme labelled antibody
2.6 最佳底物显色时间的确定 加入TMB底物后,分别室温避光孵育5、10、15、20 min,进行ELISA检测,以P/N值大于2.1且最大时确定为最佳底物显色时间。结果表明,当加入TMB孵育时间为10 min时,P/N值最大为41.211。因此最佳底物显色时间为10 min(表5)。
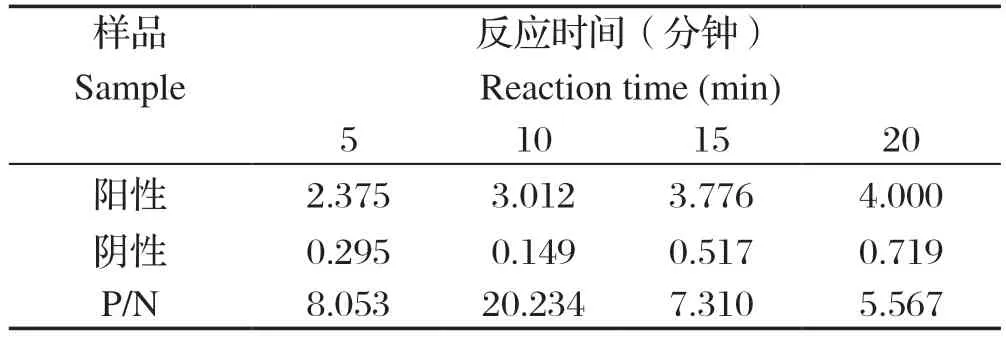
表5 确定底物显色时间Table 5 Judgement of reaction time for reaction with substrate
2.7 临界值的确定 使用建立的间接ELISA方法检测40份阴性对照血清,计算阴性对照孔的OD450平均值()及标准差(SD),以+3SD确定该方法的临界值。对得出的OD值进行统计分析和计算,从结果中可以确定该ELISA方法的临界值为0.157。P/N值大于或等于该临界值的样品即可判定为阳性(图2)。
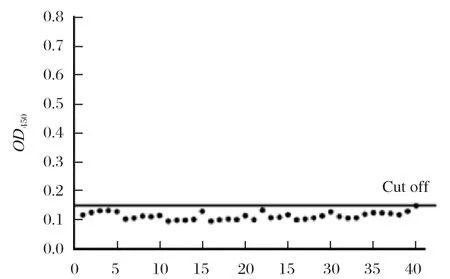
图2 40 份PCV4 Cap 阴性血清间接ELISA 检测结果Fig.2 Indirect ELISA results of 40 PCV4 Cap negative serum
2.8 重复性试验 进行批内重复试验,将同一批次纯化的蛋白包被酶标板,检测4组不同抗体水平的阳性血清样品和1组阴性血清样品。进行批间重复试验,用不同批次制备的4批蛋白抗原分别包被ELISA板,检测4组不同阳性血清样品和1组阴性血清样品。结果显示,批内重复试验和批间重复试验变异系数均低于5%(表6),表明建立的方法重复性较好。
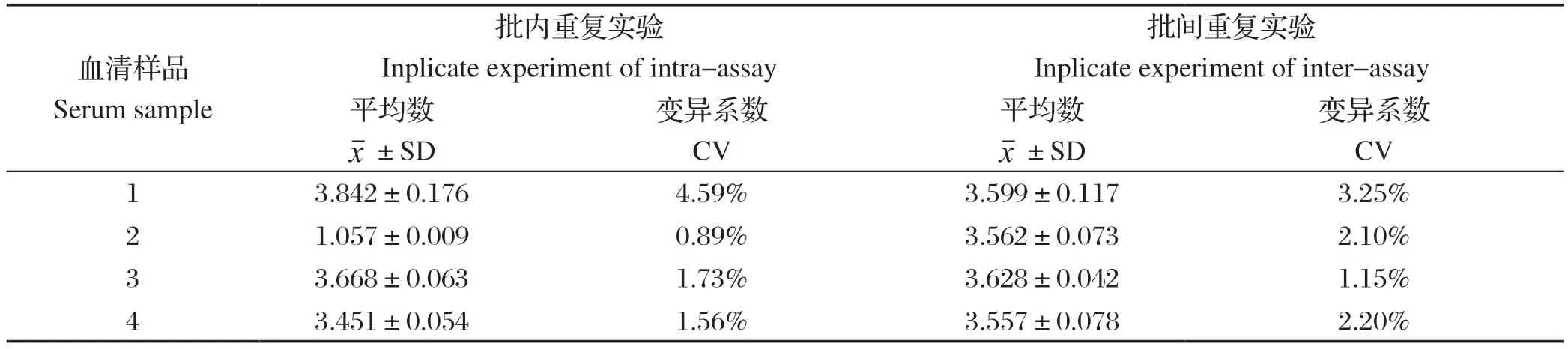
表6 PCV4 Cap 蛋白间接ELISA 方法重复性试验结果Table 6 Repeatability test results of PCV4 Cap protein indirect ELISA
2.9 敏感性试验 将PCV4 Cap阳性血清从1∶800倍稀释,2倍梯度稀释至1∶204 800,用建立的ELISA方法进行检测。结果显示,本研究建立的ELISA方法敏感性为1∶102 400(图3)。

图3 PCV4 Cap 蛋白间接ELISA 方法敏感性检测结果Fig.3 Sensitivity test results of PCV4 Cap protein indirect ELISA
2.10 特异性试验 按照建立的间接ELISA方法检测SARS-CoV-2、NiV、SVV、PDCoV、TGEV、PEDV、PCV2、PCV3阳性血清,设置PCV4阳性血清与阴性血清作为对照,评价该间接ELISA方法的特异性。结果显示,除PCV4阳性血清呈现阳性外,其他均为阴性,表明建立的方法特异性较强(表7)。
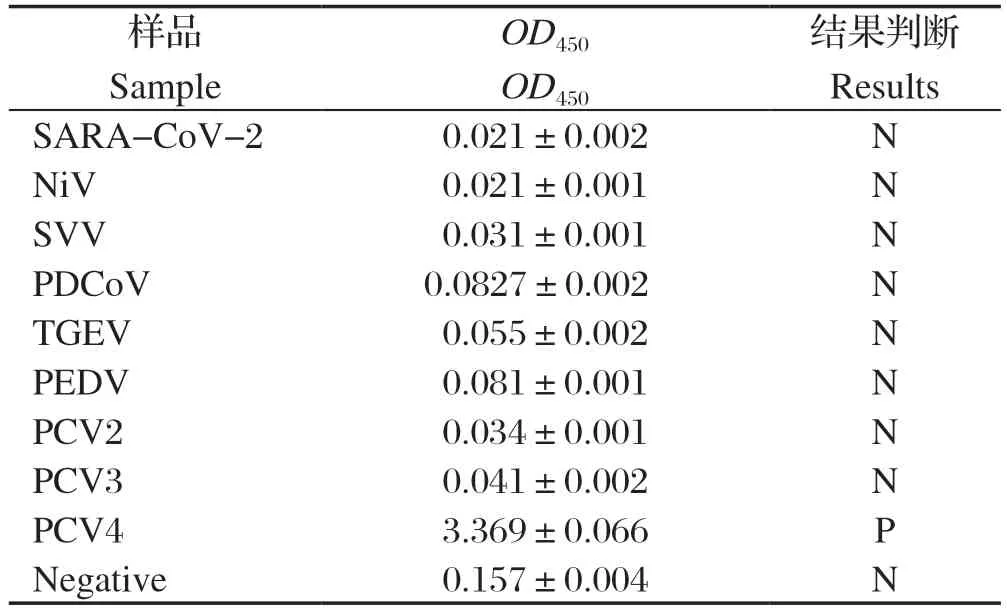
表7 PCV4 Cap 蛋白间接ELISA 方法的特异性试验结果Table 7 Result of specif icity test of indirect ELISA for PCV4 Cap protein
3 讨论
自19世纪90年代末具有致病性的PCV被发现以来,其感染猪后引起的猪圆环病毒相关疾病(Porcine circovirus associated diseases, PCVAD),造成了严重经济损失,极大威胁着全球养猪业的发展。随着时间的不断流逝,新型PCV3、PCV4相继出现,感染PCV3、PCV4后仍可以导致严重的疾病PMWS、PDNS,因此对这些病毒的诊断和预防极为迫切。对于2019年新出现的PCV4,目前不仅在我国出现了大范围的感染,在韩国等地也暴发了感染。因此PCV4的诊断和预防更是重中之重,以避免造成更大范围的感染趋势。ELISA方法一直是诊断疾病的常用方法[18-19],目前所有报道中可以检测临床猪血清的三例PCV4血清抗体ELISA检测方法均为间接免疫法。但是我国目前尚无商品化PCV4抗体检测试剂盒用于评价PCV4在其他种属上的候选疫苗,所以,针对鼠源与兔源等其他种属的候选疫苗的特异性抗体水平评价研制出一种灵敏度高准确度高的ELISA方法具有重要意义。
目前关于PCV4 ELISA检测方法的研究,主要以Rep蛋白和Cap蛋白为包被抗原。Ge等[10]使用2 μg/mL的PCV4 Rep蛋白为包被抗原,建立了待检血清为1∶100,酶标二抗为1∶10 000,Cut off值为0.21的PCV4血清间接ELISA方法,对中国17个省的不同年龄段猪血清共1790份样品进行PCV4阳性检测,结果发现除山西省的58份样品为阴性外其余省的样品均检测出PCV4阳性。此外,其他的相关研究均以Cap蛋白为靶蛋白建立PCV4血清抗体间接ELISA检测方法。Lian等[20]以原核纯化后的Cap蛋白为靶蛋白建立ELISA检测方法,使用1 μg/mL的PCV4 Cap蛋白为包被抗原,建立待检血清为1∶100,酶标二抗为1∶5000,Cut off值为0.31,敏感度可达1∶1600的PCV4血清抗体间接ELISA检测方法。其方法仅对PCV4特异,且重复率高。使用该方法对江苏省的1048个猪临床血清样品进行PCV4检测,结果发现其阳性率为3.44%(36/1048)。于成东等[12,17]使用PCV4 Cap 原核纯化后蛋白1 μg/mL为包被抗原,猪待检血清稀释倍数为1∶400,酶标二抗稀释浓度为1∶5000,Cut off值为0.341,并且批间与批内的变异系数均小于10%[12]。
因此,本研究在此基础上利用原核系统表达并纯化的PCV4 Cap蛋白,以常规的ELISA方法为基础,建立了特异性抗体水平评价的间接ELISA方法。对ELISA步骤中的各条件进行优化实验,具体优化后条件为:2 μg/mL PCV4 Cap纯化蛋白,4℃过夜包被酶标板;5%脱脂乳,封闭60 min;待检血清稀释比例为1∶800,反应条件为37℃、45 min;酶标抗体稀释比例为1∶5000,反应条件为37℃,60 min;底物显色时间为10 min;Cut off值为0.157,样品OD450值大于0.157即可判定为阳性;灵敏度可达1∶102 400。之后对建立的方法进行评价,结果发现批内重复试验和批间重复试验变异系数均低于5%;同时检测SARS-CoV-2、NiV、SVV、PDCoV、TGEV、PEDV、PCV2、PCV3、PCV4阳性血清,发现仅对PCV4呈现阳性反应,表明该方法具有高度特异性,与其他病毒不发生交叉反应。本研究所建立的方法,其待检血清稀释度、Cut off值、批内与批间重复率均低于目前已经报道的其他PCV4间接ELISA检测方法。其检测灵敏度可达1∶102 400,远高于其他ELISA检测方法灵敏度;此外,本研究在进行特异性检测时除检测与其他研究相同的猪源病毒外,还同时检测更多其他的猪源病毒以排除因交叉反应所导致的假阳性。综上所述,本研究建立的间接ELISA方法重复性良好、特异性高、敏感性高,可应用于候选疫苗的特异性抗体检测与评价。

