六种布鲁菌病疫苗对绵羊与山羊免疫效果的比较
李 鑫,徐文涛,吉雅图,段丽萍,赵 贝,杨 丹,董科学,狄栋栋,范伟兴
(1.乌拉特后旗动物疫病预防控制中心,巴彦淖尔 015000;2.乌拉特中旗温更镇综合保障和技术推广中心,巴彦淖尔 015000;3.天康生物制药有限公司,苏州 215000;4.金宇生物技术股份有限公司,呼和浩特 010000;5.中国动物卫生与流行病学中心,青岛 266000)
布鲁菌病(Brucellosis)是由布鲁菌引起的人、畜共患传染病。在家畜中,牛、羊、猪最易发生,且可由牛、羊、猪传染给人和其他动物。其特征是生殖器官和胎膜发炎,引起流产、不育和各种组织的局部病灶[1]。其中羊种布鲁菌的毒力最强,对人具有高度的致病性。人感染后常表现为持续性感染、间歇性发热,称作“波状热”,多汗、关节痛、神经痛及肝脏、脾脏肿大等症状,重者丧失劳动力[2],甚至威胁生命[3]。据报道,目前有170多个国家和地区有该病的发生和流行,其中123个国家和地区存在该病的感染。布病是一种广泛流行于世界各地的人畜共患慢性传染病[4],世界动物卫生组织(World Organization for Animal Health, WOAH)将该病定为必须报告的B类传染病,我国将其列为二类动物疫病[4-5]。该病一旦发生会造成巨大经济损失[6]。
目前,布鲁菌病在全球呈现上升态势,每年约有50万人感染布病,严重危害人类健康[7]。一方面未消灭布鲁菌病的国家和地区没有得到有效控制,仍在继续流行;另一方面已控制和消灭布鲁菌病的国家和地区,也出现了疫情反弹。在我国,布鲁菌病正处于历史高发期。究其原因,一是动物的流动性增大,检疫不到位,交易过程中不申报不检疫现象普遍存在;二是屠宰检疫手段落后,导致部分隐性感染的病畜进入流通环节,引发新的感染;三是基层兽医队伍不健全,新的检测与防控技术不能及时应用和推广。
近年来,乌拉特后旗在畜间布鲁菌病防控方面采取免疫、监测、消毒、扑杀等综合性防控措施,已达到了自治区控制区标准。但由于乌拉特草原北邻蒙古国,再加之国内目前动物流通环节的检疫不能及时到位,直接导致境内外传入疫情的风险仍然较大。因此,尽快建成乌拉特草原牛羊免疫无布鲁菌病区,保障人畜安全和边疆繁荣稳定,意义重大。
1 材料与方法
1.1 疫苗 布鲁氏菌病活疫苗(Rev.1株),批号:20220306,布鲁氏菌病活疫苗(S2株),批号:22930501,布鲁氏菌基因缺失活疫苗(M5-90Δ26株),批号:22950502,均购自金宇保灵生物药品有限公司,布鲁氏菌病活疫苗(A19株),批号:2022002,布鲁氏菌病活疫苗(M5株),批号:2021010,布鲁菌病活疫苗(A19-ΔVirB12株),批号:2022001,均购自天康生物制药有限公司。
1.2 血清与菌株 布鲁菌试管凝集抗原、琥红平板凝集抗原及标准阴、阳性血清购自禾旭生物技术有限公司(批号:20220817);无菌从受试羊颈静脉采血作为待检血清,分离血清,-20℃保存备用;含0.5%碳酸的(10%氯化钠溶液)作为血清稀释液,本实验室配制,高压灭菌后,4℃下保存备用。羊种强毒株M28,购自中国兽医药品监察所。
1.3 实验动物 从乌拉特后旗6个苏木/镇(获各琦苏木、巴音前达门苏木、乌盖苏木、潮格温都尔镇、呼和温都尔镇、巴音宝力格镇),随机选择80~100日龄健康的乌拉特土种绵羊羔和二狼山白绒山羊羔,共计660只(其中绵羊羔385只,山羊羔275只),在免疫前,常规采血,分离血清,经琥红平板凝集试验(rose bengal plate test, RBPT)和试管凝集试验(serum tube agglutination test, SAT)检测均为阴性。此外,试验羊除接种本次试验所用的6种布病疫苗外,不接种其他任何疫苗。
1.4 免疫试验 随机分为7个组,每组60~120只。其中:第1组M5组,绵羊60只,山羊60只,每只羊皮下注射1.0×1010CFU,试验地点巴音宝力格镇浩日格嘎查;第2组ReV.1组,绵羊60只,山羊60只,每只羊点眼1.0×1010CFU,地点呼和温都尔镇西补隆嘎查;第3组M5-90Δ26组,绵羊55只,山羊65只,每只羊皮下注射1.0×109CFU,地点潮格温都尔镇西日淖尔嘎查;第4组A19ΔVirB12组,绵羊60只,点眼30只,每只羊点眼1.0×1010CFU,皮下注射30只,每只3.0×1010CFU,地点巴音前达门苏木巴音高勒嘎查;第5组S2组,绵羊60只,山羊60只,每只灌服1.0×1010CFU,地点获各琦苏木前达门嘎查;第6组A19组,绵羊60只,点眼30只,每只羊点眼1.0×1010CFU,皮下注射30只,每只3.0×1010CFU,地点乌盖苏木和丰村;第7组为对照组,绵羊30只,山羊30只,地点巴音宝力格镇五支渠村。以上疫苗免疫剂量全部根据疫苗使用说明书所规定的剂量进行免疫。
1.5 实验室检测
1.5.1 琥红平板凝集试验(rose bengal plate test,RBPT) 用定量移液器将琥红平板抗原分别滴入64格玻璃板各30 μL,然后按编号顺序滴入待检血清30 μL,充分混合均匀,最后加入标准阳性血清和标准阴性血清作为对照。置室温下4 min,判定结果。
1.5.2 试管凝集试验(serum tube agglutination test,SAT)用血清学反应管将被检血清按照1∶12.5、1∶25、1∶50、1∶100、1∶200、1∶400、1∶800稀释,按照抗原使用说明稀释抗原,依次加入已经稀释的血清反应管中,稀释滴度变为1∶25、1∶50、1∶100、1∶200、1∶400、1∶800、1∶1600,同时设立标准阳性血清、标准阴性血清和比浊管对照,置37℃温箱孵育18~24 h,判定结果。
1.6 免疫后攻毒试验 免疫后攻毒试验所采用的方法和攻毒剂量是根据《兽用生物制品规程》。分别在天康生物制药有限公司和金宇生物制品有限公司研发中心完成。用于攻毒试验的羊,均随机选取6种疫苗免疫后的羊群。
1.6.1 布氏菌病活疫苗A19株、A19-ΔVirB12株、Rev.1株攻毒试验 依据《兽用生物制品规程》[8],通过田间实验样效力检验,分析3种疫苗免疫效果。随机从巴音镇、乌盖苏木、巴音前达门受试羊群中选取免疫后270 d山羊6只、绵羊30只、未免疫绵羊6只,分为6个试验组,1个对照组,每组6只。用羊种强毒菌株M28培养菌液稀释至0.5亿CFU/0.1 mL,试验组和对照组左右眼各滴入50 μL菌液,感染后用酒精棉球擦拭眼睛周围。感染后30~35 d,剖检试验组和对照组全部羊只,分别取颌下淋巴、肩前淋巴、腹股沟淋巴、脾脏,在生物安全柜中,剪取病料组织0.5 g,用PBS冲洗3~5遍,放入2 mL无菌EP管中,再加入2颗钢珠及1 mL液体培养基,用组织研磨机50Hz、300 s研磨。取研磨液100 μL,均匀的涂布于布鲁菌选择培养基上,置含5% CO2、37℃恒温培养中,培养5~7 d,观察有无布鲁菌疑似菌生长。提取疑似菌单菌落,加入50 μL灭菌蒸馏水,65℃灭活3 h后为模板,分别用M-PCR、B4B5-PCR进行鉴定。目的条带分别为731 bp和223 bp。扩增采用25 μL体系,扩增参数为:95℃预变性5 min;94℃变性60 s,58℃退火60 s,72℃延伸60 s,35个循环;72℃终末延伸10 min。产物经1.5%琼脂糖凝胶电泳检测并记录结果。
1.6.2 布鲁氏菌病活疫苗Rev.1株、S2株、M5-90Δ26株、攻毒试验 依据《兽用生物制品规程》,通过田间试验效力检验,分析3种疫苗免疫效果。随机选取免疫后270 d的山羊15只,绵羊10只,未免疫山羊5只,分为5个试验组和1个对照组。用羊种强毒菌株M28培养菌液稀释至0.5亿CFU/0.1 mL,试验组和对照组左右眼各滴入50 μL菌液,感染后用酒精棉球擦拭眼睛周围。感染后30~35 d,剖检试验组和对照组全部羊只,分别取颌下淋巴、肩前淋巴、腹股沟淋巴、脾脏,在生物安全柜中,剪取病料组织0.4~0.5 g,用PBS冲洗3~5遍,放入2 mL无菌EP管中,再加入2颗钢珠及1 mL液体培养基,用组织研磨机50 Hz、300 s研磨。取研磨液100 μL,均匀的涂布于布鲁菌选择培养基上,置5% CO2、37℃恒温培养5~7 d,观察有无布鲁菌疑似菌生长。挑取疑似菌单菌落,加入50 μL灭菌蒸馏水,65℃灭活3 h后为模板,分别用M-PCR、B4B5-PCR进行鉴定。目的条带约为731 bp和223 bp。扩增采用25 μL体系,扩增参数为:95℃预变性5 min;94℃变性60 s,58℃退火60 s,72℃延伸60 s,35个循环;终末延伸72℃10 min。产物经1.5%琼脂糖电泳检测并记录。
1.7 6种疫苗对山羊与绵羊生长发育的影响 通过对6个试验组与对照组在接种疫苗前、后称重及体格检查,观察疫苗对羊体生长发育是否有影响。采用SPSS 26.0软件对数据进行统计分析。P>0.05,差异不显著,不具有统计学意义;P<0.05表示差异显著,具有统计学意义;P<0.01表示差异极显著,具有统计学意义。
2 结果
2.1 对照组检测结果 对照组的30只绵羊和30只山羊分别在7~270 d 11个时间段静脉采血,分离血清,用RBPT和SAT检测,均未检测到相应抗体。
2.2 试验组山羊转阳检测结果 各试验组山羊在接种疫苗之前用RBPT和SAT检测,均为阴性,接种疫苗后7 d开始出现阳性。其中M5组RBPT和SAT检测,阳性率一致,达到78%;M5-90Δ26组 RBPT检测,阳性率达到81%,SAT检测阳性率为75%;S2组RBPT检测阳性率52%,SAT检测阳性率为32%。接种后21d,达到峰值,其中M5组RBPT检测,阳性率82%,SAT检测阳性率为80%;Rev.1组RBPT和SAT检测阳性率相一致,高达98%;M5-90Δ26组与S2组经RBPT和SAT 检测,两组阳性率相一致,高达100%(表1)。
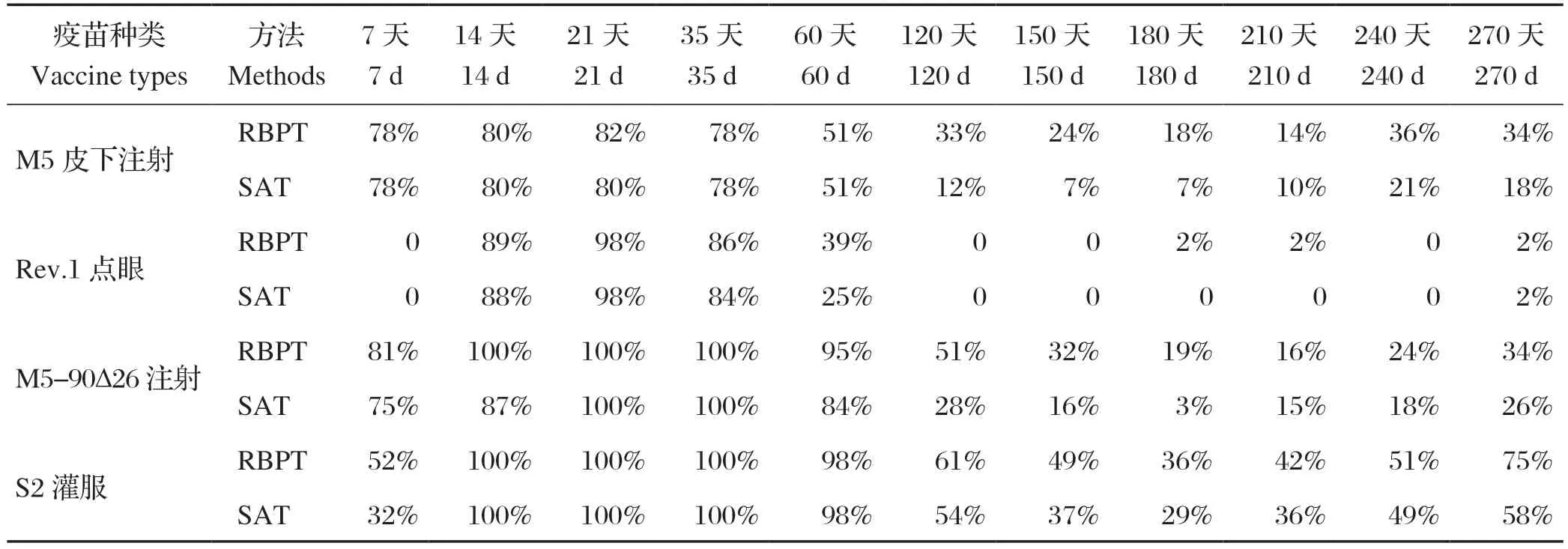
表1 试验组山羊转阳率Table 1 The positive conversion rate of goats in the experimental group
2.3 试验组绵羊转阳检测结果 各试验组山羊在接种疫苗之前用RBPT和SAT检测,均为阴性,接种疫苗后7 d开始出现阳性。其中M5组RBPT和SAT检测,阳性率一致,达到82%;M5-90Δ26组RBPT检测,阳性率达到81%,SAT检测阳性率为75%;S2组RBPT检测,阳性率52%,SAT检测阳性率为32%。接种后21 d,达到峰值,其中M5组RBPT检测,阳性率82%,SAT检测阳性率为80%;Rev.1组RBPT和SAT检测阳性率相一致,高达98%;M5-90Δ26组与S2组经RBPT和SAT检测,两组阳性率相一致,高达100%(表2)。由表1、表2可看出,接种后第7 d,6个试验组山羊转阳率最高的是M5-90Δ26组,达到81%;绵羊转阳率最高是A19组,达到100%;第二是M5组,达到82%,最低的是Rev.1组,山羊未转阳,绵羊转阳率仅为1.66%。接种第21 d,所有疫苗转阳率达到高峰,其中M5-90Δ26组山羊100%,绵羊98%;S2组山羊100%,绵羊85.18%;A19绵羊达到97%;Rev.1山羊98%,绵羊75%;接种第60 d,转阳率逐渐下降;第150 d,所有疫苗组转阳率均下降到50%以下;第180 d,S2组山羊下降到35.6%,绵羊下降到3.7%,M5组山羊下降到18.2%,绵羊下降到33%,其余均下降到20%以下;到240 d,S2山羊的转阳率由180 d的35.6%回升至50.84%,到270 d,回升至76.4%,即出现翘尾现象;M5-90Δ26、A19-ΔVirB12组也有小幅度的翘尾现象。

表2 试验组绵羊转阳率Table 2 The positive conversion rate of sheep in the experimental group
2.4 抗体效价检测结果 接种疫苗后14 d,效价达到峰值,其中抗体效价最高组为M5-90Δ26,山羊达到1∶494,绵羊达到1∶315,其次是S2组,山羊达到1∶447,绵羊达到1∶185,M5组山羊达到1∶406,绵羊达到1∶266;较低是Rev.1组,山羊为1∶164,绵羊为1∶155;接种疫苗后21 d,仅有S2组,山羊上升到1∶473,其余各试验组山羊和绵羊均渐进性下降;接种疫苗后120 d,仅有M5组的绵羊凝集价在1∶50以上,为1∶77.3,M5-90Δ26组的山羊为1∶56,S2组的绵羊为1∶50(表3)。
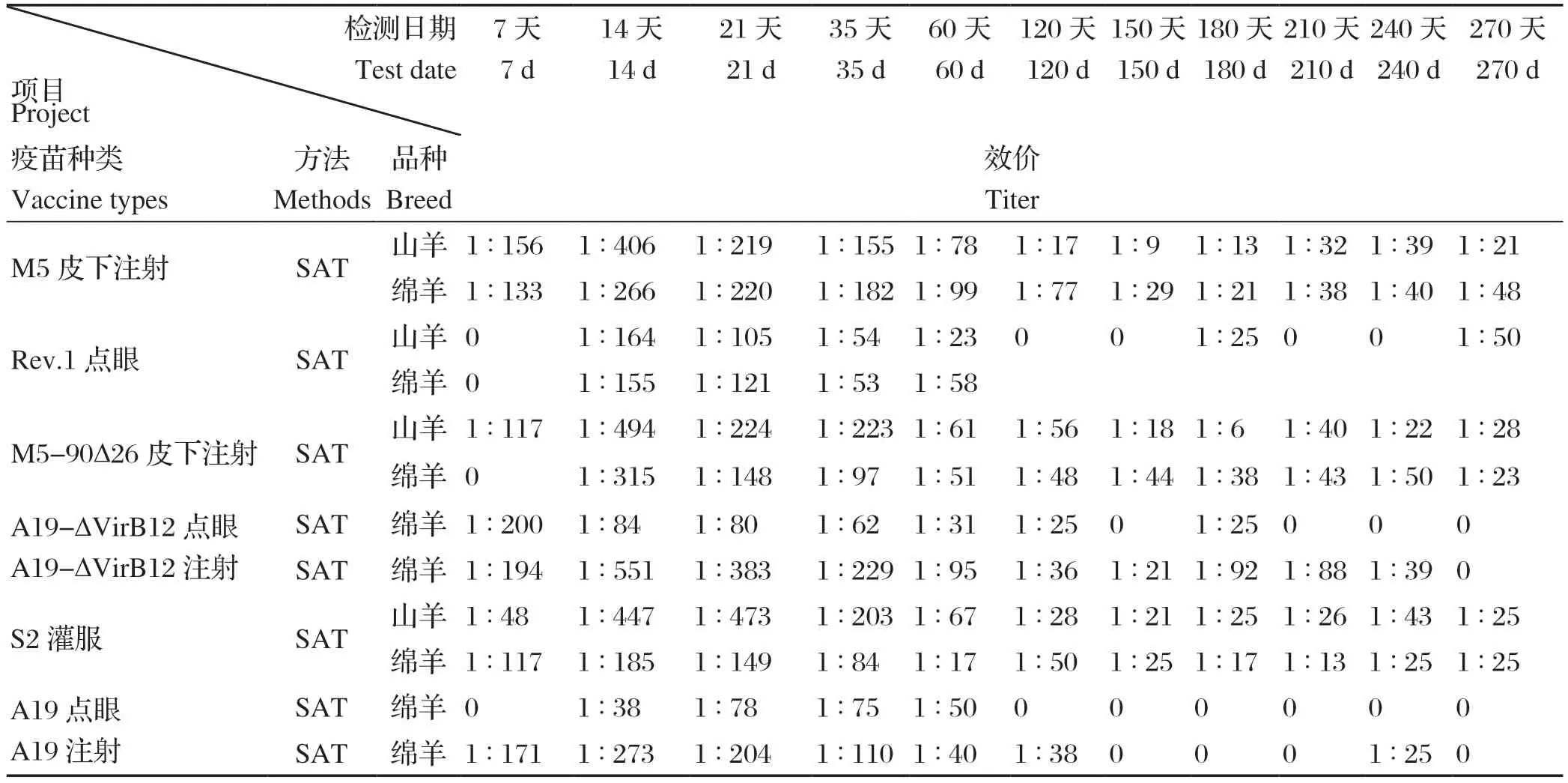
表3 抗体效价检测结果Table 3 The results of antibody titer test
2.5 免疫攻毒试验结果
2.5.1 布氏菌病活疫苗A19株、A19-ΔVirB12株、Rev.1株攻毒试验结果 判定标准依据《兽用生物制品规程》中的相关规定进行。A19组点眼免疫绵羊和Rev.1组点眼免疫山羊效力较好,保护比例均达到4/6:最差的是M5组皮下免疫山羊,保护比例为0/6(表4)。

表4 布氏菌病活疫苗M5 株、A19 株、A19ΔVirB-12 株免疫攻毒实验Table 4 Post-immunization challenge test of Brucellosis vaccine, Live (Strain M5, A19, A19ΔVirB-12)
2.5.2 布鲁氏菌病活疫苗Rev.1株、S2株、M5-90Δ26株、攻毒试验结果 判定标准依据《兽用生物制品规程》中的相关规定进行。M5-90Δ26组皮下免疫绵羊和Rev.1组点眼免疫山羊效力较好,保护比例均达到4/5;最差的是S2组灌服免疫绵羊,保护比例仅为1/5,详见表5。

表5 布鲁氏菌病活疫苗S2 株、M5-90Δ26 株、Rev.1 株免疫攻毒实验Table 5 Post-immunization challenge testof Brucellosis vaccine, Live (Strain S2, M5-90Δ26, Rev.1)
2.6 生长发育检查结果 通过对试验羊体格检查和称重,使用单因素方差分析和多重比较法进行差异显著性检验,其中M5皮下接种山羊和绵羊,与对照组相比较,P<0.05,差异显著,具有统计学意义;A19皮下接种绵羊,与对照组相比较,P<0.05,差异显著,具有统计学意义;A19点眼免疫绵羊,与对照组相比较,P>0.05,差异不显著,不具有统计学意义(表6)。

表6 试验羊生长发育体重监测结果Table 6 The results of growth and weight monitoring of sheep and goats in the experimental group
3 讨论
布鲁菌是革兰氏阴性菌兼细胞内寄生的细菌,具有独特的细胞生存和免疫机制,是一种自然疫源性疾病。根据免疫学理论,布鲁菌自然感染或人工免疫后,在动物体内首先产生免疫球蛋白IgM抗体,随后产生的免疫球蛋白IgG抗体,并且逐步升高,达到较高的水平并维持整个感染的过程。研究证实,RBPT主要检测IgG类抗体,具有较高的敏感性,适用于大规模普查。SAT是以检测免疫球蛋白IgM类抗体为主,对免疫球蛋白IgG类抗体几乎不敏感,因此可以作为早期诊断[9]。羊在感染布鲁菌后,会刺激机体产生免疫应答反应,激发体液免疫和细胞免疫。体液免疫是机体适应性免疫应答中的重要组成部分,在防御外来病原入侵发挥重要作用,而细胞免疫对于胞内寄生菌的清除起着主要作用[10]。疫苗接种后通过特异性抗体检测评价免疫效果是常用的方法。然而布鲁菌病的免疫保护主要体现在细胞免疫水平。体液免疫水平的检测只是对疫苗是否免疫成功的一个验证,因此抗体水平高低与动物机体保护力不呈正相关[11]。
血清学检测结果分析表明,M5-90Δ26和S2两种疫苗免疫山羊与绵羊后,无论是转阳率还是抗体效价均高于其余4种疫苗,其可刺激机体更早产生免疫应答反应,表现出良好的免疫原性;而且S2免疫山羊80 d后,抗体下降到35.6%,到270 d,回升至76.4%,即出现翘尾现象。这种现象可能是S2免疫山羊后出现的二次转阳,检测时应加以区别。Rev.1免疫后120 d,血清学反应未检测到抗体。因而有利于对感染抗体的检出,即对羊群中感染布鲁菌病的筛查。
免疫攻毒试验结果显示,A19用于绵羊点眼免疫和A19ΔVirB12用于绵羊皮下注射免疫,二者的保护比例都达到了4/6;M5-90Δ26用于绵羊皮下注射免疫、Rev.1用于山羊点眼免疫,二者的保护比例均达到了4/5。
通过对6种疫苗免疫效力的比较,A19绵羊点眼免疫、A19ΔVirB12绵羊皮下注射免疫、M5-90Δ26绵羊皮下注射免疫、Rev.1山羊点眼免疫均适用于草原放牧羊的免疫。
在布鲁菌病防控工作中,选择具有良好免疫原性的疫苗接种易感动物,并且结合疫苗接种动物后的抗体消长规律,制定合理的免疫程序,对控制布鲁菌病的流行至关重要。

