山桐子蛋白提取工艺优化及功能特性研究
杨文清, 罗 凯, 陈耀兵
(湖北民族大学生物与食品工程学院1, 恩施 445000)
(湖北民族大学林学园艺学院2,恩施 445000)
山桐子(IdesiapolycarpaMaxim.),别名油葡萄、水冬瓜、椅桐,属水杨科。山桐子是高大落叶乔木,是一种极具开发利用价值的木本食用油料作物[1]。山桐子果实含油率高达36.71%,亚油酸质量分数超过60%,有“树上油库”的美称,主要分布于湖北、云南、贵州和四川等地[2]。山桐子中的营养成分十分丰富,富含蛋白质、黄酮、多酚和油脂等,并且发现山桐子在不同的生长时期以及不同生长部位的营养成分含量会有所差异[3-5]。
山桐子粕是山桐子榨油后的副产物,其产量为60%以上,常被作为动物饲料和土壤堆肥[6]。山桐子粕脱脂粉中蛋白质量分数超过10.66%,而蛋白质对人体健康发挥着至关重要的作用。已有研究证明不同植物源蛋白具有不同的功能活性,如黑种草蛋白的抗氧化活性和抗糖尿病活性、沙棘籽粕蛋白的抗疲劳活性,辣木籽蛋白有益于抗菌、抗氧化、抗病毒、抗糖尿病、保肝、抗癌和心脏保护活性,而这些功能活性在生物医药、功能性食品等方面具有潜在应用价值[7-9]。目前,植物蛋白的制备研究主要采用碱提酸沉法,不仅具有操作简单、成本低廉以及产量较高等优点,还能够最大程度地降低提取过程中蛋白质变性的发生风险[10]。
近年来,国内外对山桐子的研究主要集中在油脂提炼及其营养品质分析[11-14]。关于山桐子蛋白的研究仍停留在果实中蛋白含量的初步测定,并发现山桐子种子中蛋白质含量高于山桐子果肉[15]。因此,为了提高山桐子粕资源的利用率,本实验采用碱提酸沉法对山桐子粕中蛋白质的提取工艺进行优化并对其功能性质进行研究,以对山桐子的综合开发利用提供技术支持。
1 材料与方法
1.1 材料与仪器
山桐子粕(湖北恩施山桐子榨油后的饼粕);正己烷、NaOH、浓盐酸、磷酸等,均为分析纯。
SH220F型石墨消解仪,K9860型凯氏定氮仪,YB-150型粉碎机,DF-101S型集热式恒温加热磁力搅拌器,UV-8000H型紫外可见分光光度计,Neofuge15型高速离心机,HZP-T502型pH计,SCIENTZ-100F/A型冷冻干燥机。
1.2 山桐子蛋白的提取工艺
1.2.1 原料预处理
将榨油后的山桐子饼粕用粉碎机粉碎过80目筛,得到山桐子饼粕粉。将山桐子饼粕粉用正己烷以1∶5(g/mL)料液比在磁力搅拌器上脱脂2 h后进行抽滤,取滤渣于通风橱通风48 h,得到山桐子脱脂粉。
1.2.2 蛋白质提取工艺流程
山桐子蛋白采用碱溶酸沉法进行提取[16,17]。将山桐子脱脂粉与一定浓度的NaOH溶液按照一定比例进行混合,放置于磁力搅拌器中在一定温度下搅拌一段时间后离心(8 000 r/min,15 min),除去不溶性物质收集上清液,即山桐子蛋白溶液。用考马斯亮蓝法测定上清液中蛋白质的含量并计算蛋白质提取率。用1 mol/L的HCl溶液将得到的山桐子蛋白溶液pH调至3.2进行酸沉,研究确定山桐子蛋白等电点为3.2,室温下静置2 h后离心(8 000 r/min,10 min),收集沉淀,用超纯水洗涤至中性,再用冷冻干燥机干燥24 h后得到山桐子蛋白。
1.3 蛋白质含量、纯度、提取率及得率的测定
山桐子脱脂粉中总蛋白质含量和山桐子蛋白纯度的测定按照GB 5009.5—2016《食品中蛋白质的测定》中的凯氏定氮法进行测定。
提取液中蛋白质含量测定采用考马斯亮蓝法在595 nm处测定吸光度,用牛血清白蛋白制作标准曲线,得到牛血清白蛋白质量浓度与吸光度值之间的标准曲线:y=0.006 8x+0.026 8,R2=0.995,其中y为吸光度值,x为蛋白质量浓度(μg/mL)。蛋白质提取率和得率按照式(1)、式(2)进行计算[18]:

(1)
山桐子蛋白得率=
(2)
1.4 单因素实验
研究NaOH浓度、温度、液料比和时间对山桐子蛋白质提取率的影响。NaOH浓度选取0.010、0.025、0.050、0.075、0.100 mol/L;温度选取35、45、55、65、75 ℃;液料比选取45∶1、50∶1、55∶1、60∶1、65∶1;时间选取1.5、2.0、2.5、3.0、3.5 h。
1.5 响应面实验
在单因素的基础上采用BOX-Behnken实验设计,确定响应面的四因素三水平,以蛋白质提取率为响应值,对NaOH浓度、温度、液料比和时间这4个因素进行优化,以获取蛋白质提取的最优工艺方案。响应面设计因素及水平见表1。

表1 BOX-Behnken实验设计因素水平
1.6 山桐子蛋白质等电点测定
参考王标诗等[19]方法,略作修改。将山桐子脱脂粉与0.06 mol/L的NaOH溶液以1∶55料液比进行混合,置于磁力搅拌器中53 ℃提取2 h,冷却至室温后离心(8 000r/min,15 min)取上清液。分别取30 mL上清液于8个50 mL的烧杯中,分别用1 mol/L的HCl溶液调节pH为2.4、2.6、2.8、3.0、3.2、3.4、3.6、3.8,室温静置2 h后,8 000 r/min离心10 min,用考马斯亮蓝法测定上清液蛋白质含量。
1.7 山桐子蛋白性质测定
1.7.1 持水性测定

(3)
式中:m0为样品质量/g;m1为样品和离心管的质量/g;m2为吸水后样品与离心管的质量/g。
1.7.2 持油性测定
参考Das等[21]方法,略作修改。取1 g样品与20 mL大豆油于离心管中混合均匀,分别放在25、35、45、55、65 ℃的磁力搅拌器中搅拌30 min,待蛋白质充分吸油后离心(4 000 r/min,10 min)。将离心管45°倒置15 min,将沉淀与大豆油分离。根据式(4)计算蛋白质的持油性(OBC)。
(4)
式中:ma为样品质量/g;mb为样品和离心管的质量/g;mc为与油结合后样品与离心管的质量/g。
1.8 山桐子蛋白抗氧化活性测定
1.8.1 DPPH自由基清除率的测定
参考刘晶等[22]方法,略作修改。取2 mL不同质量浓度的蛋白样品溶液(0.8、1.0、1.2、1.4、1.6、1.8、2.0 mg/mL)与2 mL DPPH溶液(0.1 mmol/L DPPH溶于无水乙醇)混合均匀,在室温条件下,避光放置30 min,在517 nm处测量吸光度为A1。样品对照组用超纯水代替DPPH溶液,测定吸光值为A2;空白组用超纯水代替样品溶液,测定吸光值为A0;以超纯水作为调零液,VC作为阳性对照。计算公式为:

(5)
式中:A0为空白组(2 mL超纯水+2 mL DPPH溶液)吸光度;A1为样品组(2 mL蛋白样品溶液+2 mL DPPH溶液)吸光度;A2为样品对照组(2 mL蛋白样品溶液+2 mL超纯水)吸光度。
1.8.2 ABTS自由基清除率的测定
参考张子木等[23]方法,略作修改。将7 mmol/L ABTS水溶液与2.45 mmol/L过硫酸钾溶液等体积混合,放置4 ℃冰箱过夜16 h,使用时将ABTS混合液用超纯水稀释至吸光度为0.70±0.02。取0.2 mL不同质量浓度的蛋白样品溶液(40、80、120、160、200、240、280、320、360、400 μg/mL)加入4 mL ABTS稀释液,避光反应6 min,在734 nm处测定吸光值为A1;样品对照组用超纯水代替ABTS稀释液,测定吸光度为A2;空白组用超纯水代替蛋白样品溶液测定吸光度为A0。VC作为阳性对照。

(6)
式中:A0为空白组(0.2 mL超纯水+4 mL ABTS稀释液)吸光度;A1为样品组(0.2 mL蛋白样品溶液+4 mL ABTS稀释液)吸光度;A2为样品对照组(0.2 mL蛋白样品溶液+4 mL超纯水)吸光度。
1.9 数据分析
每组实验做3组平行,数据均以平均值±标准差表示。采用Design-Expert 13软件进行响应面设计和统计结果分析,Origin2023b和GraphPad Prism9.0.0进行数据绘图和显著性分析。
2 结果与分析
2.1 山桐子蛋白质含量、纯度及得率的测定结果
采用凯氏定氮法测得的山桐子粕中蛋白质质量分数为8.5%;山桐子粕脱脂粉中蛋白质质量分数为10.66%;山桐子蛋白的纯度为54.81%;采用响应面最优方案得到的山桐子蛋白得率为39.13%。
2.2 单因素实验结果
2.2.1 NaOH溶液浓度对蛋白质提取率的影响
由图1可知,当碱液浓度为0.01~0.05 mol/L时,蛋白质提取率随着碱液浓度升高而显著增加,当碱液浓度为0.05 mol/L时,蛋白质提取率达到73.27%。这是因为碱液可以破坏蛋白质分子的次级键尤其是氢键,促使蛋白质分子溶出,使蛋白质提取率增加。而随着碱液浓度继续增加,蛋白质提取率呈小幅度升高状态,这可能是因为过高的碱液浓度会导致蛋白质变性或过度水解,甚至会溶出一些非蛋白类物质(如多糖、水不溶性纤维等)干扰蛋白质的测定,造成的蛋白质提取率虚高[24]。因此碱提法提取蛋白质最佳的碱液浓度应该控制在0.05 mol/L左右。

图1 单因素实验结果
2.2.2 温度对蛋白质提取率的影响
由图1可知,随着提取温度的增加,蛋白质提取率先升高后降低。温度为35~55 ℃时,山桐子蛋白提取率呈上升趋势,当提取温度为55 ℃时,蛋白提取率达到最大值为79.12%。这是因为温度升高,分子间的运动加剧,增加了分子间的有效碰撞,加快了蛋白质的溶出速率。当提取温度高于55 ℃时,提取率随着温度的增加而逐渐降低,这可能是因为温度过高达到了某些蛋白质的变性温度,从而影响了蛋白提取率。因此蛋白质的提取温度应控制在55 ℃左右。
2.2.3 液料比对蛋白质提取率的影响
由图1可知,随着液料比的增加,蛋白质提取率先升高后降低。当液料比为55∶1时,蛋白质提取率达到最高为77.78%,与液料比为40∶1时的提取率有显著性差异。这是因为当液料比较低时,由于山桐子粕中还含有一些多糖类物质分散在提取液中,导致提取液的黏稠度较大,抑制了蛋白质的溶出速率。随着液料比的增大,提取液的黏稠度逐渐变小,分子扩散速率增大,进而使得蛋白质的提取率增大。当液料比大于55∶1时,蛋白质溶解量已经达到了一定平衡,过高的浸提液体积不利于蛋白质沉淀的获取,增加了蛋白质浓缩过程中的困难。因此蛋白质的液料比应控制在55∶1左右。
2.2.4 时间对蛋白质提取率的影响
由图1可知,随着提取时间的增加,山桐子蛋白提取率先增加后降低。当提取时间在1.5~2.0 h时,蛋白质提取率显著增加;当提取时间为2.5 h时,蛋白质提取率达到最大值为76.28%,这可能是因为蛋白质在溶液中的溶解量达到了饱和状态。当提取时间超过2.5 h时,蛋白质的提取率呈降低的趋势,蛋白质长时间处于碱性条件可能会导致蛋白质的过度水解和变性,甚至会溶出其他物质(如多糖),降低蛋白质的提取纯度。因此,从经济角度出发,蛋白质的提取时间应控制在2.5 h左右。
2.3 响应面分析法优化山桐子蛋白提取工艺
2.3.1 响应面实验方案设计及结果分析
以NaOH浓度、温度、液料比和时间为因素,蛋白提取率为指标,响应面中Box-Behnken实验方案和结果见表2,对表2的数据经回归拟合后得到回归方程:

表2 响应面方案设计及结果
提取率=77.09+5.26A+1.60B+2.01C-0.981 7D-2.78AB-6.78AC+0.845 0AD+8.10BC-0.502 5BD+0.382 5CD-9.51A2-3.66B2-3.16C2+4.46D2
由Design Expert进行回归分析和方差分析结果如表3所示,由方差分析可知,模型的F=52.28,P<0.000 1,表明实验模型极显著,实验设计方案可靠,具有统计学意义。失拟项P=0.593 9,说明回归模型失拟项不显著。模型相关系数R2=0.981 2、Radj=0.962 5说明模型的拟合度好,预测值与实际值有良好的相关性,能够解释96.25%响应值的变化,可用于分析预测山桐子蛋白提取的最佳工艺及提取率。对该系数模型回归检验可知:因素A、B和C的P值<0.01,说明NaOH浓度、温度和液料比对蛋白质提取率的影响是极显著的。因素D的P值<0.05,说明时间对蛋白质提取率的影响是显著的。由F值可以看出各因素影响蛋白提取率的主次顺序为:A(NaOH浓度)>C(液料比)>B(温度)>D(时间)。

表3 回归模型与方差分析结果
2.3.2 响应面分析
通过Design-Expert 13软件分析得出山桐子蛋白提取的最佳工艺参数为:NaOH浓度0.059 mol/L、温度53.284 ℃、液料比53.138∶1.000、时间2.026 h,在此条件下,山桐子蛋白理论提取率为82.485%。基于实验条件的考量,确定最佳工艺优化条件为NaOH浓度为0.06 mol/L、温度为53 ℃、液料比为55∶1、时间为2.0 h。在该条件下通过3次平行实验验证得出山桐子蛋白实际提取率为81.98%,与理论值无显著性差异,说明该模型可用于预测山桐子蛋白的提取。
2.4 山桐子蛋白等电点
由图2可看出,山桐子蛋白等电点在2.4~3.8的范围内,经测定当pH为3.2时,上清液中蛋白含量最低。这是因为溶液中蛋白质分子在酸性条件下相互作用变强并形成聚集体,使蛋白质沉淀,故选用pH=3.2作为山桐子蛋白的等电点。由于等电点代表特定的蛋白质具有最低溶解度的pH值,因此在获取蛋白质过程中确定蛋白质等电点是至关重要的[25]。
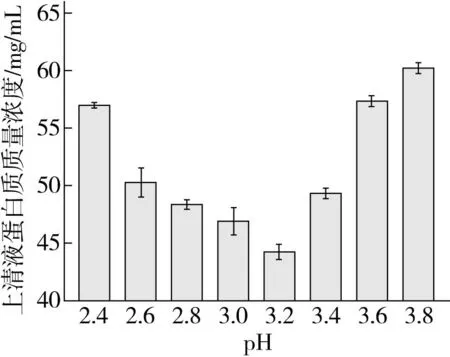
图2 山桐子蛋白等电点测定
2.5 温度对山桐子蛋白持水性和持油性的影响结果
2.5.1 温度对山桐子蛋白持水性的影响
由图3可知,温度在25~35 ℃范围内,山桐子蛋白的持水性随着温度升高而升高。当温度在35 ℃时,山桐子蛋白持水性达到最高为5.21 g/g;当温度在35~65 ℃范围内,持水性呈下降趋势,这可能是因为蛋白质开始发生变性,导致分子构象发生变化,从而导致蛋白质的水合作用减弱。与牡丹籽种子蛋白(3.55 g/g)和大豆蛋白(4.13 g/g)相比,山桐子蛋白表现出更高的持水性[26,27]。蛋白质的持水性主要取决于其氨基酸的类型,极性氨基酸越高,WHC越高,当其应用于食品加工时有助于减少水分的流失,从而改善食物的味道[28,29]。

图3 温度对山桐子蛋白持水性和持油性的影响
2.5.2 温度对山桐子蛋白持油性的影响
由图3可知,温度在25~35 ℃的范围内,山桐子蛋白的吸油能力呈上升趋势。温度为35 ℃时,山桐子蛋白的吸油能力达到最高值为1.82 g/g。当温度为35~65 ℃时,山桐子蛋白的吸油性随着温度的升高而降低,这可能是因为油的黏度会随温度升高而降低,致使油脂分子的流动性增强,从而导致与蛋白质的结合能力降低。与杏仁蛋白、大豆蛋白和豌豆蛋白相比,山桐子蛋白的持油性较低,与油脂等疏水性物质的相互作用较小[30,31]。
2.6 抗氧化能力测定
2.6.1 DPPH自由基清除能力
DPPH是一种稳定的自由基,与抗氧化物质反应后会由深紫色变成浅黄色,常被用于探索化合物作为自由基清除剂的能力[32]。由图4a可知,山桐子蛋白的DPPH自由基清除能力随着蛋白质量浓度的增大而增大,说明山桐子蛋白质量浓度对DPPH自由基清除率的影响较大。当山桐子蛋白质量浓度为2.0 mg/mL时,DPPH自由基清除率达到最大值93.64%;当山桐子蛋白质量浓度为1.2 mg/mL时,DPPH自由基清除率超过50%。与大豆分离蛋白相比,山桐子蛋白显示出更优异的DPPH自由基清除能力[33]。抗氧化化合物可用于功能食品、化妆品和制药行业,这是因为它们可以预防和降低多种疾病的发生风险(如心脑血管疾病、神经退行性疾病)[34]。

图4 山桐子蛋白抗氧化能力的测定
2.6.2 ABTS自由基清除能力
ABTS自由基清除能力常作为抗氧化物质总抗氧化能力的测定指标,测定抗氧化物质的电子转移能力[35]。ABTS溶液呈蓝绿色,当抗氧化剂与ABTS溶液发生反应时,会使ABTS溶液褪色,抗氧化能力越强,ABTS溶液褪色越明显。由图4b可知,山桐子蛋白质量浓度与ABTS自由基清除能力呈正相关,随着山桐子蛋白质量浓度的增加,ABTS自由基清除能力增强。当山桐子蛋白质量浓度为200 μg/mL时,ABTS自由基的清除率达到56.86%。尽管山桐子蛋白的ABTS自由基清除率低于VC,但与其他植物(紫苏籽粕)蛋白相比,仍显示出较高的ABTS自由基清除活性,说明山桐子蛋白中含有与ABTS自由基清除相关的活性成分[36]。
3 结论
在单因素的基础上,利用响应面分析法优化了碱溶酸沉法提取山桐子蛋白的工艺条件。最终确定最佳工艺条件为:NaOH浓度为0.06 mol/L、温度为53 ℃、液料比为55∶1、时间为2.0 h,此时山桐子蛋白提取率为81.98%,山桐子蛋白得率为39.13%。4个因素对山桐子蛋白提取率的影响为NaOH浓度>液料比>温度>时间。山桐子蛋白具有良好的持水性和持油性。山桐子蛋白等电点为pH 3.2;山桐子蛋白在35 ℃时的持水性和持油性最好。通过体外抗氧化活性测定发现山桐子蛋白具有良好的抗氧化活性,为未来功能食品的研发以及山桐子蛋白水解产物的探索提供一定的基础。

