Th1/Th2细胞因子与原发性肝癌腹腔镜手术治疗预后的关系
肖雷,蒋亚新,许家亮,李海春
(信阳市中心医院 肿瘤外科三病区,河南 信阳 464200)
腹腔镜切除术为治疗早期原发性肝癌的主要手段,可将肿瘤完整切除并保留足够维持功能的肝组织,但由于肝脏具有特殊的供血功能,使得癌细胞极易附着在血管内壁,导致术后复发、转移,影响患者预后[1-2]。因此,探究与原发性肝癌腹腔镜手术治疗预后有关的指标具有重要意义。研究表明,辅助性T淋巴细胞亚群与肿瘤的转移密切相关,其中Th1、Th2细胞因子的分泌平衡对免疫功能起到主要介导作用,在抗肿瘤免疫、肿瘤免疫逃逸等方面发挥重要作用[3]。推测Th1/Th2细胞因子的表达与原发性肝癌腹腔镜手术患者的预后具有一定关系。基于此,本研究通过对比原发性肝癌腹腔镜手术治疗患者术前、术后Th1/Th2细胞因子表达情况,探讨Th1/Th2细胞因子表达与预后的关系。
1 资料与方法
1.1 一般资料
采用前瞻性研究,选取2018年12月至2021年12月于信阳市中心医院拟行腹腔镜手术的原发性肝癌患者为研究对象。纳入标准:(1)符合《原发性肝癌诊疗规范(2017年版)》[4]中原发性肝癌诊断标准;(2)Ⅰ期及Ⅱa期;(3)符合腹腔镜手术指征且同意手术;(4)患者及家属知情同意。排除标准:(1)合并其他恶性肿瘤;(2)已接受过抗肿瘤治疗;(3)合并肝、肾等器官功能不全;(4)妊娠期或哺乳期;(5)合并血液系统、免疫系统疾病;(6)合并精神、认知障碍。本研究经医院伦理委员会审批通过(20230415)。
1.2 手术方法
所有患者术前均接受血常规、心电图等检查排除手术禁忌,并接受CT或MRI检查明确切除平面及体积,在气管插管全身麻醉下接受手术。患者取仰卧位,于脐下5~6 cm处做1 cm切口,将套管置入并建立二氧化碳气腹,将腹压设定在15 mmHg并维持,置入腹腔镜探查病灶手术可行性,明确病变位置并初步评估大小;确定手术可行性并确定预切线后,在腹腔镜引导下于左右上腹部分别置入2个套管作主、副操作孔;使用超声刀沿预切线将肝实质及周围部分正常肝组织离断,并应用电凝刀或缝扎法对出血点进行止血操作;将切除标本沿切口取出后清洗断面,检查无出血后喷洒生物蛋白胶并放置腹腔引流管。
1.3 资料收集及指标检测
(1)统计所有患者一般资料,包括性别、年龄、体重指数、分期(Ⅰa期、Ⅰb期、Ⅱa期);(2)检测术前、术后1周Th1细胞因子、Th2细胞因子表达水平以及外周血Th1、Th2细胞频数,并计算Th1/Th2比值。具体检测方法:所有患者均于清晨接受空腹静脉血清检查,抽取4 mL静脉血,以8 cm离心半径、4 000 r·min-1离心10 min,将离心后血清置于-80 ℃冰箱进行保存,于室温解冻后取2 mL采用酶联免疫吸附法检测Th1型细胞因子[干扰素-γ(interferon-γ,IFN-γ)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)]、Th2细胞因子[白细胞介素-4(interleukin-4,IL-4)、白细胞介素-10(interleukin-10,IL-10)],另取200 μL外周血加入等体积1640培养液等比稀释,分别加入各细胞因子单克隆抗体混匀并洗涤后,采用流式细胞仪(深圳迈瑞生物医疗电子股份有限公司,型号BriCyte E6)检测Th1、Th2细胞频数,计算Th1/Th2比值。
1.4 预后判定
所有患者术后均接受门诊随访,每3个月随访1次。将经影像学检查且经由活检病理确诊复发、转移,且经由活检病理确诊的患者判定为复发、转移,与随访期间因癌症死亡的患者共同纳入为预后不良组;将剩余患者纳入预后良好组。
1.5 统计学方法
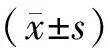
2 结果
2.1 预后情况
在1 a随访期间,92例患者23例出现复发、转移或病死,纳入预后不良组;69例患者病情稳定,未出现复发、转移,纳入预后良好组。
2.2 一般资料
两组患者性别、年龄、体重指数对比,差异无统计学意义(P>0.05);预后不良组Ⅱa期患者占比高于预后良好组,差异有统计学意义(P<0.05)。见表1。
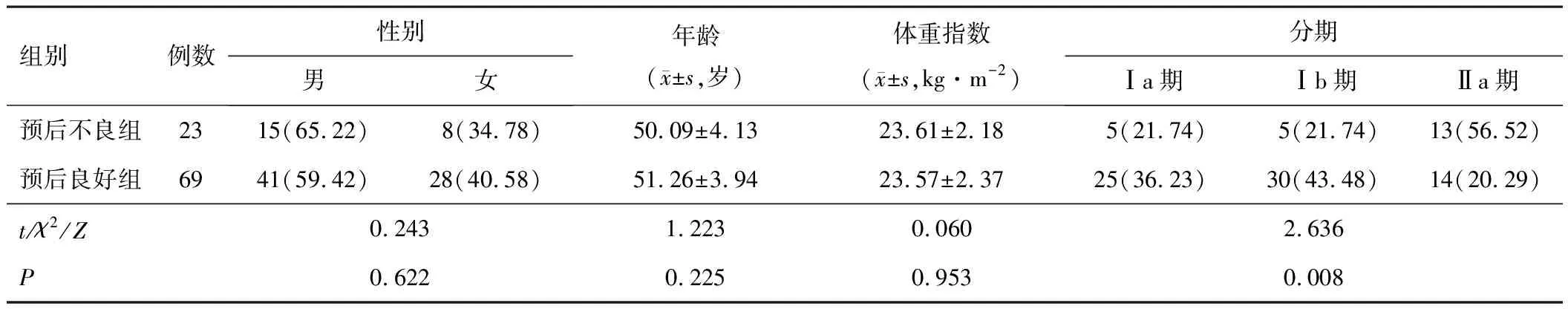
表1 两组患者一般资料对比
2.3 Th1细胞因子、Th2细胞因子表达水平对比
两组术前、术后1周的IFN-γ、IL-10对比,差异无统计学意义(P>0.05);预后不良组术前、术后1周TNF-α均低于预后良好组,IL-4高于预后不良组,差异有统计学意义(P<0.05)。见表2。
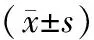
表2 术前和术后1周两组Th1细胞因子、Th2细胞因子表达水平对比
2.4 Th1、Th2细胞频数及Th1/Th2对比
两组术前、术后1周的Th1、Th2细胞频数对比,差异无统计学意义(P>0.05),预后不良组术前、术后1周的Th1/Th2均低于预后良好组,差异有统计学意义(P<0.05)。见表3。
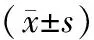
表3 术前和术后1周两组Th1、Th2细胞频数及 Th1/Th2对比
2.5 TNF-α、IL-4、Th1/Th2与预后相关性分析
将原发性肝癌患者腹腔镜手术前、术后1周的IL-4、TNF-α、Th1/Th2作为自变量(连续变量),将患者随访预后情况作为因变量(有序分类变量:预后良好=0,预后不良=1),经点二列相关性分析显示,原发性肝癌患者腹腔镜手术预后与术前、术后1周的IL-4水平呈正相关关系(r>0,P<0.05),与术前、术后1周的TNF-α、Th1/Th2水平呈负相关关系(r<0,P<0.05)。见表4。

表4 原发性肝癌腹腔镜手术患者预后与TNF-α、IL-4、 Th1/Th2的相关性分析结果
3 讨论
由于肝组织内有丰富的血窦,肿瘤细胞极易侵犯门静脉分支,形成癌栓导致肝内散播并通过人体循环转移至各个部位,原发性肝癌患者腹腔镜切除术后极易出现复发、转移,影响预后[5]。因此,若能尽早识别术后复发、转移风险并进行早期干预,或可在一定程度上降低复发、转移发生率。有研究表明,机体免疫功能与肿瘤细胞的出现、生长及发展密切相关,Th细胞为参与免疫调节的重要细胞,包括Th1、Th2两个不同亚群,若二者失衡,可导致免疫功能失调,进而影响机体抗肿瘤免疫功能[6-7]。基于此,推测Th1/Th2细胞因子与原发性肝癌腹腔镜切除术治疗预后具有一定相关性。
本研究结果表明,原发性肝癌腹腔镜手术治疗后Th1型、Th2型细胞因子表达水平均降低,并且与预后良好患者比较,预后不良患者存在IL-4高表达情况,且经点二列相关性分析表明IL-4表达与原发性肝癌腹腔镜手术治疗预后呈负相关性。分析其原因,IL-4为活化的Th2细胞分泌的具有多种生物学功能的细胞因子,主要介导体液免疫反应,可直接作用于肿瘤细胞促进细胞生长,并能够促进Th2的极化反应并维持其免疫反应,降低效应T细胞的肿瘤杀伤活性进而损害患者自身的肿瘤免疫功能[8-9]。部分原发性肝癌患者在腹腔镜手术治疗后仍有肿瘤细胞存在于病灶周围的微血管,此时IL-4水平的升高表明效应T细胞的肿瘤杀伤活性受到抑制,肿瘤细胞得以进一步发展[10]。因此,IL-4高表达与原发性肝癌腹腔镜手术患者治疗预后有关。
本研究还显示,与预后良好患者比较,预后不良患者存在TNF-α、Th1/Th2低表达情况,且经点二列相关性分析发现TNF-α、Th1/Th2低表达与原发性肝癌腹腔镜手术治疗预后不良具有正相关性。分析其原因,TNF-α为一种多效细胞分子,当TNF-α三聚体与靶细胞膜在胞外区结合可将抑制蛋白释放,向细胞核传递信息,从而产生应答,改变血管内皮细胞特性,损伤内皮细胞或导致血管功能紊乱,造成肿瘤细胞的局部血流阻断而发生出血、缺氧坏死[11-12]。因此,术后TNF-α低表达表明肿瘤细胞无法得到抑制,进而影响腹腔镜手术治疗预后。Th1型细胞通过分泌IFN-γ、TNF-α等细胞因子诱导免疫应答,从而引起效应T细胞介导的细胞免疫,当其细胞因子占优势可增强抗肿瘤免疫;而Th2细胞可通过分泌IL-4、IL-10等细胞因子引起较强的抗体反应介导体液免疫,能够对Th1细胞的增殖分化起到抑制作用,从而减弱机体抗肿瘤免疫功能,当其细胞因子占优势可增强肿瘤免疫耐受[13]。正常情况下,机体内的Th1、Th2型细胞处于动态平衡状态,当Th1/Th2出现低表达,表明Th1型细胞受到Th2型细胞的过度抑制,肿瘤免疫耐受增强,抗肿瘤免疫功能减退[14]。因此,Th1/Th2表达与腹腔镜手术治疗预后密切相关。此外,本研究对比两组患者一般资料发现,预后不良组Ⅱa期患者占比高于预后良好组,提示分期可能与原发性肝癌腹腔镜手术治疗预后不良有关,但考虑本研究目的,加之分期与预后的关系已有其他研究证实,故而本研究未进行进一步相关性分析,这也为本研究局限性所在,未来可进一步研究完善结论。
4 结论
与术前相比,原发性肝癌腹腔镜手Th1/Th2细胞因子表达水平降低,且术后低表达与原发性肝癌腹腔镜手术治疗预后不良具有相关性。

