糖尿病患者血脂管理中国专家共识(2024 版)
中国医师协会内分泌代谢科医师分会 国家心血管病专家委员会心血管代谢医学专业委员会
糖尿病是动脉粥样硬化性心血管疾病(ASCVD)的重要独立危险因素,血脂异常在糖尿病患者的ASCVD 发生和发展中起关键作用。目前我国糖尿病患者中血脂异常患病率高且控制现状不容乐观。因此,为了加强糖尿病患者的血脂管理,中国医师协会内分泌代谢科医师分会和国家心血管病专家委员会心血管代谢医学专业委员会组织专家,根据中国糖尿病患者的血脂管理现状,参考国内外新的循证证据和指南,制定了《糖尿病患者血脂管理中国专家共识(2024 版)》。本共识内容涵盖糖尿病患者的血脂谱特点和血脂异常流行病学现状以及糖尿病全人群的ASCVD 危险分层和血脂管理流程,首次将低密度脂蛋白胆固醇(LDL-C)与非高密度脂蛋白胆固醇(非HDL-C)均作为糖尿病患者血脂干预的首要靶点,并对糖尿病特殊人群(包括儿童和青少年、≥75 岁老年人以及合并慢性肾脏病、代谢相关脂肪性肝病、妊娠的患者)的血脂管理策略进行了推荐。本共识旨在传递重要临床进展,指导临床实践,以改善糖尿病患者的心血管结局。
我国的糖尿病患病率呈不断增长趋势,2011~2021 年我国糖尿病患者人数已从9 000 万增加至1.4 亿[1]。糖尿病危害巨大,是动脉粥样硬化性心血管疾病(arteriosclerotic cardiovascular disease,ASCVD)的重要独立危险因素,而ASCVD 又是糖尿病患者的常见并发症和主要死亡原因。在糖尿病患者尤其2 型糖尿病(type 2 diabetes mellitus,T2DM)患者中,血脂异常的患病率明显高于非糖尿病人群[2],血脂异常是ASCVD 发生、发展和恶化的首要危险因素。
对于糖尿病患者,血脂异常干预应以降低ASCVD 风险为主要目标,但目前国内尚缺乏专门针对糖尿病全人群[1 型糖尿病(type 1 diabetes mellitus,T1DM)和 T2DM 患者,≥40 岁及<40 岁患者]合并动脉粥样硬化风险相关血脂异常的指南或共识。近年来,大量流行病学和临床干预研究结果相继公布,相关临床研究证据也在不断积累和丰富。为更好地规范我国糖尿病患者的血脂管理,中国医师协会内分泌代谢科医师分会和国家心血管病专家委员会心血管代谢医学专业委员会组织相关领域的专家,总结国内外研究进展和专家经验,制定了《糖尿病患者血脂管理中国专家共识(2024 版)》。
本共识将证据级别分为A、B、C 三级。A 级:证据基于多项随机对照试验或Meta 分析;B 级:证据基于单项随机对照试验或多项非随机对照试验;C级:证据基于专家共识意见和(或)基于小规模研究、回顾性研究和注册研究结果。
1 糖尿病患者的血脂谱特点及心血管危害
1.1 T2DM 患者的血脂谱特点
1.1.1 血脂异常的特征
T2DM 患者的血脂谱以混合型血脂紊乱多见,包括:(1)空腹和餐后高甘油三酯(triglyceride,TG)血症以及高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)水平降低;(2)血清总胆固醇(total cholesterol,TC)和低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)水平正常或轻度升高;(3)低密度脂蛋白(low-density lipoprotein,LDL)颗粒亚型发生改变,小而密低密度脂蛋白(small dense low-density lipoprotein,sdLDL)颗粒增加[3-5]。
1.1.2 血脂异常的主要原因
T2DM 患者血脂异常的主要原因在于其存在胰岛素抵抗、胰岛素相对缺乏等导致体内游离脂肪酸水平升高,肝脏合成极低密度脂蛋白(very lowdensity lipoprotein,VLDL)的底物增加,同时胰岛素依赖性脂蛋白酯酶(lipoprotein lipase,LPL)活性下降,VLDL 清除减少,最终导致TG 和富含TG 的脂蛋白(triglyceride-rich lipoprotein,TRL)水平升高。
糖尿病患者血糖控制不佳时更易导致TG 水平升高。高TG 血症刺激胆固醇酯转运蛋白活性,显著增加TG 和胆固醇酯在TRL 与LDL 及高密度脂蛋白(high-density lipoprotein,HDL)之间的交换,导致LDL 及HDL 颗粒中的TG 含量增加及胆固醇酯减少。随后,当LDL 及HDL 中的TG 被LPL 和肝酯酶水解后,一方面促进了sdLDL 的生成,另一方面加速HDL 的分解代谢,导致HDL-C 水平降低[6-7]。
1.2 T1DM 患者的血脂谱特点
1.2.1 血糖控制不佳的T1DM 患者
其血脂异常通常与T2DM 患者类似,表现为混合型血脂紊乱,以空腹和餐后高TG 血症为主,同时伴有HDL-C 水平降低及sdLDL 水平升高[8]。T1DM 常以糖尿病酮症酸中毒(diabetic ketoacidosis,DKA)起病。DKA 发生期间,由于胰岛素严重缺乏,可以表现为TG 水平显著升高,伴随HDL-C 和LDL-C 水平下降。这些血脂异常经充分的胰岛素治疗后可迅速恢复。
1.2.2 血糖控制良好的T1DM 患者
由于长期使用外源性胰岛素导致外周高胰岛素血症,可引起LPL 活性增加,TG 水平正常或降低,HDL-C 水平正常或升高。高胰岛素血症可能上调LDL 受体,从而促进LDL 的清除,LDL-C 水平可能下降[9]。但部分研究显示,T1DM 患者即便血糖控制良好,其sdLDL 水平仍高于正常人群[8]。
1.3 糖尿病患者的血脂异常与ASCVD 风险
1.3.1 LDL-C 水平
在糖尿病患者血脂异常所带来的心血管风险中,LDL-C 是公认的首要危险因素。2008 年,针对T2DM 患者的UKPDS 研究结果显示,LDL-C 水平每升高1.0 mmol/L,T2DM 患者的冠状动脉事件发生风险增加57%[10]。2016 年,针对T1DM 患者的DCCT 研究结果同样提示,校正年龄和糖化血红蛋白(glycated hemoglobin,HbA1c)等危险因素后,T1DM 患者的LDL-C 水平每升高0.56 mmol/L,主要不良心血管事件(major adverse cardiovascular events,MACE)发生风险增加7%[11]。此外,糖尿病患者的sdLDL 水平升高,sdLDL 因在血液中循环时间长、更易进入动脉血管内膜下并滞留,最终被巨噬细胞吞噬形成泡沫细胞,因此,sdLDL 较LDL 具有更强的致动脉粥样硬化作用。
1.3.2 非HDL-C 水平
临床流行病学研究结果显示,高TG 血症与糖尿病患者的动脉粥样硬化密切相关,是心血管残余风险的主要危险因素之一[11-13]。糖尿病患者TG 水平升高实际反映的是TRL 颗粒增加和非HDL-C 水平升高,而非HDL-C 代表了全部致动脉粥样硬化脂蛋白颗粒中的胆固醇。既往研究表明,非HDL-C水平较LDL-C 水平能更好地预测ASCVD 风险[14]。一项Meta 分析结果提示,非HDL-C 水平与T2DM患者的心血管疾病风险相关,在男性和女性患者中的HR值分别为1.98(95%CI:1.70~2.30)和1.63(95%CI:1.35~1.96)[15]。
2 糖尿病患者合并ASCVD 相关血脂异常的流行病学
2.1 T2DM 患者
中国T2DM 患者合并血脂异常的比例高于普通人群,同时血脂异常的知晓率、治疗率、达标率低,患者常因自觉症状不明显而未得到充分的治疗和控制。在评估中国T2DM 患者心血管危险因素的CCMR-3B 研究中,对全国104 家医院共25 817 例门诊T2DM 患者的血脂异常调查结果显示,42%的T2DM 患者合并血脂异常,其中仅55%接受了调脂治疗,四项血脂指标均达标(TC<4.5 mmol/L、TG<1.5 mmol/L、LDL-C<2.6 mmol/L、HDL-C>1.04 mmol/L)的患者比例仅为12%,其中TC、TG、HDL-C、LDL-C 达标率分别为36.1%、46.6%、71.9% 和42.9%[16]。另一项针对全国主要城市的20 家三级医院内分泌科门诊共4 807 例40~75 岁T2DM 患者的横断面研究显示,血脂异常的比例高达67.1%;在血脂异常的T2DM 患者中,知晓率和治疗率分别为68.7%和55.9%,LDL-C 达标(<2.6 mmol/L)率为39.4%,非HDL-C 达标(<3.37 mmol/L)率为35.9%[17]。
我国开展的多项全国性多中心研究结果大致反映了当前T2DM 患者中血脂异常的患病及控制情况不容乐观(附表1),该类患者应特别注意血脂的总体管理,及早干预血脂异常和预防ASCVD。
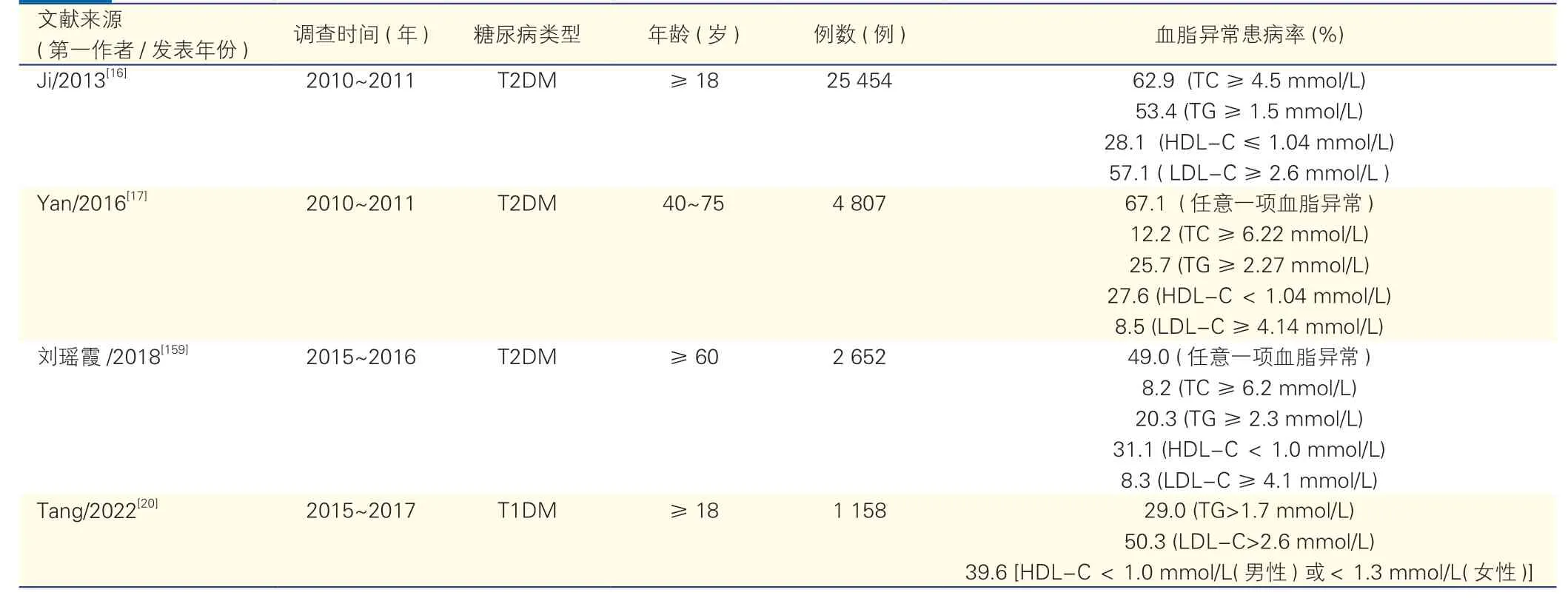
附表1 中国糖尿病患者中血脂异常患病率的流行病学调查结果
除了血脂异常患病率高之外,我国T2DM 患者的血脂异常还表现出地域差异,可能与各地区经济发展水平、自然条件和居民生活习惯不同有关。西北地区由于经济水平和医疗条件相对较差,患者对疾病的自我重视程度低,加之高碳水化合物、高脂饮食等因素,T2DM 患者中血脂异常的患病率高于其他地区[18]。
2.2 T1DM 患者
心血管疾病是T1DM 患者死亡的主要原因之一。一项纳入了26 项研究的Meta 分析结果显示,与非糖尿病人群相比,男性T1DM 患者中冠心病标化死亡率增加了5.62 倍,女性T1DM 患者中增加了11.32倍[19]。尽管T1DM 患者的ASCVD 风险增加,但关于该人群血脂异常患病率、知晓率和治疗率的大规模研究相对较少。一项针对中国24 个省级行政区共18 976 例新诊断糖尿病患者的横断面调查包含了1 158 例成人T1DM 患者,其结果显示,新诊断成人T1DM 患者中TG>1.7 mmol/L 者占29.0%,LDL-C>2.6 mmol/L 者占50.3%, HDL-C 异常(男性<1.0 mmol/L或女性<1.3 mmol/L)者占39.6%[20](附表1)。
3 糖尿病患者的ASCVD 危险分层与治疗目标
3.1 糖尿病患者的心血管风险评估
由于糖尿病是ASCVD 的重要独立危险因素,血脂异常对糖尿病患者的ASCVD 风险影响最大,因此,其血脂管理目标值设定较非糖尿病人群更为严格。为强调糖尿病患者降脂达标,建议根据其病程长短、是否合并ASCVD 及主要靶器官损害情况,将糖尿病患者分为超高危、极高危和高危(表1),以便对其ASCVD 风险进行评估。

表1 糖尿病患者的ASCVD 危险分层[21]
3.2 糖尿病患者的血脂干预靶点及目标值
3.2.1 血脂干预靶点
糖尿病患者的血脂干预靶点及目标值见表2。
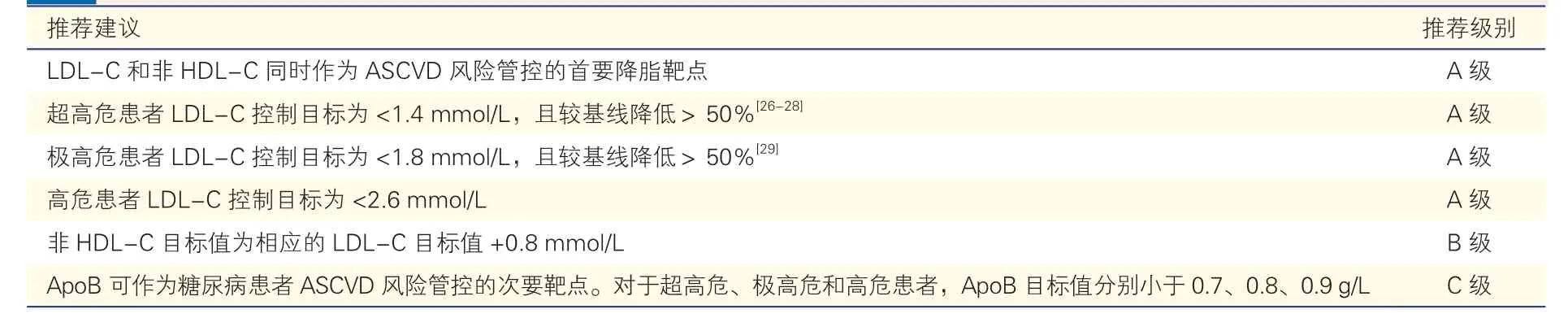
表2 糖尿病患者的血脂干预靶点及目标值推荐建议
3.2.1.1 LDL-C
多数降脂干预研究均采用LDL-C 作为观察降脂效果与ASCVD 风险下降关系的指标。胆固醇治疗试验协作组的一项Meta 分析结果显示,LDL-C每降低1.0 mmol/L 可使糖尿病患者的MACE、心血管死亡和缺血性脑卒中风险分别下降21%、13%和21%,且与基线LDL-C 水平无关[29]。
多项临床研究显示,40~75 岁的T2DM 患者可以从服用他汀类药物中获益。在一级预防研究中,与安慰剂相比,中等强度他汀类药物使LDL-C 降至2.6 mmol/L 以下可显著降低ASCVD 或全因死亡风险[30-31]。T2DM 患者如具有多项ASCVD 危险因素或靶器官损害,相当于具有ASCVD,建议对于这部分糖尿病患者,应使LDL-C 较基线降低>50%,并将LDL-C 目标值定为<1.8 mmol/L[32-34]。在二级预防研究中,他汀类药物联合依折麦布或前蛋白转化酶枯草溶菌素9(proprotein convertase subtilisin/kexin type 9,PCSK9)抑制剂的多项强化降脂研究的分层分析结果显示,LDL-C 如降至1.4 mmol/L以下,T2DM 患者的ASCVD 风险可进一步下降,且合并T2DM 的ASCVD 患者可从强化降脂治疗中获益更多[26-28]。
目前缺乏针对T1DM 患者的降脂干预研究。在心脏保护研究(HPS)中,40 岁以上的T1DM 患者接受他汀类药物治疗的获益与T2DM 患者类似[30],依此推荐其降脂靶点与目标值同T2DM 患者。
在40 岁以下T2DM 和T1DM 患者中,降脂治疗的心血管获益尚缺乏临床研究证据。考虑到40 岁以下糖尿病患者虽然10 年心血管风险低,但余生风险增加,因此40 岁以下糖尿病患者的LDL-C 也应控制在较低水平。此时,应综合考虑糖尿病病程及其他心血管危险因素和靶器官损害情况,在充分讨论治疗风险与获益的基础上,适时启用他汀类药物治疗[35-36]。
3.2.1.2 非HDL-C
仅采用LDL-C 作为糖尿病患者的降脂目标可能会低估ASCVD 风险,非HDL-C 也是糖尿病患者需要管理的首要降脂靶点。非HDL-C 是血浆中的TC减去HDL 中的胆固醇,代表了全部致动脉粥样硬化脂蛋白颗粒中的胆固醇。无论是否接受他汀类药物治疗,非HDL-C 较LDL-C 能更好地反映ASCVD风险[14,37-38]。Meta 分析发现,非HDL-C 降低幅度与ASCVD 风险降低幅度的相关性强于LDL-C降低幅度与ASCVD 风险降低幅度的相关性[39]。此外,目前多采用Friedewald 公式计算 LDL-C 水平,当血浆TG>4.5 mmol/L 或LDL-C<1.8 mmol/L 时,此方法面临一定的挑战[40-41]。由于糖尿病患者血脂异常以高TG 血症为特征,单纯以LDL-C 作为首要目标具有一定的局限性,而非HDL-C 计算简单,结果较稳定,且受血浆TG 水平影响小,因此,非HDL-C 适合与LDL-C 一起作为糖尿病患者的首要降脂靶点。
3.2.1.3 载脂蛋白B(apolipoprotein B,ApoB)
无论颗粒大小,所有致动脉粥样硬化脂蛋白颗粒均含1 个分子ApoB。从理论上而言,ApoB 检测能更准确地反映致动脉粥样硬化脂蛋白颗粒数量。糖尿病易合并高TG 血症,此时ApoB 含量高而LDL-C 水平不高。因此,同时测定ApoB 与LDL-C水平有利于判断糖尿病患者的ASCVD 风险[14,39]。近期的强化降脂研究提示,在控制 LDL-C 和非 HDL-C 的作用后,ApoB 降低幅度能独立预测ASCVD 风险的下降[42]。鉴于目前ApoB 检测成本较高、尚未在临床广泛应用,其可作为糖尿病患者ASCVD 风险干预的次要靶点。
3.2.2 潜在调脂靶点
TG、脂蛋白(a) [lipoprotein(a),Lp(a)]及HDL-C异常均与ASCVD 风险增加有关,但是目前缺乏较强证据支持药物干预这些血脂指标能降低ASCVD风险,因此将其列为糖尿病患者ASCVD 风险管控的潜在调脂靶点,临床也需予以关注。
3.2.2.1 TG
高TG 血症在糖尿病患者中很常见,血浆TG绝大部分位于TRL 中,此时患者表现为残粒胆固醇和非HDL-C 水平升高,这也是TG 水平轻度至中度升高增加ASCVD 风险的原因所在。TG 水平升高和TRL 中的残粒胆固醇增加是心肌梗死的危险因素[43]。通过生活方式干预及优化降糖药物可降低糖尿病患者的TG 水平及ASCVD 风险[44-47],但是以TG 为靶点的降脂药物(贝特类药物、处方级鱼油制剂、烟酸类药物等)治疗能否降低ASCVD 高风险糖尿病患者的MACE 发生风险尚存争议[48-53]。因此,目前仅将TG 作为糖尿病患者ASCVD 风险管控的潜在指标。
3.2.2.2 Lp(a)
在T2DM 患者中,Lp(a)水平升高是冠心病和缺血性脑卒中的独立危险因素[32,54-56]。对于糖尿病合并稳定性心绞痛的患者,Lp(a)水平升高显著增加MACE 发生风险[57]。
推荐成年人一生中至少应检测1 次Lp(a)[32,54-56]。基于我国人群的研究数据[57-62],建议将Lp(a)>300 mg/L 作为增加ASCVD 风险的切点值[63]。
3.2.2.3 HDL-C
糖尿病患者的血脂特点之一是HDL-C 水平降低,尽管低水平的HDL-C 是ASCVD 的独立危险因素,但是HDL-C 对冠心病的预测作用受HDL 功能的影响,HDL 功能较HDL-C 水平能更好地预测ASCVD 风险。此外,遗传学证据未能证明HDL-C水平与ASCVD 风险的关系,通过药物升高HDL-C水平的治疗并未能带来心血管事件风险的下降。因此,HDL-C 并未被纳入ASCVD 风险管理的血脂干预目标,只作为管理指标[32,64]。
4 糖尿病患者的降脂治疗策略
糖尿病患者的降脂达标策略包括生活方式干预和药物治疗,具体推荐建议见表3。

表3 糖尿病患者的降脂达标策略推荐建议
4.1 生活方式干预
对于糖尿病(包括T1DM 和T2DM)患者,生活方式干预是血脂管理的基础,不仅有助于降低其血脂水平,还可对其血压、血糖以及整体心血管健康状况产生有益的影响。健康、规范的生活方式干预包括以下内容。
4.1.1 健康均衡的膳食[36,73,86]
限制总脂肪、饱和脂肪酸、胆固醇和反式脂肪酸的摄入,是防治高脂血症和ASCVD 的重要措施。膳食脂肪的摄入量应不超过每日总热量的20%~30%。饱和脂肪酸摄入量不超过每日总热量的10%,高胆固醇血症者应降低饱和脂肪酸摄入量,使其低于每日总热量的7%,少吃富含胆固醇的食物(如动物内脏等),每日胆固醇摄入量应<300 mg。反式脂肪酸(如氢化植物油等)摄入量应低于每日总热量的1%,即不宜超过2 g/d。适当增加不饱和脂肪酸(植物油)的摄入,特别是富含ω-3 多不饱和脂肪酸的食物[87]。
可采用地中海饮食[88]或终止高血压膳食疗法(dietary approaches to stop hypertension,DASH)饮食等饮食模式,增加蔬菜、水果、粗纤维食物、富含ω-3 脂肪酸鱼类的摄入,膳食纤维摄入量应不少于25~30 g/d 或14 g/1 000 kcal,建议达到 35 g/d。碳水化合物、蛋白质供能占比同普通糖尿病患者。高TG 血症患者饮食成分中除限制脂肪酸的摄入外,应尤其注意减少精制碳水化合物摄入,增加纤维含量丰富的低糖饮食(如全谷类的粗粮) 摄入。
4.1.2 适度的运动
每周应进行150 min 以上的中等强度运动,可个体化制定运动处方。需减重者还应继续增加每周运动强度和时间。在空腹血糖>16.7 mmol/L、反复低血糖发作或血糖波动较大、有DKA 等急性并发症以及合并急性感染、增殖期视网膜病变、严重肾病和严重心脑血管疾病(不稳定性心绞痛、严重心律失常、短暂性脑缺血发作)等情况下不适宜运动,待病情稳定后方可逐步恢复运动[73]。
4.1.3 维持理想的体重
建议通过控制总热量摄入以及增加运动量,将体重指数维持在<24 kg/m2。超重或肥胖者减重的初步目标为3~6 个月减轻体重的5%~10%。消瘦者应通过合理的营养计划恢复并长期维持理想体重[73]。
4.1.4 控制其他危险因素
戒烟(包括电子烟);无饮酒习惯者不建议饮酒,有饮酒习惯者限制饮酒,酒精摄入量男性<25 g/d、女性<15 g/d。饮酒是TG 升高的重要影响因素,高TG 血症者更需严格限制酒精摄入。
总之,无论合并哪种类型的血脂异常,健康均衡的膳食均需贯穿生活方式干预始终。控制TC 和LDL-C,需在合理膳食的基础上,规律运动和控制体重;升高HDL-C 应重视戒烟;降低TG 则需限酒、规律运动和控制体重[68]。
4.2 降胆固醇药物治疗策略
对于所有成人糖尿病患者,尽管健康的生活方式干预为降脂治疗的基础,但仅通过生活方式干预往往难以降脂达标,建议在生活方式干预的同时启动药物治疗,以尽早使降脂靶点达标,减少ASCVD事件。
糖尿病患者的降胆固醇治疗策略和流程见图1。
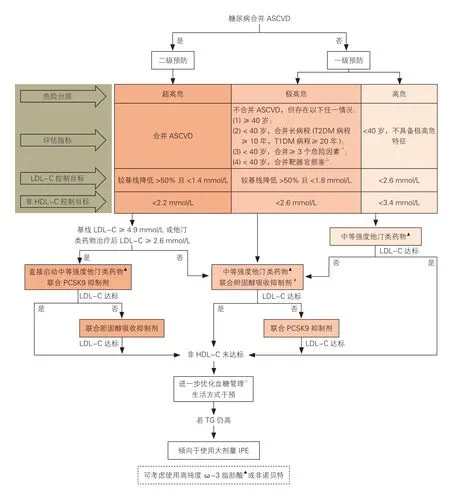
图1 糖尿病患者的降胆固醇治疗策略和流程
降胆固醇药物根据机制可分为三大类,包括他汀类药物、胆固醇吸收抑制剂和PCSK9 抑制剂。此外,临床上尚有其他降胆固醇药物,如血脂康、胆汁酸螯合剂、普罗布考、脂必泰、多廿烷醇等。本共识着重介绍目前临床上常用的前三大类降胆固醇药物(表4)。
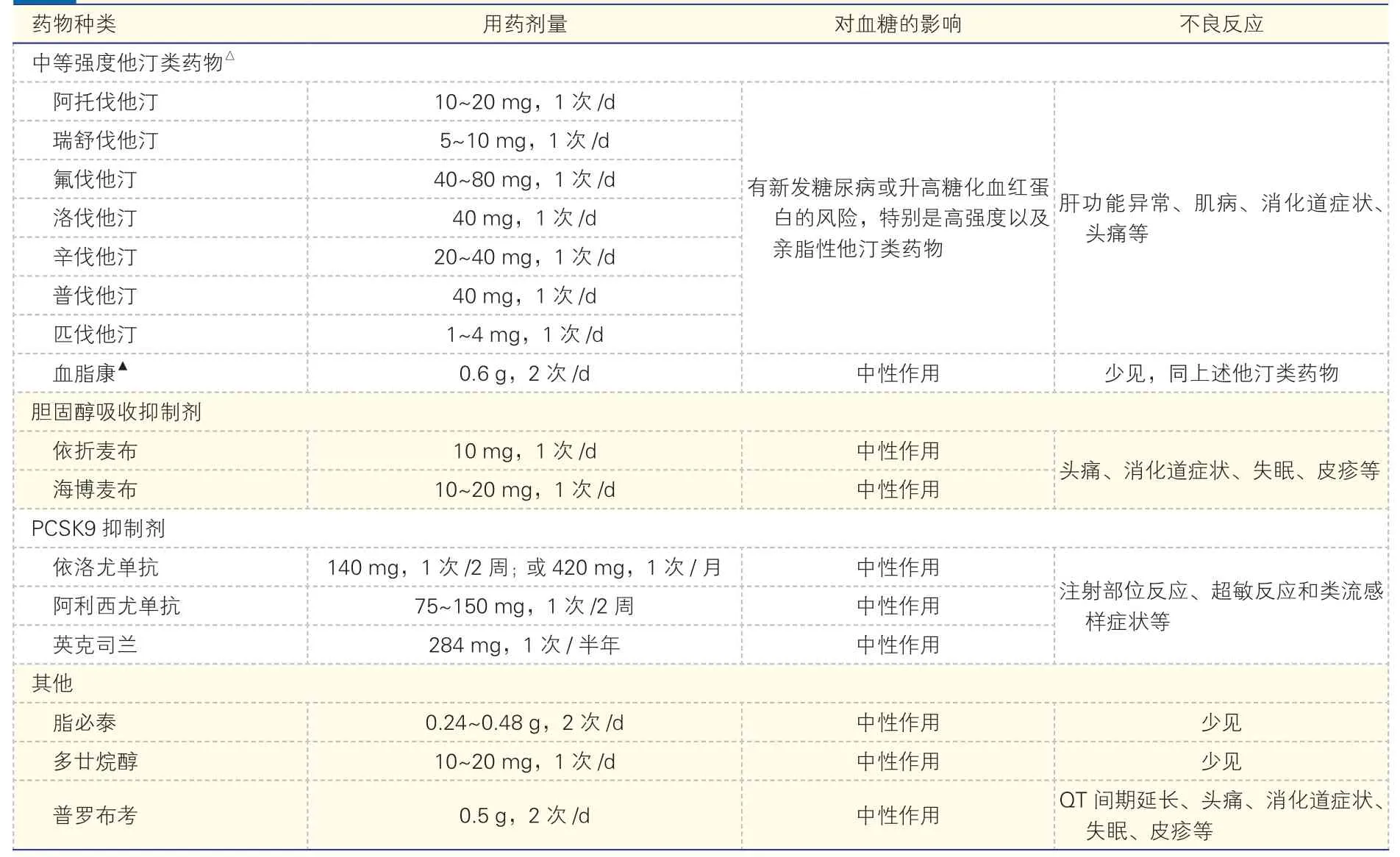
表4 临床常用降胆固醇药物的种类、用法和不良反应*
4.2.1 他汀类药物
他汀类药物为降胆固醇治疗的基础药物,通过抑制胆固醇合成限速酶3 羟基3 甲基戊二酰辅酶A还原酶,减少胆固醇合成,从而反馈上调肝细胞表面的LDL 受体,促进肝细胞摄取并清除血液中的LDL 颗粒,显著降低血清TC、LDL-C 和 ApoB 水平。多项研究结果证实,他汀类药物可显著减少糖尿病患者的ASCVD 事件(附表2),且临床获益大小与其对LDL-C 的降低幅度呈线性正相关。然而,他汀类药物剂量增倍时,LDL-C 降低幅度仅增加6%,并有潜在不良反应,包括肝功能损害、肌病及新发糖尿病等。
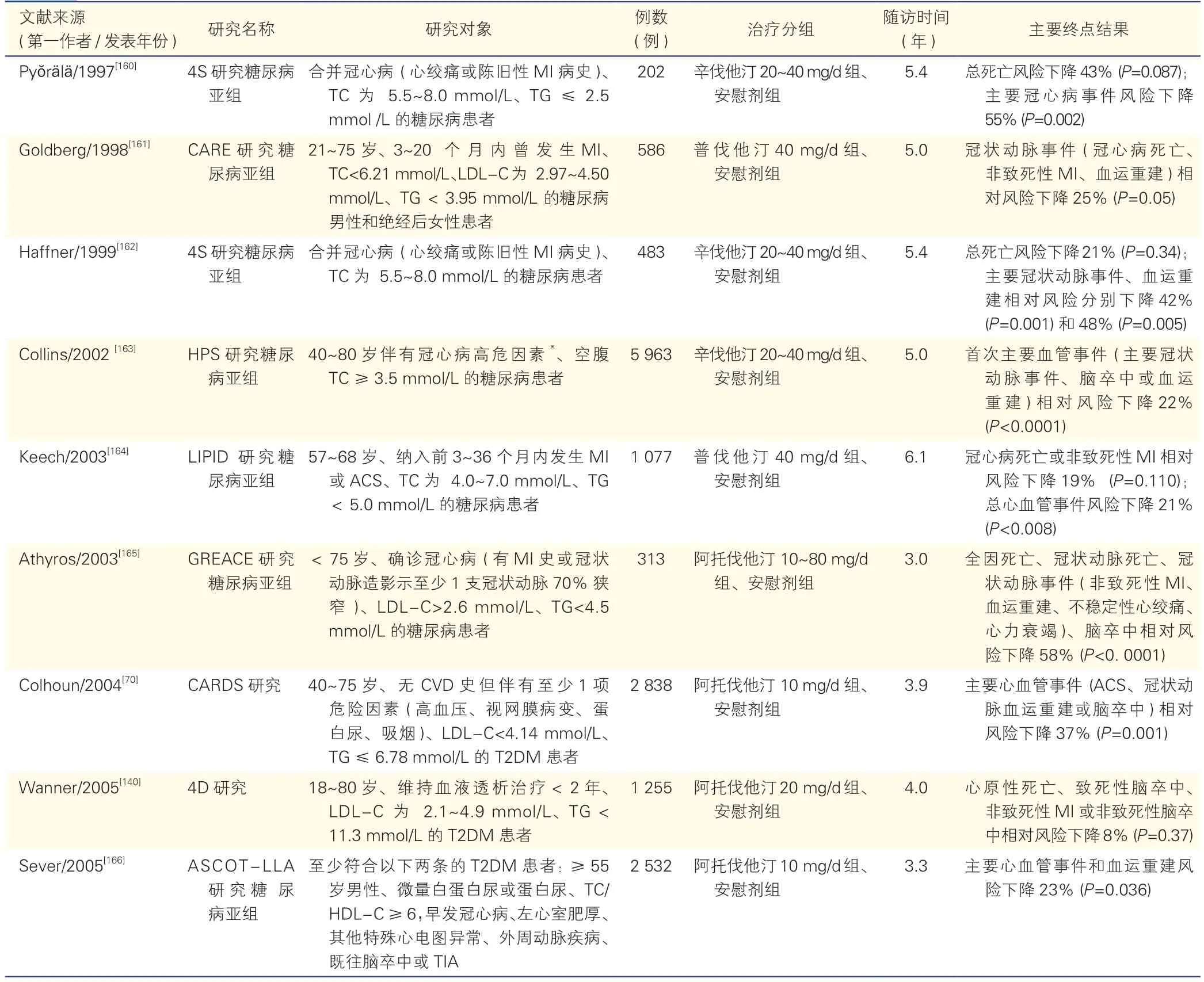
附表2 他汀类药物在糖尿病患者降脂治疗中的主要循证依据
我国人群对大剂量他汀类药物的耐受性较欧美人群差,基于疗效、安全性、耐受性和治疗费用的综合考虑,不建议使用高强度他汀类药物,推荐使用中等强度他汀类药物作为初始降脂方案[30,69-78]。目前国内临床上有洛伐他汀、辛伐他汀、普伐他汀、氟伐他汀、阿托伐他汀、瑞舒伐他汀和匹伐他汀,不同种类与剂量的他汀类药物的降胆固醇幅度有一定差别,中等强度他汀类药物是指每日剂量可降低LDL-C 25%~50%(表4)。此外,血脂康作为降脂中成药,其降脂机制类似于他汀类药物,CCSPS研究糖尿病亚组分析证实,血脂康可以有效降低LDL-C 水平,改善血脂谱,显著降低糖尿病患者的心血管事件发生率以及冠心病死亡率,且不良反应少[89]。中等强度他汀类药物治疗4~6 周内如LDL-C仍不能达标,应考虑联合胆固醇吸收抑制剂和(或)PCSK9 抑制剂治疗[26-28,79-82]。
4.2.2 胆固醇吸收抑制剂
胆固醇吸收抑制剂包括依折麦布、海博麦布,主要通过选择性作用于小肠黏膜刷状缘的尼曼-匹克C1 型类似蛋白1,抑制肠道对膳食和胆汁胆固醇的吸收。研究证实,依折麦布与不同种类他汀类药物联用时,可使LDL-C 进一步降低18%~20%左右,从而使LDL-C 降幅大于50%,且不增加他汀类药物的不良反应[79-80,90]。IMPROVE-IT 研究亚组分析显示,他汀类药物联用依折麦布可为合并糖尿病的急性冠状动脉综合征患者带来更大获益,其中心肌梗死、缺血性脑卒中和主要终点事件发生风险分别降低24%、29%和15%[26,79]。
此外,其他临床研究的亚组分析也提示,在他汀类药物基础上联用依折麦布可减少糖尿病患者的不良心血管事件。一项基于东亚人群的研究结果显示,在 ASCVD 患者中,瑞舒伐他汀/依折麦布单片复方制剂(10 mg/10 mg)较高强度他汀类药物单药治疗有更高的LDL-C 达标率和更好的耐受性,而在进一步降低心脑血管事件发生风险方面不劣于高强度他汀类药物单药治疗[80];且该研究的亚组分析显示,在糖尿病患者中这种联合降脂治疗的良好疗效及安全性仍得以保留[91]。因此,对于极高危和超高危患者,为达到>50%的LDL-C 降幅,可直接启动中等强度他汀类药物联合胆固醇吸收抑制剂治疗,为提高患者的依从性,可考虑选择他汀类药物/依折麦布单片复方制剂。胆固醇吸收抑制剂在糖尿病患者降胆固醇治疗中的主要循证依据见附表3。

附表3 胆固醇吸收抑制剂在糖尿病患者降胆固醇治疗中的主要循证依据
4.2.3 PCSK9 抑制剂
PCSK9 抑制剂主要通过抑制LDL 受体降解,增加血清LDL 的清除而降低LDL-C 水平。目前获批的PCSK9 抑制剂包括竞争性结合循环中PCSK9 的两种全人源单克隆抗体,即阿利西尤单抗和依洛尤单抗,以及靶向PCSK9 的小分子干扰RNA 药物英克司兰。研究结果显示,PCSK9 抑制剂(包括依洛尤单抗、阿利西尤单抗和英克司兰)可显著降低糖尿病患者的平均LDL-C 水平,降幅达50%~70%[92]。同时,PCSK9 抑制剂对其他血脂组分亦有明显改善,可使TG 水平降低10%~30%、ApoB 水平降低35%~41%、Lp(a) 水平降低20%~30%[93-95]。BANTING 研究[96]和BERSON 研究[97-98]结果进一步证实,PCSK9 单克隆抗体可助力大多数ASCVD 高危/极高危的T2DM 患者血脂快速达标,安全性、耐受性良好,且不影响血糖水平。
此外,多项大规模临床研究,包括FOURIER研究[81]、ODYSSEY OUTCOMES 研究糖尿病亚组分析[27]以及ODYSSEY DM-INSULIN 亚组分析[99]等,均证实PCSK9 抑制剂可显著降低糖尿病患者的心血管事件发生风险,且与LDL-C 降低幅度呈正相关[93,100]。因此,对于糖尿病合并ASCVD 患者,当基线LDL-C 水平较高(未使用他汀类药物患者LDL-C ≥4.9 mmol/L,服用他汀类药物患者LDL-C ≥2.6 mmol/L)、预计他汀类药物联合胆固醇吸收抑制剂治疗难以达标时,可考虑直接联合PCSK9 抑制剂治疗[81-82]。PCSK9 抑制剂在糖尿病患者降胆固醇治疗中的主要循证依据见附表4。

附表4 PCSK9 抑制剂在糖尿病患者降胆固醇治疗中的主要循证依据
对于不能耐受他汀类药物[即应用他汀类药物后出现与他汀类药物相关的临床不良反应和(或)实验室检测指标异常]的患者,也应考虑使用胆固醇吸收抑制剂和(或)PCSK9 抑制剂[28,83-85]。除以上两类非他汀类药物外,新型降脂药贝派地酸[101-102],通过抑制三磷酸腺苷-柠檬酸裂解酶,抑制肝脏胆固醇合成[103],可将LDL-C 水平降低达30%[104]。CLEAR-Outcomes 研究证实,贝派地酸可降低MACE 风险,且总体安全性、耐受性好,无相关肌病、血糖异常等不良反应[102],也可作为未来他汀类药物不耐受患者的一种选择。此外,脂必泰、多廿烷醇等耐受性良好的降胆固醇药物也可作为他汀类药物不耐受时的替代药物。
使用以上降胆固醇药物使糖尿病患者的LDL-C达标后,应明确非HDL-C 是否达标。非HDL-C 包含LDL-C 和残粒胆固醇,糖尿病患者残粒胆固醇水平升高与TG 水平升高密切相关,降低TG 水平是降低残粒胆固醇水平的主要途径。降低糖尿病患者TG水平的主要措施包括严格的生活方式干预、优化血糖管理和必要时应用降TG 药物。
4.3 降TG 治疗策略
糖尿病患者的TG 管理策略见表5。
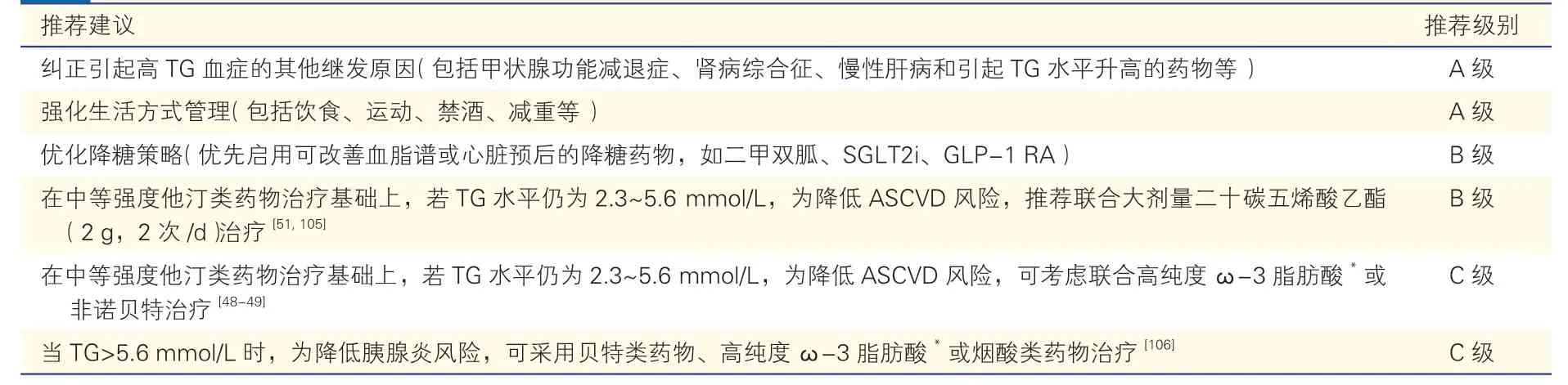
表5 糖尿病患者的 TG 管理策略推荐建议
糖尿病患者合并高TG 血症时,需评估引起高TG 血症的其他继发因素,包括甲状腺功能减退症、肾病综合征、慢性肝病和引起TG 水平升高的药物等。在纠正以上继发原因的同时,亦不可忽略严格生活方式管理。研究显示,强化饮食、运动特别是减重等生活方式管理,不仅有助于血糖控制,还可降低TG 水平,同时可将LDL-C 和非HDL-C 水平降低达5%~15%[65,107]。代谢手术作为一种有创的体重管理策略,可显著降低TG 和非HDL-C 水平以及ASCVD 风险[108-109]。
如在严格生活方式管理下糖尿病患者血糖仍未达标,亦可影响TG 和(或)非HDL-C 的控制,应进一步优化降糖策略,在促进血糖控制的同时降低TG 水平,助力非HDL-C 达标[110-112]。优化降糖策略推荐优先选用可改善血脂谱或心脏预后的降糖药物[113],如二甲双胍、胰高糖素样肽-1 受体激动剂(glucagon like peptide-1 receptor agonists,GLP-1 RA)和钠-葡萄糖共转运蛋白2 抑制剂(sodiumglucose cotransporter 2 inhibitors,SGLT2i)。以上三类降糖药物均可改善血脂谱,且各有特点,临床上可根据患者具体情况使用。二甲双胍和GLP-1 RA具有明显的减重优势,可降低糖尿病患者的TC、TG 和LDL-C 水平[114-115]。而SGLT2i 可促进脂肪酸的分解和氧化,减少脂肪合成,主要降低TG 并升高HDL-C 水平[110-111,116],兼有抗心力衰竭的作用。
若进一步强化生活方式管理以及优化降糖策略仍不能控制TG 水平<2.3 mmol/L 时,根据REDUCE-IT 研究和JELIS 研究结果,推荐在降脂治疗方案中加用大剂量二十碳五烯酸乙酯(icosapent ethyl,IPE)[51,105],以降低ASCVD 风险。由于非诺贝特仅在ACCORD 研究的亚组分析中显示出心血管获益[49],而包含二十碳五烯酸(eicosapentaenoic acid,EPA)和二十二碳六烯酸(docosahexaenoic acid,DHA)的高纯度ω-3 脂肪酸亦仅在Meta 分析中显示出降低ASCVD 风险的趋势[48],因此,非诺贝特、高纯度ω-3 脂肪酸可作为IPE 以外用来管理TG 并减少ASCVD 风险的次选药物。
流行病学研究结果提示,当TG 水平显著升高(>5.6 mmol/L)时,胰腺炎发生风险增加[106]。为降低胰腺炎发生风险,可采用贝特类药物、大剂量高纯度ω-3 脂肪酸或烟酸类药物之间的两两或以上联合治疗方案[106],以尽可能降低TG 水平。
近年来,血管生成素样蛋白3 抑制剂(全人源单抗Evinacumab)和载脂蛋白C3 抑制剂(反义寡核苷酸Volanesorsen)等新型降TG 药物问世,临床研究结果显示,两者均可显著降低TG 水平,同时可降低非HDL-C 和ApoB 水平[117-118],值得期待。
4.4 降低Lp(a)的治疗策略
降低Lp(a)的新药主要包括载脂蛋白(a)反义寡核苷酸(Pelacarsen)和载脂蛋白(a)小干扰 RNA(Olpasiran、SLN360)。尽管Ⅰ期研究显示两者均可显著降低Lp(a)水平,但大规模、国际多中心、心血管硬终点的临床研究仍在进行中。因此,目前尚无针对Lp(a)治疗的药物应用于临床,对于Lp(a)水平升高的患者,仍以进一步降低胆固醇水平为主。
在降胆固醇药物中,PCSK9 抑制剂可将糖尿病患者的Lp(a)水平降低约20%~30%,且显著减少MACE 发生,可作为临床用药选择[119]。而烟酸类药物和载脂蛋白B100 抑制剂mipomersen 尽管也可将Lp(a)水平降低20%~30%,但两者均缺乏心血管获益证据,且mipomersen 已于2019 年撤市,并不推荐使用[120-122]。
4.5 降脂药物对血糖的影响及处理策略
目前,降脂药物影响血糖的机制尚未完全清楚。一方面,与降脂药物影响胰岛β 细胞本身分泌胰岛素有关;另一方面,与降脂药物影响胰岛素敏感性、继而影响胰腺以外组织器官(如脂肪、肌肉等)的糖代谢有关[123]。目前,大规模临床研究或Meta 分析结果提示,他汀类药物和烟酸类药物对血糖控制不利并有增加新发糖尿病的风险[72,123-126]。而胆固醇吸收抑制剂、PCSK9 抑制剂、普罗布考、贝派地酸、贝特类药物、高纯度ω-3 脂肪酸对血糖调节呈中性作用,部分研究结果还显示上述药物可在一定程度上改善糖代谢、减轻胰岛素抵抗以及脂肪肝[26,80,123]。胆汁酸螯合剂虽可同时改善糖脂代谢,但降脂效果较弱[27-28,127],消化道不良反应较大,我国临床应用甚少。对于降低Lp(a)的新药,目前临床研究仍在进行中,其长期应用对血糖的影响尚不明确。
鉴于他汀类药物对心血管的保护作用远大于其对血糖控制的不利效应(HbA1c平均升高0.3%或更少)以及新发糖尿病的风险,故不推荐糖尿病患者因血糖控制不良而停服他汀类药物。由于他汀类药物对血糖控制的不利效应和新发糖尿病风险与剂量相关,且不同种类他汀类药物对血糖的影响不同,例如,阿托伐他汀、瑞舒伐他汀、辛伐他汀及氟伐他汀在正常人和T2DM 患者中对血糖调控均具有类似的不良影响,而匹伐他汀和普伐他汀对血糖调节具有较中性的作用[72,124-125,128]。因此,对于糖尿病患者,除了在他汀类药物使用前和使用过程中监测血糖或HbA1c外,可在血脂控制达标的基础上,尽量选择临床效价比高的中等强度他汀类药物及对血糖影响较为中性的他汀类药物,以减少其引起的糖代谢异常。若血脂控制不达标,可考虑联用胆固醇吸收抑制剂或PCSK9 抑制剂,而不建议增加他汀类药物剂量[27-28,80]。
研究表明,他汀类药物通过降低肠道生孢梭菌、抑制鹅去氧胆酸向熊去氧胆酸转化,引起肠道GLP-1 分泌减少,从而导致机体糖代谢异常和胰岛素抵抗[26,80,123,129],而联合使用熊去氧胆酸可以逆转他汀类药物引起的糖耐量异常,同时不改变其本身的降脂疗效,提示他汀类药物联合熊去氧胆酸可能成为未来一种新型降脂治疗策略[26,80,123,129]。同时,对于糖尿病患者,还应注意减轻体重、合理膳食和优化降糖治疗方案。烟酸类药物可导致糖代谢异常或糖耐量恶化,对糖尿病患者无心血管获益,一般不推荐在糖尿病患者中使用,若必须使用,应定期监测血糖水平[68,123]。
4.6 降脂治疗过程中的监测
对于首次服用降脂药物者,应在用药4~6 周时复查血脂、肝酶、肌酸激酶等指标。如血脂指标能达标,且无药物不良反应,逐步改为每3~6 个月复查一次。如治疗4~6 周后,血脂仍未达标,需及时调整降脂药物剂量或种类,或联合应用不同作用机制的降脂药物。每当调整降脂药物种类或剂量时,都应在治疗4~6 周时复查。此外,鉴于长期服用他汀类药物可能引起糖代谢异常,应同时加强对血糖和(或)HbA1c的监测[130]。
5 糖尿病特殊人群的降脂治疗
5.1 儿童和青少年
建议对诊断为糖尿病的10 岁以上儿童和青少年在血糖得到控制后或接受降糖药物治疗3 个月后进行血脂检测和评估。儿童与青少年糖尿病患者理想的血脂水平为LDL-C<2.6 mmol/L、HDL-C>0.9 mmol/L、TG<1.7 mmol/L、非HDL-C<3.4 mmol/L[131]。
对持续血脂异常者应进行干预,将血脂控制在理想范围内。干预措施以低脂与高纤维饮食、规律运动、保持理想体重及保持充足睡眠等健康生活方式及优化血糖控制为基础。合并家族性高胆固醇血症者可考虑启动降脂治疗,降脂药物包括他汀类药物、依折麦布、胆汁酸螯合剂和PCSK9 抑制剂,但这些药物在儿童和青少年中使用的长期安全性证据有限。
5.2 ≥75 岁老年人
糖尿病已成为老年人中常见的疾病之一,我国老年人中糖尿病患病率已高达30%[132]。考虑到≥75岁的高龄患者很少被纳入临床研究,≥75 岁的糖尿病患者是否能从降低LDL-C 的治疗中获益尚缺少充分的证据。近期一项Meta 分析纳入了29 项包括一级预防与二级预防的临床研究,其结果显示,≥75岁患者亦能从降低LDL-C 的治疗中获益,且他汀类药物与依折麦布、PCSK9 抑制剂等非他汀类药物治疗带来的心脑血管事件风险下降幅度无明显差异;在安全性方面,降脂治疗并未增加≥75 岁患者发生肿瘤、出血性脑卒中、认知功能障碍和新发糖尿病的风险[133]。
≥75 岁的糖尿病患者均为ASCVD 极高危患者,建议积极进行降脂治疗。尽管目前缺乏高龄老年患者他汀类药物降脂治疗靶目标的随机对照研究,本共识对该类患者的LDL-C 目标值也不做明确推荐,但非他汀类药物如依折麦布或PCSK9 抑制剂的相关随机对照研究纳入了≥75 岁患者[28,134],同时考虑共存的肝肾疾病、合并用药和预期寿命,对于≥75岁的极高危患者,可考虑中等强度他汀类药物联合非他汀类药物作为强化降脂治疗的手段。用药过程中应加强对肝肾功能、肌肉受损等不良反应的监测。
5.3 合并慢性肾脏病(chronic kidney disease,CKD)的患者
约有30%的T1DM 患者和40%的T2DM 患者合并CKD[135]。合并CKD 的糖尿病患者心血管死亡风险显著增加,直接归入ASCVD 极高危人群。
他汀类药物治疗对ASCVD 风险的降低受肾功能状态的影响。对于轻中度肾功能不全的非透析患者,他汀类药物治疗可显著降低全因死亡风险[136],在他汀类药物治疗基础上联用胆固醇吸收抑制剂或PCSK9 抑制剂亦可带来心血管获益[137-139]。他汀类药物治疗未能显著降低血液透析患者的心血管疾病发生风险[139-141]。
CKD 患者是他汀类药物相关肌病的高危人群,尤其在肾功能进行性减退或估算肾小球滤过率<30 ml/(min·1.73 m2)时风险显著增加,且发病风险与他汀类药物剂量密切相关,故应避免大剂量使用他汀类药物。不同CKD 分期时他汀类药物的剂量调整方案见表6。胆固醇吸收抑制剂和PCSK9 抑制剂对于肾功能受损患者是安全的,不需要调整剂量。
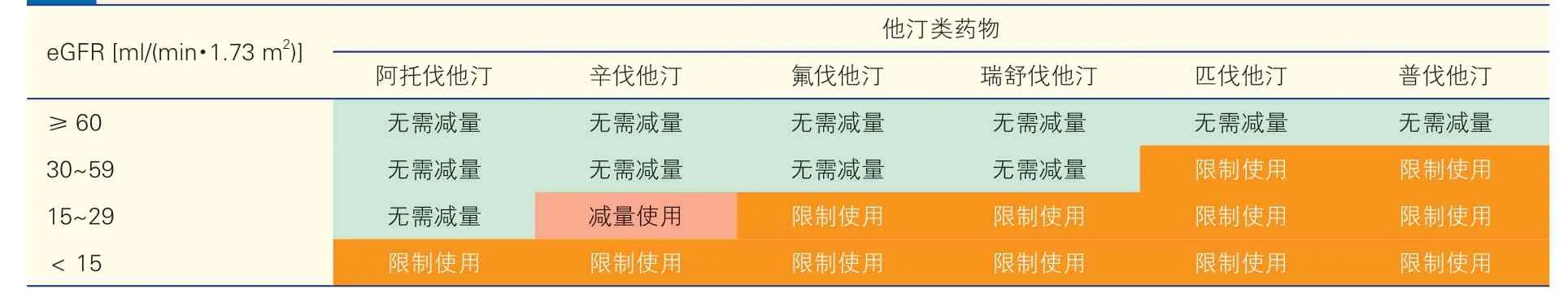
表6 不同分期慢性肾脏病患者中他汀类药物的剂量调整方案
5.4 合并代谢相关脂肪性肝病(metabolic associated fatty liver disease,MAFLD)的患者
MAFLD 指基于病理学或影像学存在脂肪肝证据,同时有超重/肥胖、T2DM 或代谢功能紊乱三项条件之一者。糖尿病与MAFLD 互为危险因素,T2DM 患者中MAFLD 患病率可高达55.5%[142],合并T2DM 的MAFLD 患者肝脏病变进展为肝硬化和肝癌的风险更高[143-144]。MAFLD 是ASCVD 的独立危险因素[145],糖尿病合并MAFLD 者比不合并MAFLD者具有更高的ASCVD 风险[146-149]。
目前尚无证据提示T2DM 合并MAFLD 患者的血脂控制是否要求更严格,在降脂药物使用过程中,需关注血脂和肝功能。他汀类药物本身可引起肝酶升高,发生率约1%,常见于开始用药或增加剂量的12 周内,呈剂量依赖性,极少引起肝功能衰竭。在肝功能正常的MAFLD 患者中,可使用中等强度他汀类药物。血清丙氨酸氨基转移酶(alanine transaminase,ALT)或天门冬氨酸氨基转移酶(aspartate transaminase,AST)升高在正常值上限3倍内且总胆红素水平正常者,可在原剂量或减量的基础上进行观察。如ALT 或AST 升高≥正常值上限3 倍,应停用他汀类药物,轻度肝功能受损(Child-Pugh 评分5~6 分)患者可采用胆固醇吸收抑制剂或PCSK9 抑制剂替代。失代偿性肝硬化和急性肝功能衰竭是他汀类药物的应用禁忌证[68,150],其他类型降脂药物在这些患者中的使用缺乏证据。
5.5 合并妊娠的患者
妊娠可导致血胆固醇水平生理性升高,LDL-C水平可升高50%;患者妊娠期胆固醇水平异常升高将增加早产和胎儿动脉粥样硬化的风险[151]。妊娠期的血脂管理重点是筛查以及饮食管理、合理运动、戒烟酒等生活方式改变,并将血糖控制在适宜范围,降脂药物的选择非常有限[152]。
基于他汀类药物导致胎儿畸形的动物实验和病例报告,通常不建议妊娠期使用他汀类药物。在近期2 项普伐他汀相关随机对照研究及队列研究中,未发现他汀类药物增加出生缺陷的风险[153-154]。Meta 分析结果提示,他汀类药物未增加出生缺陷风险,但与自发性流产风险增加相关[155-156]。基于这些证据,美国FDA 在2021 年要求取消他汀类药物的“妊娠X 类”标签。对于既往发生过冠状动脉事件或有家族性高胆固醇血症的糖尿病妊娠期女性,采用血液脂蛋白分离技术降低LDL-C 相对安全、有效,亦可在多学科协商、充分评估利弊的基础上谨慎选择他汀类药物[68]。
糖尿病合并妊娠患者由于营养摄入和雌激素分泌增加而促进肝脏TG 合成增加,导致TG 水平异常升高。尤其在妊娠晚期,LPL 活性下降,更容易出现严重高TG 血症和急性胰腺炎。妊娠期可选用的降TG 药物有限,贝特类药物在妊娠期使用尚无充分的安全性证据。
对于糖尿病合并妊娠期高TG 血症患者,应以生活方式改善和饮食管理为基础,在优化血糖控制的基础上,对严重高TG 血症(TG>5.6 mmol/L)患者,ω-3 脂肪酸能有效并相对安全地降低TG 水平,胰岛素和肝素通过激活LPL 降低TG 水平,对孕妇相对安全[157]。若发生胰腺炎的患者经药物治疗24~48 h后血清TG 水平仍>11.3 mmol/L 或降幅未达50%,可考虑进行脂蛋白分离治疗[158]。
6 总结与展望
我国糖尿病患者人数居世界之首,有效管理糖尿病患者的血脂异常、降低心血管事件风险对于实施健康中国战略具有深远意义。对糖尿病患者进行ASCVD 危险分层,针对不同危险分层确定血脂目标值和降脂治疗方案是糖尿病患者血脂管理的关键。
在糖尿病患者血脂管理方面,尚有一些亟待解决的问题,包括降脂治疗靶标、新型降脂药物的随机对照研究、特殊人群(如T1DM 患者、老年患者、儿童和青少年)的降脂治疗方案等。未来还需开展更多包括T1DM 和T2DM 患者在内的大规模、多中心临床研究,为糖尿病患者的血脂管理提供更多高质量的循证依据。
牵头专家:周智广(中南大学湘雅二医院),彭道泉(中南大学湘雅二医院)
专家委员会成员(按姓氏汉语拼音排序):毕宇芳(上海交通大学医学院附属瑞金医院),卜军(上海交通大学医学院附属仁济医院),陈红(北京大学人民医院),陈莉明(天津医科大学朱宪彝纪念医院),陈桢玥(上海交通大学医学院附属瑞金医院),程翔(华中科技大学同济医学院附属协和医院),丛洪良(天津市胸科医院),董吁钢(中山大学附属第一医院),窦克非(中国医学科学院阜外医院),郭立新(北京医院),郭远林(中国医学科学院阜外医院),贺永明(苏州大学附属第一医院),洪天配(北京大学第三医院),姬秋和(西北大学附属西安国际医学中心医院 内分泌代谢病医院), 纪立农(北京大学人民医院),金萍(中南大学湘雅三医院),匡洪宇(哈尔滨医科大学附属第一医院),李建军(中国医学科学院阜外医院),李建平(北京大学第一医院),李霞(中南大学湘雅二医院),李小英(复旦大学附属中山医院),李勇(复旦大学附属华山医院),梁春(上海长征医院),刘静(甘肃省人民医院),刘静(首都医科大学附属北京安贞医院),刘铭(天津医科大学总医院),陆国平(上海交通大学医学院附属瑞金医院),罗湘杭(中南大学湘雅医院),母义明(中国人民解放军总医院),彭永德(上海市第一人民医院),宋怀东(上海交通大学医学院附属第九人民医院),苏青(上海交通大学医学院附属新华医院),孙爱军(复旦大学附属中山医院),孙艺红(中日友好医院),唐熠达(北京大学第三医院),汪芳(北京医院),王建安(浙江大学医学院附属第二医院),翁建平(中国科学技术大学附属第一医院),吴娜琼(中国医学科学院阜外医院),肖海鹏(中山大学附属第一医院),严励(中山大学孙逸仙纪念医院),严晓伟(北京协和医院),叶平(中国人民解放军总医院),余学峰(华中科技大学同济医学院附属同济医院),袁祖贻 (西安交通大学第一附属医院),曾春雨(陆军军医大学大坪医院),张瑞岩(上海交通大学医学院附属瑞金医院),赵冬(首都医科大学附属北京安贞医院),赵家军(山东省立医院),赵水平(中南大学湘雅二医院),郑宏庭(陆军军医大学新桥医院),周胜华(中南大学湘雅二医院),朱大龙(南京大学医学院附属鼓楼医院),朱建华(浙江大学医学院附属第一医院),祝烨(四川大学华西医院),祝之明(陆军军医大学大坪医院)
编写委员会成员(按贡献大小排序):超晨(中南大学湘雅二医院),王帅(中南大学湘雅二医院),胡蝶(中南大学湘雅二医院),武超(中南大学湘雅二医院),罗永红(中南大学湘雅二医院),谢凌翔(中南大学湘雅二医院),李晨瑜(中南大学湘雅二医院)
执笔专家:肖扬(中南大学湘雅二医院),于碧莲(中南大学湘雅二医院)
利益冲突:所有作者均声明不存在利益冲突

