中国血脂管理指南(基层版2024 年)
中国血脂管理指南修订联合专家委员会
低密度脂蛋白胆固醇(LDL-C)是动脉粥样硬化性心血管疾病(ASCVD)的致病性危险因素。近几十年来,中国人群的血脂异常患病率不断升高,血脂管理刻不容缓,在基层开展血脂规范管理尤为重要。《中国血脂管理指南(基层版2024 年)》简明地推荐LDL-C 作为血脂干预的首要靶点,以ASCVD 危险分层确定其目标值;推荐在生活方式干预的基础上,以中等强度他汀类药物作为起始药物治疗,必要时联用胆固醇吸收抑制剂和(或)前蛋白转化酶枯草溶菌素9 抑制剂的达标策略;并就常见特殊人群的血脂管理策略进行了推荐。本指南旨在为基层医师开展血脂管理提供指导,全面提升基层医师的血脂管理水平,推进ASCVD 的一级和二级预防工作。
以动脉粥样硬化性心血管疾病(atherosclerotic cardiovascular disease,ASCVD)为主的心血管疾病是我国城乡居民第一位死亡原因,占死因构成的40%以上[1]。近年来,我国ASCVD 负担仍持续增加,防控形势严峻。目前已证实,低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)是ASCVD 的致病性危险因素[2]。然而,数据显示,近几十年来我国≥18 岁人群中血脂异常患病率明显升高[3],但其知晓率、治疗率和控制率均处于较低水平。因此,有必要进一步加强血脂管理,做好ASCVD的一级和二级预防。
2023 年3 月24 日,由国家心血管病专家委员会联合中华医学会心血管病学分会、内分泌学分会、糖尿病学分会、检验医学分会及中国卒中学会发布了《中国血脂管理指南(2023 年)》[4]。为便于基层医师更好地开展血脂管理,在该指南的基础上制定了《中国血脂管理指南(基层版2024 年)》。
1 血脂检测项目
建议临床血脂检测包括总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、LDL-C和高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)。TC 是指血液中各脂蛋白所含胆固醇的总和。LDL-C是ASCVD的致病性危险因素,是调脂治疗的首要干预靶点。通常情况下,HDL-C水平与ASCVD 风险呈负相关。
非HDL-C 为TC 减去HDL-C 获得,代表了所有含载脂蛋白(apolipoprotein,Apo)B 的脂蛋白胆固醇的总量。非HDL-C 也可作为ASCVD 一级和二级预防的干预靶点。
有条件的医疗机构可以开展ApoA1、ApoB、脂蛋白(a)[lipoprotein(a),Lp(a)] 检测。一般情况下,血清ApoA1 主要反映高密度脂蛋白(high-density lipoprotein,HDL)颗粒水平,血清ApoB 主要反映低密度脂蛋白(low-density lipoprotein,LDL)颗粒水平。Lp(a)由LDL 样颗粒和Apo(a)组成,是ASCVD 和钙化性主动脉瓣狭窄的独立危险因素。
2 血脂筛查对象
血脂筛查有利于及早发现血脂异常人群以及指导ASCVD 风险评估与干预治疗。对于普通人群,建议<40 岁成年人每2~5 年进行一次血脂检测(包括TC、LDL-C、HDL-C 和TG),≥40 岁成年人每年至少进行一次血脂检测。采取静脉血,采血前至少2周内保持日常饮食习惯和体重稳定,24 h 内不进行剧烈身体活动,禁食8~12 h,坐位休息至少5 min。
血脂检查的重点对象为:(1)有ASCVD 病史者;(2)有多个ASCVD 危险因素(如高血压、糖尿病、肥胖、吸烟)者;(3)有早发ASCVD 家族史(男性一级亲属<55 岁或女性一级亲属<65 岁患ASCVD)或家族性高脂血症者;(4)皮肤或肌腱黄色瘤及跟腱增厚者。
3 血脂管理原则
3.1 动脉粥样硬化性心血管疾病总体风险评估
依据ASCVD 危险分层进行不同强度干预是血脂管理的核心策略,ASCVD 总体风险评估是血脂管理决策的基础(图1)。
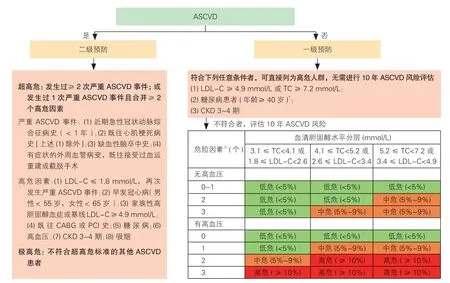
图1 中国成年人ASCVD 总体风险评估流程图
3.2 血脂合适水平的参考标准
ASCVD 一级预防低危人群(非糖尿病患者)的主要血脂指标参考标准见表1。血脂异常的临床分类依照表1 可分为高胆固醇血症、高TG 血症、混合型高脂血症和低HDL-C 血症,而血脂水平是否达标要依据ASCVD 风险的不同来判断。
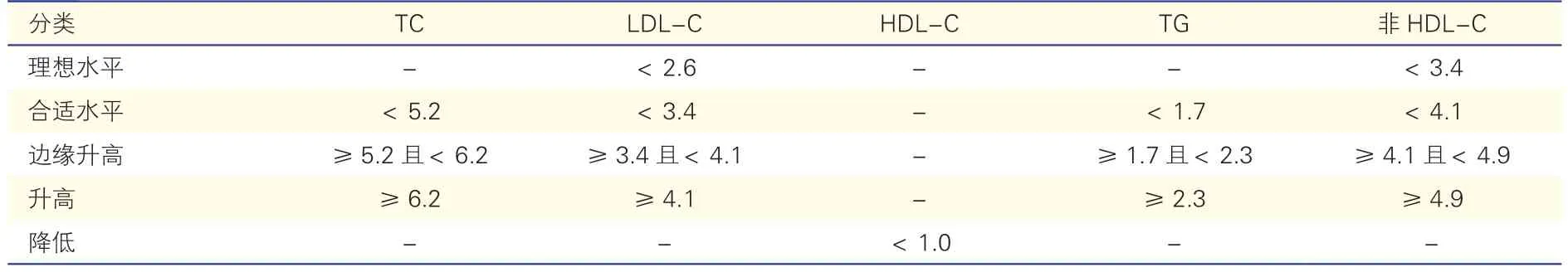
表1 中国ASCVD 一级预防低危人群(非糖尿病患者) 主要血脂指标的参考标准(mmol/L)
3.3 降脂目标
LDL-C 是降脂治疗的首要靶点。LDL-C 达标后,非HDL-C 为次要干预靶点。LDL-C 和非HDL-C 达标后TG 仍高(≥2.3 mmol/L)的ASCVD 高危及以上患者,可同时采用二十碳五烯酸(eicosapentaenoic acid,EPA)治疗以进一步降低ASCVD 风险。
LDL-C 控制水平应参照ASCVD 总体风险,LDL-C 的目标值见表2。LDL-C 降低幅度越大,持续时间越长,ASCVD 风险下降越多。非HDL-C 目标值=LDL-C 目标值+0.8 mmol/L。
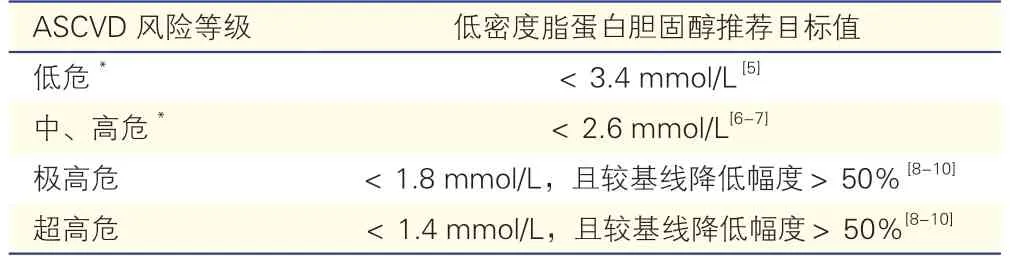
表2 降脂靶点的目标值
3.4 降脂治疗的策略
降脂治疗包括生活方式干预和药物治疗。
首先推荐健康生活方式,包括合理膳食、适度增加身体活动、控制体重、戒烟和限制饮酒等。其中,合理膳食对血脂的影响较大,主要是限制饱和脂肪酸及反式脂肪酸的摄入,增加蔬菜和水果、全谷物、膳食纤维及鱼类的摄入。对于ASCVD 中危以上人群或合并高胆固醇血症患者,应特别强调减少膳食胆固醇的摄入,每天膳食胆固醇摄入量应在300 mg以下[11-13]。 血脂管理膳食治疗建议[11-14]见表3。

表3 血脂管理膳食治疗建议
在无ASCVD 的人群中,当生活方式干预3 个月后不能达到降脂目标时,应考虑加用降脂药物。他汀类药物是降胆固醇治疗的基础,推荐起始使用常规剂量或中等强度他汀类药物。当LDL-C 不能达标时,可联合使用非他汀类降脂药物,如胆固醇吸收抑制剂[15]和(或)前蛋白转化酶枯草溶菌素9 (proprotein convertase subtilisin/kexin type 9,PCSK9) 抑制剂[10]。
对于ASCVD 超高危患者,当基线LDL-C 较高(未使用他汀类药物患者LDL-C ≥4.9 mmol/L;服用他汀类药物患者LDL-C ≥2.6 mmol/L)、预计他汀类药物联合胆固醇吸收抑制剂不能使LDL-C 达标时,可考虑直接联用他汀类药物和PCSK9 抑制剂,以保证患者LDL-C 早期达标。降脂策略流程见图2。

图2 降脂策略流程图
TG 升高与不健康生活方式及饮食密切相关,运动和控制饮食可有效降低TG。饮酒是TG 升高的非常重要的因素,TG 升高的个体更需要严格限制酒精摄入。饮食成分中除限制饱和脂肪酸的摄入外,要特别注意减少精制碳水化合物摄入,增加膳食纤维含量丰富的低糖饮食如全谷类的粗粮摄入。
降低TG 的药物主要包括贝特类药物、ω-3 多不饱和脂肪酸(ω-3 脂肪酸,指高纯度医用处方级)及烟酸类药物,具体用法见表4。

表4 降TG 的药物治疗建议
3.5 降脂治疗过程中的监测与随访
降脂治疗中监测的目的:(1)观察是否达到降脂目标值;(2)了解药物的潜在不良反应。根据评估结果,优化药物治疗方案,不建议轻易停药。降脂治疗随访时间:开始药物治疗后4~6 周随访一次,安全达标后3~6 个月随访一次(图3)。

图3 降脂治疗过程中的监测流程图
3.6 转诊指征
基层血脂管理建议转诊指征:(1)严重高胆固醇血症(LDL-C ≥4.9 mmol/L)或严重高TG 血症(TG ≥5.6 mmol/L),且合并≥2 项高危因素;(2)合并严重肝肾疾病,妊娠女性、儿童青少年及高龄老年人初始治疗,有原发性高胆固醇血症家族史;(3)降脂治疗后血脂不能达标,或有严重药物不良反应。
4 降脂药物治疗
根据其主要作用,降脂药物分为主要降低胆固醇的药物和主要降低TG 的药物。在临床实践中,通常根据血脂异常类型、基线血脂水平以及需要达到的血脂目标值来决定是否启用降脂药物或是否联合用药。
4.1 主要降胆固醇的药物
主要降胆固醇的药物包括他汀类药物、胆固醇吸收抑制剂、PCSK9 抑制剂、普罗布考及其他降脂药。
4.1.1 他汀类药物
他汀类药物适用于高胆固醇血症、混合型高脂血症和ASCVD 的防治。他汀类药物还可使TG 水平降低7%~30%、HDL-C 水平升高5%~15%。不同种类与剂量的他汀类药物对胆固醇的降低幅度有一定差别,但任何一种他汀类药物剂量增倍时,LDL-C水平进一步降低的幅度仅约为6%。他汀类药物可在任何时间段每天服用1 次,但晚上服用时LDL-C降低幅度会稍增加。
中等强度他汀类药物指LDL-C 降低幅度为25%~50% 时所采用的他汀类药物日剂量。不同种类与剂量的他汀类药物对LDL-C 的降低幅度见表5。

表5 他汀类药物降胆固醇强度
如应用中等强度他汀类药物(避免使用大剂量他汀类药物)后LDL-C 仍不达标,则考虑联合治疗[联合胆固醇吸收抑制剂和(或)PCSK9 抑制剂或其他药物]。
在应用他汀类药物期间,需关注与其他药物间的相互作用。通过细胞色素P450(CYP)3A4 途径代谢的他汀类药物与免疫抑制剂(如环孢菌素A等)、抗真菌药物、大环内酯类药物、胺碘酮、吉非罗齐以及西柚汁等联用时,可能增加肌病或肌溶解的风险,故使用上述药(食)物的患者应避免使用大剂量他汀类药物并监测不良反应。
应用他汀类药物使LDL-C 达标后应继续长期应用,如能耐受应避免停用。
目前报道的他汀类药物不良反应主要包括肝功能异常、他汀类药物相关肌痛、肌酶升高、肌炎、横纹肌溶解症(图4),多呈剂量依赖性。长期、大剂量服用他汀类药物有增加新发糖尿病的风险,但其对ASCVD 的总体益处远大于新发糖尿病风险。

图4 他汀类药物不良反应处理原则
4.1.2 胆固醇吸收抑制剂
胆固醇吸收抑制剂包括依折麦布和海博麦布,二者均为口服用药,常规用法均为10 mg,1 次/d。与他汀类药物联用时,依折麦布可使LDL-C 水平进一步降低18%~20%[21],海博麦布进一步降低16%左右[22]。胆固醇吸收抑制剂不良反应轻微,且多为一过性,主要表现为头痛和消化道症状。也应关注其与他汀类药物联用时,可发生肝酶升高和肌痛等不良反应,禁用于妊娠期和哺乳期。
4.1.3 PCSK9 抑制剂
目前获批上市的PCSK9 抑制剂有依洛尤单抗、阿利西尤单抗、托莱西单抗和小干扰RNA 英克司兰。依洛尤单抗140 mg 或阿利西尤单抗75 mg,每两周一次皮下注射,安全性和耐受性好,可使LDL-C 水平明显降低达50%~70%,其严重不良事件、肌肉相关事件、新发糖尿病、出血性脑卒中和神经认知事件等不良反应发生率与安慰剂相似[23]。托莱西单抗150 mg,每两周一次皮下注射,LDL-C 降低幅度类似[24]。英克司兰降LDL-C 的幅度与PCSK9 单抗近似,但作用更持久,注射1 剂疗效可维持半年[25];常见不良反应包括注射部位疼痛或肿块、疲劳感、恶心以及肌肉疼痛等。
4.1.4 普罗布考
普罗布考有抗氧化和延缓动脉粥样硬化的作用,目前主要联合其他降脂药用于治疗家族性高胆固醇血症患者,以减轻皮肤黄色瘤的发生及严重程度。成年人常用剂量为0.5 g,2 次/d。
4.1.5 其他降脂药
脂必泰是一种红曲与中药(山楂、泽泻、白术)的复合制剂,具有降低胆固醇的作用。
4.2 主要降甘油三酯的药物
主要降TG 的药物包括贝特类药物、ω-3 脂肪酸、烟酸及其同类物(表6)。
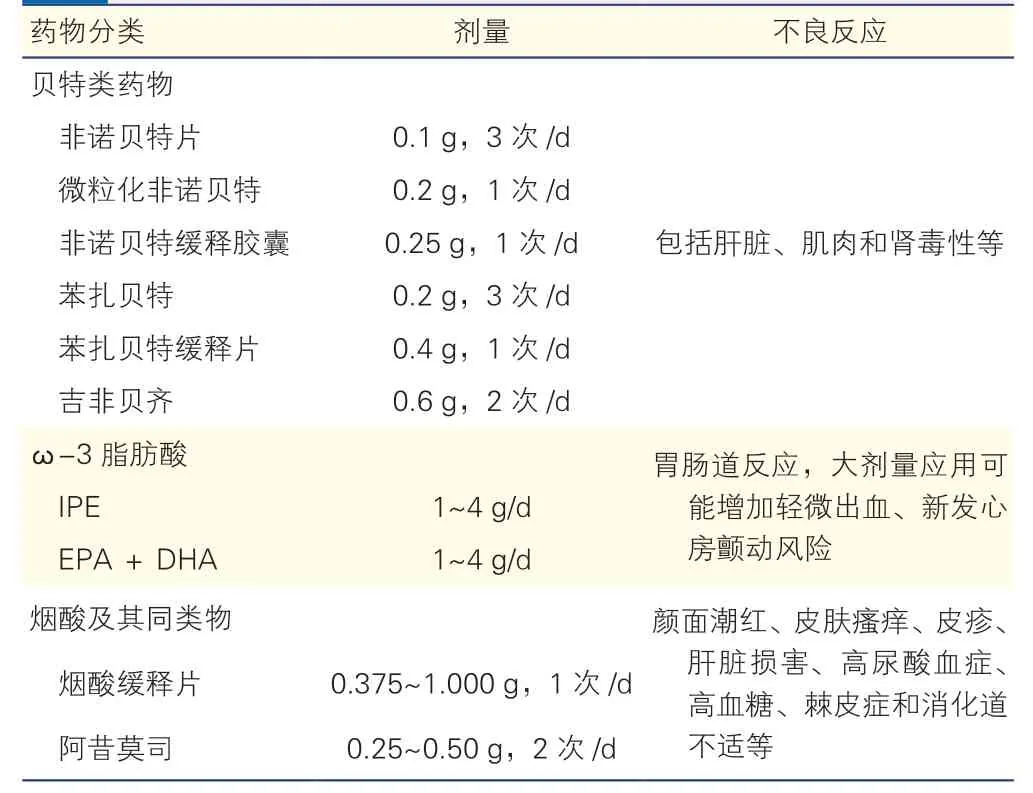
表6 主要降甘油三酯的药物
4.3 降脂药物的联合应用
降脂药物联合应用是当前血脂异常干预策略的趋势,主要目的是提高血脂达标率,进一步降低ASCVD风险,减少药物不良反应。目前可选择的降脂药物主要联合应用策略见表7。也可使用他汀类药物和(或)胆固醇吸收抑制剂固定复方制剂进一步提高依从性。

表7 降脂药物的联合应用策略
5 特定人群的血脂管理
5.1 高血压患者
高血压患者能从强化降脂中明显获益,应根据ASCVD 危险分层确定高血压患者相应的LDL-C目标值。对于高血压合并危险因素者归为ASCVD中危及以上患者,应予以积极的降胆固醇治疗,LDL-C 至少应<2.6 mmol/L。
5.2 糖尿病患者
对于糖尿病患者,推荐同时采用LDL-C 和非HDL-C 作为降脂靶点(表8)。

表8 糖尿病患者血脂目标值建议
建议ASCVD 风险为高危的糖尿病患者选择中等强度他汀类药物作为基础降脂治疗,如LDL-C不达标,需联用胆固醇吸收抑制剂或PCSK9 抑制剂[21,26]。如LDL-C 达标后仍有TG 升高或非HDL-C不达标,考虑联用二十碳五烯酸乙酯(icosapent ethyl,IPE)或其他ω-3 脂肪酸或贝特类药物[17,19-20]。
5.3 慢性肾脏病患者
对于轻中度肾功能不全患者,他汀类药物治疗能显著降低其ASCVD 风险[28];对于透析依赖的重度肾功能不全患者,他汀类药物干预研究未显示效果[29-30]。
慢性肾脏病患者是他汀类药物引起肌病的高危人群,发病风险与他汀类药物剂量密切相关,故应避免大剂量应用。贝特类药物可升高血肌酐水平,在中重度慢性肾脏病患者中与他汀类药物联用时,可能增加肌病风险,联合用药时应依据肾小球滤过率调整剂量[31-32]。
5.4 脑卒中患者
缺血性脑卒中患者可从降脂治疗中获益。对于缺血性脑卒中患者,目前中等剂量他汀类药物增加出血性脑卒中风险的证据不充分,降低LDL-C 的获益远大于有潜在出血性脑卒中的风险。脑卒中患者的降脂治疗建议见表9。存在出血性脑卒中高风险或有出血性脑卒中病史的患者应个体化评估降脂治疗的获益和风险,LDL-C 目标值不宜过低。

表9 脑卒中患者的降脂治疗建议
中国血脂管理指南(基层版 2024 年) 修订联合专家委员会
指南修订组织机构:国家心血管病专家委员会,中华医学会心血管病学分会,中华医学会内分泌学分会,中华医学会糖尿病学分会,中华医学会检验医学分会,中国卒中学会
指南修订指导委员会(按姓氏笔画排序):王成彬(中国人民解放军总医院全军医学检验质量控制中心,中华医学会检验医学分会主任委员),王拥军(首都医科大学附属北京天坛医院,中国卒中学会会长),宁光(上海交通大学医学院附属瑞金医院),朱大龙(南京大学医学院附属鼓楼医院,中华医学会糖尿病学分会主任委员),张运(山东大学齐鲁医院),赵家军(山东省立医院,中华医学会内分泌学分会主任委员),胡大一(北京大学人民医院),贾伟平(上海市第六人民医院),顾东风(中国医学科学院阜外医院),葛均波(复旦大学附属中山医院),韩雅玲(北部战区总医院,中华医学会心血管病学分会主任委员)
指南修订专家组组长
协调人:高润霖(中国医学科学院阜外医院)
成员(按姓氏笔画排序):李建军(中国医学科学院阜外医院),陆国平(上海交通大学医学院附属瑞金医院),赵冬(首都医科大学附属北京安贞医院),赵水平(中南大学湘雅二医院)
指南修订专家组(按姓氏笔画排序):于波(哈尔滨医科大学附属第二医院),马长生(首都医科大学附属北京安贞医院),马依彤(新疆医科大学第一附属医院),王文志(首都医科大学附属北京天坛医院),王俊玲(北京市朝阳区劲松社区卫生服务中心),王胜煌(宁波大学附属第一医院),王莉珉(石家庄市桥西区裕西社区卫生服务中心),王敏(绵阳市中心医院),王增武(中国医学科学院阜外医院),叶平(中国人民解放军总医院),史旭波(首都医科大学附属北京同仁医院),刘星(马鞍山十七冶医院合肥红光社区中心),刘静(首都医科大学附属北京安贞医院),刘梅林(北京大学第一医院),安美美(北京市海淀区甘家口社区卫生服务中心),孙艺红(中日友好医院),纪立农(北京大学人民医院),严晓伟(北京协和医院),杜雪平(首都医科大学附属复兴医院月坛社区卫生服务中心),李小鹰(中国人民解放军总医院),李永锦(北京市朝阳区劲松社区卫生服务中心),李光伟(中国医学科学院阜外医院),李勇(复旦大学附属华山医院),李静(中国医学科学院阜外医院),吴浩(首都医科大学全科医学与继续教育学院),吴娜琼(中国医学科学院阜外医院),邹大进(上海长海医院),陈红(北京大学人民医院),陈桢玥(上海交通大学医学院附属瑞金医院),陈韵岱(中国人民解放军总医院),武阳丰(北京大学医学部公共卫生学院),罗彩东(绵阳市中心医院),周洲(中国医学科学院阜外医院),赵文华(中国疾病预防控制中心营养与健康所),俞蔚(浙江大学医学院附属浙江医院),祝之明(陆军军医大学大坪医院),祝烨(四川大学华西医院),袁祖贻(西安交通大学第一附属医院),高传玉(阜外华中心血管病医院),高炜(北京大学第三医院),郭艺芳(河北省人民医院),郭远林(中国医学科学院阜外医院),唐熠达(北京大学第三医院),梁春(上海长征医院),彭道泉(中南大学湘雅二医院),董吁钢(中山大学附属第一医院),程翔(华中科技大学同济医学院附属协和医院),曾正陪(北京协和医院),鄢盛恺(遵义医科大学附属医院),詹思延(北京大学医学部公共卫生学院),窦克非(中国医学科学院阜外医院),廖玉华(华中科技大学同济医学院附属协和医院),霍勇(北京大学第一医院)
指南修订执笔专家:王增武(中国医学科学院阜外医院),郭远林(中国医学科学院阜外医院)
指南修订秘书组
组长:王增武(中国医学科学院阜外医院)
成员:马丽媛(中国医学科学院阜外医院),高莹(中国医学科学院阜外医院)
利益冲突:所有作者均声明不存在利益冲突

