属性层次模型-熵权法联合正交试验优化黄芩药材高温瞬时灭菌工艺*
乔晓芳,王迎举,伦琦星,陶海涛
(1. 河南省药品审评查验中心·河南省疫苗检查中心,河南 郑州 450000; 2. 江苏万创灭菌设备科技有限公司,江苏 镇江 212200)
中药制剂原料中药材多带有大量微生物,是中药制剂被微生物污染的主要途径之一[1],微生物在适宜条件下会大量生长繁殖,从而导致药品变质、腐败、疗效降低或失效,甚至可能对人体有害。基于源头控制、过程控制的风险管理理念,在药品生产过程中,减少或杀灭微生物,是保证药品质量的关键。常用的辐照灭菌法存在设备费用高,部分药物灭菌后疗效可能降低,影响液体药剂的稳定性,使用需注意安全防护的缺点[2-4];流通蒸汽灭菌法存在含挥发油类、芳香类中药材不适用,灭菌后药粉水分大易板结成块,存在需二次干燥、二次粉碎的弊端;乙醇气体灭菌法存在生产效率低、生产周期长、能源用量大、费工费时的问题[5]。药材原粉经灭菌处理后常直接用于口服固体制剂生产,如何选用适宜的方法灭菌是药厂生产的一大难题。属性层次模型(AHM)现已在药品工艺优化、药物合理性评价等多个领域广泛应用[6-7],但其受人为主观因素影响较大,存在主观偏差或人为排斥某些指标的风险;熵权法(EWM)客观性强、精准度高[8-9],但其难以考虑到人的主观感受和价值判断,受数据误差的影响较大。两法结合综合赋权,能确保多评价指标的相对权重更具科学性和准确性[10],可用于中药及其制剂、医药领域等优劣性评价。正交试验法采用多指标作为评价对象,能最大限度地降低试验误差,提高评价结果的准确性和最优方案的可行性[11-12]。本研究中在充分调研高温瞬时灭菌智能化灭菌在药品食品等行业应用情况的基础上[13-17],对黄芩药材高温瞬时灭菌新方法进行灭菌工艺探索,对其灭菌效果进行多指标综合评价,为中药材选择适宜的灭菌方法提供参考依据。现报道如下。
1 仪器与试药
1.1 仪器
QYGI-300C 型切药机(济南沃成设备有限公司);SF - 130 型锤击式中药粉碎机(吉首市中诚制药机械厂);WC - FMD - 150 型高温瞬时灭菌设备(江苏万创灭菌设备科技有限公司);LC20AT 型高效液相色谱仪(日本Shimadzu公司);BT25S型电子天平(德国Sartorius公司,精度为0.01 mg)。
1.2 试药
黄芩(禹州市凯旋药业有限公司,批号分别为221101,221102,221103);黄芩苷对照品(批号为110715-202223,含量97.2%),黄芩素对照品(批号为111595-201808,含量97.9%),汉黄芩素对照品(批号为111514 - 202207,含量≥98%),均购自中国食品药品检定研究院;甲醇、磷酸、乙醇均为色谱纯,其余试剂均为分析纯,水为娃哈哈纯净水。
2 方法与结果
2.1 高温瞬时灭菌药材制备
取药材样品适量,除去杂质,置沸水中煮10 min,取出,闷透,切薄片,干燥,粉碎成细粉,过50目筛,采用聚乙烯自封袋分装,每袋100 g,即得高温瞬时灭菌药材。
2.2 微生物限度检查及灭菌率计算
称取灭菌前后药材细粉样品各10 g,加无菌氯化钠- 蛋白胨缓冲液(pH 7.0)分别制成1∶10(m/V,下同)、1∶100、1∶1 000 和1∶10 000 的供试液。灭菌前样品按2020年版《中国药典(四部)》通则1108 中药饮片微生物限度检查法检查,微生物限度应符合需氧菌总数<105cfu/g,霉菌和酵母菌总数<103cfu/g,大肠埃希菌和沙门菌不得检出,耐胆盐革兰阴性菌<104cfu/g。灭菌后样品按2020年版《中国药典(四部)》通则1105,1106 非无菌产品微生物限度检查法检查,微生物限度应符合需氧菌总数< 104cfu / g,霉菌和酵母菌总数<102cfu/g,大肠埃希菌和沙门菌不得检出,耐胆盐革兰阴性菌<102cfu/g。灭菌率(%)=(样品灭菌前需氧菌总数+灭菌前霉菌及酵母菌总数-样品灭菌后需氧菌总数-灭菌后霉菌及酵母菌总数)/(样品灭菌前需氧菌总数+灭菌前霉菌及酵母菌总数)×100%。
2.3 黄芩苷含量测定
2.3.1 色谱条件与系统适用性试验
色谱柱:Kromasil C18柱(250 mm×4.6 mm,5 μm);流动相:甲醇-0.2%磷酸水溶液(47∶53,V/V);流速:1.0 mL/ min;检测波长:280 nm;柱温:30 ℃;进样量:20 μL。理论板数按黄芩苷峰计不低于4 000,分离度>1.5,基线分离良好。
2.3.2 溶液制备
取黄芩苷对照品适量,精密称定,加甲醇制成质量浓度为0.60 mg/mL 的对照品贮备液;取适量,用甲醇稀释10 倍,摇匀,即得对照品溶液。取样品0.6 g,精密称定,置具塞锥形瓶中,加70%乙醇75 mL,加热回流提取3 h,滤液转移至100 mL 容量瓶中,冷却至室温,加70%乙醇定容,取适量,用70%乙醇稀释20 倍,即得供试品溶液。
2.3.3 方法学考察
线性关系考察、定量限与检测限试验:精密吸取对照品贮备液适量,用甲醇分别稀释至4,10,20,40,100,200 倍,得系列对照品溶液。取适量,按2.3.1 项下色谱条件进样测定,记录峰面积,并以黄芩苷质量浓度(X,μg/mL)为横坐标、峰面积(Y)为纵坐标进行线性回归,得回归方程Y= 4.133 9 × 106X+ 829.3(r= 0.999 8,n=6)。结果表明,黄芩苷质量浓度在3.00~150.00 μg/mL范围内与峰面积线性关系良好。以信噪比(S/N)为3和10 时待测成分的质量浓度分别为检测限和定量限,结果依次为0.039 μg/mL和0.131 μg/mL。
精密度试验:取2.3.2 项下供试品溶液(批号为221101)适量,按拟订色谱条件连续进样测定6次,记录峰面积,结果的RSD为1.41%(n=6),表明方法日内精密度良好。取同一供试品溶液(批号为221101)适量,1 d进样1 次,连续6 d,记录峰面积。结果的RSD为1.86%(n=6),表明方法日间精密度良好。
稳定性试验:取同一供试品溶液(批号为221101)适量,分别于室温下放置0,2,4,7,12,18,24 h 时按拟订色谱条件进样测定,记录峰面积。结果的RSD为1.95%(n= 7),表明供试品溶液室温放置24 h 内基本稳定。
重复性试验:取同一批(批号为221101)样品适量,精密称定,共6 份,按2.3.2 项下方法制备供试品溶液,按拟订色谱条件进样测定,记录峰面积,并计算样品含量。结果黄芩苷含量的RSD为1.51%(n=6),表明方法重复性良好。
加样回收试验:取已知含量的黄芩样品(批号为221101)细粉9 份,每份约0.3 g,精密称定,分别加入3.327 mg/mL黄芩苷对照品溶液8,10,12 mL,按2.3.2项下方法制备供试品溶液,按拟订色谱条件进样测定,记录峰面积,并计算加样回收率。结果平均加样回收率为99.54%,RSD为1.21%(n=9)。
2.3.4 黄芩苷转移率
取灭菌前后样品各适量,按2.3.1项下色谱条件进样测定,记录峰面积并计算黄芩苷的含量及其转移率。黄芩苷转移率(%)= 灭菌后黄芩苷含量/灭菌前黄芩苷含量×100%。
2.4 浸出物含量及浸出率
取样品约3 g,精密称定,置锥形瓶中,精密加入稀乙醇100 mL,按2020年版《中国药典(四部)》通则2201醇溶性浸出物测定法项下的热浸法测定,计算供试品中浸出物含量,并计算浸出率。浸出率(%)=灭菌后浸出物含量/灭菌前浸出物含量×100%。
2.5 高温瞬时灭菌工艺优化
2.5.1 因素与水平
在前期单因素预试验的基础上,以进料速率(A)、灭菌温度(B)、灭菌时间(C)为影响因素,以浸出率、灭菌率、黄芩苷转移率的综合评分为考察指标,采用L9(34)正交试验法进行工艺优选。因素与水平见表1。
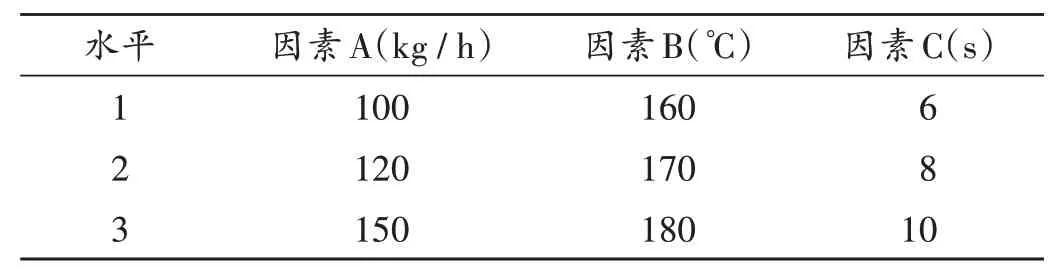
表1 因素与水平Tab.1 Factors and their levels
2.5.2 指标权重考察
AHM:本研究中邀请5名副高级职称及以上药学专家,按AHM 法对3 个考察指标(灭菌率、黄芩苷转移率和浸出率)分别比较指标Pa相对于Pb(a ≠b)的相对重要性ia-b和ib-a,根据数学属性要求ia-b和ib-a满足ia-b≥0,ib-a≥0,ia-b+ib-a=1,ia-a=0 和ib-b=0,构建相对属性判断矩阵(表2)。一致性检验计算公式如下。
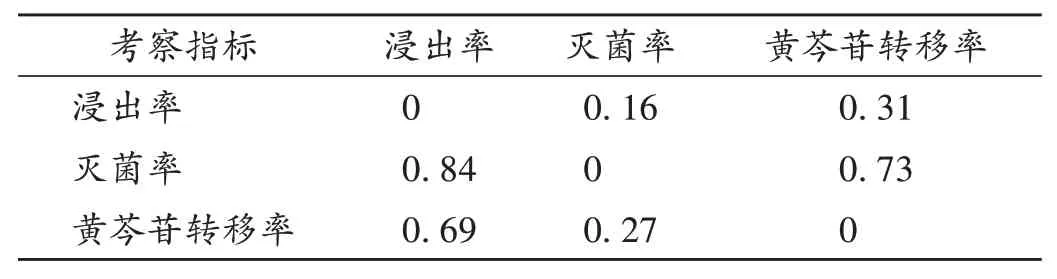
表2 考察指标相对属性判断矩阵Tab.2 Relative attribute judgment matrix of investigation indicators
参考上述公式对相对属性判断矩阵进行一致性检验,同时按公式分别计算3个考察指标的相对权重。结果见表2。可见,所构建的相对属性判断矩阵符合一致性检验要求,表明判断矩阵合理,灭菌率、黄芩苷转移率和浸出率AHM相对权重依次为0.523 3,0.320 0,0.156 7。
EWM:首先对考察指标检测结果的原始数据进行归一化处理,按公式(式中,Zab=;若Zab= 0,则lnZab= 0)计算3 个考察指标(灭菌率、黄芩苷转移率和浸出率)的信息熵,再按公式计算3 个考察指标的相对权重,结果显示灭菌率、黄芩苷转移率、浸出率EWM 相对权重依次为0.727 4,0.189 2,0.083 4。
2.5.3 正交试验设计与结果
取2.1项下高温瞬时灭菌样品,并固定出料温度为35 ℃,L9(34)正交试验设计方案与结果见表3(其中综合评分= 灭菌率× 0.837 9 + 黄芩苷转移率× 0.133 3 +浸出率×0.028 8),方差分析结果见表4。
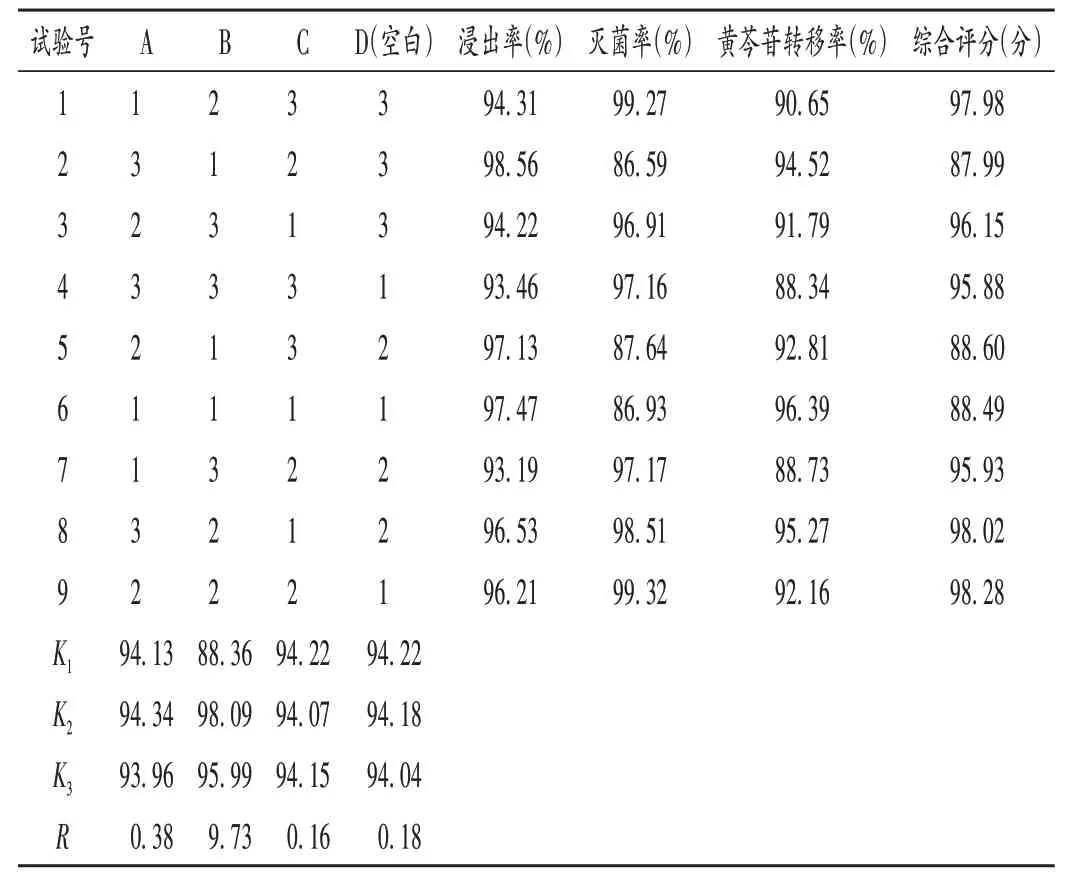
表3 L9(34)正交试验设计及结果Tab.3 Design and results of the L9(34)orthogonal test
由表3 可知,3 个因素作用强度依次为B > A > C。由表4可知,因素B(灭菌温度)对结果有显著影响(P<0.05)。综合表3、表4结果及实际情况,确定黄芩高温瞬时灭菌最佳工艺为A2B2C1,即进料速率为120 kg/h,灭菌温度为170 ℃,灭菌时间为6 s(出料温度为35 ℃)。
2.6 中试验证试验
取3 批黄芩药材样品适量,按2.1 项下方法制备高温瞬时灭菌样品,按优选工艺参数,依法对样品进行高温瞬时灭菌。按2.2项下方法对灭菌前后样品进行微生物限度检查并计算灭菌率,结果见表5(其中- 为未检出);按2.3 项下方法进行黄芩苷含量测定并计算转移率,结果见表6;按2.4项下方法进行浸出物检测并计算浸出率,结果见表7。结果显示,灭菌后样品含菌量明显减少,3 批样品灭菌率均大于99.0%(批号221101,221102,221103样品分别为99.90%,99.43%,99.79%);灭菌前后黄芩苷及浸出物含量无明显变化,黄芩苷转移率及浸出率均大于95.0%。表明工艺重现性好,多指标综合评价黄芩高温瞬时灭菌对有效成分均无影响,优选出的工艺参数可用于样品的高温瞬时灭菌。
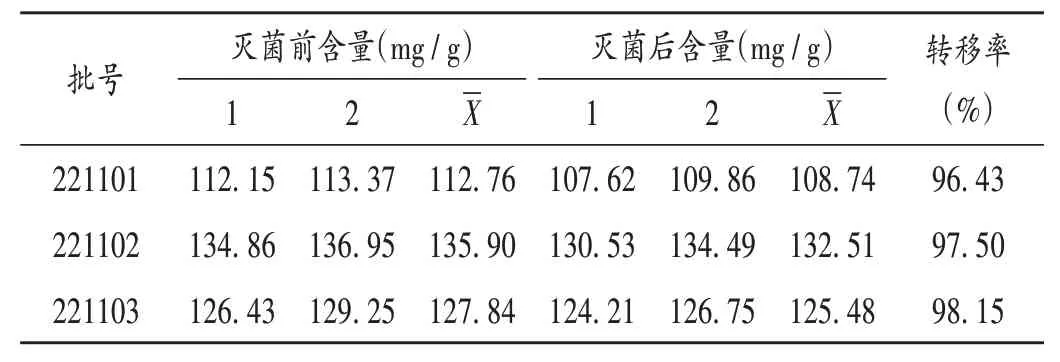
表6 灭菌前后样品中黄芩苷含量及转移率Tab.6 Content and transfer rate of baicalin in samples before and after sterilization
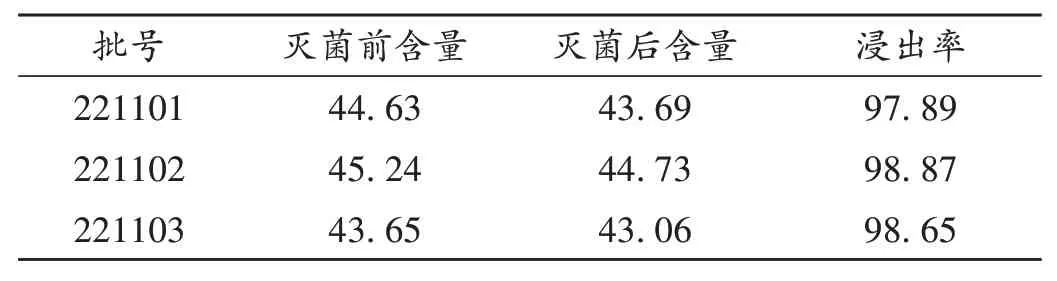
表7 灭菌前后样品浸出物含量及浸出率(%)Tab.7 Extract content and extraction rate of samples before and after sterilization(%)
3 讨论
3.1 高温瞬时灭菌因素水平选择
中药细粉按试验设定的进料速率进入高温瞬时灭菌设备,搅拌桨带动物料旋转,使物料悬浮于高速流动过热蒸汽中,实现对中药细粉的高温瞬时灭菌,灭菌后细粉经汽料分离冷却系统进行快速物料分离并急骤冷却,降低了中药细粉中有效成分的流失。进料速率、搅拌旋转速率、灭菌温度、蒸汽压力、灭菌时间、物料出口温度等工艺参数均会直接影响灭菌效果和中药细粉质量,优化高温瞬时灭菌工艺参数对于确保产品质量具有重要意义。本研究中选取进料速率、灭菌温度和灭菌时间等关键因素,采用L9(34)正交试验法对黄芩高温瞬时灭菌工艺进行优化。通过单因素预试验摸索,最终确定正交试验中3个指标的水平。
3.2 正交试验评价指标选择
灭菌设备及工艺能否有效实施不仅要考虑灭菌效果,同时还需确保所灭菌物料的产品质量。2020年版《中国药典(四部)》分别对中药饮片和非无菌产品需氧菌总数、霉菌和酵母菌总数、大肠埃希菌、沙门菌及耐胆盐革兰阴性菌进行了具体规定,大肠埃希菌和沙门菌均为不得检出,同时中药饮片中耐胆盐革兰阴性菌含菌量通常较低,遂考虑将需氧菌总数、霉菌和酵母菌总数作为黄芩高温瞬时灭菌工艺灭菌效果评价指标,同时规定中药饮片需氧菌总数< 105cfu/ g,霉菌和酵母菌总数< 103cfu/ g,非无菌含药材原粉产品需氧菌总数<104cfu/g,霉菌和酵母菌总数<102cfu/g,故最终将灭菌率作为灭菌效果评价指标。黄芩苷为黄芩特征成分和主要活性成分,浸出物含量也直接影响着黄芩的产品质量,为确保试验结果的准确性和可靠性,对灭菌前后黄芩苷转移率和浸出率进行分析,并将其作为黄芩药材高温瞬时灭菌工艺产品质量保障评价指标,对黄芩药材高温瞬时灭菌工艺进行优化。同时将微生物限度检查、黄芩苷含量、浸出物含量等指标作为中试验证产品的检测指标,确保优化后的最优工艺能满足黄芩药材高温瞬时灭菌的要求。
3.3 方法评价
本研究中优化后的黄芩药材高温瞬时灭菌工艺重复性好,灭菌效果良好,灭菌后样品符合2020年版《中国药典(四部)》非无菌含药材原粉的固体口服给药制剂项下的相关规定,灭菌率达99.0%,能满足产品生产需要;同时灭菌前后黄芩苷及浸出物含量无明显变化。本研究中为推进高温瞬时灭菌新方法在中药灭菌生产中的应用提供了数据支持。然而,中药材种类繁多,高温瞬时灭菌是否适用于花类、叶类、果实类、含挥发油类、芳香类等中药材的灭菌,还有待进一步论证。

