射频消融与外科手术在富动脉血供肿块型肝内胆管癌中的疗效对比
沈少博,彭帅,吴慧,张坤,李芳,李炳荣,纪建松
丽水市中心医院,浙江 丽水 323000,1.放射科,3.肿瘤介入中心,4.肝胆外科;2.广西医科大学第一附属医院 放射科,广西 南宁 530021
肿块型肝内胆管癌(intrahepatic mass-forming cholangiocarcinoma,IMCC)具有高度侵袭性,即便是在行根治性手术切除后,肿瘤的复发转移概率也较高[1]。但近来有学者发现影像上呈现动脉期大面积高强化的IMCC患者却有着非常良好的预后[2],该研究结论给IMCC患者的术前评估提供了非常有价值的参考。然而,这种富动脉血供IMCC却极容易被误诊为肝细胞癌(hepatocellular carcinoma,HCC)[3],这可能会导致该类患者在未经组织学确认的情况下接受射频消融(radiofrequency ablation,RFA)、经导管动脉化疗栓塞术(transarterial chemoembolization,TACE)等适用HCC的介入方案进行“根治”。由于肝内胆管癌目前唯一公认的根治性治疗标准仍是外科手术[4],因此临床有必要对这种误判下的介入“根治”方案在富动脉血供IMCC中的疗效进行观察研究,这可以为IMCC后续诊治方案的改进与细化提供一定借鉴。
1 资料和方法
1.1 一般资料
回顾性分析2014 年9 月至2020年4 月间丽水市中心医院(13例)和广西医科大学第一附属医院(24例)经病理证实且增强MRI表现为动脉期富血供的IMCC患者资料,获医院伦理委员会批准(批号分别为2023-632,2023-E543-01),患者均知情同意。
纳入标准:(1)IMCC为单发;(2)动脉期具有大范围高强化的IMCC(本次研究将病灶在绝大多数层面上于动脉期时发生明显强化且明显强化区面积大于50%者判定为富动脉血供IMCC);(3)首诊MRI检查与取得病理检查结果的时间间隔不超过2个月。排除标准:(1)无MRI增强检查资料;(2)围管浸润型或管内生长型肝内胆管癌;(3)患者有其他脏器恶性肿瘤史;(4)无复查资料者。符合上述标准的病例按其根治性方案分为手术组(n=24)及介入组(n=13),比较两组临床、影像及预后差异。
1.2 治疗方法
RFA方法为静脉基础麻醉和2%利多卡因局麻后使用18 G穿刺针按预定方向及深度进入肝内占位,切取组织2条;然后采用微波穿刺针进入肝内病灶,扫描确定微波针针尖所在部位后设定功率45 W,消融时间为10 min,同法行多点消融后烧灼穿刺通道并退出微波针。TACE方法为心电监护下右腹股沟2%利多卡因局麻后,采用Seldinger穿刺法穿刺右股动脉,将导管头后造影观察肿瘤动脉走行,再将微导管超选至肿瘤供血动脉内并注入奥沙利铂100 mg和碘化油10 mL,在碘化油在病灶内明显沉着后将导管固定于肝固有动脉内并间断注入肝素盐水。手术治疗采用局部切除或肝段解剖性切除。
1.3 影像学分析
去除相关信息后导出患者影像资料,由两名均有12年以上肝胆成像经验的副高级职称影像诊断医师通过Dicom软件阅片共同评估相关征象并达成一致意见。评估内容包括:(1)病灶的部位与长径;(2)病灶的动脉期强化表现;(3)病灶周围有无动脉期异常灌注强化;(4)有无腹腔淋巴结增大。
1.4 观察指标
记录患者一般资料、术前实验室指标、病灶影像学征象、病理分化程度、术后并发症情况及肿瘤有无复发等资料。
1.5 随访
通过电话及门诊复查进行预后随访,约每6 个月随访1次,随访日期截至2023年8月30日。
1.6 统计学分析
采用SPSS 21.0软件进行统计分析。符合正态分布的计量资料以()表示,组间比较采用独立样本t检验。不符合正态分布的计量资料,以M(P25,P75)表示,计数资料以频数(%)表示,组间比较均采用Mann-whitneyU检验。组间生存率分析采用Kaplan-Meier分析和对数秩检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组治疗前一般资料、病灶影像和术后病理分化程度对比
37 例术前均被误诊为“HCC”的富动脉血供IMCC患者纳入研究。手术组24例,其中17例行局部切除术、7 例行肝段解剖性切除,均为R0 切除。介入组13 例,均由穿刺病理证实,其中TACE联合RFA治疗5例;单纯RFA治疗8例(图1),4例因“消融不足”,在首次RFA后5 d~4周内接受第二次RFA以灭活残留癌灶。两组患者Child-Pugh分级均为A级,巴塞罗那分期均为A期。两组在性别、年龄、HCC高危风险类型、实验室检验(甲胎蛋白、糖链抗原199、凝血酶原时间、白蛋白、总胆红素、丙氨酸转氨酶、白细胞、血小板、中性粒细胞)数值异常的例数、肿瘤部位、肿瘤长径、有瘤周异常灌注强化的例数、有腹腔淋巴结增大的例数、肿瘤分化程度等资料的对比,差异均无统计学意义(均P>0.05),见表1。

表1 两组治疗前一般资料、病灶影像学资料和术后病理分级资料比较
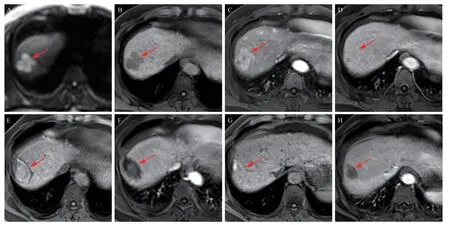
图1 接受射频消融的富动脉血供IMCC患者磁共振影像(箭头所示为病灶/术区)
2.2 两组治疗后预后情况对比
研究期间介入组和手术组中位随访时间分别为77.9(56.9,93.7)个月和72.1(57.7,87.6)个月,介入组死亡4例、存活9例、复发7例;手术组死亡7例、存活17例、复发12例。两组生存总时间、无瘤生存时间、总生存率、无瘤生存率差异和比较结果见表2。两组总生存(overall survival,OS)与无瘤生存(relapse-free survival,RFS)曲线见图2。

表2 介入组与手术组预后指标比较
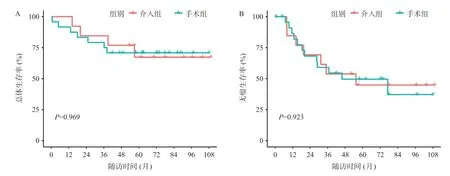
图2 富动脉血供IMCC患者介入或手术治疗后总体生存曲线图(A)和无瘤生存曲线(B)
介入组术后总并发症发生率低于手术组[38.5%(5/13)vs91.7%(22/24),Z=-3.432,P=0.001],术后疼痛[30.8%(4/13)vs75.0%(18/24),Z=-2.580,P=0.010]、肝功能损害[0vs33.3%(8/24),Z=-2.319,P=0.020]、感染[0vs54.2%(13/24),Z=-3.250,P=0.001]发生率均明显少于手术组;而两组发热[7.7%(1/13)vs16.7%(4/24)]、胸腔/腹腔积液[0vs8.3%(2/24)]、脏器衰竭[0vs8.3%(2/24)]发生率差异无统计学意义(均P>0.05),两组均未发生术区出血。
3 讨论
介入医学目前在IMCC中的应用大多是辅助肿瘤降期、复发/转移灶的局部控制或仅为姑息治疗,临床一般不会在已获知病理的情况下对IMCC采用介入方案进行根治[5-7]。既往与本研究类似的文献仅有少数个例报道,这可能是因呈现动脉期大范围高强化的IMCC临床很少见,也或许是介入治疗时临床不会再进行病理确认(病灶已被误诊为HCC)。但这些个案报道的富动脉血供IMCC患者在接受RFA“根治”后却均获得了长期的无瘤生存[8-9],并且部分案例的病灶长径也突破了3.0 cm这个IMCC射频治疗的重要参考阈值[10],达到4.0 cm或近5.0 cm。这说明相比临床常见的“乏血供”IMCC而言,RFA对富动脉血供IMCC的治疗可能会收获更好的疗效。
诚然,采用RFA为核心的介入根治术是富动脉血供IMCC误诊为HCC后的非标准治疗方案,但本研究结果表明介入组与手术组患者的OS与RFS差异并无统计学意义,换句话来说,即便是将富动脉血供IMCC误诊为HCC进行介入根治可能也不会影响患者的预后获益。笔者认为基于以下原因,RFA为核心的介入医学可成为富动脉血供IMCC的根治性治疗方案供临床选择。(1)病灶长径、有无血管浸润、有无淋巴结转移等因素与IMCC患者的预后密切相关[11-12],这些因素同时也是肝癌介入治疗中的重要评估指标;研究表明富动脉血供IMCC通常为单发、病灶长径较小、出现微血管浸润的概率很低、罕见淋巴结转移[13-14],这显然大幅拓展了介入治疗对IMCC进行根治的适应证范围。(2)本研究显示富动脉血供IMCC好发于有HCC高危风险的患者,尤其是乙肝患者;而近年来研究认为发生于乙肝的IMCC其临床生物学特性更类似于HCC而并非胆道恶性肿瘤[15-16],此观点或许也在提示可以将富动脉血供IMCC当作是一种特殊类型的HCC进行介入根治。(3)介入治疗创伤较小、并发症出现概率较低,对于年龄较大、基础疾病较多的患者来说更为安全[17]。(4)研究表明富动脉血供IMCC病灶周围常可见较多淋巴细胞呈环状或片状聚集[13],这种免疫反应或许降低了肿瘤的侵袭性。但需要指出的是,富动脉血供IMCC一般无假包膜且呈浸润性生长,这意味着病灶的形态往往不规则,可能导致术者对拟消融区域评估不足而增大“肿瘤局部残存”风险(本研究中4 例);因此临床在RFA前应全面观察病灶的形态以确保消融区域可全面覆盖,同时也应在术后积极影像随诊以确保病灶被彻底灭活。综上所述,RFA很可能是富动脉血供IMCC的一种有效根治方案。
本研究的局限性:(1)富动脉血供IMCC临床很少见,研究的样本量偏少;(2)介入组均为穿刺病理,无法完全排除因采样偏差对病理结果的影响。在今后除了要扩大样本量进行回顾性分析以期对本研究结论进行验证之外,也应该在准确识别病灶是富动脉血供IMCC的基础上(例如通过影像组学等方式)开展前瞻性研究,进一步确定RFA在富动脉血供IMCC治疗时的病灶长径阈值以及使用胆管癌常用化疗药物(例如吉西他滨)进行TACE联合RFA时的疗效。
利益冲突所有作者声明无利益冲突。

