PD-1抑制剂预防肝细胞癌消融术后复发的临床研究
张洪海,袁春旺,生守鹏,张永宏,孙玉
首都医科大学附属北京佑安医院 肝病与肿瘤介入治疗中心,北京 100069
原发性肝癌是我国目前排名第四位的常见恶性肿瘤和排名第二位的肿瘤致死病因,其中肝细胞癌(hepatocellular carcinoma,HCC)是最常见的病理类型[1-2]。局部消融术作为HCC根治性治疗方案之一,目前已经广泛用于早、中期肝癌的治疗,患者长期生存率与外科切除术类似[3]。但不论是肝切除术还是局部消融术,HCC患者5 年复发率仍高达40%~70%[4-5],因此,降低肝癌根治性治疗后的复发率是提高患者生存率的重要举措之一。关于HCC根治性治疗后的抗复发,目前尚无统一方案。程序性细胞死亡受体-1(programmed cell death protein-1,PD-1)抑制剂因其可通过阻断PD-1与程序性细胞死亡-配体1(programmed cell death-ligand 1,PD-L1),恢复和提高T细胞对肿瘤细胞的有效识别和杀伤,发挥抗肿瘤治疗效果,目前已广泛用于中晚期肝癌的治疗,取得了较为肯定的临床疗效[6]。有研究表明,肝癌外科切除术后辅助性应用PD-1抑制剂可有效降低肝癌复发率,提高患者生存率[7]。但PD-1抑制剂对于肝癌根治性消融后的复发预防研究相对较少。本研究分析了肝癌患者根治性局部消融术后辅助性应用PD-1抑制剂的临床效果,旨在为指导肝癌临床治疗及预后判断提供依据。
1 资料和方法
1.1 研究对象
前瞻性选择2021 年1 月至2023 年3 月在北京佑安医院行肝动脉栓塞(transcatheter arterial embolization,TAE)序贯局部消融术治疗的HCC患者。
病例纳入标准:(1)首次经临床或病理学确诊为HCC,诊断标准参照《原发性肝癌诊疗指南(2022年版)》[1];(2)所有患者经过TAE序贯1~2 次射频消融(radiofrequency ablation,RFA)或微波消融(microwave ablation,MWA)治疗,目的均为使每个肿瘤达到完全消融。治疗结束后1 个月行腹部增强MRI或CT检查,肿瘤达到完全消融;(3)存在至少一项肝癌高危复发风险因素:①单发肿瘤最大径>5 cm;②多发肿瘤;(4)所有肿瘤均无血管、胆管和邻近器官侵犯及远处转移;(5)肝功能Child-Pugh A级或B级;(6)不合并其他恶性肿瘤;(7)无心、脑、肺、肾等重要器官严重器质性病变;(8)无活动性感染或消化道出血;(9)术前与患者充分沟通病情,获得患者和委托人知情同意。本研究方案获得本院伦理委员会批准(批号:京佑科伦字[2020]118号)。
1.2 治疗方法及分组
(1)TAE:采用改良Seldinger法穿刺股动脉,腹腔动脉或肝总动脉造影,明确肿瘤大小、数目、位置及血供,选择性插管至肿瘤供血动脉,根据肿瘤大小和数目,应用超液化碘油和明胶海绵颗粒栓塞肿瘤供血动脉。术后1周复查腹部平扫CT,与术前腹部增强CT或MRI对比,明确消融病灶。
(2)局部消融术:CT扫描定位,确定进针路径,RFA针或MWA天线经皮经肝脏穿刺入肿瘤病灶,根据肿瘤大小及位置选择消融条件进行局部消融治疗,术后即刻行腹部增强CT判断消融效果及有无并发症。术后1 个月再次行腹部增强MRI或CT检查,明确是否完全消融,未完全消融者行补充消融,直至达到完全消融。
(3)分组:根据患者本人意愿非随机分配至试验组或对照组。①试验组:定期给予患者PD-1 抑制剂卡瑞利珠单抗(江苏恒瑞医药公司,国药准字S20190027)治疗(200 mg,静脉滴注30~60 min,每3 周1次),共8次,后进入规律随访。②对照组:无抗复发辅助治疗,规律随访,随访时间及频率同试验组。
1.3 随访
试验组用药期间,每3周随访1次,用药结束后每3个月随访1次,随访终点为2023年11月。记录无复发生存期(relapse free survival,RFS),即肿瘤完全消融至复发或随访截止时间。
1.4 观察指标及随访
(1)人口学资料(性别、年龄);(2)患者临床症状及体征;(3)实验室指标:肝炎病毒指标[包括乙型肝炎病毒(hepatitis B,HBV)和丙型肝炎病毒(hepatitis C,HCV)]、Child-Pugh分级、甲胎蛋白(alpha fetoprotein,AFP)、血小板(platelat,PLT)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)、γ-谷氨酰转肽酶(γ-glutamyl transpeptidase,γ-GT)、碱性磷酸酶(alkaline phosphatase,ALP)、凝血酶原时间(prothrombin time,PT)、白蛋白(albumin,ALB)、总胆红素(total bilirubin,TBIL),计算白蛋白-胆红素(albumin-bilirubin,ALBI)=0.66×(Log10TBIL)-0.085×ALB(TBIL单位为μmol/L,ALB单位为g/L),ALBI分级标准为:1 级(<-2.60)、2 级(-2.60~-1.39)、3级(>-1.39);(4)影像学资料:肝脏增强CT或MRI检查,收集肿瘤情况。
1.5 统计学分析
应用SPSS 22.0软件进行统计分析。计数资料以百分数表示,组间比较采用χ2检验。Kaplan-Meier法绘制累计复发率曲线,Log-rank检验比较两组生存率差异;应用Cox单因素分析得出影响HCC患者局部消融术后RFS的因素,Cox多因素回归分析得出独立危险因素。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者基线资料
本研究共纳入HCC患者63例,其中男50例,女13例;年龄39~74岁,平均(59.13±8.30)岁。试验组31例,对照组32例。两组患者性别、年龄、肝病病因、肝硬化、血常规、肝功能、肿瘤参数、消融方式比较,差异均无统计学意义(均P>0.05),具有可比性,见表1。

表1 两组患者基线资料比较(例)
2.2 两组患者治疗情况
所有肿瘤均进行了TAE+消融治疗,如果肿瘤最大径较小,一次消融术可消融2~3个肿瘤。试验组基线共有52个肿瘤,其中45个富血供肿瘤,碘油沉积密实,7个乏血供肿瘤,碘油沉积欠佳;行RFA术16 次,MWA术15 次。对照组共有55 个肿瘤,其中47个富血供肿瘤,碘油沉积密实,8个乏血供肿瘤,碘油沉积欠佳;行RFA术21次,MWA术11次。两组患者TAE序贯局部消融术治疗期间,均无严重腹腔出血、肝脓肿、肝功能衰竭、治疗相关死亡等严重不良反应出现。
试验组应用PD-1 抑制剂卡瑞利珠单抗治疗过程中,共27例患者发生免疫相关不良事件(immunerelated adverse events,irAE),包括反应性皮肤毛细血管增生症(reactive cutaneous capillary endothelial proliferation,RCCEP)、甲状腺功能异常、肝功能异常、血小板计数减少、腹泻、乏力等,其中1~2 级irAE发生率为92.59%(25/27),≥3级irAE为7.41%(2/27),1例患者因免疫性结肠炎停药,1例因严重乏力停药,无治疗相关死亡。
两组治疗后随访2~15个月,中位随访时间8个月。试验组13例患者(41.94%)复发,均为肝内复发,无远处复发;对照组22例患者(68.75%)复发,其中20例为肝内复发,2例出现远处转移。两组复发率相比,差异有统计学意义(χ2=4.59,P=0.03)。试验组中位RFS 11个月(95%CI7.53-14.47),对照组中位RFS 6个月(95%CI4.05-7.96),试验组RFS高于对照组,Log-rank检验结果显示两组差异有统计学意义(χ2=9.07,P<0.01)。见图1。
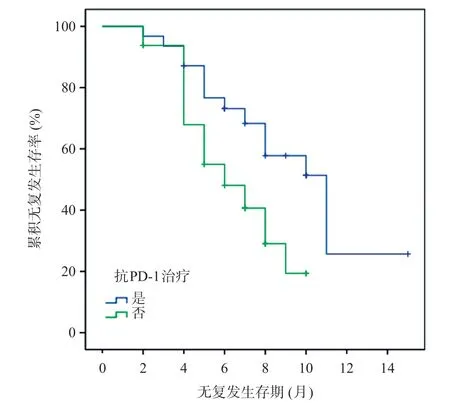
图1 两组患者累积无复发生存率比较
2.3 影响HCC患者局部消融术后RFS的单因素和多因素分析
单因素分析显示:肿瘤最大径(≤5 cm/>5 cm)和卡瑞利珠单抗抗PD-1治疗(是/否)对HCC患者局部消融术后RFS影响差异有统计学意义(P<0.05)。将单因素分析中P≤0.1 的指标包括肿瘤最大径、肿瘤数目、AFP、抗PD-1 治疗纳入Cox多因素回归模型,结果显示,肿瘤最大径与抗PD-1 治疗是HCC患者根治性局部消融术后RFS的独立影响因素(P<0.05)。见表2。
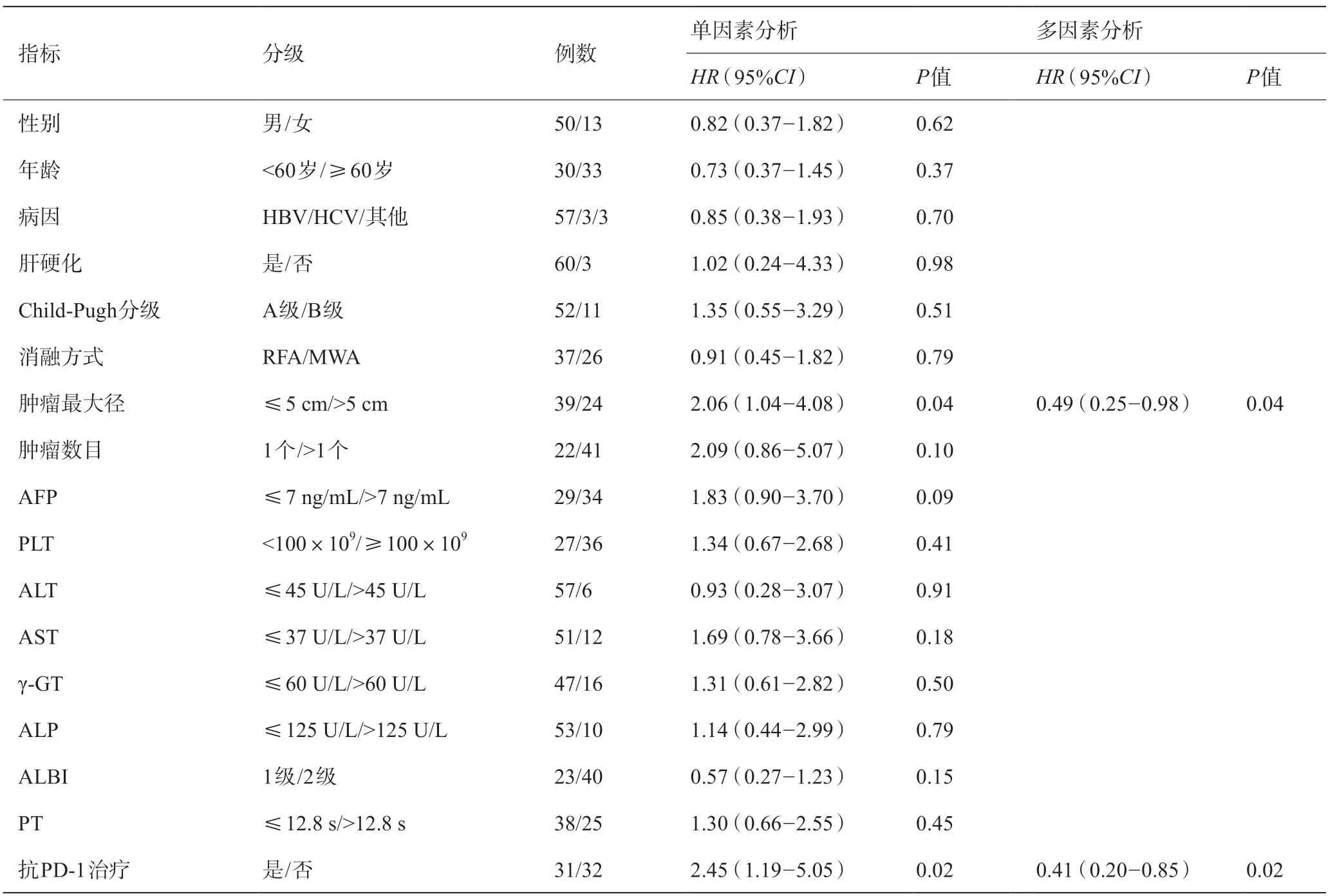
表2 影响HCC患者局部消融后RFS的单因素和多因素分析(n=63)
3 讨论
局部消融术和肝切除术均是HCC的根治性治疗方法,但均存在一定的复发率。一项HCC病理学研究表明,最大径小于2 cm的肿瘤中约10%存在显微镜下肝内转移,约27%合并微血管侵犯[8],因此即使是极早期肝癌也有复发的风险。肝癌消融术后复发是决定患者长期生存的关键因素,如何预防复发是临床医师极为关注的问题,但目前国内外尚无统一的推荐预防方案。有研究发现,肝癌经过RFA或MWA治疗后可释放肿瘤相关抗原,后者可被抗原递呈细胞呈递给CD8+T淋巴细胞;识别这些抗原后,CD8+T细胞被激活并到达肿瘤位点如微卫星灶,识别并攻击肿瘤细胞[9]。而PD-1 抑制剂可通过阻断T细胞表面的PD-1/PD-L1信号通路,防止肿瘤免疫逃逸,诱导肝脏中残留的微卫星病灶坏死。Duffy等[10]研究证实肝癌局部消融术联合免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)治疗后肿瘤组织内CD8+T细胞明显增加,研究者认为ICIs可增强局部消融术后的免疫激活效应。因此我们推测,肝癌经局部消融术后,加用PD-1抑制剂能更好地预防肿瘤复发。
本研究采用前瞻性研究方式探讨真实世界中肝癌完全消融后高复发风险人群抗肿瘤复发的方案疗效。结合国内外关于HCC根治性治疗后高危复发风险因素的研究[11-12],本研究的入组患者为基线单发肿瘤最大径>5 cm或多发肿瘤患者。在两组患者基线特征差别无统计学意义的前提下,试验组患者加用PD-1抑制剂卡瑞利珠单抗辅助抗复发治疗,研究结果显示,相比对照组,应用PD-1抑制剂的试验组患者RFS明显延长。进一步对影响HCC患者消融术后的复发因素进行分析发现,PD-1抑制剂治疗是HCC患者消融术后RFS的独立危险因素,提示PD-1抑制剂辅助治疗可降低HCC消融术后高危患者的复发风险。Li等[7]对517例根治性切除术后高复发风险肝癌患者进行研究,其中53例接受了ICIs辅助治疗,结果显示接受辅助治疗的患者RFS及总生存期明显长于未接受辅助治疗的患者,同样提示ICIs可改善HCC根治性切除术后复发高风险患者的RFS。Wang等[13]回顾性分析了接受PD-1抑制剂联合RFA对比单独接受RFA治疗HCC的效果,研究发现两组患者1 年无复发生存率分别为32.5%和10.0%,总生存期分别为50.9周和47.3周,两组在无复发生存率(P=0.001)和总生存期(P=0.016)方面差异均存在统计学意义,提示联合治疗效果优于单独治疗,与本研究结论相符。需要注意的是,辅助治疗的不良反应是影响患者依从性及治疗效果的重要因素。PD-1抑制剂在抗肿瘤的同时,也会给正常机体组织带来免疫相关损伤,本研究观察到PD-1抑制剂1~2级irAE为92.59%,≥3级irAE为7.41%,未出现irAE相关死亡病例,提示应用PD-1抑制剂辅助治疗8周期安全性良好。
多数研究认为随着肿瘤最大径增加、肿瘤数目增多、AFP水平升高,肝癌复发风险增加[11-12,14]。为减少复发,本研究中所有患者局部消融术前均联合TAE,这样不仅能再次明确肿瘤部位、数目及大小,发现术前影像学检查可能遗漏的隐匿病灶,而且可使肿瘤提前去血管化,有助于提高后续消融的疗效。尽管如此,本研究结果依然显示肿瘤最大径是影响HCC患者消融术后RFS的独立危险因素;肝癌多呈浸润性生长,肿瘤最大径越大,侵袭周围血管发生肝内转移的可能性越大。另外,本研究中AFP水平、肿瘤数目不是影响HCC患者复发的独立危险因素,除考虑与单中心入组患者较少有关外,也侧面反映出PD-1抑制剂辅助治疗和肿瘤最大径对肝癌复发的影响更大。
综上所述,PD-1抑制剂用于肝癌消融术后高复发风险患者的辅助治疗初显成效。但本研究为单中心研究,存在一定局限性;另外,为降低药物相关不良反应,本研究仅对高复发风险患者进行研究,患者存在选择偏倚;再者,本研究随访时间较短,结果仅提示短期内疗效,也尚未发现PD-1抑制剂的严重不良反应,还需延长随访时间,扩大样本量,评估PD-1抑制剂的长期疗效及安全性,从而为临床提供更多的治疗依据。

