PA-TACE的时机选择对肝细胞癌患者根治性切除术后近期预后的影响
顾炜,张智勇,吴鸣宇,季圆
南京医科大学附属无锡人民医院/南京医科大学无锡医学中心,江苏 无锡 214023,1.肝胆外科,2.健康管理中心
肝细胞癌(hepatocellular carcinoma,HCC,简称肝癌)是全球五大恶性肿瘤之一,全世界每年新增肝癌病例约90万,新增死亡病例83万[1]。近年来,我国肝癌病例数量持续增加,患者总数已超过全世界肝癌患者总数的50%。目前手术仍是肝癌最为有效的治疗手段,近年来随着外科技术的不断提高,腹腔镜技术、达芬奇机器人技术的不断成熟,手术器械的不断革新,肝癌手术切除的成功率也随之大大提高,显著改善了患者术后生存率。但肝癌术后复发率高的问题仍然无法彻底解决。有报道称我国每年新增肝癌患者约37万例,手术切除率仅为30%左右,肝癌术后5 年内复发转移率高达70%左右[2]。术后辅助性肝动脉化疗栓塞(postoperative adjuvant transarterial chemoembolization,PA-TACE)目前被广泛应用于肝癌切除术后伴有高复发风险的患者的治疗,高复发风险包括大血管侵犯、微血管侵犯(microvascular invasion,MVI)、肿瘤多发及肿瘤最大径>5 cm等[3]。PA-TACE作为预防肝癌术后早期复发转移的重要手段,已被临床上一致认可。但外科手术后具体多久接受预防性TACE治疗为宜,目前尚未有统一的规定。金志成等[4]研究认为,原发性肝癌患者切除术后随着接受预防性TACE治疗时间的延迟,其复发率会明显增长。为此,本研究探讨PA-TACE的时机选择对HCC患者手术切除近期预后的影响,现报道如下。
1 资料和方法
1.1 一般资料
回顾性分析南京医科大学附属无锡人民医院2015年1月至2021年12月收治的125例肝癌切除术后半年内接受TACE治疗的原发性肝癌患者的临床资料。本研究经我院临床研究伦理委员会批准(批号:2022 科研伦审第9 号),治疗方案经患者本人知情同意。
纳入标准:(1)行肝癌根治性切除术;(2)术后病理证实为HCC;(3)术后半年内接受TACE治疗;(4)术后未接受其他方式治疗;(5)TACE治疗前肝功能Child-Pugh评分为A级或B级;(6)TACE治疗前营养状况良好,PS-SGA评分0~3分,PS评分0~2分,能耐受介入治疗;(7)巴塞罗那(BCLC)分期0/A期或B期,无远处转移,门静脉主干未完全阻塞。排除标准:(1)合并其他脏器(如心、肺、肾等)功能不全;(2)凝血功能异常,且通过药物治疗无法纠正;(3)TACE治疗前明确已有肿瘤复发或转移;(4)临床资料不全,或术后失访。
22 例患者被剔除,其中4 例术后接受其他治疗方式,3例术后失访,6例发生远处转移,5例接受了姑息性切除,4例临床资料不全,最终实际纳入103例患者。
1.2 病例分组
103例患者根据肝癌根治性切除术后接受TACE治疗的时间不同,分为2组。观察组:术后4~8周内接受TACE治疗,共53例;对照组:术后9~26周接受TACE治疗,共50例。所有入组患者均在TACE治疗前3 d接受术前评估,进行肝功能、肾功能、凝血功能、AFP检测。
1.3 TACE治疗方法
两组患者均应用Seldinger技术将导管经右侧股动脉高选择性插入肝固有动脉,灌注氟尿嘧啶(5-Fu)500~1 000 mg、奥沙利铂100~200 mg,并以超液化碘油5~10 mL和丝裂霉素(MMC)6~10 mg制成的混悬剂栓塞。具体剂量根据患者体表面积确定。如有复发,可间隔2个月后重复应用,期间最多不超过4次。
1.4 观察指标及评价标准
1.4.1 复发率和生存率 比较两组患者肝癌根治性切除术后2年复发率、2年生存率。肿瘤复发判定标准:(1)下列任何一项影像学检查,包括彩超造影、增强CT、增强MRI或肝动脉造影,提示肝占位性病变,且符合原发性肝癌特征;(2)血清AFP>400 ng/mL,排除妊娠或活动性肝病、生殖腺胚胎源性肿瘤以及消化道肿瘤[5]。
1.4.2 不良反应发生率 比较TACE治疗期间两组患者不良反应的发生率。
1.4.3 PS评分 采用PS评分对两组患者肝癌根治性切除术后2 年的体力状况进行评价,根据患者照顾自己的能力、日常活动和身体能力(行走、工作等),将患者的体力状况分为0~5共6个级别。级别越高,患者的体力状况越差[6]。
1.4.4 Child-Pugh评分 采用Child-Pugh评分对两组患者外科手术后2 年的肝功能进行评价,根据血清胆红素、凝血酶原延长时间、血清白蛋白、是否合并腹水及是否合并肝性脑病这5项指标进行评价,每项指标0~3分,其中3分最严重;总得分5~6分,提示肝脏功能正常,7~9 分,提示轻中度肝功能损害,10~15分,提示严重肝功能损害[7]。
1.4.5 PG-SGA评分 采用PG-SGA评分对两组患者外科手术后2 年的营养状况进行评价,根据对患者的体质量、摄食情况、症状、活动和身体功能、疾病与营养需求的关系、代谢需求、体格检查7个方面,将患者的营养状况分成4类:0~1分(无营养不良)、2~3 分(轻度营养不良)、4~8 分(中度营养不良)、≥9分(重度营养不良)[8]。
1.4.6 FPS-R评分 采用修订版面部表情疼痛量表(FPS-R)评分对两组患者外科手术后2 年的疼痛情况进行评价。FPS-R量表由6 个面部表情脸谱组成,从左至右依次表情越来越痛苦,并给予相应的分数(0~10),0分表示无痛,10分代表最痛,分值越高疼痛越严重;最后由患者根据其自身感受选出代表其疼痛程度的面部表情脸谱,并统计出相应的分数[9]。
1.4.7 生活质量评分 采用肝癌患者生活质量测评量表(QOL-LC V2.0)对两组患者肝癌根治性切除术后2年的生活质量进行评价,即从患者的躯体、心理、症状/副作用以及社会功能等多个方面进行评价,分值越高表示患者的生活质量越好[10]。
通过电话问卷调查和社区门诊复查等方式,对两组患者进行为期2年的追踪随访,TACE治疗后半年内,每隔1 个月至当地社区医院复查肝功能、血AFP及肝脏彩超,半年后每隔3个月复查一次。对疑似复发转移者进一步行超声造影、上腹部增强CT或增强MRI检查。随访内容包括两组患者的复发情况及生存状况。
1.5 统计学分析
用SPSS软件进行统计分析。计数资料用[例(%)]表示,两组比较采用χ2检验;符合正态分布的计量资料组间比较采用t检验,不符合正态分布的计量资料组间比较采用Wilcoxon检验。采用Kaplan-Meier方法进行生存分析。P<0.05表示差异具有统计学意义。
2 结果
2.1 两组患者基线特征比较
两组患者肝癌根治性切除术前,基线指标比较差异均无统计学意义(均P>0.05),具有可比性,详见表1。
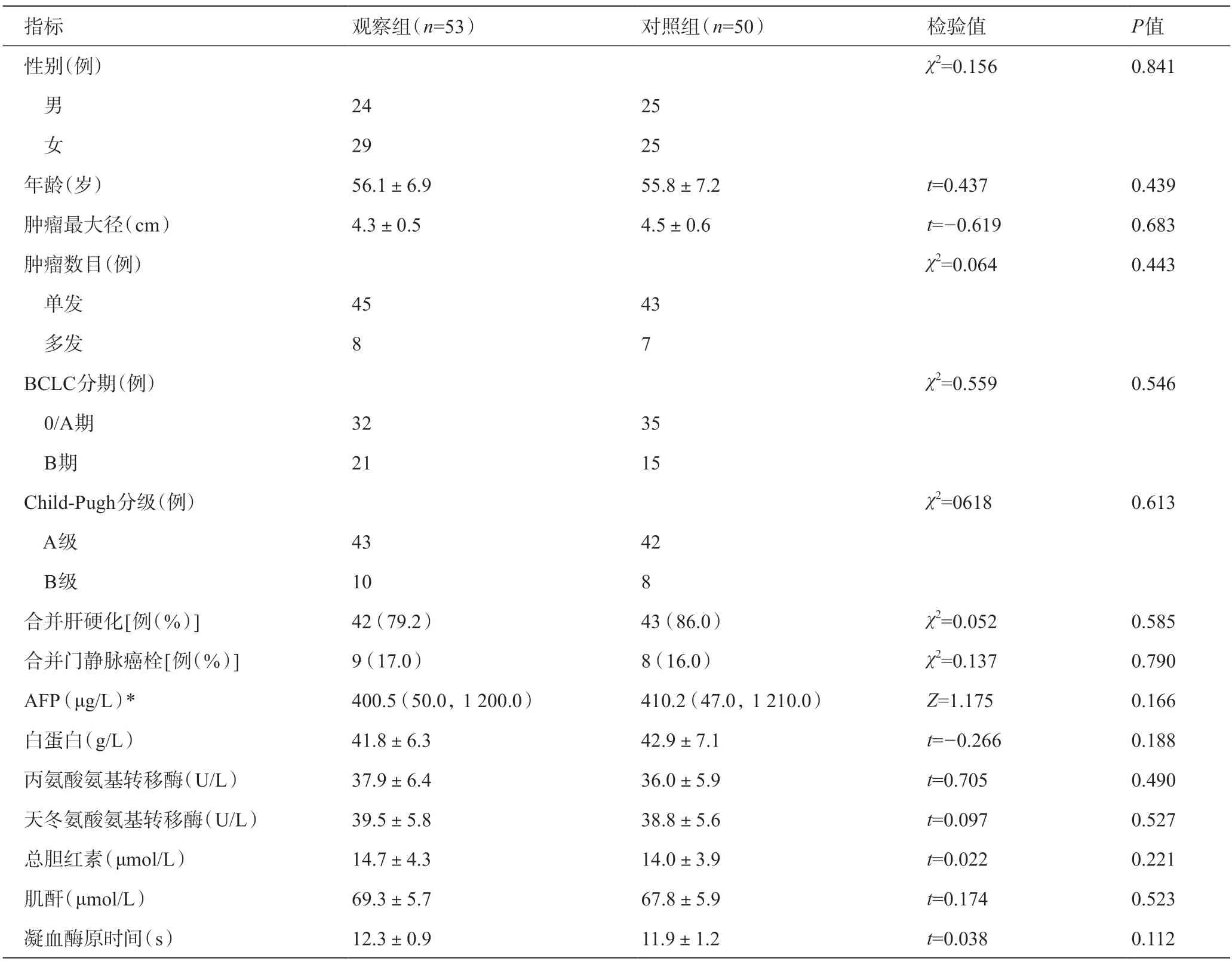
表1 两组患者基线指标比较
2.2 两组根治性切除术后2年复发率和生存率比较
肝癌根治性切除术后2 年内,随访对象先后共有17 例死亡,其中观察组6 例,对照组11 例。随访期间,观察组有2例患者失访,对照组有1例患者失访。观察组患者肝癌根治性切除术后2 年复发率低于对照组,2年生存率高于对照组,差异均具有统计学意义(P<0.05),详见表2。
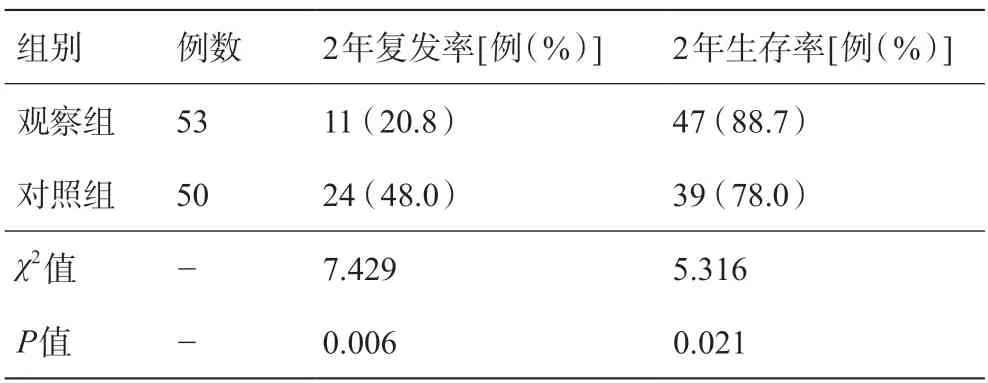
表2 两组患者根治性切除术后2年复发率及生存率比较
Kaplan-Meier分析表明,观察组患者术后无复发率明显优于对照组(χ2=4.347,P=0.004),生存率亦明显优于对照组(χ2=3.727,P=0.001),详见图1~2。
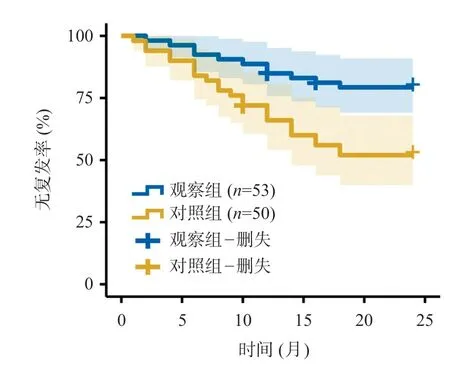
图1 两组术后无复发Kaplan-Meier曲线
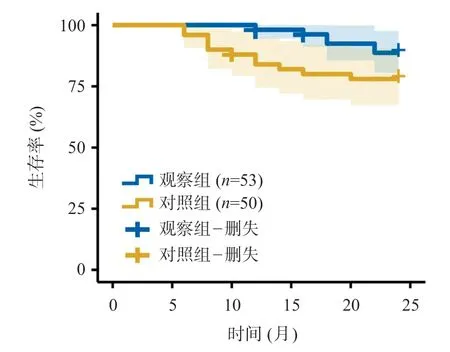
图2 两组术后Kaplan-Meier生存曲线
2.3 两组TACE治疗期间不良反应发生情况比较
TACE治疗期间,两组患者均出现上腹部疼痛、发热、胃肠道反应、一过性肝功能损害、骨髓抑制等不良反应,经对症支持治疗后好转,两组患者均无≥3 级不良反应发生。观察组患者的不良反应总发生率为50.9%(27/53),高于对照组患者的50.0%(25/50),但差异无统计学意义(χ2=0.160,P=0.689)。详见表3。
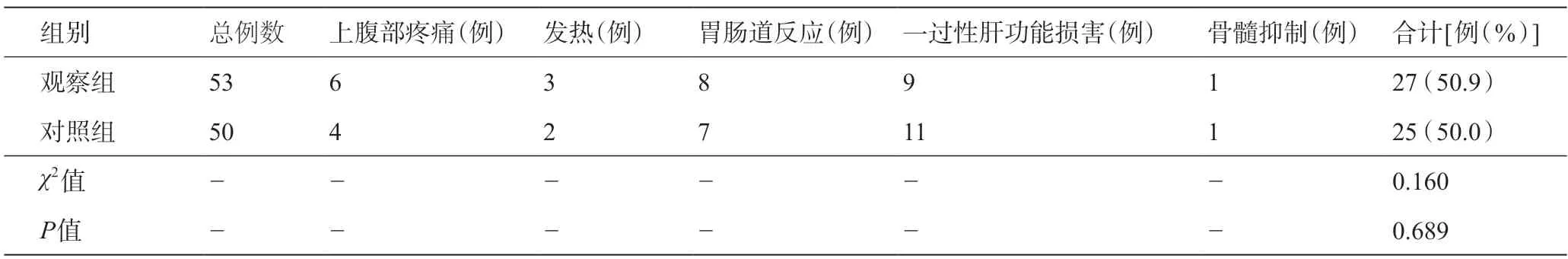
表3 两组患者不良反应发生情况的比较
2.4 两组根治性切除术后2年各项评估量表指标比较
肝癌根治性切除术后2 年,观察组患者的PS评分、Child-Pugh评分、PS-SGA评分、FPS-R评分均低于对照组,但两组间差异均无统计学意义(P>0.05);观察组生活质量评分高于对照组,差异具有统计学意义(P<0.05)。详见表4。

表4 两组患者根治性切除术后2年各项评估量表指标比较
3 讨论
目前肝癌患者的首选治疗方式依然是手术切除,随着外科手术技术的不断进步,手术成功率有了明显的提高,但患者术后复发率仍然很高。究其原因,肝癌早期复发(2 年以内)主要是因为单中心生长的微小癌灶或微转移灶的残留,这种微病灶或是在术前已经发生,亦或是在手术过程中所致的医源性播散,残存的微病灶术后逐渐生长导致早期复发。肝癌术后辅助治疗的原则是控制基础肝病,预防术后肿瘤复发,提高患者生存率,改善生活质量。目前临床上常用的术后辅助治疗包括以下几种。(1)PA-TACE:TACE具有微创、高效、不良反应小、可重复性高等特点,目前公认为是肝癌非手术治疗最常用、最有效的方法。有研究认为,PA-TACE能够通过血管造影,及时发现残留或新发的微小癌灶、微转移灶;通过栓塞肿瘤供血靶动脉,阻断肿瘤血供;局部注射化疗药物,抑制残留或新生的癌细胞生长,从而预防肿瘤早期复发,延长患者无瘤生存时间[11]。(2)中医中药:通过扶正固本,活血消癥等功效,调理机体,抑制肿瘤转移和扩散。有研究证实,肝癌切除术后接受槐尔颗粒治疗,可以降低复发率并延长患者术后生存时间[12]。(3)核苷类抗病毒药物:对于HBV相关的肝癌患者,核苷类抗病毒药物(诸如恩替卡韦等)治疗不仅能够控制基础肝病,还有助于降低术后肿瘤复发率[13]。(4)α-干扰素:可以减少术后复发,延长肝癌患者生存时间[14];此外有研究发现,肝癌miR-26a表达与α-干扰素治疗的疗效相关[15]。(5)免疫治疗、靶向治疗、免疫调节剂、肝动脉灌注化疗(HAIC)等:国内外有关研究显示,这些方法均可不同程度地延长肝癌患者术后生存时间[16-17]。本研究中有4例患者因手术后接受了除PATACE以外的其他治疗方式,被从研究对象中剔除。
关于PA-TACE治疗的最佳时间,医学界存在不同的意见。有研究认为肝癌切除术后不宜过早进行PA-TACE治疗,因为TACE治疗的核心(肝动脉栓塞、化疗药物)均会对肝功能产生一定程度的损害;术后介入时间过早,短期内经过手术创伤的肝脏,其肝功能尚未完全恢复正常,TACE治疗会加重肝脏负担,不仅不利于术后恢复,而且会增加术后并发症的发生率,继而严重影响患者术后生活质量[18-19]。相反另一部分学者认为,如果介入时间过晚,由于手术应激,患者术后机体免疫力下降,肝内肿瘤播散灶迅速增生,可能导致肿瘤术后复发率的升高[20-21]。温馨等[22]研究认为,肝癌切除术后只要患者的肝功能基本恢复,具备TACE的基本条件[根据《原发性肝癌诊疗规范(2021年版)》,TACE的适应证中要求患者PS评分为0~2 分,肝功能Child-Pugh A级或B级,并且不伴有无法纠正的凝血功能障碍、肾功能障碍],需尽早接受PA-TACE治疗。两者意见不一致的主要原因,可能是研究对象的临床、病理因素或研究方法不同,对比研究少、随访时间短所致。笔者认为,在肝癌切除术后2~3周多数患者的肝功能尚未恢复,此时接受TACE治疗不良反应较多;而术后4周,多数患者的肝脏功能可以恢复至Child-Pugh A级或者B级,且肝癌复发的高峰期大多集中在外科手术后半年之内,此时行PA-TACE治疗,能够两者兼顾,既能减少肝功能损害,又能很好地抑制肝内肿瘤播散灶的发生。故我们将研究的时间范围限定在肝癌术后4~26周,研究显示:观察组患者根治性切除术后2 年复发率低于对照组(P<0.05),表明术后4~8周内接受PA-TACE治疗较术后9~26周接受治疗能够更好地抑制肝癌复发转移。相关研究表明,肝癌切除术后<8周行PA-TACE治疗,患者的1、2年肿瘤复发率低于>8周行PA-TACE治疗[23]。术后延迟PA-TACE可能会降低肝癌患者术后生存率,且每延迟4周,会增加5%的死亡率。有研究表明,与术后8周内行PA-TACE治疗的患者相比,术后3个月以上再接受PA-TACE的患者死亡率可能增加2 倍[24],这与本研究结果一致。同时,本研究结果显示:观察组患者术后2年生存率高于对照组(P<0.05),表明肝癌根治性切除术后4~8周内接受PA-TACE治疗较术后9~26周接受治疗能够有效延长患者生存时间。
TACE术后的不良反应主要为栓塞后综合征,包括上腹部疼痛、发热、胃肠道反应、一过性肝功能损害等,其他少见的并发症还包括:异位栓塞、肝衰竭、骨髓抑制等。大多数不良反应症状较轻,且多为自限性。本研究显示,TACE治疗期间,两组患者均出现上腹部疼痛、发热、胃肠道反应、一过性肝功能损害及骨髓抑制等不良反应,但两组患者的不良反应总发生率比较差异无统计学意义(P>0.05)。
有研究表明,临床上大部分肝癌患者接受TACE治疗2~3 个月之后,肝功能能够恢复正常;少数严重肝硬化的患者,或者是自身存在一些基础病的患者,术后身体恢复相对较慢,肝功能恢复的时间就会延长,可能要持续6个月甚至是更长的时间[25]。故我们选取肝癌根治性切除术后2年作为研究的时间。本研究中,肝癌根治性切除术后2 年,观察组患者的PS评分、Child-Pugh评分、PS-SGA评分、FPS-R评分均低于对照组,但两组间差异均无统计学意义(P>0.05);观察组生活质量评分高于对照组,差异具有统计学意义(P<0.05),表明根治性切除术后4~8 周内接受PA-TACE治疗能够提高肝癌患者生活质量,且安全可靠。
综上所述,PA-TACE治疗在HCC术后4~8周内实施,能够减少术后早期的肿瘤复发率,提高生存率,提高术后生活质量。此结论对临床上进一步规范PA-TACE治疗方案具有一定的指导意义。

