澳洲坚果抗菌肽分离纯化及其肽段鉴定与分析
郭刚军,胡小静,马尚玄,付镓榕,缪福俊,肖县田,黄克昌,贺熙勇
(1.云南省热带作物科学研究所,云南景洪 666100;2.云南省澳洲坚果农业工程研究中心,云南景洪 666100;3.文山学院三七医药学院,云南文山 663099;4.云南省林业和草原科学院,云南昆明 650201)
抗菌肽(antimicrobial peptides,AMPs)是一种天然低分子量多肽,一般由2~50 个氨基酸残基组成,存在赖氨酸、精氨酸等残基,并含有大于30% 的疏水性氨基酸[1],广泛存在于细菌、植物、软体动物等体内[2],可阻止外界微生物产生的侵害、清除体内突变细胞[3],具有安全高效、热稳定性好、活性强与杀菌速度快等特点[4-5]。截至2019 年,已有8 000 多种抗菌肽被鉴定发现,其中有2 000 多种是从天然产物中提取得到[6]。抗菌肽由于其天然的抗菌性能和较弱的细菌耐药性,可替代化学防腐剂或抗生素等防腐抗菌药物,如从洋麻和花椒种子蛋白水解物分离的抗菌肽已成功被用作防腐剂应用于食品保鲜领域[7-8]。
澳洲坚果(Mɑcɑdɑmiɑintegrifoliɑ)又称夏威夷果[9],其果仁含油高达65%~80%,蛋白质含量8%~20%,还含有碳水化合物、钙、磷、铁、B 族维生素、烟酸、多酚、黄酮、生育酚、角鲨烯、甾醇等多种成分[10]。据农业农村部统计,2020 年全国澳洲坚果种植面积为26.61 万hm2,随着产业的进一步发展,作为一种木本油料作物,澳洲坚果油将成为重要的产品形式[11]。榨油后的副产物澳洲坚果粕含有30%左右的蛋白质,通过酶法及相关分离纯化技术制备功能肽是提高其利用率的有效途径之一[7]。
在功能肽的制备方法中,酶法具有反应条件温和、时间短、产品营养价值高等优点[12],通过选择适当蛋白酶,控制一定水解度,水解某些蛋白质可得到生物活性多肽,这些活性肽除易被人体消化吸收外,还具有许多独特生理功能,如抗菌、抗氧化、抗病毒、降血压、降血脂、降胆固醇、促进钙吸收、免疫调节等,也可以作为药物或者药物的前体,是当今科技界研究的一个热点[13-14]。国内外学者采用酶解法筛选制备了诸多的抗菌肽。Daoud 等[15]用胃蛋白酶在低水解度下酶解牛血色素,经纯化制备了一个对藤黄微球菌、李斯特菌、大肠杆菌和肠炎沙门氏菌均具有抗菌活性的多肽。Liu等[16]以牡蛎为原料,用碱性蛋白酶和菠萝蛋白酶水解,经系列纯化,得到一个富含半胱氨酸的抗菌肽Cg-Pep33,其能够抑制多种细菌和真菌的生长。在有关澳洲坚果抗菌活性多肽研究中,周晓馥等[17]通过测定平均疏水性预测了澳洲坚果多肽具有抗菌活性。马尚玄等[18]研究发现采用碱性蛋白酶水解、透析袋分离制备的不同分子量澳洲坚果多肽中,分子量小于300 Da 的多肽对金黄色葡萄球菌、鼠伤寒沙门氏菌、大肠埃希氏菌、铜绿假单胞菌抑菌活性较好。但有关澳洲坚果抗菌肽分离纯化及肽段序列分析鲜有研究。本研究利用碱性蛋白酶水解制备澳洲坚果多肽,以抑菌活性为跟踪指标,运用超滤、大孔吸附树脂、凝胶色谱分离技术纯化筛选抗菌肽,并对其进行肽段鉴定与氨基酸序列分析,以期为澳洲坚果的深度利用和开发新型抗菌肽提供理论基础。
1 材料与方法
1.1 材料与试剂
液压压榨澳洲坚果粕:西双版纳云垦澳洲坚果科技开发有限公司。
碱性蛋白酶(10 万U/g):广西南宁东恒华道生物科技有限公司;白色念珠菌(ATCC10231)、金黄色葡萄球菌(ATCC6538):上海鲁微科技有限公司;DA201-C型大孔吸附树脂:廊坊淼阳化工有限公司。G-25 型交联葡聚糖凝胶:合肥博美生物科技有限公司;乙腈(≥99.9%)、超纯水:美国Fisher Chemical 公司;碘乙酰胺、二硫苏糖醇、碳酸氢铵、甲酸:美国Sigma-Aldrich公司;氢氧化钠、乙醇、柠檬酸、盐酸、氯化钠、酒石酸钾钠、无水硫酸铜、三氯乙酸、亚硫酸氢钠(均为分析纯):国药集团化学试剂有限公司;牛肉膏蛋白胨琼脂培养基:青岛海博生物科技有限公司。
1.2 仪器与设备
Ultimate 3000 型毛细管高效液相色谱仪、Q Exactive™Hybrid Quadrupole-Orbitrap™型电喷雾-组合型离子阱、Orbitrap 型质谱仪:美国赛默飞世尔科技公司;Concentrator plus 型真空离心浓缩仪:德国艾本德公司;D1008 型掌上离心机、MX-S 型涡旋仪:美国Scilogex公司;RV10 型旋转蒸发仪:德国IKA 集团;H3-18KR型高速冷冻离心机:湖南可成仪器设备有限公司;TD5AWS 型离心机:湖南湘仪离心机仪器有限公司;TUV1810 型紫外可见分光光度计:上海佑科仪器仪表有限公司;CL90MM 型超滤杯:杭州九龄科技有限公司;SHZ-A 型振荡器、YXQ-LS-50A 型立式压力蒸汽灭菌锅:上海博迅实业有限公司医疗设备厂;BSP-400 型生化培养箱:上海跃进医疗器械有限公司;SW-CJ-IG型单人净化工作台:苏州净化设备有限公司;8 mm×6 mm×10 mm 牛津杯:上海三麝实业有限公司;FiveEasy 型酸度计、ME204 型电子天平:瑞士梅特勒托利多公司;C-MAGHS7 型数显加热磁力搅拌器:艾卡广州仪器设备有限公司。
1.3 试验方法
1.3.1 澳洲坚果粗多肽的制备
按照文献[7]的方法并略作修改,制备澳洲坚果粗多肽。液压压榨澳洲坚果粕经温度50 ℃烘干,粉碎,过60 目筛,以底物浓度110 g/L 比例调浆,加入碱性蛋白酶2 400 U/g(占坚果粕质量),调节pH11.0,在45 ℃下恒温水解3.5 h,反应结束后,沸水灭酶10 min,冷却至室温,4 000 r/min 离心10 min,取上清液,调节pH4.6(蛋白质等电点),静置30 min,再于转速4 000 r/min条件下离心10 min,取上清液,真空浓缩,冷冻干燥,制得澳洲坚果粗多肽。
1.3.2 不同分子量澳洲坚果多肽的超滤分离
配制30 mg/mL 的澳洲坚果多肽(macadamia nut peptide-0,MNP-0)溶液,然后采用截留分子量分别为10、5、1 kDa 的超滤膜逐级分离[19],得到分子量(Mr)>10 kDa MNP-1、5 kDa<分子量(Mr)<10 kDa MNP-2、1 kDa<分子量(Mr)<5 kDa MNP-3、分子量(Mr)<1 kDa MNP-4 4 种澳洲坚果多肽组分,真空浓缩,冷冻干燥。以MNP-0 为对照,测定其多肽含量与抑菌活性。
1.3.3 DA201-C 型大孔吸附树脂分离纯化澳洲坚果多肽
1.3.3.1 大孔吸附树脂对澳洲坚果多肽的静态吸附与解吸
用无水乙醇浸泡大孔吸树脂24 h,在波长220 nm条件下洗至无吸收峰,然后采用蒸馏水洗净。称取15 g 湿树脂,然后放置于250 mL 三角瓶中,加入15 mL 30 mg/mL 1.3.2 方法所得抑菌活性最强的超滤多肽组分,在温度25 ℃、转速160 r/min 的摇床中进行振荡吸附,每隔60 min 取样1 次,测定其多肽含量,按公式(1)计算吸附率(W,%),确定吸附平衡时间。
式中:ρ0为上样多肽质量浓度,mg/mL;ρ1为吸附后溶液多肽质量浓度,mg/mL。
采用不同浓度乙醇对1.3.3.1 方法中多肽组分吸附平衡的大孔树脂进行洗脱,按公式(2)计算解吸率(Z,%),确定乙醇溶液的适宜浓度。
式中:ρ0为上样多肽质量浓度,mg/mL;ρ1为吸附后溶液的多肽质量浓度,mg/mL;ρ2为洗脱液的多肽质量浓度,mg/mL;v1为吸附液体积,mL;v2为洗脱液体积,mL。
1.3.3.2 大孔树脂吸附澳洲坚果多肽的动态洗脱
配制浓度为30 mg/mL 1.3.2 方法所得抑菌活性最强的超滤分离多肽组分溶液,经大孔树脂充分吸附后,抽滤,弃去未吸附的溶液,然后用去离子水以1 BV/h的流速洗涤层析柱至无吸收峰,之后用适宜浓度的乙醇洗脱剂以2 BV/h 的流速流经层析柱,每6 mL 洗脱液收集一管,加入24 mL 双缩脲试剂,在540 nm 波长处测定吸光度,合并洗脱液,真空浓缩,冷冻干燥,备用。
1.3.4 交联葡聚糖凝胶Sephadex G-25 分离纯化澳洲坚果多肽
配制30 mg/mL 1.3.3.2 方法所制备的澳洲坚果多肽溶液,在交联葡聚糖凝胶Sephadex G-25 柱上继续进行分离纯化,上样量为15 mL。以去离子水为洗脱液,洗脱流速为0.3 mL/min,采用自动部分收集器收集洗脱液,每3 mL 收集一管,加入12 mL 双缩脲试剂,用紫外可见分光光度计在540 nm 波长处测定吸光度,收集各洗脱峰多肽组分,真空浓缩,冷冻干燥,得到澳洲坚果纯化多肽组分1(macadamia nut purified peptide-1,MPP-1)、MPP-2、MPP-3,测定其抑菌活性。
1.3.5 多肽含量与抑菌活性测定
澳洲坚果多肽含量参考文献[18]中的双缩脲法进行测定;澳洲坚果多肽对金黄色葡萄球菌与白色念珠菌抑菌活性参考文献[20]中的牛津杯法进行测定。
1.3.6 澳洲坚果抗菌肽LC-MS/MS 肽序列鉴定
将澳洲坚果抗菌肽溶液加入二硫苏糖醇溶液使其浓度为10 mmol/L,于37 ℃水浴中还原4 h,然后加入碘乙酰胺溶液使其浓度为50 mmol/L,避光反应40 min,然后采用自填脱盐柱脱盐,45 ℃真空离心浓缩,挥干溶剂。将上述样品溶解在200µL 2%乙腈(加0.1%甲酸)溶液中,通过Nano 液相系统和Orbitrap 质谱系统,使用分析柱(RP C18,75µm×150 mm)分析,流动相A:2% 乙腈(加0.1%甲酸),流动相B:80% 乙腈(加0.1%甲酸)组成,以300 nL/min 的流速分离,分析时间为78 min。采用正离子检测法,离子传输毛细管温度为325 ℃,母离子扫描范围为m/z 350~1 800,选择母离子top 20 进行二级碎裂,动态排除时间18 s。使用Maxquant(1.6.2.10)检索uniprot 数据库,检索参数如下。固定修饰:Carbamidomethyl(C);可变修饰:Oxidation(M);酶:non-specific;遗漏酶切位点:2;一级质谱误差:20 ppm;二级质谱误差:0.6 Da;肽段/碎片离子质量数:Monoisotopic(单同位素);显著性阈值:0.01[8,21]。
1.4 统计分析
数据采用SAS 9.2 软件处理,应用邓肯氏法进行显著性分析,P<0.05 表示差异显著。用Origin 2021 软件进行数据图像处理。试验均重复3 次,试验结果以平均值±标准差表示。
2 结果与分析
2.1 超滤分离的不同分子量澳洲坚果多肽质量分布
不同分子量澳洲坚果多肽在所有多肽中所占质量分数见图1。

图1 不同分子量澳洲坚果多肽在所有多肽中所占质量分数Fig.1 Mass fraction of macadamia nut polypeptides with different molecular weight in all peptides by ultrafiltration
由图1 可知,通过超滤分离,不同分子量澳洲坚果多肽在所有多肽中所占质量分数不同,其中MNP-4 多肽占比最高,达到29.55%,与其他分子量多肽存在显著性差异(P<0.05),其次是MNP-3 与MNP-1 多肽,质量分数分别为27.11% 与24.44%,两者之间也存在显著性差异(P<0.05),MNP-2 多肽的质量分数最低,仅为18.90%。
2.2 超滤分离的不同分子量澳洲坚果多肽抑菌活性
不同分子量澳洲坚果多肽的抑菌活性见图2。

图2 不同分子量澳洲坚果多肽的抑菌活性Fig.2 Antibacterial activity of macadamia nut polypeptides with different molecular weight by ultrafiltration
由图2 可知,MNP-0 与超滤分离的不同分子量多肽对受试细菌(金黄色葡萄球菌)与真菌(白色念珠菌)呈现出不同的抑菌活性。其中多肽MNP-4 对金黄色葡萄球菌抑菌活性最好,抑菌圈直径达到10.01 mm,与多肽MNP-0 及其他分子量多肽存在显著性差异(P<0.05);其次是多肽MNP-0,其抑菌圈直径为8.26 mm;抑菌活性最低的为多肽MNP-3,其抑菌圈直径仅为4.29 mm。多肽MNP-4 对白色念珠菌抑菌活性也最好,抑菌圈直径达到9.41 mm,与多肽MNP-0 及其他分子量多肽存在显著性差异(P<0.05);其次是多肽MNP-0,其抑菌圈直径为7.64 mm;抑菌活性最差的为多肽MNP-1,抑菌圈直径仅为5.15 mm。由上述分析可知,对金黄色葡萄球菌与白色念珠菌抑菌活性最好的均为多肽MNP-4,选择对其进一步分离纯化。Chang 等[22]研究发现,多肽的分子量是影响蛋白肽生物活性的关键因素,分子量越小抗菌活性越高,这与本研究结果整体一致。
2.3 DA201-C 型大孔吸附树脂分离纯化澳洲坚果多肽
2.3.1 大孔吸附树脂对多肽的静态吸附
大孔吸附树脂对澳洲坚果多肽的静态吸附曲线见图3。

图3 大孔吸附树脂对澳洲坚果多肽的静态吸附曲线Fig.3 Curves for static adsorption of macadamia nut polypeptides on DA201-C macroporous resin adsorption
由图3 可知,随着静态吸附平衡时间的延长,大孔吸附树脂对澳洲坚果多肽MNP-4 的吸附率在前1 h 大幅增加,1~3 h 缓慢增加,3 h 以后达到吸附平衡状态,在吸附3 h 时的吸附率达到68.00%。由此可知DA201-C 型大孔吸附树脂对澳洲坚果多肽MNP-4 的吸附属于快速平衡型,其不仅是利用多孔网状结构及高比表面积形成的分子筛作用,而且是通过范德华力或氢键相互作用结合的[23]。因此,大孔吸附树脂对澳洲坚果多肽MNP-4 的吸附平衡时间选择为3 h。
2.3.2 洗脱剂浓度对多肽解吸率的影响
乙醇溶液浓度对澳洲坚果多肽解吸率的影响见图4。

图4 乙醇溶液浓度对澳洲坚果多肽解吸率的影响Fig.4 Effect of ethanol solution concentration on macadamia nut polypeptides desorption rate
洗脱剂选择醇类物质较佳,因其具有解吸效率高、易于蒸馏回收、节能、价廉和毒性小等优点[24]。由图4可知,随着洗脱剂乙醇溶液浓度的增加,澳洲坚果多肽MNP-4 的解吸率呈先升高后降低的趋势,当乙醇溶液浓度为75%时,解吸率达到最大值,为88.65%。这是因为当多肽MNP-4 溶于水时,大孔树脂对其吸附作用大于多肽与水之间的作用,多肽被吸附在树脂上;当用乙醇溶液洗脱时,多肽与乙醇溶液间的作用大于其与大孔树脂间的吸附作用,多肽被洗脱下来。乙醇溶液浓度越高,多肽与大孔树脂之间范德华力越小,解吸率越高,当乙醇溶液浓度过高时,解吸剂中的含水量较少,多肽难以溶出,解吸率反而降低[23]。因此,选择浓度为75% 的乙醇溶液为澳洲坚果多肽MNP-4 的洗脱剂。
2.3.3 大孔吸附树脂对多肽的动态洗脱
大孔吸附树脂对澳洲坚果多肽的动态洗脱曲线见图5。
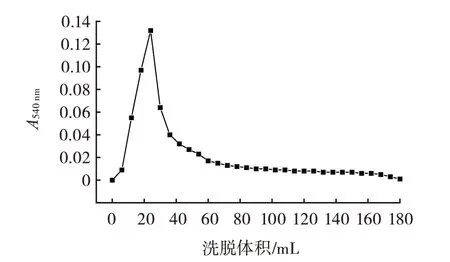
图5 大孔吸附树脂对澳洲坚果多肽的动态洗脱曲线Fig.5 Curves for dynamic elution of macadamia nut polypeptides on DA201-C macroporous resin adsorption
由图5 可知,随着洗脱液流出体积的增大,洗脱液的多肽含量吸光值呈现先迅速增大后迅速减小,最后趋于平缓的趋势。当流出液体积为6 mL 时即有少量多肽被洗出,随后洗脱液中的多肽含量吸光度急剧上升,在24 mL 左右时达到最大值,之后的洗脱液中,多肽吸光度又出现急剧下降,当洗脱液达到60 mL 时,多肽基本被洗脱完全,故吸光度较低。因此,选择的洗脱体积为60 mL。
2.4 交联葡聚糖凝胶Sephadex G-25 分离纯化澳洲坚果多肽
澳洲坚果多肽交联葡聚糖凝胶Sephadex G-25 洗脱曲线见图6。

图6 澳洲坚果多肽交联葡聚糖凝胶Sephadex G-25 洗脱曲线Fig.6 Elution profile of macadamia nut polypeptides by crosslinked dextran gel Sephadex G-25
凝胶过滤可用于分离水溶性的物质,如多糖、蛋白、多肽等化合物,还可用于脱盐。由图6 可知,从交联葡聚糖凝胶Sephadex G-25 中主要洗脱出3 个多肽峰组分,分别记为MPP-1、MPP-2 和MPP-3,各个峰的洗脱体积分别为0~21、21~66 mL 与66~168 mL,分别收集3 个多肽组分的洗脱液,真空浓缩,冷冻干燥,待进一步测定分析。
2.5 交联葡聚糖凝胶Sephadex G-25 分离纯化的澳洲坚果多肽组分抑菌活性
澳洲坚果多肽Sephadex G-25 纯化后各组分的抑菌活性见图7。

图7 澳洲坚果多肽Sephadex G-25 纯化后各组分的抑菌活性Fig.7 Antibacterial activity of different macadamia nut polypeptide fractions purified by cross-linked dextran gel Sephadex G-25
由图7 可知,交联葡聚糖凝胶Sephadex G-25 分离纯化的3 个澳洲坚果多肽组分中,多肽组分MPP-2 对金黄色葡萄球菌和白色念珠菌均具有最强的抑菌活性,其抑菌圈直径分别达到18.67 mm 与16.83 mm,与多肽组分MPP-1 与MPP-3 存在显著性差异(P<0.05),优于多肽MNP-0 与超滤分离多肽组分,其次是多肽组分MPP-1,其抑菌圈直径分别为12.33 mm 与10.52 mm,最差的为多肽组分MPP-3,其对金黄色葡萄球菌和白色念珠菌均无抑菌活性。因此,选择对澳洲坚果多肽组分MPP-2 进一步进行肽段鉴定与氨基酸序列分析。
2.6 澳洲坚果抗菌肽肽段鉴定与氨基酸序列分析
澳洲坚果抗菌肽MPP-2 的总离子流色谱图见图8,澳洲坚果抗菌肽MPP-2 肽段组成与氨基酸序列见表1,WDL、FDW 的质谱图见图9。N 端带电片段离子分类为a、b 或c,C 端带电片段离子分类为x、y 或z。

表1 澳洲坚果抗菌肽MPP-2 肽段组成与氨基酸序列Table 1 Composition and amino acid sequence of antimicrobial peptide MPP-2 from macadamia nuts

图8 澳洲坚果抗菌肽MPP-2 的总离子流色谱图Fig.8 Total ions chromatography of antimicrobial peptide MPP-2 from macadamia nuts

图9 WDL、FDW 的质谱图Fig.9 Mass spectra of WDL and FDW
一般来说,具有抗菌活性的多肽一级结构具有共有的特点,N 端富含赖氨酸、组氨酸和精氨酸等阳离子型氨基酸,相对来说其含有的阳离子型氨基酸越多,抗菌活性越大;C 端富含丙氨酸、缬氨酸、亮氨酸、苯丙氨酸、半胱氨酸、色氨酸等非极性氨基酸,中间部分则富含脯氨酸,在β 折叠型结构类与伸展性螺旋结构类中的抗菌肽均富含脯氨酸[18,25]。由图8、图9、表1 可知,经液相色谱分离,一级质谱和二级质谱鉴定,澳洲坚果多肽组分MPP-2 含有DDLTDPAPA、VLL、WDY、VPV、WDL、LLW、LWL、FDW 8 个肽段,其均含有具有抗菌作用的氨基酸,其中,DDLTDPAPA 含有亮氨酸(L)、丙氨酸(A)、脯氨酸(P),VLL 含有缬氨酸(V)、亮氨酸(L),WDY 含有色氨酸(W),VPV 含有脯氨酸(P)、缬氨酸(V),WDL、LLW、LWL 均含有亮氨酸(L)、色氨酸(W),FDW 含有苯丙氨酸(F)、色氨酸(W)。疏水性和净电荷是影响抗菌肽活性的重要因素[26],通过数据库http://www.peptide2.com/N_peptide_hydrophobicity_hydrophilicity.php 检索查询,肽段DDLTDPAPA、VLL、VPV、WDL、LLW、LWL、FDW 的疏水率均大于50%[8],符合抗菌肽的疏水性特征。尽管诸多的阳离子抗菌肽的研究被报道[1,5],但阴离子抗菌肽也具有很强的抗菌活性,Song 等[27]从半鳍凤尾鱼水解物的美拉德反应产物中分离得到2 个阴离子抗菌肽RVAPEEHPTL 与FFTQATDLLSR,其对细菌具有很强的抗菌活性。通过数据库http://www.innovagen.com/proteomics-tools 检索查询,肽段DDLTDPAPA、WDY、WDL、FDW 均带有不同程度的负电荷,其中,肽段DDLTDPAPA 带有3 个负电荷,WDY、WDL、FDW 均带有1 个负电荷,符合阴离子抗菌肽的净电荷特征。综合肽段的抗菌氨基酸、疏水性与净电荷分析来看,分离纯化的澳洲坚果抗菌活性多肽中属于抗菌肽的肽段可能为DDLTDPAPA、WDL、FDW。通过抗菌肽的收集数据库(http://www.camp.bicnirrh.res.in/predict/),采用支持向量机(support vector machines,SVM)算法进一步预测分析,DDLTDPAPA、WDL、FDW 属于抗菌肽的概率得分a(1.00≥a≥0.50)分别为0.27、1.00 与1.00,表明肽段WDL 与FDW 属于抗菌肽,其一级质谱和二级质谱图(图9)显示疏水率均为66.67%,均带有1 个负电荷,等电点分别为0.69 与0.67,并具有较好的溶解性。
3 结论
采用超滤技术将碱性蛋白酶水解制备澳洲坚果多肽分离为4 种不同分子量的多肽组分,其在所有多肽中所占质量分数不同,抑菌活性也有所差异。其中,澳洲坚果多肽MNP-4 质量占比最高,对金黄色葡萄球菌与白色念珠菌的抑菌活性最强。经大孔树脂、交联葡聚糖凝胶Sephadex G-25 对其进行分离纯化后,获得的3 个多肽组分中,多肽组分MPP-2 对金黄色葡萄球菌与白色念珠菌的抑菌活性最强,优于多肽MNP-0 与超滤分离的多肽组分。通过Nano 液相色谱系统分离、Orbitra 质谱系统鉴定及抗菌肽数据库检索分析,分离纯化的澳洲坚果抗菌活性多肽MPP-2 由DDLTDPAPA、VLL、WDY、VPV、WDL、LLW、LWL、FDW 8 个肽段组成,经分析预测,属于抗菌肽的肽段为WDL 与FDW,其拥有较高的疏水率,带有一定的负电荷,等电点较低,具有较好的溶解性,下一步可进行肽段生物合成,评价验证其抗细菌、真菌等活性,进一步筛选获得活性更强的抗菌肽,为澳洲坚果功能肽产品的开发与应用提供一定的理论依据。

