石屏臭豆腐来源的高产蛋白酶菌株筛选及酶学特性研究
刘 超
赵良忠1,2
王瑶琼1
李 明3
冯绪忠4
(1. 邵阳学院食品与化学工程学院,湖南 邵阳 422000;2. 豆制品加工与安全控制湖南省重点实验室,湖南 邵阳 422000;3. 广州佳明食品科技有限公司,广东 广州 511458;4. 深圳尚古堂食品发展有限公司,广东 深圳 518000)
石屏臭豆腐为发酵型臭豆腐[1],在发酵过程中可以产生多种有益化合物。例如,臭豆腐富含生物可利用的S-雌马酚,有助于减少骨质流失和缓解更年期症状;大豆中蛋白质经生物降解为更易吸收的多肽和氨基酸,如谷氨酸、噻唑氨酸、酪氨酸和色氨酸等,这些氨基酸富含生物活性,能够维持人体氮元素平衡[2];发酵过程中产生的维生素B12对预防老年痴呆有一定作用[3]。发酵臭豆腐中分离的血管紧张素I转换酶抑制肽和γ-氨基丁酸有利于缓解高血压,表面活性素、异拉奉、呋喃酮、胰蛋白酶抑制剂和3-羟基邻氨基苯甲酸具有抗癌活性[4]。
发酵豆制品以细菌作为发酵剂,主要有枯草芽孢杆菌、地衣芽葡萄球菌、植物乳杆菌、酱油片球菌、酱油四联球菌[5],鲜见以金黄杆菌属菌株发酵豆制品的报道。金黄杆菌属是一类自然界广泛分布的细菌[6],主要从人体[7]、废水[8]、垃圾处理厂[9]、土壤[10]中分离得到,是引起食品变质腐败的重要因素。研究发现,金黄杆菌属所产蛋白酶具有多种生理特性,如抑制革兰氏阴性致病菌的增殖;促进屠宰场或家禽养殖场的羽毛废弃物利用[11];可将农用废弃物生物质转化为乙醇[12]等。
石屏臭豆腐生产采用自然接种发酵工艺,即利用环境中存在的微生物进行接种发酵,这导致石屏臭豆腐发酵过程周期长,微生物种类不易控制,产品常因杂菌污染而变质,贮藏时间短[13]。研究拟从石屏臭豆腐中筛选高产蛋白酶优势菌株,探究其发酵条件及相关酶学特性,以期利用石屏臭豆腐高产蛋白酶优势菌株发酵提供臭豆腐生产菌种资源。
1 材料与方法
1.1 材料
1.1.1 样品
石屏臭豆腐:采于云南省红河哈尼族彝族自治区州石屏县豆腐园区5个工厂,每个工厂随机无菌采取3份样品,液氮速冻处理,-40 ℃贮藏备用。
1.1.2 培养基
豆浆分离培养基:将黄豆与水按V水∶m黄豆=1∶8 (mL/g)制成豆浆,再稀释3倍制成豆浆培养基,琼脂1.5%;
脑花分离培养基:将黄豆与水按V水∶m黄豆=1∶8 (mL/g)制成豆浆,用酸浆点至成脑花后用豆浆机磨碎再用水稀释4倍,制成脑花培养基,琼脂1.5%;
初筛选培养基:大豆分离蛋白1.0%,琼脂1.5%;
种子培养基:酪蛋白1.0%、酵母膏1.0%、葡萄糖1.0%、NaCl 0.5%、琼脂1.5%、pH 7.0~7.5;
发酵培养基:酪蛋白1.0%、葡萄糖1.0%、NaCl 0.5%,pH 7.0~7.5;
培养基灭菌条件:121 ℃、15 min。
1.1.3 主要试剂和仪器
大豆分离蛋白:BR级,上海源叶生物科技有限公司;
福林酚试剂:BR级,国药集团化学试剂有限公司;
琼脂:福建众邦海洋生物科技有限公司;
无水碳酸钠:AR级,天津市光复科技发展有限公司;
三氯乙酸:AR级,天津市科密欧化学试剂有限公司;
盐酸、磷酸氢二钠:AR级,天津市科密欧化学试剂有限公司;
磷酸二氢钠:AR级,天津市大茂化学试剂厂;
氢氧化钠:AR级,成都金山化学试剂有限公司;
乳酸、乳酸钠:AR级,天津市光复精细化工研究所;
硼酸:AR级,德州润昕实验仪器有限公司;
酪蛋白:上海希格玛高技术有限公司;
L-酪氨酸:中国惠兴生化试剂厂;
显微镜:BA210型,麦克奥迪实业集团有限公司;
恒温振荡器:IS-AX型,苏州捷美电子有限公司;
双人单面净化工作台:SW-CJ-2FD型,江苏通净净化设备有限公司;
电热恒温水浴锅:DZKW-4型,北京中心伟业世纪仪器有限公司;
紫外可见分光光度计:D-7型,南京菲勒仪器有限公司;
台式高速离心机:3H16RI型,湖南赫西仪器装备有限公司;
全波长酶标仪:EL340型,美国Bio-Tek公司。
1.2 方法
1.2.1 产蛋白酶菌株筛选 在无菌条件下,切取石屏臭豆腐样品表皮25.0 g,充分研磨后倒入装有225 mL无菌生理盐水的广口锥形瓶中充分混匀。采用10倍稀释法,最终选择10-4,10-5,10-63个梯度的稀释液0.5 mL均匀涂布于豆浆分离培养基和脑花分离培养基,每种浓度稀释液重复3次,30 ℃培养48~96 h挑选单菌落纯化培养,多次划线,直至获得单一菌落。
将纯化后的单菌落点接于初筛选培养基上,30 ℃培养72 h,观察菌落大小和菌落周围水解圈大小,以菌株水解大豆分离蛋白所形成的透明圈直径D与菌落径d之比值(D/d)为筛选依据,选取D/d值较大的菌株进一步复筛。
挑选初筛菌株接种发酵培养基中,30 ℃,160 r/min摇瓶培养48 h后取10 mL发酵液,10 000 r/min离心10 min,收集上清液,得到粗酶液。测定蛋白酶的活力,选取蛋白酶活力最高的菌株为试验的目的菌株。
1.2.2 蛋白酶活力测定 按GB/T 23527—2009《蛋白酶制剂》执行。
1.2.3 菌株鉴定
(1) 菌落和个体形态学观察:将菌株在初筛选培养基上划线培养,30 ℃培养72 h,形成肉眼可观察到的菌落形状、颜色、表面质地等形态特征,制片染色,观察显微镜下菌株的形态特征。
(2) 菌株生理生化鉴定:参考文献[14]。
(3) 菌株分子生物学鉴定:斜面保存的菌株平板划线得出菌株单菌落,细菌16S rRNA中最保守的序列设计引物,引物F:5′-AGAGITTGATCMTGGCTCAG-3′,引物R:5′-AAGGAGGTGWTCCARCC-3′,PCR反应体系20 μL。热循环参数94 ℃预变性5 min,94 ℃变性30 s,55 ℃退火45 s,72 ℃延伸2 min,循环30次,72 ℃延伸10 min,取2 μL反应液进行10 g/L琼脂糖电泳检测,PCR扩增产物送至生工生物工程(上海)股份有限公司测序。测序所得16S rRNA基因序列结果与NCBI中blast比对,运用MEGA6软件,Neighbor-Joining法构建系统进化树。
1.2.4 菌株生长与产酶曲线绘制 以2%的接种量转接于发酵培养基中,30 ℃、160 r/min恒温振荡培养,每间隔4 h取发酵液10 mL,未接种的作为空白对照,检测OD600 nm值,绘制菌株生长曲线。每隔12 h取10 mL,检测酶活,绘制不同生长时间下粗酶液中蛋白酶活力与时间的关系曲线。
1.2.5 菌株JX-11发酵条件优化
(1) 温度:固定氮源蛋白胨添加量10 g/L,碳源葡萄糖添加量10 g/L,pH为7,金属离子NaCl添加量5 g/L,考察温度(20,25,30,35,40 ℃)对菌株JX-11产酶活力的影响。
(2) 碳源:固定氮源蛋白胨添加量10 g/L,pH为7,金属离子NaCl添加量5 g/L,培养温度30 ℃,考察碳源(葡萄糖、蔗糖、乳糖、麦芽糖、淀粉、麦芽糖,10 g/L)对菌株JX-11产酶活力的影响,确定最适碳源后进行最适碳源添加量(5,10,15,20,25 g/L)优化。
(3) 氮源:固定碳源葡萄糖添加量10 g/L,pH为7,金属离子NaCl添加量5 g/L,培养温度30 ℃,考察氮源(蛋白胨、酵母膏、牛肉膏、酪蛋白、尿素,10 g/L)对菌株JX-11产酶活力的影响,确定最适氮源后进行最适氮源添加量(5,10,15,20,25 g/L)优化。
(4) pH值:固定氮源蛋白胨添加量10 g/L,碳源葡萄糖添加量10 g/L,金属离子NaCl添加量5 g/L,培养温度30 ℃,考察pH(5,6,7,8,9,10,11)对菌株JX-11产酶活力的影响。
(5) 金属离子:固定氮源蛋白胨添加量10 g/L,碳源葡萄糖添加量10 g/L,pH为7,培养温度30 ℃,考察金属离子(K+、Na+、Mg2+、Ca2+、Cu2+,10 g/L)对菌株JX-11产酶活力的影响,确定金属离子后进行最适金属离子添加量(5,10,15,20,25 g/L)优化。
1.2.6 菌株发酵条件优化的响应面试验设计 在单因素试验结果的基础上,以培养温度、葡萄糖、蛋白胨、pH为因素,酶活力为评价指标,设计四因素三水平响应面试验。
1.2.7 菌株JX-11蛋白酶酶学性质 最佳发酵条件下的发酵液10 000 r/min离心10 min,取上清液作为粗酶液,用于酶学性质初步研究。
(1) 最适反应温度和热稳定性:固定反应时间1 h,考察在不同反应温度(10,20,30,40,50,60 ℃)下,菌株JX-11的相对酶活力;固定粗酶液保温时间1 h,将酶液置于上述温度(10,20,30,40,50,60 ℃),考察在不同保温温度下,菌株JX-11的残留酶活力。
(2) 最适反应pH值及酸碱稳定性:固定反应时间1 h,考察在不同pH值缓冲液中[乳酸—乳酸钠缓冲液(pH 3.0)、柠檬酸—柠檬酸钠缓冲液(pH 5.0)、磷酸氢二钠—磷酸二氢钠缓冲液(pH 7.0)、碳酸钠—碳酸氢钠缓冲溶液(pH 9.0)、硼酸—氢氧化钠缓冲液(pH 11.0)]菌株JX-11的相对酶活力;固定粗酶液保温时间1 h,将酶液置于上述缓冲液(pH 3.0,5.0,7.0,9.0,11.0),考察在不同pH下,菌株JX-11的残留酶活力。最高酶活为100%,计算相对酶活力和残留酶活力。
(3) 金属离子及抑制剂对酶活性的影响:固定反应时间1 h,考察不同金属离子(Mg2+、K+、Na+、Ca2+、Mn2+、Cu2+,100 mmol/L)对菌株JX-11的相对酶活力。
(4) 有机化学试剂对JX-11菌株蛋白酶的影响:固定反应时间1 h,考察不同有机试剂[吐温80、乙醇、乙酸、丙酮、甘油、乙二胺四乙酸(EDTA)、甲醇、十二烷基硫酸钠(SDS),100 mmol/L]对菌株JX-11的相对酶活力。不加金属离子、有机试剂的蛋白酶活力为100%,计算相对酶活力。
2 结果与分析
2.1 产蛋白酶菌株筛选
菌株在初筛平板透明圈效果见图1,在大豆分离蛋白培养液中初筛结果见表1。根据平板上菌落水解圈直径及菌落直径的比值(D/d)大小,筛选获得酶活较强的菌株6株。由表1可知,编号为6的菌株D/d值最大(为2.91),但酶活力较低,仅有11.48 U/mL,初筛平板有一定的局限性。编号为4的菌株D/d值为1.94,蛋白酶酶活性最高,达23.25 U/mL,因此,选用该菌株进行下一步研究,并将其命名为JX-11。
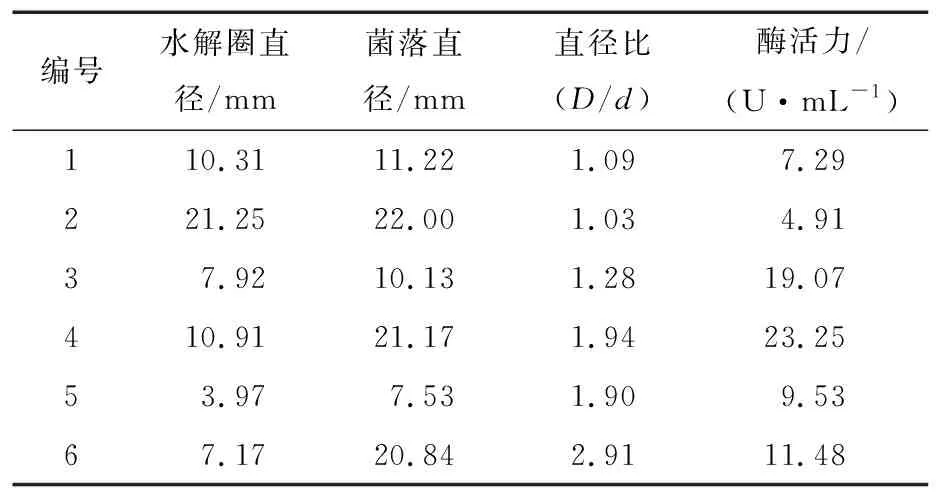
表1 石屏臭豆腐中产高蛋白酶活力菌株的初筛†

图1 不同菌株大豆分离蛋白板水解圈照片
2.2 菌株鉴定
2.2.1 菌株菌落形态 如图2所示,JX-11菌落为圆形,边缘呈锯齿状,表面水润,颜色黄色,经革兰氏染色结果为阳性杆菌。

图2 JX-11菌落形态及革兰氏染色图
2.2.2 生理生化鉴定 由表2可知,JX-11菌株不适合高盐环境,可以利用葡萄糖、麦芽糖、淀粉、甘露醇、甘油等碳源产酸。过氧化氢酶、氧化酶、明胶酶结果呈阳性,其他试验结果均为阴性。
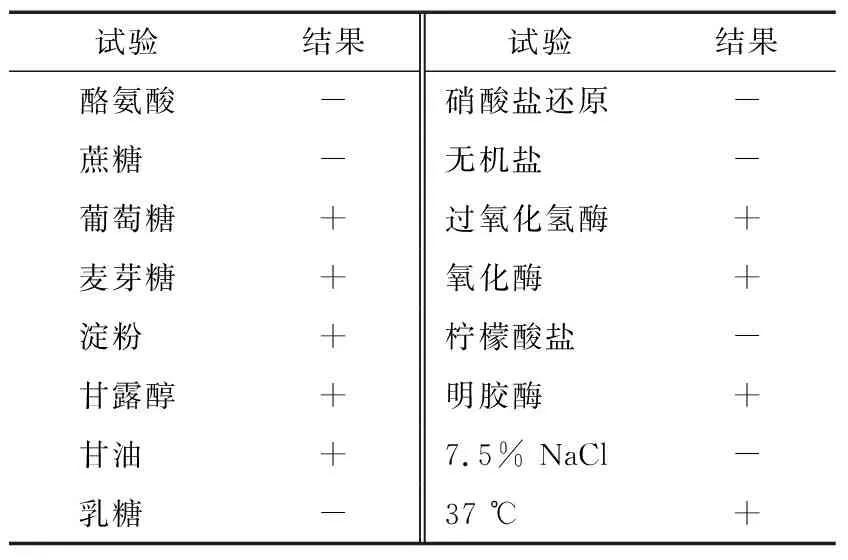
表2 JX-11菌株的生理生化特征表†
2.2.3 16S rRNA基因序列及系统发育分析 经过基因组DNA的提取,以总DNA为模板,利用27F/1492R引物,通过PCR扩增、琼脂糖凝胶电泳后得到菌株约1 000 bp的16S rRNA基因条带,结果见图3。将菌株的16S rRNA基因序列提交至NCBI数据库进行相似性比对。发现JX-11菌株与彭尼普尔金黄杆菌(C.pennipullorum)的16S rRNA基因序列自然聚类,相似度为99.65%,与10条相似性较高的序列构建系统发育树如图4所示,JX-11菌株与彭尼普尔金黄杆菌(C.pennipullorum)strain7 F195菌株在同一分支上,表明JX-11菌株与彭尼普尔金黄杆菌(C.pennipullorum)的亲缘关系最近。

M. Marker 1. 其他菌株 2. JX-11

图4 JX-11依据16S rRNA序列建立的系统发育树
2.3 菌株JX-11生长与产酶情况
如图5(a)所示,JX-11菌株在0~4 h时为生长延滞期,该菌株对生存环境的适应能力较弱,生长缓慢;在4~8 h时处于对数生长期,该菌株潜伏期短,生长迅速,对新鲜培养基的适应能力强[15],32 h后菌株生长进入衰亡期,可能是由于营养物质的减少,生长代谢产物的增加,导致菌株的生长繁殖受到抑制,逐步进入衰亡,菌落密度降低。如图5(b)所示,JX-11菌株在0~36 h时处于生长时期,产蛋白酶能力弱;36~48 h细菌生长进入衰亡期,产蛋白酶能力增强;JX-11菌株培养48 h后,培养基中营养物质减少,细菌生长受到抑制,代谢产物增加,蛋白酶活力降低。因此,选择48 h作为JX-11菌株的最适发酵时间。

图5 JX-11菌株生长曲线及其产酶活力曲线
2.4 JX-11菌株发酵条件优化
如图6(a)所示,JX-11菌株利用淀粉、乳糖、葡萄糖的活性在同一水平上,考虑到葡萄糖分子量,选择葡萄糖为最适碳源,优化添加量结果[图6(b)]为10 g/L;JX-11菌株利用碳源广泛,可以有效降解可溶性淀粉,如Wang等[16]从土壤中分离得到的C.taeanenseTKU001可以有效降解可溶性淀粉,得到最终产物葡萄糖和麦芽糖;Dahal等[17]从北极土壤中分离得到的C.antibioticumRP-3-3能够水解CM-纤维素、酪蛋白、淀粉和DNA。
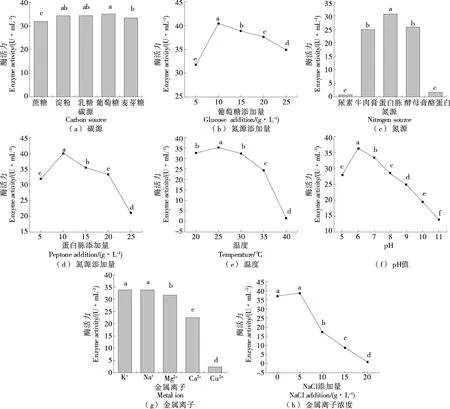
小写字母不同表示差异显著(P<0.05)
以蛋白胨为氮源时蛋白酶活性最高,为(30.57±0.68) U/mL[图6(c)],最适添加量为10 g/L[图6(d)];且有机氮源比无机氮源更有利于促进该菌株蛋白酶的酶活,由此可以认为,有机氮源能为该菌体的生长提供更丰富的氨基酸、维生素和生长因子等营养物质,从而促进蛋白酶的产生。
温度是催化蛋白酶活性和促进菌株生长发酵的重要因素之一,如图6(e)所示,培养温度为25 ℃的酶活力与20,30 ℃的有显著性差异(P<0.05),培养温度为25 ℃时酶活最高,达(35.13±0.81) U/mL;当培养温度超过25 ℃时,随着温度的增加,酶活力逐渐降低,过高的温度(>30 ℃)会抑制菌株的生长及产酶活力。因此,选择最适培养温度为25 ℃。
如图6(f)所示,随着pH的上升,酶活逐渐增加,在pH 6.0时酶活最高,为(36.25±0.84) U/mL;当pH继续上升时,酶活逐渐降低。因此,选择pH 6.0为最佳pH。
金属离子对JX-11菌株产酶活力的影响在同一水平上[P>0.05,图6(g)],选择Na+作为最适金属离子。进一步优化添加量结果显示,不添加与添加0.5%的NaCl,JX-11菌株产酶活力无显著性差异,低盐度对JX-11菌株产酶活力无显著促进作用[P>0.05,图6(h)];且随着NaCl添加量的增加,JX-11菌株产酶活力降低。高浓度NaCl会抑制JX-11菌株所产蛋白酶的活力。JX-11菌株更适合在低盐度下发酵产酶,与何小玉等[18]的研究结果一致。因此,不选择金属离子Na+为响应面试验因素。
2.5 发酵条件响应面试验
2.5.1 试验设计 在单因素试验基础上,选择温度、葡萄糖添加量、蛋白胨添加量和pH 4个因素的水平值,以酶活力为响应值,运用Design-Expert 8.0.6.1软件进行Box-Behnken响应面设计和数据分析。响应面试验因素水平见表3,试验方案见表4。

表3 响应面试验因素水平

表4 Box-Behnken试验方案及结果

表5 回归方程方差分析†
2.5.2 响应面模型建立与方差分析 通过Design-Expert 11对响应面试验结果进行分析,得到酶活力与各因素的二次回归方程:
Y=35.09-5.63A-1.50B+2.03C-0.043D-0.29AB-3.56AC-1.82AD-1.94BC-0.38BD-0.52CD-9.14A2-1.61B2+0.40C2-2.49D2。
(1)
由表3可知,模型P值<0.000 1,影响显著;失拟项P=0.258 1,影响不显著;R2=0.926 3,表明此回归方程为回归显著型,与实际拟合程度较好。该回归模型中,A、C对酶活力的影响达到极显著效应(P<0.01);AC对酶活力的影响达到显著效应(P<0.05),其他项对酶活力的影响不显著(P>0.05)。从P值以及F值可以看出,4个因素对酶活力的影响显著性大小依次为温度>蛋白胨添加量>葡萄糖添加量>pH,温度对JX-11菌株所产酶活力影响最大。
2.5.3 响应面交互作用分析 由图7可知,温度与蛋白胨添加量的响应面斜面较陡,交互作用较明显,达到显著水平(P<0.05);温度对JX-11菌株所产酶活力的影响最大,葡萄糖添加量、蛋白胨添加量次之,pH的影响最小,与方差分析结果一致。

图7 两两因素交互作用响应面与等高线图
2.5.4 响应面结果及验证实验 通过Design-Expert 8.0.6.1软件分析,预测出酶活力的最优工艺为温度22.66 ℃,葡萄糖添加量6.66 g/L,蛋白胨添加量14.98 g/L,pH 6.4,模型预测菌株JX-11酶活力为41.32 U/mL,调整工艺为温度23.00 ℃,葡萄糖添加量6.70 g/L,蛋白胨添加量15.00 g/L,pH 6.4,测定酶活力为(39.16±3.24) U/mL,与预测值的偏差<5%,模型有效。
在优化工艺条件下,JX-11菌株所产酶的活力已超过同属的C.taeanenseTKU001 (0.14 U/mL)[19]、C.proteolyticum9670 (0.16 U/mL)[20]、C.indologenesTKU014 (0.47 U/mL)[21]和C.spkr6 (33.2 U/mL)[22]等菌株,为高产蛋白酶菌株。
2.6 JX-11菌株酶学性质
2.6.1 温度对JX-11菌株的蛋白酶反应活性和稳定性的影响 如图8所示,JX-11菌株所产蛋白酶在10~40 ℃几乎保持了原有酶活力,相对酶活力>66.90%;但随着温度上升,酶活迅速降低,超过60 ℃时,残留酶活仅剩4.14%,表明JX-11菌株所产蛋白酶对高温敏感。当温度为10~30 ℃时蛋白酶能保持原有的活性,相对酶活力>50%;JX-11菌株蛋白酶的最适反应温度为30 ℃,但当温度高于30 ℃后,保温1 h,蛋白酶活力迅速下降,温度达到60 ℃时保温1 h,相对酶活力为16.35%,推测蛋白酶在高温下活性的急剧下降与蛋白酶结构的变化和高温下蛋白酶反应体系中溶解氧的减少有关。JX-11菌株所产蛋白酶有较广的适应温度,可以一定程度地适应粗放型工业生产条件,其蛋白酶产酶能力使其在工业生产中具有一定的应用价值。

图8 温度对JX-11菌株所产蛋白酶活力的影响
2.6.2 pH对JX-11菌株的蛋白酶反应活性和稳定性的影响 如图9所示,pH>5.0时,相对酶活力快速增大,在pH 7.0时达到最大酶活力;pH在6.0~9.0时残留酶活力为60%以上,有较好的稳定性;当pH>9.0,酶活性迅速下降,说明该粗酶液对碱性环境较敏感,不适合在强碱性环境下进行保存。反应体系的pH值会影响酶与不同底物的结合状态,从而产生不同的催化效率。在pH 7.0~9.0范围内反应1 h,相对酶活力>80%,最大酶活力pH为7.0,表明JX-11蛋白酶为中性蛋白酶,上清粗酶液对碱性环境较敏感,当pH>9.0时,酶活性迅速降低。因此,该酶在洗涤、制革、丝绸等行业具有较大的应用潜力。

图9 pH对JX-11菌株所产蛋白酶活力的影响
2.6.3 金属离子对JX-11菌株蛋白酶活性的影响 如图10所示,向蛋白酶粗酶液中加入金属离子Zn2+、Cu2+、K+抑制该蛋白酶的活性,其中Zn2+抑制该蛋白酶的活性作用次之,相对酶活力72.92%,Cu2+抑制作用最强,相对酶活力仅有43.52%;Mn2+对该蛋白酶酶活力有显著促进作用,对比空白,Mn2+对JX-11菌株所产酶活力促进率达到433.42%;而Na+、Mg2+、Ca2+对JX-11蛋白酶活力影响不大。其中Mn2+对JX-11菌株所产酶的影响和其他文献报道有差异,Deng等[23]发现Mn2+对芽孢杆菌属蛋白酶起抑制作用;殷方荣等[24]发现Mn2+对贝莱斯芽孢杆菌角蛋白酶有轻微抑制作用;张军等[25]发现Mn2+完全抑制乙酰微小杆菌低温蛋白酶。但Mageswari等[26]的研究表明,Mn2+具有促进金黄杆菌属酶活的作用,当Mn2+存在时酶活性显著增强,这是C.pennipullorum蛋白酶的罕见特征。此外,Bhavikatti等[27]从河水和河岸土壤样品中分离出的C.cucumerisSARJS-2,Zn2+对其酶活无显著抑制作用。Wang等[28]以红曲稻为唯一的碳氮源,从土壤中分离得到C.taeanenseTKU001,Mg2+、Ca2+对其酶活无显著影响,Zn2+抑制该酶活性,且在5 mmol Cu2+和Fe2+条件下完全失活,与JX-11菌株所产酶的特征相似。综上,JX-11菌株所产酶可能是一种活性中心需Mn2+参与的金属蛋白酶类,有关该酶分子的具体结构及活性中心有待进一步深入研究。
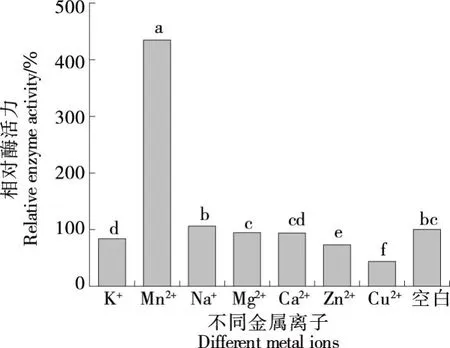
小写字母不同表示差异显著(P<0.05)
2.6.4 化学试剂对JX-11菌株蛋白酶活性的影响 如图11所示,甘油对该酶有显著的激活作用,相对酶活可达132.94%,甘油可作为非离子表面活性剂能够与游离水进行水合,降低了游离水含量,减少了游离水对蛋白酶构象灵活性的影响[29];乙醇、丙酮对酶活基本无影响;吐温80、乙酸、甲醇显著抑制该酶活性,有机溶剂会削弱蛋白质的疏水键,使蛋白酶分子内斥力增加,造成蛋白质的三级结构延展,最终导致催化活性丧失;EDTA对该酶的抑制作用显著,EDTA是一种金属螯合剂,与酶分子中的金属离子形成螯合物从而使酶失活,进一步表明该酶发挥作用需要金属离子参与;而SDS对酶活具有显著抑制作用,可能是因为SDS为离子型表面活性剂,可通过静电作用结合到蛋白酶表面带有电荷的氨基酸残基上,从而产生抑制作用[30]。
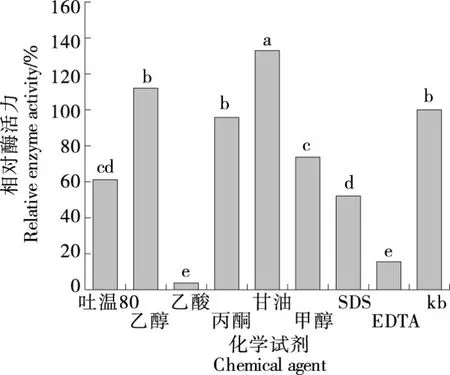
小写字母不同表示差异显著(P<0.05)
3 结论
利用模拟豆腐营养成分培养基,从石屏臭豆腐中分离筛选出一株高产蛋白酶的菌株,命名为JX-11,经过鉴定,为彭尼普尔金黄杆菌(Chryseobacteriumpennipullorum)。研究对菌株JX-11培养条件进行优化,优化后酶活达到(39.16±3.24) U/mL,较优化前提高了40.63%。酶学性质结果表明菌株JX-11所产蛋白酶最适温度为30 ℃,最适pH为7.0,是中性蛋白酶;在10~40 ℃和pH 6.0~9.0时酶活力稳定;金属离子Mn2+对酶活力有明显激活作用,可使酶活提高4.33倍,而Zn2+、Cu2+、K+对其有抑制作用,乙醇、丙酮对酶活基本无影响;吐温80、乙酸、甲醇、SDS、EDTA显著抑制该酶活性,金属螯合剂EDTA对该酶活性的抑制作用最大,同时也进一步验证了该酶为金属蛋白酶类。考虑C.pennipullorum菌株的安全性,今后可采用代谢工程的方法对相关致病基因进行敲除;也可通过基因工程手段异源表达蛋白酶的基因,利用所产蛋白酶应用于石屏臭豆腐的发酵。

