M1型乙酰胆碱受体在微波辐射致小鼠认知行为改变中的作用
何钢华 , 潘 婷 , 冯志华 , 崔智琳 , 杨镁楹 , 李 杨 , 左红艳 , 邓 桦
(1. 佛山科学技术学院生命科学与工程学院 , 广东 佛山 528231 ; 2. 中国人民解放军军事科学院军事医学研究院辐射医学研究所 , 北京 海淀 100850)
伴随各种电子设备的发展和应用,微波辐射对人体健康的影响备受关注。微波辐射(Microwave radiation,MR)是指频率在300 MHz~300 GHz,波长为1 mm~1 m的电磁波辐射[1],其作为一种严重的环境污染源,可对人或动物的中枢神经系统造成影响。研究表明,中枢神经系统是对微波辐射敏感的重要靶器官,且海马是微波辐射敏感的重要靶部位,微波辐射可导致认知功能障碍[2],但其作用机制尚未阐明。众所周知,胆碱能神经系统由能够合成乙酰胆碱(Acetylcholine,ACh)的胆碱能神经元组成,ACh和乙酰胆碱受体(Acetylcholine receptors,AChRs)在学习和记忆中发挥关键作用[3]。然而,关于微波辐射对脑内AChRs的影响及其在认知功能障碍中的作用尚不明确。
本试验在前期工作基础上,建立微波辐射动物模型[4],基于微波辐射对海马各亚区组织形态结构的影响,以及海马AChRs亚型基因表达变化,选取M1型AChR(M1-AChR)特异性激动剂,进一步探讨M1-AChR在微波辐射致小鼠认知行为改变中的作用,以期为微波辐射脑损伤效应机制及其防治研究提供新思路。
1 材料与方法
1.1 主要试剂 苏木精-伊红(Hematoxylin-Eosin,H.E.)染液,购自北京雷根(Leagene)生物技术有限公司;RNA Isolater Total RNA Extraction Reagent、HiScript Ⅲ RT SuperMix RNA逆转录试剂盒和TaqPro Universal SYBR qPCR Master Mix试剂盒,均购自南京诺唯赞生物科技股份有限公司;VU0357017 hydrochloride M1-AChR激动剂,购自TargetMol中国(陶术生物)公司。
1.2 主要仪器 RM2255石蜡切片机,德国徕卡(Leica)仪器有限公司产品;Pannoramic MIDI Ⅱ数字切片扫描系统,匈牙利 3DHISTECH公司产品;N60-Touch超微量紫外分光光度仪,因普恩(北京)国际贸易有限公司产品;CFX Opus 96荧光定量PCR仪,伯乐生命医学产品(上海)有限公司产品;Any-maze动物行为学视频分析系统,美国Stoelting公司产品。
1.3 实验动物 10周龄SPF级C57BL/6N健康小鼠共49只,体重(26 ± 2)g,雌雄各半,购自斯贝福(北京)生物技术有限公司[生产许可证号:SCXK(京)2019—0010],饲养于中国人民解放军军事科学院军事医学研究院(以下称军科院)实验动物中心。动物试验符合军科院实验动物中心医学伦理委员会标准(伦理批准号:IACUC-DWZX-2021-685)。
1.4 微波辐射动物模型建立 将小鼠随机分为空白对照组(Con组)和微波辐射组(MR组),MR组利用军科院自建微波辐射模拟源对小鼠进行单次全身照射。将小鼠放置于透明带孔的圆形有机玻璃盒中,自由体位,采用中心频率为2.856 GHz,平均功率密度为8 mW/cm2,SAR值为6.12 W/kg的微波对小鼠全身均匀辐射15 min(单次);Con组小鼠放置于相同的有机玻璃盒内,在同样的照射环境中进行单次伪辐射15 min。
1.5 海马组织病理学观察 Con组和MR组小鼠各6只。微波辐射后7 d,小鼠经腹腔注射1%戊巴比妥钠[50 mg/(kg·bw)]麻醉后取脑组织,经4%多聚甲醛室温固定2周,依次进行梯度乙醇脱水、二甲苯透明、浸蜡、包埋和石蜡切片,切片厚度3 μm;经H.E.染色后,采用Pannoramic MIDI Ⅱ 数字切片扫描系统观察海马组织形态结构改变。
1.6 实时荧光定量PCR(Real-time fluorescence quantitative PCR,RT-qPCR)检测海马AChRs基因表达 Con组和MR组小鼠各5只。微波辐射后7 d,小鼠经腹腔注射1%戊巴比妥钠[50 mg/(kg·bw)]麻醉后取脑组织,冰上剥离双侧海马。采用TRIzol试剂提取海马组织总RNA,利用超微量紫外分光光度仪测定RNA浓度以及A260/A280和A260/A230比值。取1.8

表1 实时荧光定量PCR引物信息
1.7 VU0357017 hydrochloride给药方法 将小鼠随机分为空白对照组(Con-NS组)、辐射对照组(MR-NS组)和辐射给药组(MR-VU组),每组各9只。微波辐射后7 d,MR-VU组小鼠腹腔注射M1-AChR特异性激动剂VU0357017 hydrochloride,注射剂量为10 mg/(kg·bw);Con-NS组和MR-NS组注射同等体积生理盐水,各组于给药后30 min进行行为学试验。
1.8 行为学试验
1.8.1 新物体识别(Novel object recognition,NOR)试验 采用40 cm×40 cm×40 cm旷场箱,将大小相同但颜色不同的2个正方体(4 cm×4 cm×4 cm)沿对角线置于距箱体边缘10 cm处。试验前将小鼠置于试验环境中,每天对其进行适应性操作30 min,连续3 d。试验开始时,采用Any-maze动物行为学视频分析软件记录小鼠运动轨迹5 min,采集小鼠探索新和旧物体的时间。分别按公式(1)和(2)计算动物的辨别指数(Discrimination index,DI)和认知指数(Recognition index,RI),检测小鼠新物体探索行为的改变。
DI=(探索新物体时间-探索旧物体时间)÷(探索新物体时间+探索旧物体时间)
(1)
RI(%)=探索新物体时间÷(探索新物体时间+探索旧物体时间)×100%
(2)
1.8.2 Y迷宫(Y maze)试验 采用臂长30 cm、宽8 cm、高15 cm的Y迷宫,试验前将小鼠置于试验环境中,每天对其进行适应性操作30 min,连续3 d。试验开始时,采用Any-maze动物行为学视频分析软件记录小鼠运动轨迹8 min,采集小鼠进入Y迷宫各臂的时间和次数,按公式(3)计算自由交替率(Spontaneous alternation),检测小鼠空间探索能力的改变。
自由交替率(%)=连续进入3个不同臂的次数 ÷ (进臂总次数-2)×100%
(3)
2 结果
2.1 微波辐射对小鼠海马各亚区组织形态结构的影响 微波辐射后7 d,H.E.染色结果显示,空白对照组小鼠海马阿蒙氏角1(Cornu ammonis 1,CA1)、阿蒙氏角2(Cornu ammonis 2,CA2)、阿蒙氏角3(Cornu ammonis 3,CA3)和齿状回(Dentate gyrus,DG)区组织结构均基本正常(图1A~1E);微波辐射组小鼠海马CA1和CA3区部分锥体神经元核固缩深染,血管周围间隙略增宽,其中CA3区组织病理学改变更为明显;CA2和DG区组织结构变化不明显(图1F~1J)。

图1 微波辐射后小鼠海马的组织病理学变化(H.E.染色,A和F:8×; B~E和G~J:40×)
2.2 微波辐射对小鼠海马组织AChR亚型基因表达的影响 RT-qPCR结果如图2所示,微波辐射后7 d,与空白对照组相比较,微波辐射组小鼠海马组织M1和M3型AChR mRNA相对表达量均显著下调(M1-AChR,P<0.01;M3-AChR,P<0.05),M2、M4、α4和α7型AChR mRNA相对表达量均显著上调(P<0.05),M5和β2型AChR mRNA相对表达量均未见统计学差异变化(P>0.05)。
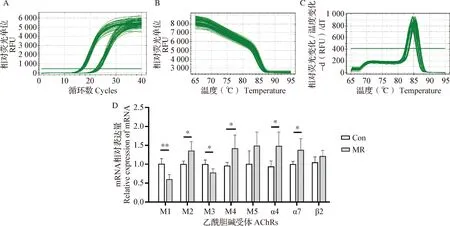
图2 微波辐射后小鼠海马乙酰胆碱受体基因mRNA表达的变化
2.3 M1型AChR激活对微波辐射致小鼠认知行为改变的影响 新物体识别试验结果显示,微波辐射后7 d,与空白对照组(Con-NS组)相比,辐射对照组(MR-NS组)小鼠对新物体的DI和RI均显著下降(P<0.05);腹腔注射M1-AChR激动剂VU0357017 hydrochloride(VU)后,与辐射对照组相比较,辐射给药组(MR-VU组)小鼠对新物体的DI和RI均显著升高(P<0.05),且与Con-NS组相比无统计学差异(P>0.05,图3E~3F)。Y迷宫试验结果显示,微波辐射后7 d,各试验组之间小鼠的自由交替率均未见显著性变化(P>0.05,图3G)。

图3 M1型乙酰胆碱受体激活对微波辐射所致小鼠认知行为改变的影响
3 讨论
流行病学研究表明,长期微波辐射暴露可导致头痛、脑电波异常、神经衰弱、记忆力减退和睡眠障碍等[2,5]。啮齿类动物暴露于一定条件的电磁波辐射可造成其长时记忆、短时记忆和运动性记忆能力下降,并伴随兴奋和焦虑等神经行为的异常[6]。
海马是参与学习和记忆功能的重要脑区,也是电磁波辐射的敏感靶部位之一[7]。本课题组前期采用Morris水迷宫和穿梭箱行为学试验发现,2.856 GHz、8 mW/cm2、15 min的微波辐射可引起小鼠空间参考记忆能力和联合型学习记忆能力下降,同时导致海马CA3区组织病理学改变[8]。本试验在前期工作基础上,进一步分析了微波辐射后海马CA1、CA2、CA3和DG区的组织形态结构变化,发现CA3区病变最为明显,表明海马CA3区对微波辐射较为敏感。Wang等[9]分别利用1.5 GHz、5 mW/cm2,1.5 GHz、30 mW/cm2和1.5 GHz、50 mW/cm2微波辐射大鼠6 min,以及Hasan等[10]通过2 400 MHz、738 μW/cm2射频电磁辐射暴露小鼠40 min,均发现海马神经元固缩深染,血管周隙增宽,与本试验中海马病理形态学改变特点基本一致。
ACh是中枢胆碱能系统的重要神经递质,ACh及其受体的表达调控与认知功能密切相关[3]。AChRs可分为毒蕈碱型乙酰胆碱受体(Muscarinic acetylcholine receptors,mAChRs,主要包括M1~M5五个亚型)和烟碱型乙酰胆碱受体(Nicotinic acetylcholine receptors,nAChRs,主要包括α4、α7、β2和α4β2型)[11]。研究表明,mAChRs通过偶联G蛋白进行信号转导,nAChRs通过调节神经突触膜上Ca2+通道通透性而激活蛋白激酶C(Protein kinase C,PKC)信号通路,并调节Ca2+依赖的蛋白激酶Ⅱ而发挥作用[12-13]。关于微波辐射对海马中AChRs的影响尚不明确。Kumar等[14]采用2.45 GHz、0.029 mW/cm2微波辐射小鼠1个月(2 h/d),发现辐射组小鼠海马M1-AChR上调且AChE活性增加;Hassanshahi等[15]采用2.45 GHz、23.6 dBm微波辐射大鼠1个月(12 h/d),海马mAChRs表达升高,AChE活性及其胞内Ca2+浓度升高。本课题组前期研究发现,大鼠经2.856 GHz、8 mW/cm2、15 min微波辐射后6 h,其海马中仅α4型AChR mRNA相对表达量显著上调,其余AChRs mRNA相对表达量均未见明显变化;微波辐射后7 d,大鼠海马M1、M3和β2型AChR mRNA相对表达量显著下调,α7型AChR mRNA相对表达量显著上调[16]。以上研究表明,一定条件的微波辐射可引起脑内ACh合成和代谢紊乱,造成AChRs表达失调。
本试验在前期工作基础上进一步利用微波辐射小鼠模型,确证了微波辐射后7 d,海马M1和M3型AChR mRNA相对表达量显著下调,M2、M4、α4和α7型AChR mRNA相对表达量均显著上调,进一步提示微波辐射可引起海马AChRs亚基构成比发生变化,且不同亚型AChRs对微波辐射的敏感程度存在差异,其中,微波辐射可引起海马M1、M2、M3、M4、α4和α7型AChR基因表达异常,而对M5和β2型AChR基因表达影响不明显。
研究表明,M1-AChR占mAChRs的50%~60%,其主要在海马中表达[17]。M1-AChR可通过促进谷氨酸和γ-氨基丁酸神经传递而改善学习记忆[18-20]。此外,M1-AChR基因敲除小鼠在长时程增强中表现出认知缺陷[21-22]。目前,M1-AChR已成为治疗阿尔兹海默和老年痴呆症等中枢神经系统疾病的潜在靶点[23-24]。以上研究提示,M1-AChR对学习和记忆功能具有正向调控作用。因此,可推测海马M1-AChR mRNA相对表达量下调可能在微波辐射致认知行为改变中发挥重要作用。本试验通过对微波辐射小鼠腹腔注射M1-AChR特异性激动剂,并结合行为学评估其对认知功能的影响,结果发现,微波辐射可导致小鼠新物体探究和识别记忆功能障碍,而M1-AChR激活可有效改善微波辐射所致小鼠新物体识别记忆受损,表明M1-AChR对于微波辐射所致认知功能障碍具有重要调控作用。
综上所述,本试验发现,微波辐射可引起海马AChRs亚基构成比变化和CA3区组织病理学改变,M1-AChR mRNA相对表达量于辐射后显著下调,并在微波辐射所致认知行为功能下降中发挥重要调控作用,进一步揭示了微波辐射致海马结构和功能损伤的分子机制,同时为其药物研发和医学防护提供了理论依据和试验参考。

