猪链球菌靶向DC重组蛋白DC3pep-SDZ对斑马鱼的免疫保护性分析
于恩远 , 荣睿璠 , 曾 君 , 赵瑞利 , 郭海悦 , 张东超 , 胡 烨 , 李 颖 , 王心如
(1. 天津农学院动物科学与动物医学学院 天津市农业动物繁育与健康养殖重点实验室 , 天津 西青 300392 ;2. 天津市动物疫病预防控制中心 , 天津 北辰 300402)
猪链球菌(Streptococcussuis,SS)主要致病血清型为2型(SS2)、3型(SS3)、7型(SS7)和9型(SS9)等[1-3]。为了开发具有型间交叉保护效果的SS亚单位疫苗,本课题组前期选取了SS2、SS3和SS9中高度保守的分泌型DNA核酸酶A(Secretory DNA nuclease A,SsnA)、二氢硫辛酰胺脱氢酶(Dihydrolipoamide dehydrogenase,DLDH)和高亲和力锌摄取系统蛋白(High-affinity zinc uptake system protein,ZnuA)3种毒力因子作为保护性抗原,利用生物信息学软件筛选得到了优势的B细胞和辅助T(Helper T,Th)细胞表位,将这些优势表位与树突状细胞靶向肽(Dendritic cell targeting peptide,DC3pep)氨基酸序列串联,构建并制备了靶向树突状细胞(Dendritic cells,DC)的多表位重组蛋白DC3pep-SDZ[1]。
斑马鱼(Daniorerio,Zebrafish)是目前SS相关研究中常用的模式生物之一[4],由于斑马鱼与哺乳动物基因同源性较高,有着完整特异性的先天性免疫和获得性免疫系统,当鱼体感染细菌、病毒和寄生虫等病原体后可以释放一系列炎性细胞因子[5]。Pressley等[6]报道了用迟缓爱德华菌感染斑马鱼后,鱼体IL-1β和TNF-a基因的表达量显著上调。Rodríguez等[7]检测显示,被嗜水气单胞菌感染的斑马鱼肾脏中TNF-α和IFN-γ基因的表达量上调。
为了探究本课题组前期构建的SS多细胞表位靶向DC重组蛋白DC3pep-SDZ对致病型SS感染斑马鱼的免疫保护效果,本试验采用了与构建重组蛋白DC3pep-SDZ相同的方法构建了不含DC3pep的对照重组蛋白SDZ,将制备的2种重组蛋白分别免疫斑马鱼,攻击致病型SS2、SS3和SS9,计算存活率,采用苏木精-伊红(Hematoxylin-eosin,H.E.)染色法探究重组蛋白DC3pep-SDZ对斑马鱼感染SS后产生的免疫保护效果,采用实时荧光定量PCR(Real-time fluorescence quantitative PCR,RT-qPCR)检测SS3攻击斑马鱼后的炎性细胞因子表达量,以期为后续SS重组亚单位疫苗的开发提供参考依据。
1 材料与方法
1.1 主要试剂 Todd-Hewitt肉汤(Todd-Hewitt broth,THB)粉末,购自青岛海博生物技术有限公司;异丙基-β-D-硫代半乳糖苷(Isopropyl-beta-D-thiogalactopyranoside,IPTG),购自翌圣生物科技(上海)有限公司;二甲苯,购自天津市风船化学试剂科技有限公司;间氨基苯甲酸乙酯甲磺酸盐(3-Aminobenzoic acid ethyl ester methanesulfonate,MS-222),购自上海阿拉丁生化科技股份有限公司;2×ExTaqMix,购自上海联硕生物科技有限公司;伊红、苏木精、焦碳酸二乙酯(Diethyl pyrocarbonate,DEPC)水和磷酸盐缓冲液等,均购自北京索莱宝科技有限公司;TRIzol总RNA提取试剂,购自宝日医生物技术(北京)有限公司。
1.2 主要仪器 荧光倒置显微镜,Nikon尼康精机(上海)有限公司产品;JXFSTPRP-CL-24冷冻研磨仪,上海净信实业发展有限公司产品;琼脂糖电泳仪,北京六一生物科技有限公司产品;超微量分光光度计,赛默飞世尔科技(中国)有限公司产品;iMax酶标仪、凝胶成像分析仪和荧光定量PCR仪,伯乐生命医学产品(上海)有限公司产品。
1.3 菌株和实验动物 SS2(ZY05719)、SS3(TJ1806)和SS9(TJ0102)分离株,由天津农学院兽医学实验室保存;原核表达载体pET28a-SDZ和感受态细胞E.coliBL21(DE3),由上海捷瑞生物工程有限公司构建。健康成年AB系野生型斑马鱼(体长2.5~3.5 cm),由天津农学院兽医学实验室繁殖饲养,本试验经天津农学院动物实验伦理委员会批准(批准号:2021LLSC07)。
1.4 试验方法
1.4.1 重组质粒pET28a-SDZ的构建 将重组蛋白DC3pep-SDZ氨基酸序列[1]中N端的DC3pep和与之相连的首个GGGG柔性短肽序列删除,即获得重组蛋白SDZ的氨基酸序列。采用参考文献[1]中的方法,用ProtParam在线分析重组蛋白SDZ氨基酸序列理化性质后将氨基酸序列转化为核苷酸序列并优化,构建原核表达载体pET28a-SDZ并转化感受态细胞E.coliBL21(DE3)。
1.4.2 免疫原的制备 采用参考文献[1]中的方法制备重组蛋白DC3pep-SDZ和SDZ。将pET28a-DC3pep-SDZ/BL21(DE3)和pET28a-SDZ/BL21(DE3)扩大培养,于600 nm波长处检测菌液的吸光度(Optical density,OD)约为0.5时,加入终浓度为1 mmol/L的IPTG进行诱导,6 h时采用SDS-PAGE分析诱导产物表达情况,Western blot鉴定诱导产物可溶性[封闭:5%脱脂奶粉4 ℃过夜;一抗:小鼠抗6×His单克隆抗体(1∶5 000),孵育90 min;二抗:山羊抗小鼠IgG-HRP(1∶3 000),孵育60 min]。将上清中的产物利用亲和层析镍柱纯化和超滤浓缩,采用SDS-PAGE鉴定纯化产物,超微量分光光度计测定重组蛋白DC3pep-SDZ和SDZ浓度并分别调整至1 mg/mL,置于4 ℃待用。
1.4.3 SS的复壮和鉴定 取复苏的SS ZY05719、TJ1806和TJ0102接种于THB培养基常规培养后收集菌体,调整菌液浓度(ZY05719:3.5×1010CFU/mL、TJ1806:4.2×109CFU/mL、TJ0102:4.4×109CFU/mL)。随机选取15尾斑马鱼,使用MS-222(55 μg/L)麻醉后随机分为3个组:第1组、第2组和第3组,每组5尾,每尾分别腹腔注射10 μL ZY05719、TJ1806和TJ0102菌液,注射后12~24 h观察斑马鱼发病情况,从濒死斑马鱼脑内分离细菌接种于THB平板并扩大培养。取菌悬液利用PCR扩增SS特异性荚膜基因cps,引物由生工生物工程(上海)股份有限公司合成,引物序列见表1。PCR反应体系(20 μL):cDNA 1 μL,2×ExTaqMix 10 μL,上、下游引物各1 μL,ddH2O 7 μL;反应程序:95 ℃预变性5 min;30个循环(94 ℃ 1 min,55 ℃ 90 s,72 ℃ 1 min);72 ℃延伸 10 min。使用1%琼脂糖凝胶电泳对PCR产物进行鉴定。

表1 SS cps基因引物信息
1.4.4 斑马鱼半数致死量(Median lethal dose,LD50)的测定 选取190尾斑马鱼随机分为4个大组,包括3个试验组(ZY05719攻击组、TJ1806攻击组和TJ0102攻击组)和PBS对照组,3个试验组每组各60尾鱼,PBS对照组10尾鱼。每个试验组再根据菌液稀释梯度将斑马鱼随机分为100、10-1、10-2、10-3、10-4和10-5组共6个小组,每小组10尾,麻醉后每尾腹腔接种10 μL与组名对应的稀释度的菌液(100组每尾斑马鱼接种ZY05719、TJ1806和TJ0102细菌数分别为1.9×109CFU、1.1×109CFU和1.4×109CFU);PBS对照组每尾腹腔接种10 μL PBS,按照Reed-Muench法[8]计算LD50。
1.4.5 重组蛋白免疫保护效果评价 选取180尾斑马鱼随机分为3个大组,分别为重组蛋白DC3pep-SDZ组、重组蛋白SDZ组和PBS对照组,每组60尾。麻醉后3个大组斑马鱼每尾分别腹腔注射10 μL(500 mg/mL)重组蛋白DC3pep-SDZ、10 μL(500 mg/mL)重组蛋白SDZ和10 μL PBS。一共进行3次免疫,每次免疫间隔10 d。在第3次免疫后10 d,每个大组随机分为3个小组(ZY05719攻击组、TJ1806攻击组和TJ0102攻击组),每个小组20尾鱼,分别取5倍LD50剂量的ZY05719、TJ1806和TJ0102菌悬液以每尾10 μL的剂量分别腹腔注射攻击3个小组,攻击后连续观察7 d,每日观察斑马鱼存活情况,计算存活率。
1.4.6 斑马鱼脑组织病理学检查 在ZY05719、TJ1806和TJ0102攻击后24 h,随机选取重组蛋白SDZ组、重组蛋白DC3pep-SDZ组和PBS对照组中被ZY05719、TJ1806和TJ0102攻击的斑马鱼各2尾,取出脑组织置于4 %多聚甲醛溶液中固定24 h以上,参考Yang等[9]方法制作病理切片,H.E.染色后镜检观察。
1.4.7 斑马鱼脑组织炎性细胞因子相对表达量检测 在TJ1806攻击后24 h,取重组蛋白SDZ组、重组蛋白DC3pep-SDZ组和PBS对照组斑马鱼脑组织,放入无RNase的EP管中,利用TRIzol法提取RNA,合成cDNA,RT-qPCR检测白细胞介素-6(Interleukin-6,IL-6)、白细胞介素-10(Interleukin-10,IL-10)、干扰素γ(Interferon gamma,IFN-γ)、肿瘤坏死因子α(Tumor necrosis factor-α,TNF-α)和转化生长因子β1(Transforming growth factor-beta1,TGF-β1)mRNA的相对表达量。各炎性细胞因子基因序列参照参考文献[10],引物均由生工生物工程(上海)股份有限公司合成,引物信息见表2。

表2 斑马鱼炎性细胞因子基因引物信息
RT-qPCR反应体系(25 μL):2×UltraSYBR Mixture 12.5 μL,上、下游引物各0.5 μL,cDNA 1 μL,添加RNase-free ddH2O至25 μL;反应程序:95 ℃预变性10 min;39个循环(95 ℃ 15 s,60 ℃ 30 s,95 ℃ 15 s);60 ℃ 60 s,95 ℃ 30 s,60 ℃ 15 s。
1.4.8 统计分析 使用SPSS 22.0软件对试验数据进行统计分析,采用方差分析和卡方检验进行数据比较分析,数据用“平均值±标准差”表示,P<0.05为差异性显著,P<0.01为差异性极显著,P<0.001为差异性极其显著。
2 结果
2.1 免疫原的制备 本课题组前期构建的重组蛋白DC3pep-SDZ分子式为C1429H2209N429O517S2,分子质量为44 kDa,理论等电点(Isoelectric point,pI)为4.65,亲水性总平均数(Grand average of hydropathicity,GRAVY)为-0.462,属于亲水性蛋白[1]。重组蛋白SDZ氨基酸序列理化性质分析结果显示,分子式为C1360H2116N410O500S2,分子质量为42 kDa,pI为4.5,GRAVY为-0.4436,同样属于亲水性蛋白。pET28a-SDZ/BL21(DE3)、pET28a-DC3pep-SDZ/BL21(DE3)诱导后蛋白大量表达(图1A),重组蛋白DC3pep-SDZ和SDZ主要以可溶性蛋白表达于上清液中(图1B和1C),将上清液纯化后得到了高纯度重组蛋白DC3pep-SDZ和SDZ(图1D)。
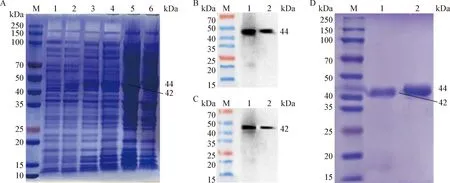
图1 重组蛋白DC3pep-SDZ和SDZ的表达、可溶性分析和纯化鉴定
2.2 SS的复壮和鉴定 从濒死斑马鱼脑内分离的3株SS的PCR鉴定结果显示,分别扩增出了SS2、SS3和SS9对应的特异性cps基因,阳性条带大小分别为557、1 273和300 bp(图2)。

图2 cps基因的PCR扩增
2.3 斑马鱼LD50的测定 结果显示,ZY05719攻击组、TJ1806攻击组和TJ0102攻击组的最小菌液稀释度的100组斑马鱼在感染SS 24 h内已出现发病和死亡,死亡数在36 h内达到高峰,10-1、10-2、10-3、10-4和10-5组斑马鱼则在96 h内均陆续出现病变和死亡,PBS对照组斑马鱼无病变和死亡情况出现(表3),计算得出ZY05719、TJ1806和TJ0102对斑马鱼的LD50分别为8.71×104、1.1×106和4.47×105CFU。

表3 斑马鱼LD50测定结果
2.4 重组蛋白免疫保护效果评价 攻毒后7 d重组蛋白DC3pep-SDZ组、重组蛋白SDZ组和PBS对照组的斑马鱼存活率结果如图3所示,PBS对照组所有斑马鱼48 h内全部感染死亡,重组蛋白DC3pep-SDZ组和重组蛋白SDZ组中ZY05719攻击组、TJ1806攻击组和TJ0102攻击组3个小组存活率分别为50.0%、65.0%和60.0%,45.0%、47.3%和45.0%。重组蛋白DC3pep-SDZ组和重组蛋白SDZ组之间无显著差异(P>0.05),但与PBS对照组相比较均差异极其显著(P<0.001)。结果表明,重组蛋白DC3pep-SDZ和SDZ对SS2、SS3和SS9攻击可以产生一定的交叉免疫保护力。
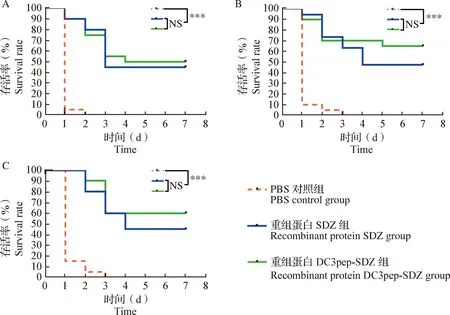
图3 斑马鱼存活率
2.5 斑马鱼脑组织病理学检查 PBS对照组(图4A)被3株SS攻击后脑组织均有红细胞坏死、溶解并形成了不同程度的微血栓,且颗粒细胞层水肿,胞质出现空泡化,特别是ZY05719攻击组的颗粒细胞层损伤较为严重,空泡数量明显增多,TJ1806攻击组的脑组织分子层明显水肿、结构松散紊乱,水平细胞和星形细胞数量减少;重组蛋白SDZ组(图4B)中的ZY05719攻击组的脑外颗粒层出现少量空泡;而重组蛋白DC3pep-SDZ组(图4C)的ZY05719攻击组、TJ1806攻击组和TJ0102攻击组3个小组脑颗粒细胞层的细胞均没有产生明显的病变,细胞形态正常且颗粒层边界清晰。结果表明,重组蛋白SDZ组对SS3和SS9攻击产生了保护效果,重组蛋白DC3pep-SDZ对SS2、SS3和SS9攻击均产生了一定的保护效果。
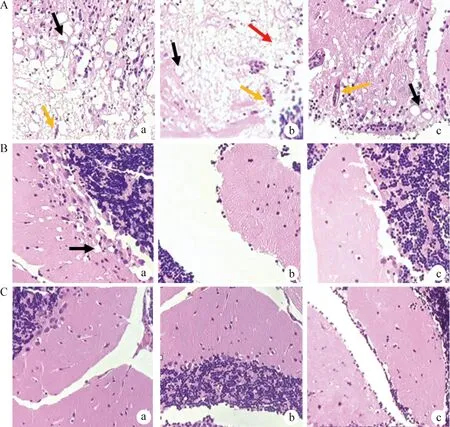
图4 斑马鱼脑组织病理学检测(H.E.染色,200×)
2.6 斑马鱼脑组织炎性因子相对表达量检测 TJ1806攻击后24 h,重组蛋白DC3pep-SDZ组促炎性细胞因子与PBS对照组相比较,IL-6、TNF-α和IFN-γmRNA表达量分别极显著(P<0.01)、极其显著(P<0.001)和极显著(P<0.01)下调,与重组蛋白SDZ组相比较,IL-6和TNF-αmRNA表达量分别极显著(P<0.01)和显著下调(P<0.05)(图5A);重组蛋白DC3pep-SDZ组抗炎性细胞因子与PBS对照组相比较,IL-10和TGF-β1 mRNA表达量分别极显著(P<0.01)和极其显著(P<0.001)上调,与重组蛋白SDZ组相比较,IL-10和TGF-β1 mRNA表达量分别不显著(P>0.05)和显著上调(P<0.05)(图5B)。结果表明,免疫重组蛋白DC3pep-SDZ和SDZ都能够减轻斑马鱼感染SS3后的脑部炎症反应,但重组蛋白DC3pep-SDZ减轻感染症状和缓解炎症反应的效果更好。

图5 斑马鱼脑组织炎性细胞因子mRNA相对表达量
4 讨论
斑马鱼是研究遗传学、发育生物学、血管生物学和疾病建模方面常用的模式动物,具有体型小、饲养成本较低、遗传操作简便、胚胎透明、发育周期全透明、繁殖周期短、产卵量大、发育迅速和易于管理操作等优点[11-12]。由于斑马鱼对SS易感,Neely等[13]早先建立了SS斑马鱼感染模型,后来我国陆承平等[14]也采用单一纯系AB斑马鱼作为动物模型研究SS的致病性并进行溶菌酶释放蛋白(Muramidase-released protein,MRP)对斑马鱼的免疫试验。近年来,孔里程[15]将SS的三磷酸甘油醛脱氢酶(Glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、MRP和DLDH三个毒力因子的B细胞表位进行串联,原核表达后免疫斑马鱼,证实了多B细胞表位蛋白可以对斑马鱼机体产生有效的免疫应答,具有一定的保护作用。基于此,本试验将构建了含有B和Th细胞表位的靶向DC细胞重组蛋白DC3pep-SDZ免疫斑马鱼,评价重组蛋白DC3pep-SDZ对SS2、SS3和SS9的免疫保护效果。
在重组蛋白免疫保护效果评价试验中,重组蛋白DC3pep-SDZ和SDZ对3种分型SS的感染都能表现出一定的交叉保护力,这验证了本课题组前期筛选的保护性抗原SsnA、DLDH和ZnuA的B和Th细胞表位的有效性。在存活率计算和H.E染色试验后,碍于对斑马鱼采血等技术操作限制,本试验没有检测鱼体相关抗体水平的变化,后续研究将把重组蛋白DC3pep-SDZ和佐剂混合制备亚单位疫苗,免疫小鼠和仔猪,采用计算存活率、检测血清中特异性抗体水平、细胞因子浓度以及脏器和血液载菌量等方法全面评价亚单位疫苗DC3pep-SDZ的保护效果。
SS的细胞壁成分属于病原体相关分子模式(Pathogen-associated molecular patterns,PAMP)之一,能被Toll样受体2(Toll-like receptor 2,TLR2)识别[16],激活DC信号传导的同时触发IL-6的分泌,从而引发机体炎症[10]。在检测SS3感染斑马鱼脑组织炎性细胞因子试验中,重组蛋白DC3pep-SDZ组促炎性细胞因子IL-6和TNF-αmRNA表达量显著低于重组蛋白SDZ组,表明了免疫靶向DC策略的重组蛋白相较于纯表位重组蛋白可以更有效地缓解炎症,此结果符合设想,但机制目前还不清楚。研究表明,斑马鱼感染SS2后可以通过刺激TLR2和髓样分化因子(Myeloid differentiation factor 88,MyD88)信号通路触发促炎性细胞因子IL-6等的分泌,进而加深脑膜炎的炎症反应[10],因此后续研究还将检测这些触发炎性细胞因子表达的相关信号通路的变化,分析免疫靶向DC重组蛋白较非靶向DC重组蛋白更有效缓解炎症反应的相关机制。

