基于MIMIC数据库探讨预后营养指数与重症肝硬化患者预后的相关性*
张雅芳 姚 锐 陆建红 孙 旭
1.湖州市第三人民医院十三病区 (浙江 湖州, 313000) 2.湖州市中心医院,浙江大学医学院附属湖州医院重症医学科 3.湖州市中心医院,浙江大学医学院附属湖州医院普外科
肝硬化是一种慢性进行性肝脏疾病,其特征是肝脏组织逐渐受损、纤维化和瘢痕化,导致肝脏结构和功能的持续恶化。晚期或重症肝硬化是一种危及生命的疾病,治疗选择有限。据统计,全球约有1.6亿人患有肝硬化[1],2019年估计死亡人数超过147万人[2],是全球主要的十大死亡原因之一[3]。对于高死亡风险的患者,应进行精确的预后评估,并提供有效的治疗。因此,有学者开始探索预测肝硬化患者预后及严重程度的指标,包括肝活检、肝静脉压梯度、末期肝病模型(MELD)评分、Child-Pugh评分及红细胞分布宽度(RDW)等,但大多存在某些缺陷,如实施繁琐,重复性不高,获取困难等而尚未得到认可及大范围的实施[4]。因此,如何及时识别高风险患者,精确及早期判断肝硬化患者预后仍是目前的一大难题。
预后营养指数(PNI)已被证明可以准确全面地评估患者的营养状况,通过将外周血淋巴细胞计数与血清白蛋白相结合,反映了炎症和相关信号通路对营养和新陈代谢的影响[5]。最初PNI被用来预测胃肠手术前的免疫状态和风险,但近年来发现它与许多癌症(如食管癌、肺癌、胃癌)的预后有着密切关系[6-8]。但目前在肝硬化患者中尚未发现报道。因此,本研究通多对美国重症监护医学信息数据库(MIMIC-IV,v2.0)中数据来探讨PNI与重症肝硬化患者的相关性,以期尽早精准判断患者预后。
1 资料与方法
1.1 资料来源 采用回顾性研究方法,分析2008至2019年MIMIC-IV数据库中所有符合要求的成年患者数据。纳入标准:① 年龄≥18周岁的肝硬化患者;②首次在重症监护室(ICU)住院患者。排除标准:①ICU住院时间<24 h;②ICU住院当天死亡;③未收集到白蛋白和淋巴细胞计数等数据。
MIMIC-IV数据库由贝斯以色列女执事医疗中心和麻省理工学院附属机构审查委员会批准。本研究的一位作者获取了访问MIMIC-IV数据库的权限(ID号:42303155)。
1.2 数据收集及分组
1.2.1 数据的收集 本研究收集纳入患者的临床资料,包括年龄、性别、序贯器官衰竭评估(SOFA)评分、实验室检查结果、合并症、治疗及ICU住院时间。
其中实验室检查包括了白细胞计数、血红蛋白、血小板计数、淋巴细胞计数、白蛋白、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、胆红素、肌酐、凝血酶原时间、血钙、血糖、血磷、阴离子间隙。合并症包含了高血压、糖尿病、慢性肺病、心房颤动(AF)、恶性肿瘤、肝性脑病、急性心肌梗死(AMI)、急性肾损伤(AKI)、深静脉血栓(DVT)和呼吸机相关性肺炎(VAP)。治疗包括接受多巴胺、机械通气(MV)、连续性肾脏替代治疗(CRRT)、输血(红细胞、血浆、血小板)等治疗。所有实验室检查结果均为患者入ICU后第一次检测所记录的结果。
依据既往文献,PNI计算公式为白蛋白(g/L)+5×淋巴细胞计数(109/L)[9]。
1.2.2 分组 依据患者90 d预后情况,将患者分为存活组(n=832)和死亡组(n=515)。同时,根据限制性立方样条(RCS)分析中90 d死亡风险比(HR)为1时的PNI值,将患者分为高PNI组(PNI≥34.46,n=691)和低PNI组(PNI<34.46,n=656)。
1.3 研究结局 研究结局指标是患者入院后90 d全因死亡率。

2 结果
2.1 一般情况比较 最终纳入符合要求的患者1 347例,死亡组年龄、SOFA评分、白细胞计数、谷草转氨酶、胆红素、肌酐、凝血酶原时间、血磷、阴离子间隙、接受治疗(多巴胺、MV及机械通气及输血)比例、并发症(AF、恶性肿瘤、肝性脑病及AKI)的比例更高,ICU住院时间也更长,且差异有统计学意义(P<0.05)。而血红蛋白、白蛋白、血糖、淋巴细胞计数、PNI值更低,差异有统计学意义(P<0.05),见表1。
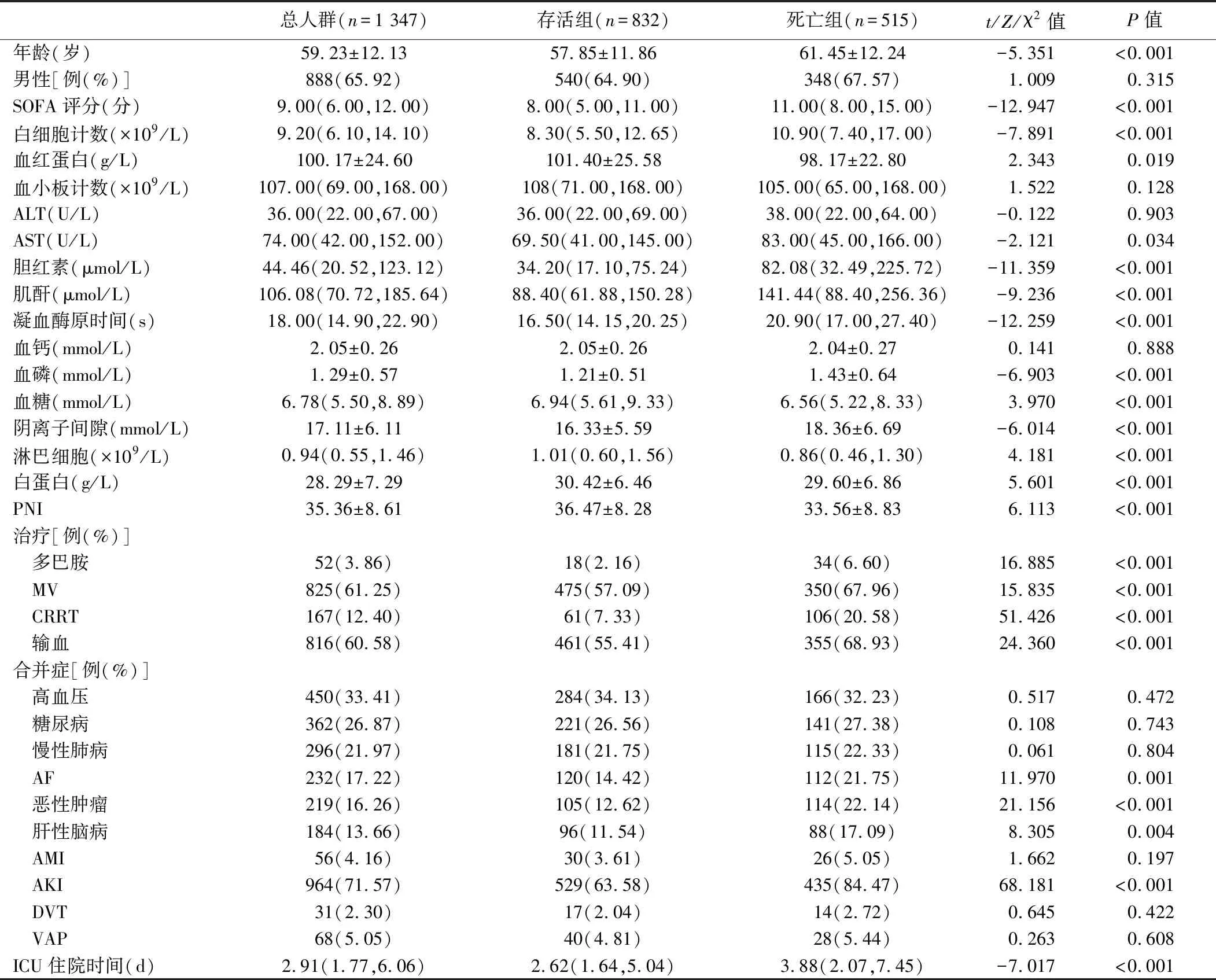
表1 两组患者基本资料比较
2.2 RCS分析 RCS显示,PNI与90 d全因死亡风险整体呈非线性趋势关系(χ2=20.800,P<0.001)。在一定范围内,随着PNI值的降低,重症肝硬化患者90 d全因死亡风险随之升高,见图1。
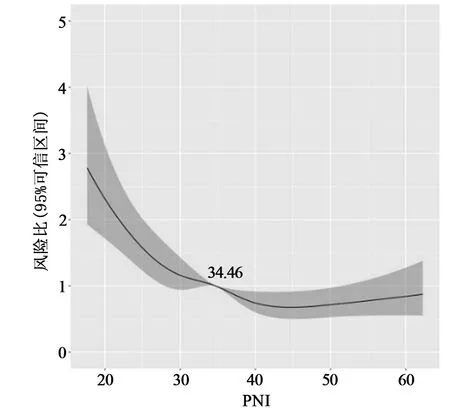
图1 PNI水平与重症肝硬化患者90 d全因死亡风险相关性
2.3 Kaplan-Meier生存曲线 与高PNI组相比,低PNI组患者90 d的累积生存率更低,差异有统计学意义(P<0.001),见图2。

图2 90 d累积生存率曲线
2.4 Cox回归分析模型 在未调整任何混杂因素时,即模型一中,Cox分析得出,低PNI肝硬化患者90 d死亡的HR(95%CI)为1.652(1.386~1.969),提示低PNI是重症肝硬化患者90 d全因死亡的危险因素(P<0.05)。同时年龄、SOFA评分、白细胞计数、肌酐、胆红素、凝血酶原时间、血磷、血糖、阴离子间隙、AF、恶性肿瘤、肝性脑病、AKI、多巴胺、MV、CRRT、输血是同样是重症肝硬化患者90 d全因死亡的危险因素(P<0.05)。模型二中,经过对19个混杂因素的调整后,Cox分析显示,低PNI是重症肝硬化患者90 d全因死亡的独立危险因素(HR=1.337,95%CI=1.112~1.607,P<0.05)。同时年龄、SOFA评分、胆红素、凝血酶原时间、阴离子间隙、恶性肿瘤、AKI及多巴胺的使用是患者90 d全因死亡的独立危险因素(P<0.05),见表2。

表2 两组重症肝硬化患者90 d全因死亡风险Cox回归分析
3 讨论
重症肝硬化作为ICU中常见的疾病,其发病率及死亡率始终居高不下[3]。寻找精准判断肝硬化患者预后的指标一直是管理肝硬化患者的主题及难题之一。目前肝活检和肝静脉压力梯度已被证明能够反映肝硬化患者的预后,但由于侵入性的操作在临床应用中受到限制[10]。Child-Pugh评分和MELD评分目前是预测晚期肝硬化预后的非侵入性方法。然而,Child-Pugh评分受主观因素影响较多,而MELD评分是为经颈静脉肝内门体分流手术患者所建立的,且更适用于肝硬化终末期患者[11,12]。因此,目前临床上更加需要简单、可重复和非侵入性的指标来预测肝硬化患者的预后。有学者研究发现超敏C反应蛋白、RDW、中性粒与淋巴细胞比值、血白蛋白等水平均不同程度影响着肝硬化患者的预后[4,10],但研究大多并未得到进一步的证实。
众所周知,肝硬化是由长期的肝脏炎症和损伤引起,其中炎症是导致肝脏组织纤维化和瘢痕化的重要因素之一。当肝脏受到损伤时,机体的免疫系统会启动炎症反应,以试图修复受损区域。如果损伤持续存在,炎症反应可能变得长期化,并导致肝脏组织的慢性炎症,这种长期的炎症刺激会促使细胞释放炎症因子和细胞因子,进一步导致纤维化过程的启动。此外,肝硬化本身也可以引起炎症反应。受损的肝脏组织可能会释放更多的炎症因子,这可能导致全身性的炎症反应,进一步影响其他器官和系统[13,14]。因此,管理肝硬化的策略之一是控制炎症,以减缓疾病的进展和减少并发症的风险。从另一角度来说,尽早发现与预后有关炎症指标也同样是管理肝硬化的一个重要方面。上述超敏C反应蛋白、中性粒细胞与淋巴细胞比值也是对从此角度出发的指标的一系列研究,却未得到确切结论。
PNI作为一个炎症指标,由外周血淋巴细胞及白蛋白计算得出,是一个反映人体营养和炎症状态的易于获取的指标[6]。1980年,Buzby等人[15]首次将该指数应用于评估胃肠外科手术风险。随着临床实践中营养评估重要性的迅速增加,越来越多的研究开始重视PNI,并报告该指数能够预测许多疾病的预后。Hu与Feng等[16,17]的研究表明,低PNI与接受肾切除手术的肾细胞癌及髋部骨折患者不良结局相关。低PNI与慢性硬膜下血肿复发的风险增加有关,可能在预测慢性硬膜下血肿患者的复发方面发挥重要作用[9]。也有学者发现PNI与较多内科疾病相关。有报道称,PNI作为免疫营养标志物与糖尿病肾病的发病率相关,是2型糖尿病患者全因死亡的独立预测因子[18]。同时,PNI是晚期心力衰竭患者长期全因死亡和心血管死亡的独立预测因子,可作为一种客观且简单的风险分层工具[19]。此外,PNI与接受静脉溶栓治疗的急性缺血性卒中患者的3个月预后独立相关,在临床工作中可能是一个有用的营养评估工具[20]。但目前仍未发现PNI在肝硬化患者中的报道。
本研究通过研究发现,PNI与90 d全因死亡风险整体呈非线性趋势关系(χ2=20.800,P<0.001)。同时在一定范围内,随着PNI值的降低,重症肝硬化患者90 d全因死亡风险随之升高。生存分析显示,与高PNI组相比,低PNI组患者90 d的累积生存率更低(log-rank检验,χ2=32.560,P<0.001)。多因素Cox回归分析显示,低PNI是重症肝硬化患者90 d全因死亡的独立危险因素(HR=1.337,95%CI=1.112~1.607,P<0.05)。该结论提示,临床医师及护理人员可从PNI入手,对肝硬化患者进行风险分层,发现90 d预后差的高危肝硬化患者,从而早期判断患者预后。
本研究人群来自真实世界,研究样本量相对较大,且首次探讨了PNI与肝硬化患者预后的相关性,并为早期识别预后不佳的高危肝硬化患者提供了PNI的截断值。但也存在着一定的不足:本研究为回顾性研究,存在着不可避免的偏倚;且只研究了PNI与90 d预后的相关性,缺乏长期随访数据,这将是我们后期研究的重点。综上所述,入ICU时PNI水平降低(PNI<34.46)是重症肝硬化患者90 d全因死亡的独立危险因素,可作为重症肝硬化患者预后风险分层的一项工具。

