涠洲岛海水中可培养细菌的溶藻活性初探
黄华林 覃仙玲 农志文 赖俊翔 苏芯莹 赖海清 黄丹蕾 李菲
摘要:目的 選取3种海洋赤潮甲藻为研究对象,从广西涠洲岛海域来源细菌中筛选出高效溶藻的菌株,研究菌株的溶藻效果和初步作用机制,为开展赤潮的防治工作奠定基础。方法 采用细菌发酵液与甲藻共培养来测定菌株的溶藻活性,检测藻细胞中丙二醛和抗氧化相关酶系统的响应规律,分析甲藻胞外溶解性有机物组成,并通过KEGG和CAZy数据库预测目标菌株合成溶藻物质的能力。结果 从24株细菌中筛选到15株对至少一种甲藻表现出溶藻活性的菌株,总阳性率为62.5%,菌株M026对3种甲藻均表现出显著的溶藻效果。添加10%的M026发酵无菌滤液,共培养3 d后,3种甲藻细胞死亡率均高达95.0%。生理生化响应表明,在M026发酵无菌滤液胁迫下,甲藻细胞膜脂过氧化损伤严重,3种抗氧化相关酶(SOD、CAT和APX)活性先增加后下降,且三维荧光光谱检测到藻细胞内溶产物为类富里酸和类蛋白类物质。通过全基因组分析,菌株M026含有溶藻活性的次级代谢产物生物合成基因,及多种降解植物细胞壁的酶。结论 菌株M026可作为微生物溶藻菌剂的候选菌株。
关键词:涠洲岛;可培养细菌;甲藻;溶藻活性
中图分类号: Q939.1文献标志码:A
Study on the algicidal activity of culturable bacteria isolated
from seawater in Weizhou Island
Abstract Objective To screen highly effective algicidal bacterial strains from the seawater in Weizhou Island, Guangxi Zhuang Autonomous Region, China. Three marine dinoflagellates were selected as the research object to study the algicidal efficiency and mechanism of those strains for the prevention and control of red tide. Methods The bacterial fermentation broth and dinoflagellate were co-cultured to determine the algicidal effect of the strains, determine the response rules of malondialdehyde (MDA) and antioxidant related enzyme systems in algae cells, analyze the composition of extracellular soluble organic matter (EDOM) in dinoflagellate, and predict the ability of the target strain to synthesize algicidal substances through KEGG and CAZy databases. Results Total 15 strains that showed algicidal activity against at least one species of dinoflagellate were screened out from 24 strains of bacteria. The total positive rate was 62.5%. Among them, strain M026 showed significant algicidal activity against three dinoflagellates. After inoculating 10% of M026 fermentation sterile filtrate and co-culturing for 3 days, the cell death rate of the three dinoflagellates reached 95.0%. The physiological and biochemical responses indicated that algae suffered serious lipid peroxidation, three related enzymes (SOD, CAT and APX) activities increased first and decreased subsequently under the oxidative stress of M026 sterile filtrate. Three-dimensional fluorescence spectroscopy results showed that the algae lysates were fulvic acid-like and protein-like substances. According to the analysis of draft genome, strain M026 contains potential secondary metabolite biosynthetic gene with algicidal activity, as well as a variety of plant cell wall degrading enzymes. Conclusion Due to the high algicidal efficiency and mechanism of strain M026, it can be used as a candidate strain to develop microbial algicidal agents.
Key words Weizhou island; Culturable bacteria; Dinoflagellate; Algicidal activity
赤潮(red tide)是海洋生态系统中藻类生物条件性暴发增殖或高密度聚集而引发水体变色的一种异常现象[1]。赤潮不仅严重破坏海洋生态平衡,影响渔业和旅游业发展,给人类带来直接经济损失;还常常伴随藻毒素和溶解氧耗尽等问题,威胁着鱼类、海洋哺乳动物、贝类和其他海洋生物的生长,且摄食藻毒素积累的海鲜也会导致人类和动物的疾病和死亡[2-3]。目前,赤潮防治的方法主要有化学、物理和生物法,其中物理和化学法对有害藻类具有很强的杀灭作用,但因其成本高、大规模应用难、二次污染引入及非目标生物毒性等缺点,很大程度上限制了这些方法的应用[4]。生物法则是利用生物间互作关系来控制或除去赤潮生物,该法具有溶藻潜力高和生态友好等优点,是近年来有害藻华治理最具前景的手段[5]。在过去的几十年里,研究人员从藻华水体、污泥、土壤、植物等介质中分离和鉴定出众多的溶藻细菌,其中拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)占50%,γ-变形杆菌(Gammaproteobacteria)占45%和放线菌门(Actinobacteria)占5% [6]。
甲藻(dinoflagellate)是一类能自由运动的单细胞真核生物,多分布于海洋环境,是海洋浮游生物群落的重要组成部分[7],也是形成有害藻华的原因种之一[8]。据统计,全球范围内存在约300种浮游植物可产生藻华,其中甲藻约184种,占比55%(有毒甲藻类约94种)[9-10]。这些甲藻赤潮分布广泛,在我国边缘海近岸环境中时常暴发,严重威胁我国沿海生态环境和经济。综上,本论文拟采用室内藻类培养观察、生理生化试验及生物学手段探索广西涠洲岛海域来源细菌对3种甲藻的溶藻活性和潜在机制,为探索更高效广谱的微生物溶藻剂奠定基础。
1 材料与方法
1.1 供试藻种
东海原甲藻(Prorocentrum donghaiense)、微小原甲藻(Prorocentrum minimum)和米氏凯伦藻(Karenia mikimotoi)均保藏于廣西海洋科学院藻种库,藻种培养采用f/2培养基[11],培养条件:温度(20±1) ℃,光照强度为2000 lx,光暗周期12 h:12 h。
1.2 供试菌株
选择供试细菌24株(表1),来源于广西涠洲岛海域(21°1'2''N,109°2'29''E)的表层海水样品,该采样区域爆发夜光藻;经2216E固体培养基分离纯化,委托生工生物工程(上海)股份有限公司进行16S rRNA测序分析,并通过EzBioCloud数据库(https://www.ezbiocloud.net/)[12]在线比对,现保藏于广西科学院北部湾海洋微生物种质资源库中。
1.3 溶藻细菌的初筛
将24株细菌分别接种至1/10的2216E液体培养基(MA,海博生物;3.7 g/L 2216E液体培养基,1000 mL
蒸馏水,121 °C高压灭菌20 min),180 r/min摇床,
28 °C培养5 d。发酵菌液经8000 r/min离心10 min,收集上清液,经0.22 μm的PES膜滤(BKMAM)以收集无菌滤液,于4 °C下储存备用。取10 mL无菌滤液加入90 mL生长对数期的藻液中,初始藻细胞密度为
104 cells/mL。以2216E液体培养基作为对照组,按藻种培养条件培养24,48和72 h后,取1 mL藻液用鲁哥氏碘液固定,通过光学显微镜观察藻细胞形态变化,并对其进行拍照。再用血球计数板对藻细胞进行计数,每个处理设3组平行,以此抑制率(AR, %)评估溶藻效果。计算公式如下:
AR= (Ct-Tt)/Ct×100%
式中Ct和Tt分别为对照组和实验组中甲藻细胞数量(cells/mL)。
1.4 目标菌株M026的溶藻特性
1.4.1 M026不同生长阶段对溶藻活性影响
将生长初期(培养1 d),对数期(培养3 d),稳定期(培养5 d),衰亡期(培养7 d)的M026菌液以10%含量分别添加至对数期3种甲藻培养物中,以加入等体积2216E液体培养基作为对照组。按藻种培养条件培养24,48和72 h取样观察和计数。
1.4.2 M026菌液不同投加量对溶藻活性影响
将稳定期的M026发酵菌液,以1%,2.5%,5%和10%(V/V)含量分别添加至3种对数期甲藻培养物中,以加入等体积2216E液体培养基作为对照组,每个处理设3组平行。按藻种培养条件培养24,48和
72 h后取样观察和计数。
1.4.3 叶绿素a含量测定
采用丙酮比色法[13]测定“1.4.1”和“1.4.2”中共培养24,48和72 h后的藻液中叶绿素a(Chl-a)含量。将共培养的藻液过滤收集藻细胞,置于5 mL
90%丙酮浸泡24 h,4000 r/min离心10 min后收集上清液,采用紫外分光光度计测定,波长设定为664、647、630和750 nm。Chl-a含量计算公式如下:
Chl a(%)=(11.85×△1-1.54×△2-0.08×△3) ×V1/V
△1=A664-A750,△2=A647-A750,△3=A630-A750;
式中,A为不同波长下吸光度;V为样品量;V1为上清液定容量。
1.4.4 丙二醛含量和抗氧化酶活性测定
取10 mL目标活性菌株的无菌发酵滤液,分别添加至90 mL对数期3种甲藻培养物中,对照组不加菌液而加等体积2216E(1/10)液体培养基。按藻种培养条件培养24,48和72 h取样。粗酶液制备:取
30 mL样品经6500 r/min离心5 min,收集藻细胞,在冰水浴中匀浆5次(8000 r/min,作用时间10 s,间隔时间5 s),加入2 mL预冷的PBS缓冲液(0.1 mol/L,
pH 7.4),涡旋混匀3 min,8000 r/min离心10 min取上清液,即粗酶液储存在-20 °C待测[14]。采用相应试剂盒(南京建城生物工程研究所)测定丙二醛(malondialdehyde,MDA)含量,超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)和抗坏血酸过氧化物酶(ascorbate peroxidase,APX)活性。
1.4.5 胞外溶解性有机物(EDOM)组成
收集“1.4.3”中样品的上清滤液,经过0.45 μm滤膜(BKMAM)后收集胞外溶解性有机物溶液,使用荧光分光光度计(F-7000,日立)检测。参数设置:激发光源为15 W氙灯,光电倍增管电压700 V,信噪比>110,激发波长(Ex)和發射波长(Em)扫描范围分别为220~500 nm和220~550 nm,步长为10 nm,扫描速度为12000 nm/min[15]。数据经OriginPro 2021软件绘图,图中误差棒代表3次实验之间的标准偏差。
1.5 目标菌株的基因组分析
将菌株接种于1/10的2216E液体培养基中,28 °C、
180 r/min摇瓶震荡培养5 d,8000 r/min离心10 min收集菌体,用无菌水洗涤菌体三次后装入离心管,迅速冷冻后寄送至上海美吉生物医药科技有限公司完成基因组的提取、测序、组装和注释,通过KEGG数据库(Kyoto Encyclopedia of Genes and Genomes,http://www.genome.jp/kegg/)和碳水化合物活性酶数据库(CAZy,http://www.cazy.org/)分别预测目标菌株中参与溶藻作用的代谢产物及相关酶的合成基因。
2 结果与讨论
2.1 溶藻细菌筛选
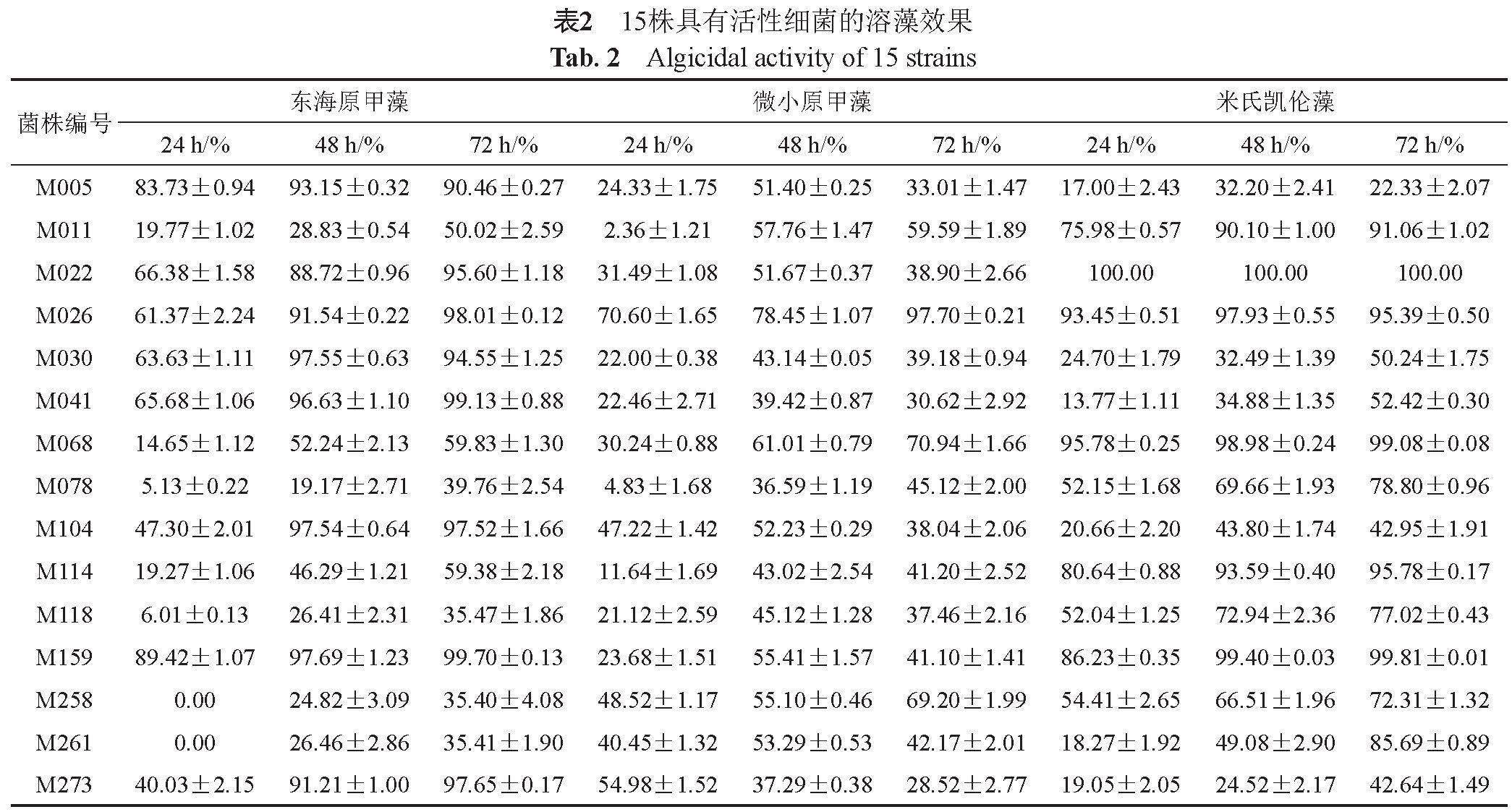
将24株细菌进行溶藻活性筛选,获得15株细菌对至少一种甲藻表现出溶藻活性(抑制率大于50%,表2),总计有10株、4株和10株细菌分别对东海原甲藻、微小原甲藻和米氏凯伦藻表现出溶藻效果;其中,菌株M026对3种甲藻均表现出显著的溶藻活性。
在对照组中,3种甲藻的藻细胞生长良好,细胞膜完整,叶绿体分布均匀(图1A/B/C-对照组);在实验组中,东海原甲藻(图A-实验组)和微小原甲藻(图B-实验组)细胞膜破裂,胞内溶物呈颗粒状逐渐散开,最终藻细胞死亡;米氏凯伦藻细胞出现萎缩,边缘模糊,叶绿体聚团并出现黄化现象,体积显著减少,进而细胞破裂,内容物流出,细胞死亡(图C-实验组)。随着共培养时间增加,视野中死亡的藻细胞数量增加。可见,菌株M026对于3种甲藻具有很强的破坏能力。
2.2 菌株M026溶藻特性
2.2.1 M026不同生长阶段对溶藻活性影响
不同生长阶段M026发酵无菌滤液对东海原甲藻,微小原甲藻和米氏凯伦藻生长的影响如图2所示。随着共培养时间延长,3对照组的藻生物量增加,各阶段的M026菌液对3种甲藻的抑制活性增加。当共培养时间相同,实验组中的3种甲藻细胞中Chl-a含量呈现显著下降的趋势(P<0.05),而对照组由于对数期藻细胞的繁殖,其Chl-a含量呈现略微上升趋势;对应实验组的藻细胞数量呈现出与藻细胞中Chl-a含量相同的变化趋势,即抑制活性递增;其中,稳定期的M026菌液对3种甲藻的抑制活性最好。基于以上结果,采用稳定期M026菌液(发酵培养5d)进行后续溶藻实验。
2.2.2 M026发酵滤液不同投加量对溶藻活性影响
M026无菌发酵滤液的投加量对东海原甲藻,微小原甲藻和米氏凯伦藻生长的影响如图3所示。随着培养时间增加,3对照组的藻生物量增加,不同添加量的M026菌液对3种甲藻表现出不同的抑制活性。当菌株发酵液添加量为10%时,东海原甲藻,微小原甲藻和米氏凯伦藻细胞数量及Chl-a含量显著低于对照组(P<0.05);当菌株发酵液添加量为5%时,微小原甲藻细胞数量及Chl-a含量与对照组相近,而东海原甲藻和米氏凯伦藻细胞数量及Chl-a含量较对照组的低;当菌株发酵液添加量为2%时,仅有米氏凯伦藻细胞数量及细胞中Chl-a含量较低;当菌株发酵液添加量为1%时,3种甲藻细胞中Chl-a的含量与对照组的相近,即M026对3种甲藻的生长影响较低或没有。综上,采用10%菌液投加量进行后续溶藻机理初探实验。
2.2.3 藻细胞丙二醛含量和抗氧化酶活性变化
丙二醛作为机体中膜脂质过氧化产物,可依据其含量变化来评估机体氧化损伤程度,进而判断机体受到自由基攻击的情况[16]。如图3A所示,在空白对照组中,3种供试甲藻的MDA含量始终保持在相对较低且稳定水平,在0.147~0.201 nmol/mg prot (prot表示蛋白质,下同)波动;在相同滤液投加量的实验组中,随着培养时间的增加,3种甲藻中MDA含量总体都呈现上升趋势。共培养24 h时,东海原甲藻、微小原甲藻和米氏凯伦藻中MDA含量分别为0.809,0.448和0.943 nmol/mg prot,分别为对照组的5.4倍,2.7倍和5.9倍;共培养48 h时,东海原甲藻、微小原甲藻和米氏凯伦藻中MDA含量分别上升至1.196,1.112和1.900 nmol/mg prot,分别为对照组的8.1倍,5.8倍和12.8倍;共培养72 h时,东海原甲藻、微小原甲藻和米氏凯伦藻中MDA含量分别上升至1.565,0.181和2.148 nmol/mg prot,分别为对照组的9.7倍,5.9倍和13.4倍;其中,微小原甲藻的MDA含量升高幅度较小,在培养48 h后,其增长倍数变化不大。综上,在M026无菌发酵滤液作用下,东海原甲藻、微小原甲藻和米氏凯伦藻均会受到不同程度的损伤,并且培养时间越长,膜脂过氧化损伤的程度越高。
如图4B,对照组中SOD活性保持在较低而平稳的水平上,即培养72 h内SOD酶活在11.15~27.11 U/mg
prot;实验组中,随着培养时间的延长,3种甲藻的SOD活性呈现出较对照组先上升后下降的趋势;其中在共培养48 h后,东海原甲藻和微小原甲藻的SOD活性最高。共培养24 h,东海原甲藻、微小原甲藻和米氏凯伦藻的SOD活性分别为79.373,40.476和171.438 U/mg prot,分别为对照组的5.3倍,3.6倍和13.4倍,此时米氏凯伦藻的SOD活性最高;共培养48 h,东海原甲藻、微小原甲藻和米氏凯伦藻的SOD活性分别为131.438,101.059和99.037 U/mg prot,分别为对照组的7.1倍,5.5倍和4.5倍,此时东海原甲藻和微小原甲藻的SOD活性最高;共培养72 h,东海原甲藻、微小原甲藻和米氏凯伦藻的SOD活性分别为91.483,51.330和78.058 U/mg prot,分别为对照组的3.4倍,2.1倍和3.6倍。如图3C,对照组中CAT活性在培养72 h内均处在较低且平稳水平,即7.440~10.592 U/mg prot;实验组中,东海原甲藻在培养24 h,48 h和72 h时CAT活性分别为44.891,63.985和30.063 U/mg prot,分别是对照组的5.2倍,6.6倍和2.8倍;微小原甲藻在培养24 h,48 h和72 h时CAT活性分别为34.110,50.208和20.163 U/mg prot;分别是对照组的4.0倍,5.4倍和1.9倍;米氏凯伦藻在培养24,48和72 h时CAT活性分别为68.629,36.366和15.823 U/mg
prot,分别是对照组的9.2倍,3.8倍和1.5倍。如图3D,3种供试藻种的APX活性变化趋势与SOD、CAT活性变化趋势相同,APX活性较对照组提升2.7~10.7倍。综上所述,在M026无菌发酵滤液的胁迫下,3种供试藻种均开启了自我防御机制。
2.3 藻胞外溶解性有机物(EDOM)组成
研究指出,藻类有机物含有蛋白质、氨基酸和腐殖酸类等物质[17],通过研究M026细菌发酵液与甲藻共培养过程中,甲藻胞外有机物组成变化如图5~7所示,推测M026中具有潜在溶藻活性物质。3组对照组光谱中均检测到激发和发射中心位置为280/335 nm
(Ex/Em,下同)的类色氨酸荧光峰(FL-a),此类物质多为含氮物质和芳香族氨基酸等[18];其中,米氏凯伦藻对照组中的FL-a强度高,即米氏凯伦藻代谢产物中类色氨酸丰富;此外,还检测到类富里酸荧光峰(260/440 nm,FL-b)和类腐殖酸荧光峰(340/440 nm,FL-c),此类物质是微生物降解有机物或藻类细胞后的代谢产物,不能被溶藻菌作为营养物质吸收[19]。
与对照组相比,除检测到FL-a、FL-b和FL-c外,还在共培养48和72 h的东海原甲藻处理组及72 h
米氏凯伦藻里均检测到类蛋白荧光峰(230/330 nm,FL-d)[14]。随着共培养时间延长,溶藻产物中类富里酸和类蛋白物质的荧光峰强度呈增强趋势。综上,M026破坏了3种甲藻细胞的同时释放了类富里酸和类蛋白等藻细胞内有机物,且共培养时间越长,藻细胞破坏和降解程度越严重。
2.4 M026全基因组分析
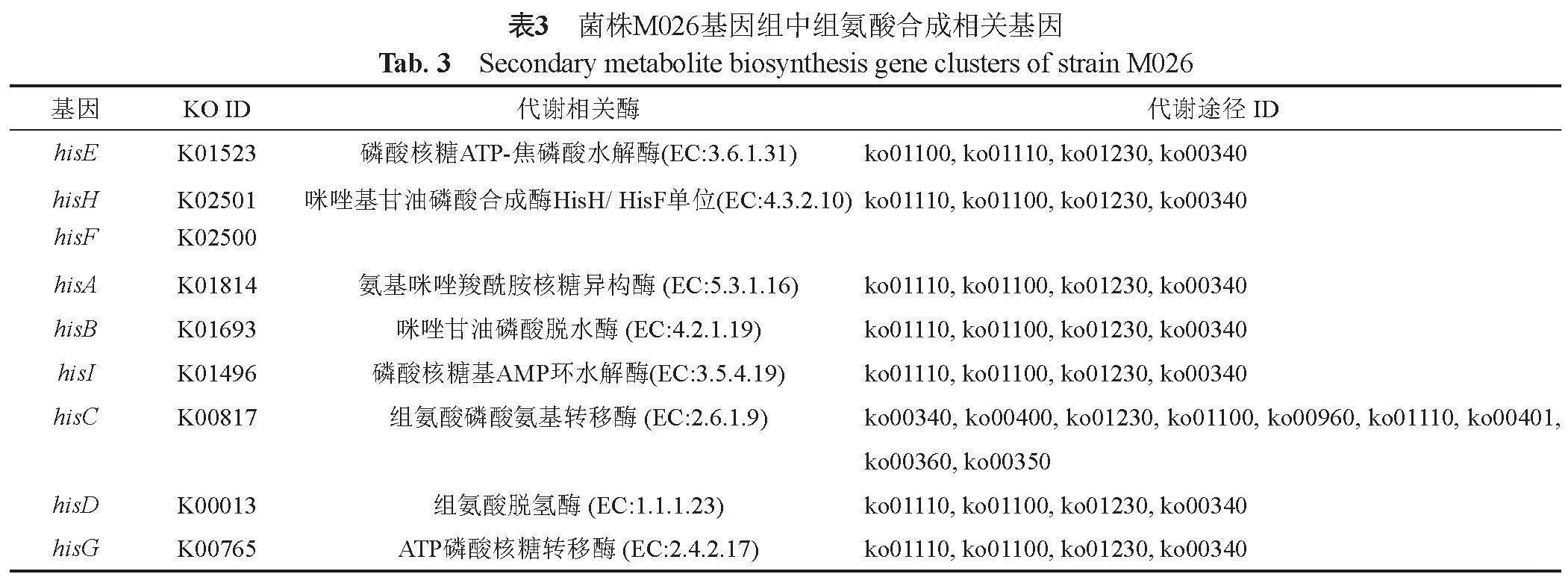
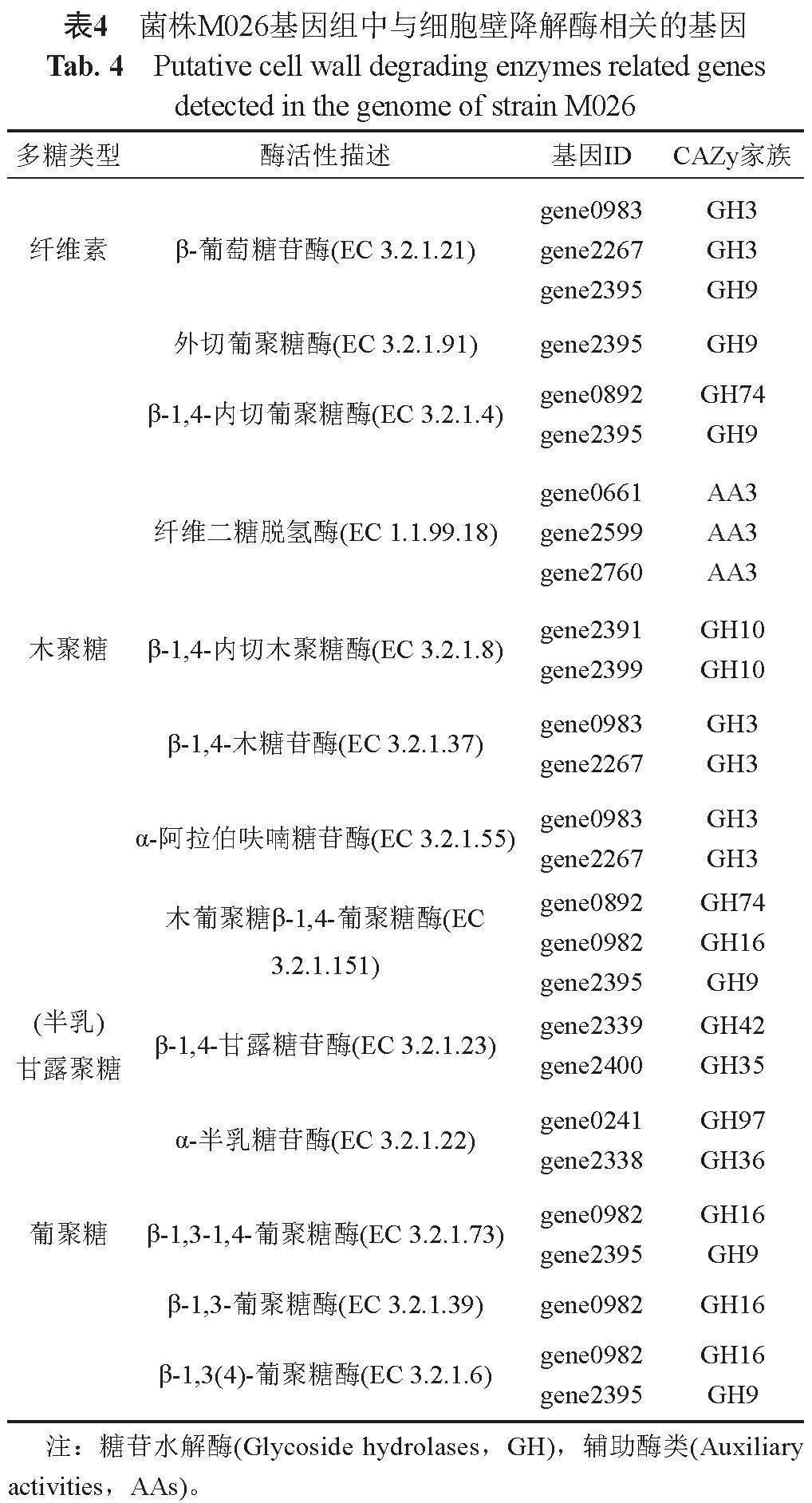
基于基因组信息对菌株M026合成次级代谢产物及相关酶的潜力进行预测,菌株M026基因全长为3.2 Mbp,G+C含量为64.8%。经KEGG数据库预测分析,菌株M026中含有合成组氨酸的代谢途径和相关酶活(表3);CAZy数据库分析,菌株M026中含有植物细胞壁降解酶系,主要降解由纤维素、木质素、(半乳)甘露聚糖、葡聚糖等多糖组成的植物细胞壁(表4)。
3 讨论
3.1 溶藻细菌与赤潮的生物防治
近年来,面对国际上赤潮暴发频率增加、影响面积增大及发生地增多等赤潮防控领域亟待解决的重大问题,迫切需要寻找一种新型高效环保的赤潮调控方法。目前,“以菌治藻”是最有潜质生物防治手段,其基于溶藻菌易培养、高效裂解藻细胞及安全性能高等特点,深入研究其溶藻特性及作用机理,研发出经济高效、环境友好型生物的除藻剂。目前国内外对甲藻的研究主要集中在其生长特性、藻毒素毒理效应、群落结构特征及赤潮消亡过程
等[20-22],对溶藻菌的相关研究仍处于初步阶段。已报道的甲藻溶藻菌主要有海杆菌属(Marinobacter),弧菌属(Vibrio),交替假单胞菌属(Pseudoalteromonas),芽孢杆菌属(Bacillus),Muricauda属等[23-26]。本研究从广西涠洲岛海域海水中分离出的1株对3种有害甲藻具有很强溶藻能力的菌株M026,隶属于α-变形杆菌纲(Alphaproteobacteria)中的短小盒菌属(Parvularcula),这不仅丰富了甲藻溶藻菌资源库信息,还为开发新型生物除藻剂提供依据。
3.2 溶藻物质对藻细胞生理活性的影响
膜脂过氧化终产物丙二醛可作为反映机体非酶类抗氧化能力的指标[27],即可用于判断细胞膜完整性指标。在M026发酵无菌滤液胁迫下,甲藻中MDA含量增加,藻細胞膜脂质过氧化加剧,细胞膜的完整性破坏,进而导致藻细胞死亡。此外,当藻际环境不友好时,藻细胞会主动产生大量活性氧(ROS),ROS的过度积累会使细胞中脂质降解,蛋白质变性,DNA异构化,氧化损伤严重,进而致使藻细胞死亡。藻细胞会通过分泌SOD、CAT和APX等抗氧化酶来避免ROS过度积累引起的伤害,其中SOD催化超氧阴离子发生歧化变为过氧化氢[28],CAT和APX再将过氧化氢降解为水,从而维持藻细胞内ROS含量处于较低水平以减少藻细胞损伤[29]。在溶藻物质作用下,本研究中3种抗氧化酶活性整体先呈上升趋势,表明藻细胞出现损伤,机体自身的防御机制开启。随着作用时间增加,SOD、CAT和APX活性均不足以清除大量的ROS或抵制其带来的氧化损伤,最终藻细胞仍然遭受不可逆转的氧化损伤,酶活性丧失,藻细胞死亡。综上,推测菌株M026在胁迫藻细胞过程中,溶藻物质刺激藻细胞在短时间产生大量有害自由基,或是溶藻物质具有强氧化性可产生大量有害自由基,导致细胞内抗氧化系统失衡,藻细胞膜完整性被破坏,膜通透性增加,大量溶藻物质进入藻细胞内,最终细胞破裂死亡。
3.3 菌株M026中溶藻物质的挖掘
初步确定了M026对藻细胞生理活性的影响,但对其溶藻机理的深入研究仍需继续。据报道,溶藻活性物质主要包括蛋白质、多肽、氨基酸、含氮化合物、抗生素、生物碱和色素等[30]。为了明确其作用机制,往往需要对菌株中活性物质进行分离纯化、结构解析等,这会花费大量时间、精力和费用[31],
且分离到的化合物种类和数量较理论的低[32]。因此,本文采用分子生物学手段对菌株M026进行了全基因组测序分析,挖掘菌株M026中潜在的溶藻活性物质,结果发现菌株M026中具有合成组氨酸完整的代谢通路。此外,菌株M026中含有植物细胞壁降解酶系,可降解由纤维素、木质素、(半乳)甘露聚糖、葡聚糖等聚合物组成的植物细胞壁。后续对溶藻物质进行分离、检验和分析,可进一步确定溶藻的作用机制。
4 结论
本研究发现菌株Parvularcula maris M026通过胞外分泌溶藻物质经间接溶藻作用而导致3种甲藻的裂解,溶藻效果受到菌液发酵时间、投加量等因素的影响;溶藻物质通过胁迫藻细胞动态氧化平衡失衡,影响藻细胞正常生理状态,藻细胞脂质过氧化破坏了结构完整性,细胞膜通透性增加,大量胞外物质进入细胞内,同时细胞内叶绿素a合成受阻,抑制细胞正常生长代谢,最终细胞停止分裂,藻体死亡;预测菌株代谢的溶藻物质为组氨酸和降解植物细胞壁的酶等。
参 考 文 献
高清清, 曹兵, 杨波, 等. 江苏海域赤潮分布特征研究[J]. 海洋通报, 2017, 36(2): 217-221.
Edvardsen B, Imai I. The ecology of harmful flagellates within Prymnesiophyceae and Rapidophyceae. In: Grane?li E and Turner JT (editors)[M]. Ecology of Harmful Algae Berlin Springer, 2006: 67-79.
Nishibori N, Niitsu M, Fujihara S, et al. Occurrence of the polyamines caldopentamine and homocaldopentamine in axenic cultures of the red tide flagellates Chattonella antiqua and Heterosigma akashiwo (Raphidophyceae)[J]. FEMS Microbiol Lett, 2009, 298: 74-78.
Jancula D, Marsalek B. Critical review of actually available chemical compounds for prevention and management of cyanobacterial blooms[J]. Chemosphere, 2011, 85(9): 1415-1422.
El-Shehawy R, Gorokhova E, Ferndndez-Pinas F, et al. Global warming and hepatotoxin production by cyanobacteria: What can we learn from experiments?[J]. Water Res, 2012, 46(5): 1420-1429.
Meyer N, Bigalke A, Kaulfuss A, et al. Strategies and ecological roles of algicidal bacteria[J]. FEMS Microbiol Rev, 2017, 41(6): 880-899.
Wisecaver J H, Hacket J D. Dinoflagellate genome evolution[J]. Annu Rev Microbiol, 2011, 65: 369-387.
Al-Yamani F, Saburova M, Polikarpov I. A preliminary assessment of harmful algal blooms in Kuwait's marine environment[J]. Aquat Ecosyst Health, 2012, 15: 64-72.
龐景贵, 周军, 康辰香, 等. 赤潮历史记载及其成因与危害[J]. 海洋信息, 2011, (4): 16-18.
高养春, 董燕红, 李海涛, 等. 有害甲藻的分类鉴定与研究进展[J]. 生物安全学报, 2016, 25(4): 238-254.
Guillard, R R L. Culture of phytoplankton for feeding marine invertebrates//In: Smith W L, Canley M H(Eds.), Culture of marine invertebrate animals[M]. New York: Plenum Press, 1975: 29-60.
Yoon S H, Ha S M, Kwon S, et al. Introducing EzBioCloud: a taxonomically united database of 16S rRNA gene sequences and whole-genome assemblies[J]. Int J Syst Evol Microbiol, 2017, 67: 1613-1617.
Zeng G M, Zhou J, Huang T, et al. Extraction of Chlorophyll-a from eutrophic water by repeated freezing and thawing-extraction method[J]. Asian J Chem, 2014, 26(8): 2289-2292.
卢露, 马金玲, 牛晓君, 等. 铜绿微囊藻溶藻菌EA-1的分离鉴定及溶藻特性[J]. 中国环境科学, 2021, 41(11): 5372-5381.
Song Q, Niu X J, Zhang D Q, et al. The behaviors of Microcystis aeruginosa and microcystins during the Fe(2+)/persulfate (PS) preoxidation-coagulation and flocs storage period[J]. Environ Res, 2020, 186: 109549.
马宏瑞, 章欣, 王晓蓉, 等. 芽孢杆菌Z5溶铜绿微囊藻特性研究[J]. 中国环境科学, 2011, 31(5): 828-833.
孔赟. 溶藻菌分离鉴定、溶藻特性及作用机理研究[D]. 杭州: 浙江大學, 2013.
于燕. 多功能溶藻链霉菌的分离及其对铜绿微囊藻溶藻特性的研究[D]. 重庆: 西南大学, 2019.
樊乾龙. 溶解铜绿微囊藻的细菌筛选及溶藻效果的研究[D]. 北京: 北京林业大学, 2016.
严冰, 岑竞仪, 吕颂辉. 有害甲藻米氏凯伦藻(Karenia mikimotoi)对海洋青鳉鱼(Oryzias melastigm)的急性毒性效应研究[J]. 海洋环境科学, 2022, 41(03): 402-407.
冯晟霖, 邹嘉澍, 苏玉萍, 等. 平潭海域浮游植物时空分布和甲藻赤潮特征研究[J].福建师范大学学报(自然科学版), 2022, 38(5): 9-17.
李光毅, 刘保清, 邱勇, 等. 链状裸甲藻赤潮消亡过程及其与休眠包囊关系的初步研究[J]. 海洋学报, 2022, 44(8): 123-132.
杜文俊, 冯燕楼, 安莹, 等. 米氏凯伦藻抑藻菌的分离鉴定及抑制效应[J]. 曲阜师范大学学报(自然科学版), 2021, 47(2): 101-105.
Wang B X, Yang X R, Lu J L, et al. A marine bacterium producing protein with algicidal activity against Alexandrium tamarense[J]. Harmful algae, 2012, 13: 83-88.
蒋贤龙, 乔冰清, 潘知顺, 等. 一株赤潮藻溶藻菌的筛选鉴定及溶藻特性分析[J]. 水生生物学报, 2023, 47(7): 1129-1138.
史荣君, 黄洪辉, 齐占会, 等. 一株溶藻细菌对海洋原甲藻的溶藻效应[J]. 生态学报, 2012, 32(16): 4993-5001.
Li Y, Zhu H, Guan C, et al. Towards molecular, physiological,and biochemical understanding of photosynthetic inhibition and oxidative stress in the toxic Alexandrium tamarense induced by a marine bacterium[J]. Appl Microbiol Biot, 2014, 98(10): 4637-4652.
张嗣萍. 一株广谱性溶藻细菌的筛选鉴定、溶藻特性及溶藻机理的研究[D]. 重庆: 西南大学, 2018.
Kaur S, Srivastava A, Kumar S, et al. Biochemical and proteomic analysis reveals oxidative stress tolerance strategies of Scenedesmus abundans against allelochemicals released by Microcystis aeruginosa[J]. Algal Res, 2019, 41: 101525.
王飞, 李燕. 溶藻细菌胞外溶藻活性物质分离的研究进展[J]. 安徽农业科学, 2008, 36(17): 7071-7073.
郑洁, 庹利, 李伟, 等. 江苏盐城沿海滩涂湿地放线菌多样性及功能基因的筛选[J]. 遵义医学院学报, 2019, 42(3): 282-290.
李红玲. 非核糖体肽合成酶结构研究进展[J]. 临床合理用药杂志, 2013, 6(28): 180-181.
——以汝溪河为例
——阿米巴藻Amoebophrya spp.的研究进展

