基于网络药理学与分子对接研究麻黄-桂枝药对治疗变应性鼻炎的作用机制*
刘卉,申琪
1 河南中医药大学,河南 郑州 450000; 2 河南中医大学第一附属医院,河南 郑州 450000
变应性鼻炎(allergic rhinitis,AR)是鼻黏膜的Ⅰ型变态反应性疾病,临床特点为阵发性和反复发作的喷嚏、流清涕、鼻塞、鼻痒,又称为过敏性鼻炎[1-3]。属于中医“鼻鼽”范畴。流行病学调查显示2004—2005年我国11个城市AR的患病率为11.1%[4],2011年18个城市的患病率为17.6%[5]。该病反复发作、迁延难愈,为哮喘、鼻窦炎、中耳炎等疾病的常见诱发因素,影响患者的身心健康及生活质量,加重其经济负担[6-7]。关于AR的发病机制,目前较为公认的是由IgE介导的Th2型炎症反应[8],西医主要治疗方法有回避过敏原、药物治疗、免疫治疗和健康教育,药物治疗常用糖皮质激素、抗组胺药、抗白三烯药物等,免疫治疗是当下有望根治AR的方法,但因其治疗周期长、价格昂贵等原因尚未推广[1-2]。中医治疗本病以辨证论治为指导思想,通过调节相关脏腑功能及调节体质达到缓解临床症状、减少复发的目的,具有药物不良反应小、有效缓解全身症状、远期疗效好的优势,但是由于中药方剂种类繁多、配伍复杂、作用机制尚不明确,药理学研究难度较大,中医药治疗本病的研究受到一定限制。
麻黄为麻黄属草本状灌木麻黄的干燥草质茎,性辛温、微苦,归肺、膀胱经,具有发汗解表、宣肺平喘、利水消肿的功效。桂枝属植物肉桂的干燥嫩枝,性辛甘温,入肺、心、膀胱经,具有发汗解肌、温通经脉、助阳化气、平冲降逆的功效。两者合用具有抗炎、退热、止痛、抗哮喘、免疫调节等作用[9-11],常相须为用,为临床经典药对。长期临床观察及研究显示,以麻黄-桂枝药对合用的中药方剂(如小青龙汤、麻黄汤等)治疗变应性鼻炎具有良好的效果[12-14]。但是该病的发病及病理机制复杂,麻黄-桂枝药对治疗该病的药理作用机制亦尚未完全明确。
网络药理学综合生物信息学、药理学等多学科理论,其系统分析的特点与中医的整体观念、辨证论治契合,是目前从多角度研究中药方剂治疗疾病的靶点、通路及机制的新方法[15-16]。因此,本研究采用网络药理学和分子对接的技术方法,构建药物疾病的“成分-靶点-通路”网络,探讨麻黄-桂枝药对治疗AR的作用机制,为该药对治疗AR的药理学研究及遣方用药奠定基出。
1 资料与方法
1.1 麻黄-桂枝药对的活性成分收集及靶点筛选 采用中药系统药理数据库与分析平台(https://tcmspw.com/tcmsp.php)[17]分别对麻黄、桂枝的活性成分进行检索,基于口服生物利用度(druglikeness,OB)≥30%及药物相似性(oral bioavailability,OB)≥0.18[18]为条件筛选,同时根据已发表的文献报道进行补充收集,得到麻黄-桂枝药对的活性成分。采用TCMSP数据库收集活性成分对应的蛋白靶点,使用Unitprot数据库(https://www.uniprot.org/),设定物种为人,将蛋白靶点转化为对应的基因官方名称,最终获得麻黄-桂枝药对的活性成分及作用靶点。
1.2 AR靶点筛选 在OMIM数据库(在线人类孟德尔遗传数据库,https://www.omim.org/)、GeneCards数据库(https://www.genecards.org/)、DrugBank数据库(https://go.drugbank.com/)、TTD数据库(http://db.idrblab.net/ttd/)中键入“变应性鼻炎”的英文名“allergic rhinitis”进行检索,整合并删除重复项,最终获得变应性鼻炎的靶点信息。
1.3 麻黄-桂枝药对-AR共同靶点筛选 基于Excel 2019软件取药物作用靶点(“1.1”项得到)和疾病作用靶点(“1.2”项得到)的交集,得到麻黄-桂枝药对治疗AR的作用靶点,并利用微生信网站(Bioinformatics,http://www.bioinformatics.com.cn/)绘制韦恩图。
1.4 “麻黄-桂枝药对-成分-靶点-AR”网络构建 将麻黄-桂枝药对活性成分、作用靶点(“1.1”项得到)以及交集靶点(“1.3”项得到)导入Cytoscape 3.7.2软件构建“麻黄-桂枝药对-成分-靶点-AR”网络,利用软件工具分析计算网络参数,包括连接度(degree)、紧密度(closeness centrality)、介度(betweenness centrality)等信息,根据参数信息识别网络中起到主要作用的成分及靶点。
1.5 蛋白质相互作用(PPl)网络构建及拓扑分析 将交集靶点(“1.3”项得到)导入STRING数据库(https://string-db.org/cgi/input.pl),设定物种为人,最低交互值选择0.900,其余参数为默认参数,获得靶点的PPI网络及信息。将PPI信息导入Cytoscape 3.7.2软件构建PPI网络,并拓扑分析,根据连接度值(degree)调节网络节点的大小和颜色,根据节点相互作用强度值(combined score)大小调节边的粗细和颜色,根据连接度值降序排列设置度值大于平均度值14,实现PPI网络可视化。
1.6 KEGG富集分析与GO富集分析 将交集靶点(“1.3”项得到)导入Metascape数据库(https//www.metascape.org),设定物种为人,分别进行KEGG富集分析与GO富集分析,P<0.01代表富集结果显著。并利用微生信网站绘制KEGG富集气泡图和GO富集柱状图,实现可视化分析。
1.7 分子对接验证 应用Pubchem数据库(https://pubchem.ncbi.nlm.nih.gov/)下载靶点蛋白的晶体结构,保存为PDB格式;使用pymol去配体,用autodock 1.5.6去水加氢分配原子,计算电荷,保存为PDBQT格式;从TCMSP数据库下载化合物的三维结构,保存为mol2格式;用chem3d软件做mm2力场分析,最小能量化,保存为mol2格式;进行靶点蛋白与化合物的对接,使用discovery2016软件进行数据可视化。
2 结果
2.1 麻黄-桂枝药对活性成分及靶点筛选结果 通过TCMSP数据库检索麻黄和桂枝,以OB≥30%且DL≥0.18为条件筛选,并根据已发表文献补充,得到活性成分麻黄23个、桂枝7个,删除重复,最终筛选出麻黄-桂枝药对活性成分为27个。其中活性成分包括雄黄醇、紫杉酚、柚皮苷、白细胞精蛋白、滑石粉等。见表1。

表1 麻黄-桂枝药对活性成分信息
将27个活性成分分别上传到TCMSP数据库进行靶点预测,保留唯一值,并使用UnitProt数据库规范靶点名称,预测到麻黄-桂枝药对的靶点为199个。
2.2 AR靶点筛选结果 通过OMIM数据库筛选得到AR相关靶点为130个,通过GeneCards数据库筛选得到AR相关靶点为1183个,通过DrugBank数据库筛选得到AR相关靶点为94个,通过TTD数据库筛选得到AR相关靶点为26个,汇总删除重复项,最终得到AR的相关靶点为1282个。
2.3 麻黄-桂枝药对-AR共同靶点的筛选结果 将药物靶点(“2.1”项得到)和疾病靶点(“2.2”项得到)上传Excel 2019软件取交集,得到交集靶点109个,即为麻黄-桂枝药对治疗AR的作用靶点,并绘制韦恩图。见图1。
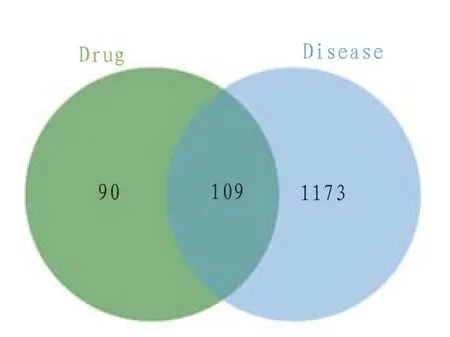
图1 药物靶点与疾病靶点的Venny分析图
2.4 “麻黄-桂枝药对-成分——靶点-AR”网络构建结果 利用Cytoscape 3.7.2软件构建“麻黄-桂枝药对-成分-靶点-AR”网络图,见图2。

图2 麻黄-桂枝药对-成分-靶点-AR网络图
该网络图包括227个节点、692条边。图中左右两侧浅绿色圆形图标代表中药麻黄、桂枝,红色六边形图标代表中药活性成分;图上方粉色、淡黄色、紫色六边形图标代表中药共有成分;图下方黄色正方形图标代表疾病变应性鼻炎;图正中墨绿色菱形图标代表靶点基因,直观体现麻黄-桂枝药对治疗变应性鼻炎的多靶点、多成分特征。连接度(Degree)表示此节点连接的边的数量,Degree值越大,该节点与其他节点的密集程度越高,表明该节点在此网络中重要性越高;利用软件工具分析计算Degree值,根据Degree值调节节点面积,即在图2中,节点边的数量越多,面积越小,Degree值越大。根据Degree值大小筛选出排名前10的关键活性成分,见表2;排名靠前的靶点有PTGS1、PTGS2、NCOA2、PGR等;疾病节点的Degree值为109。

表2 麻黄-桂枝药对连接度排名前10的活性成分信息
2.5 PPl网络构建与分析结果 将109个交集靶点(“2.3”项得到)导入STRING数据库,最低交互值选择0.900,获取PPI网络及信息,包括109个蛋白、395条作用关系。将PPI信息导入Cytoscape 3.7.2软件构建PPI网络图并拓扑分析。见图3。
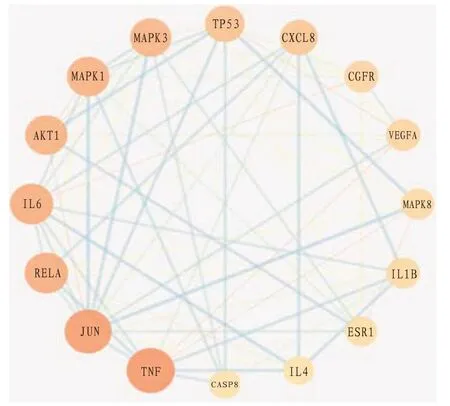
图3 药物-疾病作用靶点PPI网络图
该PPI网络图包括连接度值大于平均度值14的靶点16个,如肿瘤坏死因子(tumor necrosis factor,TNF)、转录因子AP-1(transcription factor AP-1,JUN)、转录因子p65(transcription factor p65,RMLA)、白细胞介素6(interleukin-6,IL-6)、丝氨酸/苏氨酸蛋白激酶1(RAC-alpha serine/threonine-protein kinase 1,AKT1)、丝裂原活化蛋白激酶1(mitogen-activated protein kinase 1,MAPK1)、丝裂原活化蛋白激酶3(mitogenactivated protein kinase 3,MAPK3)、细胞肿瘤抗原p53(cellular tumor antigen p53,TP53)、白细胞介素8(interleukin-8,CXCL8)、表皮生长因子受体(epidermal growth factor receptor,EGFR)等。其中每个节点的面积由小到大、颜色由冷到暖,代表连接度值由小到大;连线由细到粗、颜色由暖到冷,代表节点相互作用强度值由低到高,可见TNF、JUN、RELA、IL6、AKT1等连接度值与节点相互作用强度值最高,提示这些靶点在PPI网络中发挥关键作用。
2.6 KEGG富集分析与GO富集分析结果 对109个交集靶点(“2.3”项得到)进行KEGG富集分析,结果以P<0.01为条件筛选,得到324条通路结果。按照Count值(基因数)对通路结果降序排列,选取前20的通路绘制KEGG富集分析气泡图。见图4。

图4 KEGG富集分析气泡图
散点面积由小到大代表Count值由小到大,散点颜色由绿到红代表显著性由低到高。KEGG富集分析结果提示,麻黄-桂枝药对治疗AR的通路主要涉及癌症的信号通路、流体剪切应力与动脉粥样硬化信号通路、PI3K-Akt信号通路、TNF信号通路、AGE-RAGE信号通路、IL-17信号通路、卡波西肉瘤相关疱疹病毒感染、人巨细胞病毒感染等。
对109个交集靶点(“2.3”项得到)进行GO富集分析,包括生物过程(biological processes,BP)、细胞组分(cellular components,CC)、分子功能(molecular functions,MF),结果以P<0.01为条件筛选,共得到富集结果生物过程1903条、细胞组分78条、分子功能162条。按照基因数分别对通路结果降序排列,分别选取前10的通路绘制GO富集分析柱状图。见图5。
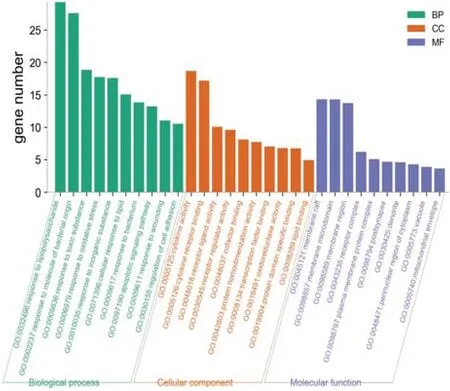
图5 GO富集分析柱状图
生物过程主要涉及对脂多糖的反应、对细菌来源的分子的反应、对有毒物质的反应、回应氧化应激、对无机物的反应、细胞对脂质的反应、对细菌的反应、凋亡信号通路等过程;细胞组分主要涉及膜筏、膜微区、膜区、受体复合物、等离子膜蛋白复合物、突触后、细胞质核周区、液泡、线粒体膜等部位;分子功能主要涉及细胞因子活性、细胞因子受体结合、受体配体活性、受体调节活性、辅因子结合、蛋白质同源二聚活性、转录因子结合、氧化还原酶活性、脂质结合等。
2.7 分子对接验证结果 槲皮素和山柰酚是本药对中靶点最多的活性成分,选择其与关键靶点IL-6、AKT1进行分子对接验证,前者为配体,后者为受体。配体和受体结合所需结合能越小,两者越易结合且结合后结构越稳定。通常认为,结合能<0,配体和受体可自行结合;结合能<-5.0 kcal/mol,配体和受体结合力较好[19]。槲皮素、山柰酚和IL-6、AKT1配对的结合能结果显示其均具有较好结合力。槲皮素与IL-6的D链222位的PRO、227位的SER形成传统氢键;与D链225位的TRP、221位的ASP、229位的PHE、228位的SER、226位的ASN、V链57位的ARG、59位的TYR、104位CYS、101位的SER、102位的ILE、A链75位的GIN形成范德瓦尔斯力;与D链223位的HIS形成pi-pi Tshaped作用。槲皮素与AKT1的A链56位的SER、79位的GIN、78位的LEU、186位的ILE、59位的GLN形成传统氢键;与A链57位的VAL、53位的ASN、58位的ALA形成范德华力;与A链60位的CYS形成π-烷基化作用;与A链77位的CYS形成π-sulfur作用。山柰酚与IL-6的D链223位的HIS、225位的TRP、v链101位的SER形成传统氢键;与v链57位的ARG、D链228位的SER形成碳氢键;与V链102位的ILE、103位的ARG、105位的ALA、59位的TYR、52位的TYR、55位的SER、227位的SER、221位的ASP、226位的ASN形成范德瓦尔斯力;与D链222位的PRO形成unfavorable aceptor-aceptor;与v链104位的CYS形成pi-sulfur。山柰酚与AKT1的A链185位的VAL、104位的GLN、108位的ASP形成传统氢键;与A链111位的LYS、78位的LEU、76位的ARG、83位的VAL、77位的CYS、61位的GLN形成范德瓦尔斯力;与A链59位的GLN、60位的CYS形成酰胺-π堆积;与A链186位的ILE形成π-烷基化作用。见表3、图6。

图6 分子对接结果
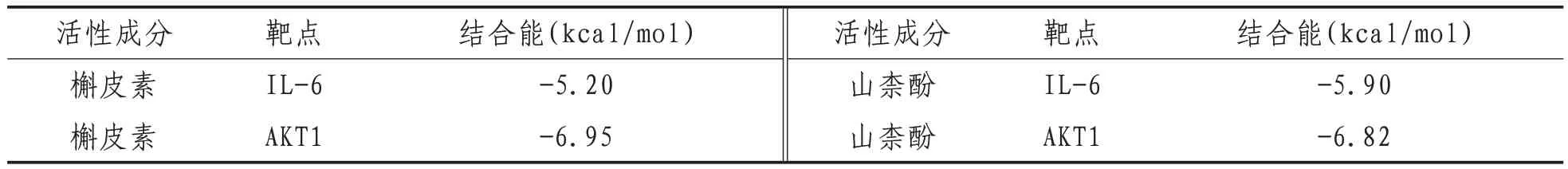
表3 分子对接结合能结果
3 讨论
变应性鼻炎为鼻黏膜的Ⅰ型变态反应性疾病,发病机制目前较为公认的是IgE介导的Th2型炎症反应,Th1和Th2细胞失衡,黏膜局部Th2细胞浸润,Th2免疫活性及表达于Th2细胞的炎性因子(如IL-4、IL-5等)分泌增加,在IL-4作用下血清免疫球蛋白E(IgE)合成增加,进一步导致该病发生[20-21]。该病病理机制复杂,涉及多种生物过程、细胞通路,比如免疫反应、炎症、组织重塑、神经调节等[1-2,8]。该病为本虚标实之证,外因为邪气侵袭,内因为肺、脾、肾三脏虚损,病机尤以肺气失调为核心[22],证型以肺气虚寒证最为多见[23]。中医治疗本病以辨证论治为指导思想,调节肺、脾、肾功能以缓解症状、减少复发,治疗当首重肺气,常用治法有温肺散寒、益气固表、益气健脾、温补肾阳等。麻黄-桂枝是温肺解表代表药对,合用治疗该病疗效显著。已有多项研究从单药或成方角度探讨其药理作用,有必要从药对角度研究其药理作用及配伍优势。本研究应用网络药理学与分子对接的研究方法,筛选麻黄-桂枝活性成分及靶点,预测其治疗AR的靶点,构建网络,系统探讨麻黄-桂枝药对治疗AR的机制。
分析麻黄-桂枝药对的27个活性成分,结果显示靶点数量前10依次是槲皮素、β-谷甾醇、山柰酚、木犀草素、柚皮苷、豆甾醇、滑石粉、儿茶素、芫花素、果胶苷。
槲皮素(quercetin)属黄酮类化合物,以糖苷形式存在于植物和食品中,具有调节免疫、抗炎、抗氧化、抗肿瘤、降糖降压等多重作用[24-26]。研究显示,槲皮素可有效抑制Th2细胞因子如IL-4、IL-5、IL-6、肿瘤坏死因子α和一氧化氮等的产生,降低IgE含量[27-28],可一定程度抑制AR的免疫炎症反应;此外,槲皮素可通过抑制TLR4/NF-κB通路抑制呼吸道炎症[29]。β-谷甾醇(beta-sitosterol)是植物甾醇类成分,主要存在于植物油、坚果中,具有免疫调节、抗炎、抗肿瘤、抑制中枢神经系统等多重作用[30-31]。研究显示,β-谷甾醇可促进Th1细胞增殖,增加Th1细胞因子(干扰素-γ、IL-2等)分泌[32],纠正AR发病过程中的Th1/Th2细胞失衡。山柰酚属黄酮醇类化合物,可从豆科植物干燥成熟果实中提取,具有抗炎、抗肿瘤、保护损伤细胞等多重作用[33-34]。研究显示,山柰酚可通过抑制肥大细胞中酪氨酸激酶(Lyn)的活性降低IgE的敏感度,并抑制嗜酸性粒细胞浸润、血管舒张,降低机体对变应原的反应[35-36]。木犀草素属黄酮类化合物,具有抗炎、抗过敏、降尿酸、神经保护等多重作用[37-38]。研究显示,木犀草素通过减少pSTAT6和GATA3的表达来降低IL-4的分泌,减少嗜酸性粒细胞浸润及鼻上皮黏液分泌,减轻鼻部过敏症状[39-40]。豆甾醇是植物甾醇类成分,存在于大豆、烟叶中,具有抗炎、抗氧化、改善记忆、降低胆固醇等多重作用[41-42]。研究显示,豆甾醇可下调IL-1β、IL-6等细胞因子,但不会影响巨噬细胞的生存能力。还可下调IL-6,从而抑制Th2、Th17细胞活性,降低该病炎症反应[43]。儿茶素属酚类活性物质,从茶叶等天然植物中提取,具有抗氧化、抗肿瘤、抗炎、保护心脑血管等多重作用[44]。研究显示,其有效地减少了T细胞和巨噬细胞在气道基底层中的积累,降低过敏性气道炎症[45-46]。芫花素属黄酮类化合物,存在于芫花之中,具有抗炎、保护心脑血管、保护神经、祛痰止咳等多重作用[47]。研究显示,芫花素档下调LPS诱导的TNF-α、IL-1β和IL-6 mRNA的转录[48]。
在PPI网络图分析过程中,按照连接度值、相互作用强度值将麻黄-桂枝药对治疗变应性鼻炎的109个作用靶点降序排列,排名靠前的有TNF、JUN、RMLA、IL-6、AKT1、MAPK1、MAPK3、TP53、CXCL8、EGFR等,药物成分可能主要通过这些靶点起到关键治疗作用。TNF有TNF-α和TNF-β两种类型,已证明TNF-α是诱导和维持变应性鼻炎炎症的重要介质,TNF-α通过TNF信号通路显著上调前列腺素D2诱导的嗜酸性粒细胞趋化性和CRTH2的Eol-1细胞表面表达,并损伤嗅神经细胞[49-50]。IL-6具有调节免疫、获得性免疫应答、促进细胞增殖分化等作用;已证实IL-6与AR发病关系密切[51],在AR发病过程中,IL-6通过可溶性IL-6受体促进B细胞终末分化和浆细胞产生大量IgE[52]。AKT1属于AKT家族,AKT可通过PI3K/Akt通路调节对暴露过敏原的反应和肥大细胞活性[53]。MAPK1、MAPK3属于MAPK家族,MAPK激活IL-13诱导的鼻上皮细胞炎性因子表达,调控T细胞增殖分化[54-55]。研究发现,EGFR可上调嗜酸性粒细胞趋化聚集水平,同时促进气道上皮细胞产生粒细胞-巨噬细胞集落刺激因子构建过敏性气道疾病[56]。
KEGG富集分析显示,麻黄-桂枝药对治疗AR主要涉及的通路有PI3K-Akt信号通路、TNF信号通路、AGE-RAGE信号通路、癌症信号通路、流体剪切应力与动脉粥样硬化信号通路、IL-17信号通路、人巨细胞病毒感染、MAPK信号通路等。已证实PI3K/Akt信号通路对AR免疫调节起到重要作用;IgE与肥大细胞表面受体结合是迅速出现变应性鼻炎症状的关键因素,PI3K/Akt信号通路可介导肥大细胞的成熟和激活、增强Ⅱ型固有淋巴细胞转录因子和Ⅱ型细胞因子的表达[57]。已证实TNF信号通路介导炎症的发生,调节嗜酸性粒细胞趋化性、促进其聚集至鼻部,并促进黏附因子的表达及炎症细胞活化浸润[58]。已证实AGE/RAGE信号通路涉及激活蛋白激酶C、MAPK等多种通路,参与IL-1、IL-6、TNF-α等多种细胞因子的表达[59]。已证实IL-17信号通路诱导趋化因子和促炎因子来介导炎症,并参与先天免疫增强变态反应性炎症[60];在AR发病过程中,IL-17信号通路诱导Th2细胞活化、IgE产生及嗜酸性粒细胞聚集浸润[61-62]。已证实MAPK信号通路参与变应鼻炎的激活、炎症细胞的增殖分化及Th2炎症因子(如IL-4、IL-5)的产生[63]。GO富集分析显示,麻黄-桂枝药对治疗AR主要涉及的生物过程有对脂多糖的反应、对细菌来源分子的反应、对有毒物质的反应、回应氧化应激、对无机物的反应、细胞对脂质的反应、对细菌的反应、凋亡信号通路等;主要通过影响细胞因子活性、细胞因子受体结合、辅因子结合、蛋白质同源二聚活性、转录因子结合、氧化还原酶活性、脂质结合等来治疗AR。
综上所述,本研究应用网络药理学的技术方法,分析麻黄-桂枝药对治疗变应性鼻炎的活性成分、靶点及通路,并用分子对接技术初步验证了成分和靶点具有良好的结合性,阐明了麻黄-桂枝药对治疗变应性鼻炎多成分、多靶点、多通路的作用机制,为深入研究其药理学作用提供方向、奠定基出。但是由于数据库对药物、疾病的靶点及通路收集有限,本研究尚有一定局限性,麻黄-桂枝药对治疗变应性鼻炎的作用机制有待基出或临床试验的进一步研究和验证。

