槲皮素对奈瑟球菌感染脑膜炎大鼠脑保护作用的研究*
王旭东,朱海生,李晓蕾,麻瑞娟
邯郸市中心医院,河北 邯郸 056001
细菌性脑膜炎是一种中枢神经系统感染性疾病,儿科较为多见。及时应用抗菌药物能够明显改善细菌性脑膜炎患者转归,但仍有20%的患者死亡,约30%的患者留下脑麻痹、癫痫、听力损伤、认知障碍等永久性神经系统后遗症[1-2]。革兰氏阴性菌被杀灭解体后,其细胞壁中的内毒素脂多糖(lipopolysaccharide,LPS)释放入血,引发内毒素血症,破坏脑组织结构,是导致患者死亡的主要因素之一[3],而抗菌药物不能有效控制LPS水平的升高[4]。槲皮素(Quercetin,Que)是一种天然存在的黄酮醇化合物,对内毒素所致肺损伤、心肌损伤具有保护作用[5-6]。脑膜炎奈瑟球菌属革兰氏阴性菌,是细菌性脑膜炎常见致病菌之一,氨苄青霉素(ampicillin,AMP)是临床治疗革兰氏阴性菌感染脑膜炎的一线用药。本实验通过小延髓池注射奈瑟球菌悬液制备奈瑟球菌感染脑膜炎大鼠模型,以AMP为阳性对照药物,研究Que对奈瑟球菌感染脑膜炎大鼠脑组织的保护作用及其机制,现将研究结果报道如下:
1 材料与方法
1.1 实验动物 SPF级2周龄SD大鼠180只,雌雄不限,体质量(75±5)g,购自河北医科大学实验动物中心,实验动物许可证号:SCXK(冀)2018-004。饲养条件:在室温(25±1)℃、相对湿度(60±5)%、光照黑暗各12 h交替的环境中饲养3天后开展实验。动物实验遵守实验动物福利伦理审查指南。
1.2 药物与试剂 脑膜炎奈瑟球菌由邯郸市中心医院微生物室提供;Que(纯度≥98%,上海源叶生物科技有限公司,批号:B20527);注射用氨苄西林钠(齐鲁制药有限公司,批号:2020B011302,规格:0.5 g/瓶);HE染色试剂盒和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素1β(interleukin-1β,IL-1β)、白细胞介素6(interleukin-6,IL-6)酶联免疫(ELISA)试剂盒(北京索莱宝科技有限公司,批号:G1120、SEKR-0009、SEKR-0002、SEKR-0005);脂多糖(lipopolysaccharide,LPS)ELISA试剂盒和BCA试剂盒(江苏晶美生物科技有限公司,批号:JM-02053R1、JM-100009A);p65、IκBα、高迁移率族蛋白1(HMGB1)、β-actin抗体和IgG二抗(北京博奥森生物科技有限公司,批号:bs-20159R、bs-1287R、bs-55098R、bs-0061R、bs-0295G)。
1.3 分组、造模及给药 将180只实验大鼠按照随机数字表法分为6组,分别为正常对照组,模型组,AMP组和Que低、中、高剂量组,每组30只。除正常对照组外,其余各组大鼠均采用小延髓池注射10 μL奈瑟球菌悬液(浓度1×108个/L)的方法制备奈瑟球菌感染脑膜炎大鼠模型。造模后,AMP组以200 mg/kg剂量皮下注射给药,Que低、中、高剂量组分别以50、100、200 mg/kg剂量灌胃给药[7],正常对照组和模型组灌胃给予生理盐水,每12 h进行1次,共给药5次。
1.4 观察指标
1.4.1 大鼠存活率 分别于造模完成后第12、24、36、48、60 h统计存活率。60 h正常对照组存活30只、模型组11只、AMP组15只、Que低剂量组12只、Que中剂量组16只、Que高剂量组22只。
1.4.2 症状评分及血脑屏障(blood-brain barrier,BBB)通透性检测 1)参照文献[8]报道的方法行症状评分:活动和行走未见异常计0分,活动和行走迟缓、减少计1分,直立动作缓慢计2分;不能直立计3分。2)尾静脉注射浓度2%的伊文思蓝溶液(4 mL/kg),1 h后实施麻醉,开胸暴露心脏,由左心室-右心耳通路灌注300 mL生理盐水,断头取脑,去除小脑、脑干、绣球,研磨匀浆后加入3倍甲酰胺溶液,60 ℃、避光孵育24 h,取上清液(离心半径15 cm、3000 r/min离心10 min),通过酶标仪检测伊文思蓝含量,伊文思蓝含量越高则表示BBB通透性越高。
1.4.3 脑组织病理学检查 实施麻醉后开胸,由左心室-右心耳通路依次灌注300 mL生理盐水、300 mL 4%多聚甲醛溶液,断头取脑,去除小脑、脑干、绣球后置于4%多聚甲醛溶液固定3天,石蜡包埋、切片、展片、梯度乙醇脱蜡后行常规HE染色,中性树脂封片后通过光学显微镜行脑组织病理学检查。
1.4.4 血浆LPS含量和脑组织生化指标检测 实施麻醉后,于眼眶内取血,滴加抗凝剂,离心(半径15 cm、1500 r/min离心5 min)取血浆,按照ELISA试剂盒说明检测血浆LPS含量。脊椎脱臼处死后,取脑组织,去除小脑、脑干,加入9倍冷裂解液,于冰上研磨匀浆,离心(半径15 cm、3000 r/min离心10 min)取上清液,按照ELISA试剂盒操作说明检测脑组织TNF-α、IL-1β、IL-6含量;黄嘌呤氧化法检测SOD活性,钼酸铵法检测CAT活性,硫代巴比妥酸法检测MDA含量。
1.5 脑组织蛋白表达检测 取脑组织匀浆液,4 ℃,离心半径15 cm,12 000 r/min离心20 min后取上清液,提取蛋白、BCA法检测总蛋白浓度、95 ℃水浴使蛋白变性,30 μg总蛋白量上样、凝胶电泳、转膜、5%脱脂牛奶室温封闭1 h后,滴加目标蛋白、β-actin一抗4 ℃过夜,洗膜后滴加二抗室温孵育1 h,洗膜后DAB显色,以目标蛋白条带灰度值与β-actin(内参)条带灰度值的比值计算目标蛋白相对表达量。
1.6 统计学方法 运用SPSS 17.0进行统计分析,计量资料以表示,采用单因素方差分析,组间多重比较采用LSD-t检验,计数资料采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 大鼠死亡率 造模后60 h时,正常对照组大鼠全部存活,模型组存活11只;造模24 h后,AMP组和Que中、高剂量组大鼠存活率较模型组升高(P<0.01);造模48 h后,Que高剂量组大鼠存活率较AMP组升高(P<0.01)。见表1。
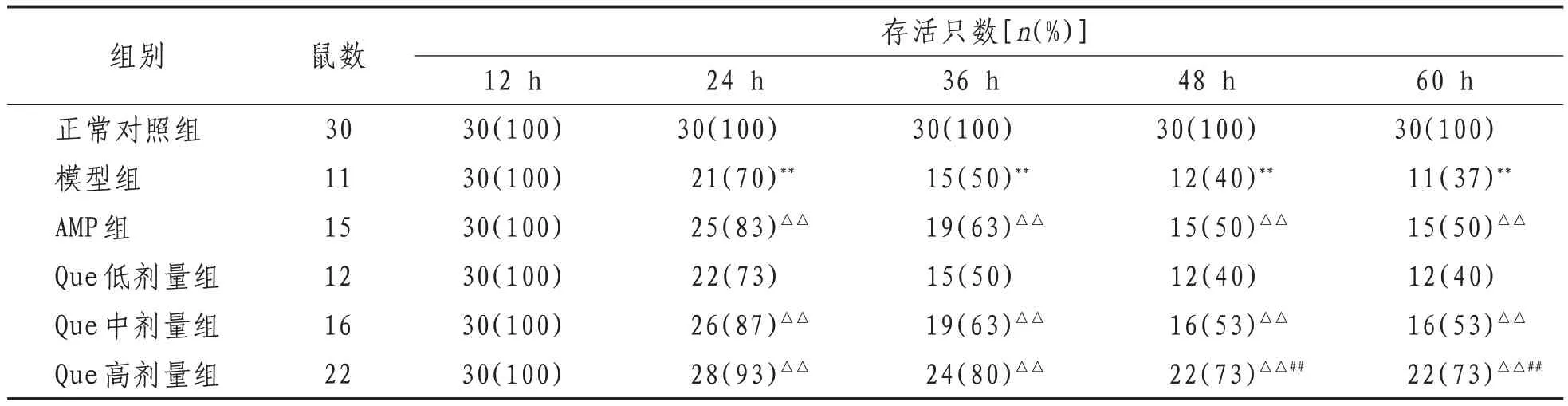
表1 各组大鼠不同时间段存活率比较
2.2 大鼠症状评分 较正常对照组,模型组大鼠症状评分升高(P<0.01);较模型组,AMP组和Que中、高剂量组症状评分降低(P<0.01);较AMP组,Que高剂量组症状评分降低(P<0.01)。见表2。
表2 各组大鼠症状评分和脑组织伊文思蓝含量比较()
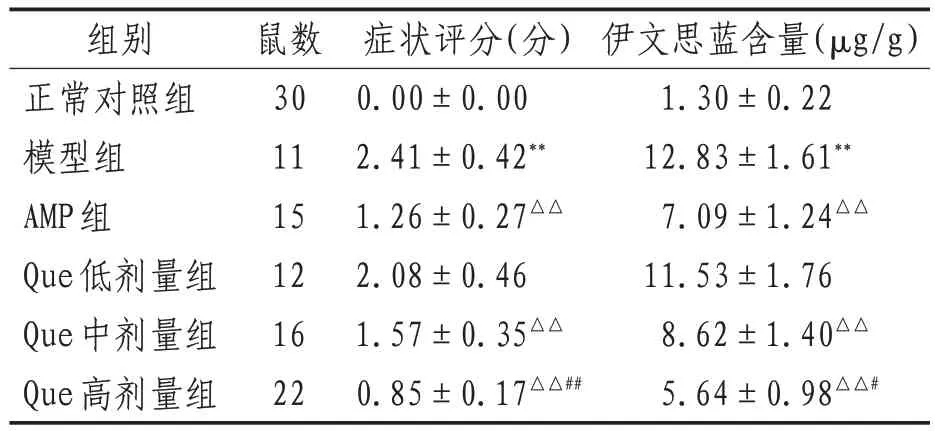
表2 各组大鼠症状评分和脑组织伊文思蓝含量比较()
注:与正常对照组比较,**表示P<0.01;与模型组比较,△△表示P<0.01;与AMP组比较,#表示P<0.05,##表示P<0.01
伊文思蓝含量(μg/g)1.30±0.22 12.83±1.61**7.09±1.24△△11.53±1.76 8.62±1.40△△5.64±0.98△△#组别正常对照组模型组AMP组Que低剂量组Que中剂量组Que高剂量组鼠数30 11 15 12 16 22症状评分(分)0.00±0.00 2.41±0.42**1.26±0.27△△2.08±0.46 1.57±0.35△△0.85±0.17△△##
2.3 大鼠BBB通透性检测 较正常对照组,模型组大鼠脑组织伊文思蓝含量升高(P<0.01);较模型组,AMP组和Que中、高剂量组伊文思蓝含量降低(P<0.01);较AMP组,Que高剂量组伊文思蓝含量降低(P<0.05)。见表2。
2.4 大鼠脑组织病理学改变 观察HE染色病理切片发现,正常对照组大鼠脑组织未见异常。模型组呈现神经数量减少、细胞间隙增大,胞体肿胀,大量炎性细胞浸润等病理性改变。较模型组,AMP组和Que低、中、高剂量组神经细胞肿胀、炎性细胞浸润等呈不同程度减轻;其中Que高剂量组效果较优,神经细胞数量、胞体形态基本正常,仅可见极少量炎性细胞浸润。见图1。

图1 各组大鼠脑组织病理学改变(HE,×200)
2.5 大鼠血浆LPS和脑组织TNF-α、lL-1β、lL-6含量 较正常对照组,模型组大鼠血浆LPS和脑组织TNF-α、IL-1β、IL-6含量升高(P<0.01);较模型组,AMP组和Que中、高剂量组血浆LPS和脑组织TNF-α、IL-1β、IL-6含量降低(P<0.05或P<0.01);较AMP组,Que高剂量组血浆LPS和脑组织TNF-α含量降低(P<0.01)。见表3。
表3 各组大鼠血浆LPS和脑组织TNF-α、lL-1β、lL-6含量比较()pg/mL

表3 各组大鼠血浆LPS和脑组织TNF-α、lL-1β、lL-6含量比较()pg/mL
注:与正常对照组比较,**表示P<0.01;与模型组比较,△表示P<0.05,△△表示P<0.01;与AMP组比较,##表示P<0.01
组别正常对照组模型组AMP组Que低剂量组Que中剂量组Que高剂量组IL-6 56.35±5.97 138.07±14.35**74.29±8.56△△126.85±13.52 97.63±10.18△△71.36±8.56△△鼠数30 11 15 12 16 22 LPS 9.35±1.96 35.84±5.70**29.14±4.59△30.11±4.82 21.75±3.37△△14.29±2.64△△##TNF-α 23.76±3.28 76.35±9.04**55.31±7.16△△64.94±10.25 48.50±7.28△△33.96±6.01△△##IL-1β 35.97±5.15 120.58±14.82**54.73±8.65△△106.48±12.27 85.24±9.36△△52.01±7.49△△
2.6 大鼠脑组织MDA含量和SOD、CAT活性 较正常对照组,模型组大鼠脑组织MDA含量显著升高,SOD、CAT活性降低(P<0.01);较模型组,AMP组和Que中、高剂量组MDA含量降低,SOD、CAT活性升高(P<0.05或P<0.01);较AMP组,Que高剂量组MDA含量显著降低,SOD活性升高(P<0.05或P<0.01)。见表4。
表4 各组大鼠脑组织MDA含量和SOD、CAT活性()
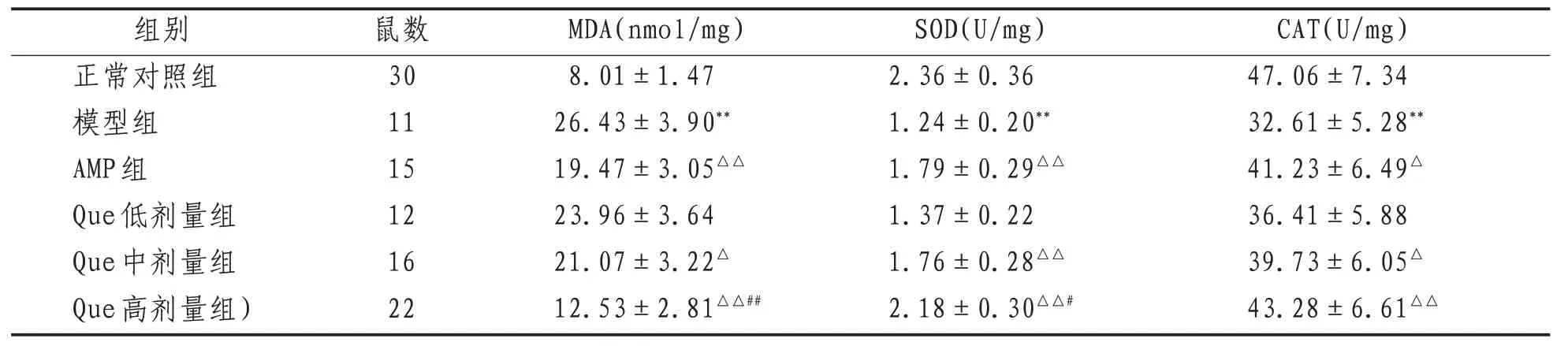
表4 各组大鼠脑组织MDA含量和SOD、CAT活性()
注:与正常对照组比较,**表示P<0.01;与模型组比较,△表示P<0.05,△△表示P<0.01;与AMP组比较,#表示P<0.05,##表示P<0.01
CAT(U/mg)组别鼠数MDA(nmol/mg)SOD(U/mg)47.06±7.34 32.61±5.28**41.23±6.49△36.41±5.88 39.73±6.05△43.28±6.61△△正常对照组模型组AMP组Que低剂量组Que中剂量组Que高剂量组)30 11 15 12 16 22 8.01±1.47 26.43±3.90**19.47±3.05△△23.96±3.64 21.07±3.22△12.53±2.81△△##2.36±0.36 1.24±0.20**1.79±0.29△△1.37±0.22 1.76±0.28△△2.18±0.30△△#
2.7 大鼠脑组织p65、lκBα、HMGB1蛋白表达 较正常对照组,模型组大鼠脑组织p65、HMGB1相对表达量升高而IκBα相对表达量降低(P<0.01);较模型组,AMP组和Que中、高剂量组p65、HMGB1相对表达量降低而IκBα相对表达量升高(P<0.01);与AMP组比较,Que高剂量组p65、HMGB1相对表达量降低而IκBα相对表达量升高(P<0.05或P<0.01)。见表5、图2。
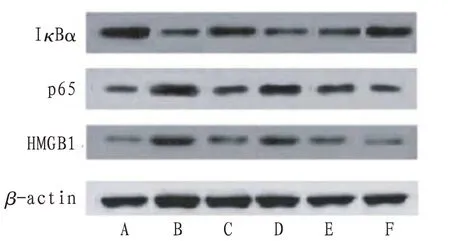
图2 各组大鼠脑组织p65、IκBα、HMGB1蛋白表达电泳图
表5 各组大鼠脑组织p65、lκBα、HMGB1蛋白相对表达量比较()
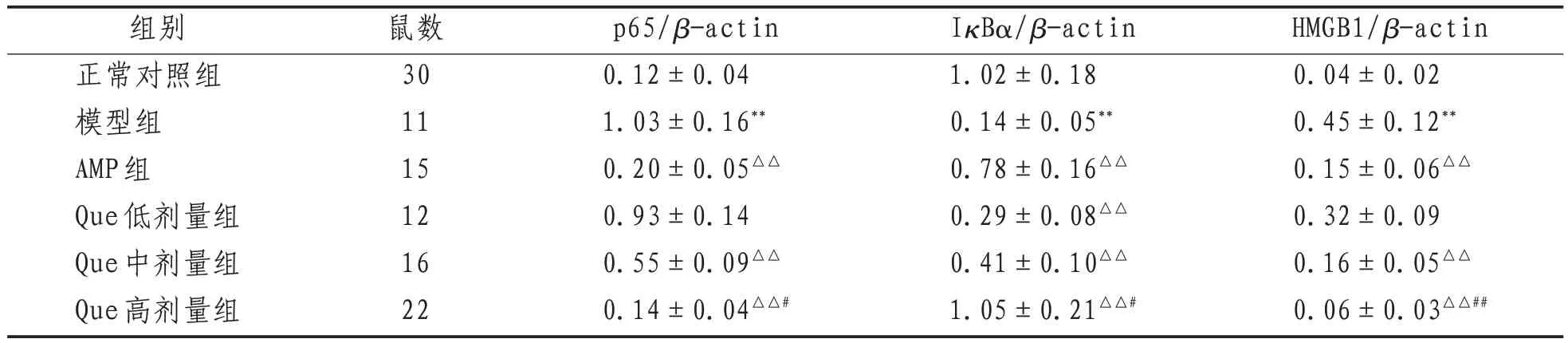
表5 各组大鼠脑组织p65、lκBα、HMGB1蛋白相对表达量比较()
注:与正常对照组比较,**表示P<0.01;与模型组比较,△△表示P<0.01;与AMP组比较,#表示P<0.05,##表示P<0.01
HMGB1/β-actin 0.04±0.02 0.45±0.12**0.15±0.06△△0.32±0.09 0.16±0.05△△0.06±0.03△△##组别正常对照组模型组AMP组Que低剂量组Que中剂量组Que高剂量组鼠数30 11 15 12 16 22 p65/β-actin 0.12±0.04 1.03±0.16**0.20±0.05△△0.93±0.14 0.55±0.09△△0.14±0.04△△#IκBα/β-actin 1.02±0.18 0.14±0.05**0.78±0.16△△0.29±0.08△△0.41±0.10△△1.05±0.21△△#
3 讨论
细菌性脑膜炎是一种中枢神经系统感染性疾病,及时给予抗菌药物能够挽救大部分脑膜炎患者的生命,但革兰氏阴性菌被杀灭过程可能引发内毒素血症,破坏脑组织结构和功能,导致其治疗结局并不理想。因此,寻找抗菌药物之外的新型药物对改善革兰氏阴性菌感染脑膜炎预后至关重要。
细菌性脑膜炎中奈瑟球菌是最常见的病原菌之一,属于革兰氏阴性菌;AMP对革兰氏阴性菌具有较好的抗菌活性,是临床治疗奈瑟球菌感染脑膜炎的一线用药。Que是一种黄酮醇类化合物,具有抗菌、抗氧化、抗病毒、抗肿瘤等多种药理学作用[9-10]。本实验采用经小延髓池注射奈瑟球菌悬液的方法制备奈瑟球菌感染脑膜炎大鼠模型,给予AMP或Que治疗则能够显著提高奈瑟球菌感染脑膜炎大鼠存活率,其中Que高剂量组存活率达73%,显著高于AMP组;并且经Que治疗能够明显降低症状评分、改善脑组织神经数量减少、胞体肿胀、炎性细胞浸润等病理性改变。BBB是存在于血液循环和脑组织之间的一种特殊屏障,对维持脑组织内环境稳定起着重要作用,BBB通透性异常升高是导致血管源性脑水肿而致残、致死的重要因素[11-12]。本研究发现,经Que治疗能够明显降低奈瑟球菌感染脑膜炎大鼠BBB通透性。提示Que对奈瑟球菌感染脑膜炎大鼠脑组织具有保护作用。
奈瑟球菌细胞壁中含有大量LPS,被杀灭解体后LPS释放进入血液循环,LPS分子上的类脂A结构能够与Toll样受体4结合,刺激单核、巨噬细胞大量释放炎症因子(TNF-α、IL-1β、IL-6等),进而导致系列炎症反应,引发内毒素血症[13]。并且TNF-α、IL-1β作为炎性趋化因子能够刺激粒细胞而进一步释放炎症因子,形成炎症级联反应而加重炎症损伤[14-15]。IL-6则能够刺激细胞大量产生活性氧(reactive oxygen species,ROS),抗氧化酶(SOD、CAT)被过度消耗,导致ROS过剩而引发氧化应激损伤,产生具有生物毒性的MDA[16]。NF-κB以p50/p65二聚体形式存在,对机体炎症反应具有重要调控作用。生理状态下,p50/p65与酶抑制剂IκBα结合而以无活性形式存在;病理状态下,p50/p65与IκBα解离而被激活,位移至细胞核后p65亚基与DNA特异性位点结合而诱导单核、巨噬细胞合成与释放TNF-α、IL-1β、IL-6等炎症因子[17]。本研究发现,经Que治疗能够明显降低奈瑟球菌感染脑膜炎大鼠血浆LPS和脑组织TNF-α、IL-1β、IL-6含量,降低脑组织MDA含量并提高SOD、CAT活性,下调p65、HMGB1表达并上调IκBα表达;并且Que高剂量组对血浆LPS和脑组织TNF-α、MDA含量,SOD活性,脑组织p65、IκBα、HMGB1蛋白表达的调控作用优于AMP组。说明Que对奈瑟球菌感染脑膜炎大鼠的脑保护作用可能与降低LPS水平、抑制NF-κB炎症通路、下调HMGB1蛋白表达有关。
综上所述,Que可通过降低LPS水平、抑制NF-κB炎症通路、下调HMGB1表达、改善抗氧化酶活性,降低脑组织炎症反应和氧化应激损伤,进而起到保护奈瑟球菌感染脑膜炎大鼠脑组织的作用。

