血小板活化因子水平对急性脑梗死静脉溶栓后血管再闭塞的预测效能
何思思 黄向东 陈建媚 茅新蕾
急性脑梗死约占脑血管病的75%,造成严重的社会经济负担[1]。超早期采用重组组织型纤溶酶原激活剂(recombinant tissue plasminogen activator,rt-PA)静脉溶栓是改善急性脑梗死结局最有效的药物治疗手段[2-3]。静脉溶栓后部分患者会发生再闭塞而导致预后不良[4]。溶栓后血管再闭塞主要原因可能与再通后遗留的局部栓子、内皮损伤,甚至溶栓药物本身所诱发的血小板活化聚集有关[5]。血小板活化因子(platelet activating factor,PAF)是血管内皮功能损伤、血小板活化的特异性生物标志物,在动脉粥样硬化、炎症性疾病的诊断方面有重要临床价值[6-7]。本研究旨在揭示血浆PAF 水平对急性脑梗死静脉溶栓后血管再闭塞的预测效能,现将结果报道如下。
1 对象和方法
1.1 对象 选择2019 年1 月至2022 年6 月在温州市中心医院神经内科住院并实施rt-PA 治疗的急性脑梗死患者276 例,其中男174 例,女102 例;年龄52.00~81.00(65.45±7.51)岁;BMI 21.21~30.79(25.40±1.79)kg/m2;吸烟史148 例,饮酒史147 例;合并糖尿病105 例,高血压164 例,冠心病89 例,高脂血症144 例;使用抗血小板药物188 例,他汀类162 例,抗凝药物42例;入院时美国国立卫生研究院卒中量表(National Institute of Health stroke scale,NIHSS)评分8~27 分,中位数评分13(12,16)分;后循环脑梗死60 例。将溶栓后血管再闭塞的患者61 例纳入观察组,未发生者215 例纳入对照组。纳入标准:符合中华医学会2018 年制定的急性脑梗死诊断和rtPA 静脉溶栓治疗标准[3];静脉溶栓后血管闭塞改善。排除标准:近1 个月内手术及感染史;严重心、肝、肺、肾功能不全、恶性肿瘤及免疫系统疾病等;拒绝参与研究及临床资料缺失。本研究经本院医学伦理委员会审查通过(批准文号:L2024-03-020),患者家属均签署知情同意。
1.2 方法
1.2.1 一般资料收集 参照中华医学会2018 年制定的标准,采用rt-PA(阿替普酶)对两组患者进行静脉溶栓和规范化治疗。入院时记录患者性别、年龄、BMI、收缩压、舒张压、吸烟史、饮酒史、合并疾病、药物使用情况和梗死部位等资料,采用NIHSS 评价患者神经功能状态。溶栓后血管再闭塞定义为溶栓后24 h以内,在溶栓有效时最低NIHSS 评分基础上恶化2 分及以上,且影像学除外颅内出血[8-9]。
1.2.2 实验室检查 静脉溶栓前抽取患者静脉血5 mL,离心后分离,采用ELISA 法测定PAF 水平(货号:XGE990882,上海西格生物科技有限公司)。同时检测血常规、生化、凝血功能等,记录PLT、TC、TG、HDL-C、LDL-C、血糖、APTT、PT、Fib等指标。
1.3 统计学处理 采用SPSS 23.0 和R4.2.1 统计软件。正态分布的计量资料以表示,组间比较采用独立样本t检验;非正态分布的计量资料以M(P25,P75)表示,组间比较采用Mann-WhitneyU检验;计数资料组间比较采用χ2检验或Fisher 确切概率法。将上述差异有统计学意义的变量纳入二元logistic 回归模型,采用逐步回归法揭示静脉溶栓后再闭塞的独立预测因素。将静脉溶栓后再闭塞的独立预测因素组合成预测模型,采用ROC 曲线评估血浆PAF 水平及预测模型的预测效能。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者一般资料和血清指标比较 观察组患者BMI、NIHSS 评分、后循环脑梗死比例、血糖和血浆PAF 水平高于对照组,差异均有统计学意义(均P<0.05),两组患者其他一般资料比较,差异均无统计学意义(均P>0.05),见表1。
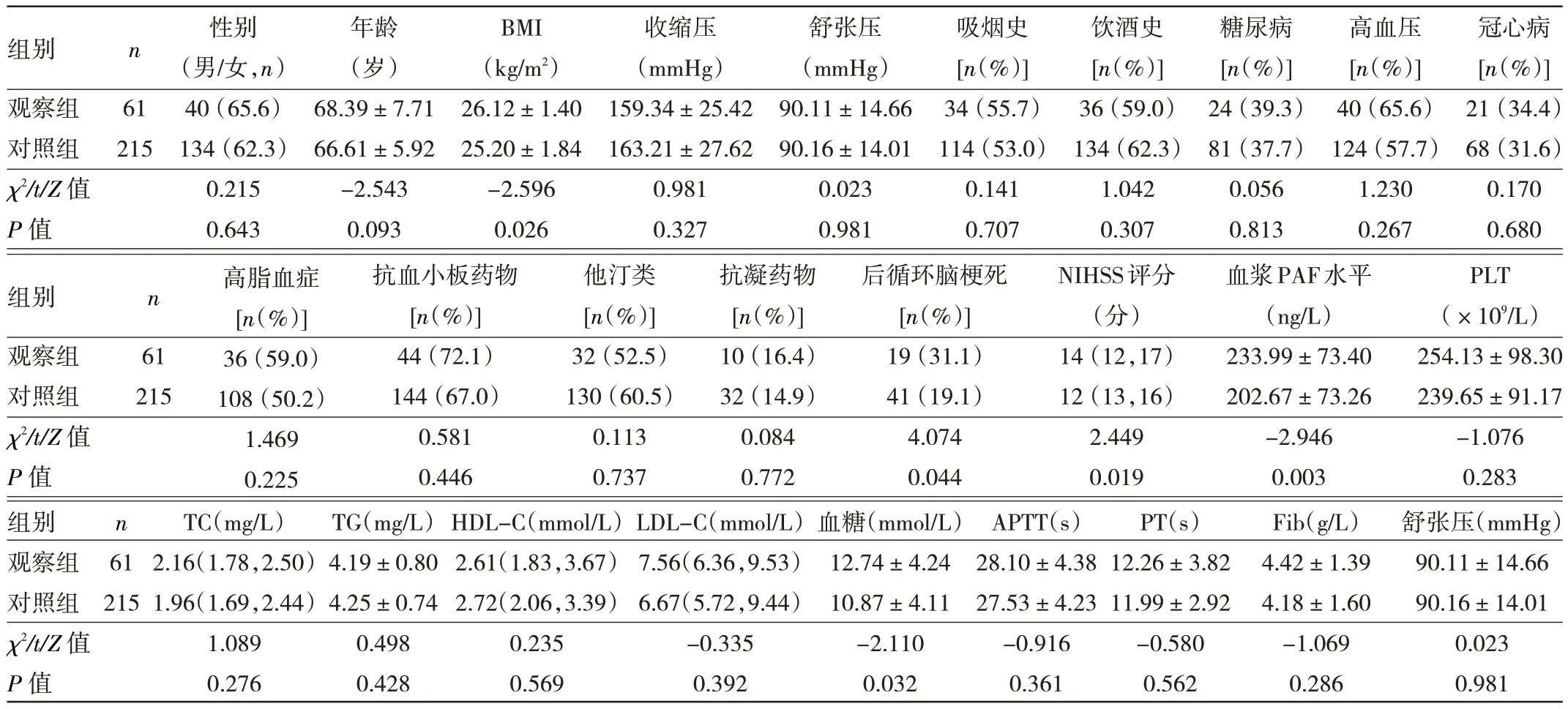
表1 两组患者一般资料及血清指标比较
2.2 静脉溶栓后血管再闭塞预测因子的多因素分析将BMI、NIHSS 评分、后循环脑梗死比例、血糖和血浆PAF 水平这5 项指标纳入二元logistic 回归模型,结果显示,NIHSS 评分、后循环脑梗死和血浆PAF 水平均是静脉溶栓后血管再闭塞的影响因素(均P<0.05),见表2。
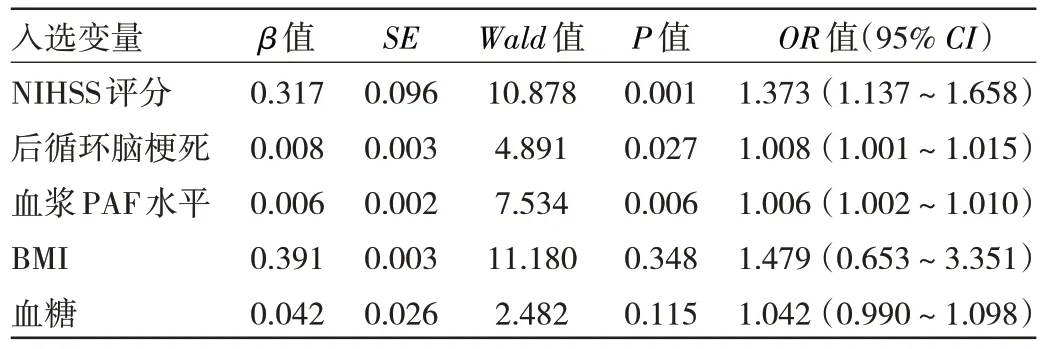
表2 影响静脉溶栓后血管再闭塞的二元logistic 回归分析
2.3 logistic 回归模型建立、验证和效能评价 基于多因素分析的结果,用NIHSS 评分、后循环脑梗死和血浆PAF 水平构建急性脑梗死患者rt-PA 静脉溶栓后血管再闭塞的预测模型。血浆PAF 水平预测静脉溶栓后血管再闭塞的AUC 为0.725(95%CI:0.632~0.778,P<0.001),最佳阈值为221.50 ng/L,灵敏度为0.739,特异度为0.688。预测模型预测急性脑梗死患者静脉使用rtPA 溶栓后血管再闭塞的AUC 为0.816(95%CI:0.748~0.874,P<0.001),见图1。
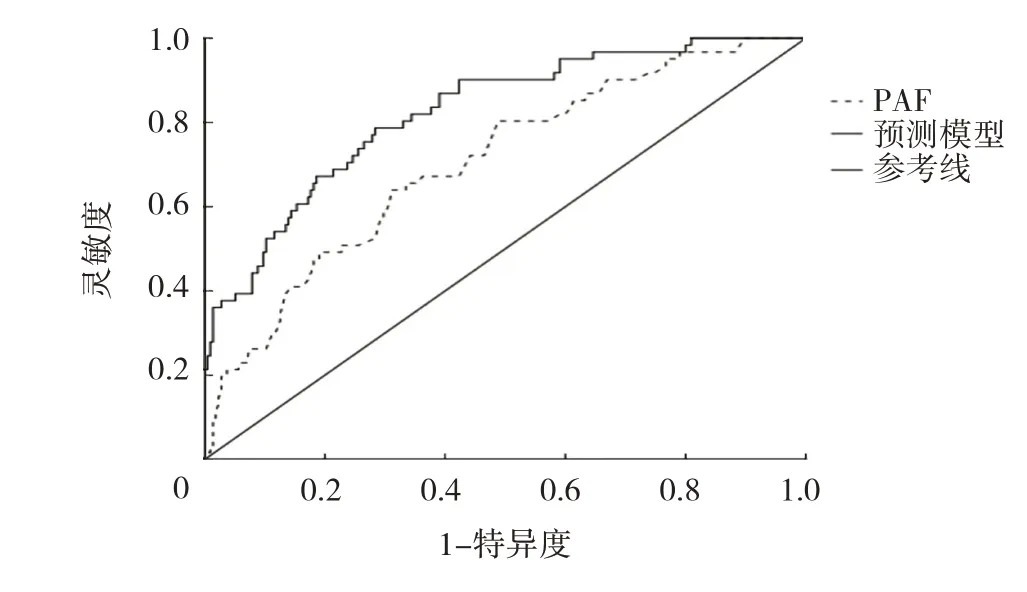
图1 预测模型预测急性脑梗死患者静脉使用rt-PA 溶栓后血管再闭塞的ROC 曲线
3 讨论
急性脑梗死是神经内科常见病,该病发生后一定时间内颅内梗死病灶缺血半暗带细胞损伤的可逆性是罹患此病的患者早期溶栓治疗的病理生理基础,该治疗方案有利于急性脑梗死患者恢复脑组织血流灌注、减轻脑神经缺损以及改善预后[10]。rt-PA 为第二代溶栓药物,半衰期短、无抗原性,诱导纤溶酶原进一步成为纤溶酶溶解血块,对血栓部位具有较强选择性,可特异性激活血栓中纤溶酶原起到溶解血栓的作用。目前临床上实施rt-PA 静脉溶栓是多国指南推荐的急性脑梗死最重要治疗方式之一[3]。但是,相关研究表明静脉溶栓的血管再通率仅为46%,且再通病例中血管再闭塞的发生率高达14%~34%[4]。本研究血管再闭塞的发生率为22.1%。
血管再闭塞主要原因可能是部分再通后遗留的局部栓子、内皮损伤,甚至纤溶酶自身导致的血小板活化,进而引发再闭塞,说明血小板功能活化是急性脑梗死患者静脉使用rt-PA 溶栓治疗后血管再闭塞的重要因素[9]。由于早期使用抗血小板药物治疗可能增加出血性转化风险,因此出于安全性考虑,目前临床指南推荐溶栓时间窗为24 h,且排除颅内出血情况后再加用抗血小板药物治疗。然而,大多数溶栓后血管再闭塞发生在责任血管再通后24 h 内,甚至可发生于溶栓治疗后的数分钟内[11],使得部分患者错过了治疗最佳时机,导致不良预后。因此,如何早期识别溶栓治疗后血管再闭塞,判断高危患者再发血管病事件的风险具有重要意义。
PAF 最早是由德国科学家发现,是嗜碱性粒细胞受到攻击时产生的一类可溶性脂质分子,可行使血小板活化和聚集等生物学功能,检测血浆PAF 水平可间接反映血小板的功能状况。随着研究深入,PAF 已被视作脑卒中病理生理过程中从血栓形成到缺血损害的关键点,具有极其重要的作用[12]。既往研究发现,PAF在下肢动脉粥样硬化、脓毒性休克中发挥重要作用[7,13]。黄丽等[14]发现血浆PAF 水平在短暂性脑缺血发作进展为脑梗死的患者中显著高于对照组,并且对脑梗死的发生具有一定的预测效能。然而,PAF在急性脑梗死患者溶栓后血管再闭塞中的作用并不明确,缺乏相关报道。本研究发现,观察组患者血浆PAF 水平均高于对照组,差异有统计学意义。基于多因素logistic 回归分析的结果,入院时NIHSS 评分、后循环脑梗死和血浆PAF 水平与静脉溶栓后血管再闭塞呈独立相关关系。本研究绘制PAF预测溶栓后血管再闭塞的ROC曲线,血浆PAF水平预测静脉溶栓后血管再闭塞的AUC 为0.725,最佳阈值是221.50 ng/L,灵敏度为0.739,特异度为0.688。
Yoshida 等[15]认为,PAF 可参与炎症反应与血管内皮损伤,促进血栓形成。因此,血小板功能状态的差异可能与溶栓后血管再闭塞有关,而PAF 与血管再闭塞的发生具有一定的相关性,其机制可能与PAF 通过介导内皮损伤后的血小板活化聚集有关[16]。
本研究还发现急性脑梗死患者入院时NIHSS 评分和后循环脑梗死与静脉溶栓后血管再闭塞呈独立相关关系,表现为入院时NIHSS 评分越高,梗死部位发生于后循环,溶栓后血管再闭塞的风险就越高。Gong等[17]发现在接受静脉溶栓治疗的急性脑梗死患者中,NIHSS 评分可能与溶栓后早期神经功能恶化有关。后循环脑梗死多与椎基底动脉粥样硬化病变原位血栓形成有关,临床表现形式复杂多样,预后较差[18]。因此,NIHSS 评分和后循环脑梗死也可能是静脉溶栓后血管再闭塞的独立预测因素。基于血浆PAF 水平、NIHSS 评分和后循环脑梗死构建的预测模型预测溶栓后血管再闭塞的AUC 为0.816。然而,本研究为单中心、前瞻性研究,样本量较小,具有一定的局限性。此外,因采用NIHSS 评分的变化作为判断血管再闭塞的依据,在反映血管状况方面有所欠缺。虽然本研究具有上述局限性,但是仍对血浆PAF 水平与溶栓后血管再闭塞之间的关系具有一定的提示意义,可为进一步多中心、大规模前瞻性研究提供理论依据。

